A base da terapia para cirrose hepática continua sendo o tratamento da doença hepática crônica subjacente, quando possível, e a prevenção de insulto hepático sobreposto, o que pode resultar em insuficiência hepática crônica agudizada (HICA). São essenciais a detecção precoce, o controle e o tratamento das complicações; os pacientes que desenvolvem complicações devem ser encaminhados a uma avaliação para transplante de fígado.
Os pacientes devem ser informados da necessidade da nutrição adequada, exercícios regulares e evitação de hepatotoxinas.[92]Perumpail BJ, Li AA, Cholankeril G, et al. Optimizing the nutritional support of adult patients in the setting of cirrhosis. Nutrients. 2017 Oct 13;9(10):E1114.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5691730
http://www.ncbi.nlm.nih.gov/pubmed/29027963?tool=bestpractice.com
Tratamento da doença hepática crônica subjacente e prevenção de agressão hepática sobreposta
Devido a cirrose ser o estágio terminal patológico de qualquer doença hepática crônica, é essencial tratar a doença causadora subjacente para desacelerar ou impedir a evolução da cirrose. Os antivirais de ação direta orais são considerados um tratamento de primeira linha para a infecção crônica pelo vírus da hepatite C. Uma revisão sistemática e metanálise revelou que o tratamento precoce com antivirais de ação direta reduziu a recorrência do carcinoma hepatocelular, a descompensação hepática e a mortalidade por todas as causas, e preveniu o carcinoma hepatocelular em pacientes com cirrose compensada e sem cirrose, mas não preveniu o transplante de fígado.[93]Yew KC, Tan QR, Lim PC, et al. Assessing the impact of direct-acting antivirals on hepatitis C complications: a systematic review and meta-analysis. Naunyn Schmiedebergs Arch Pharmacol. 2024 Mar;397(3):1421-31.
http://www.ncbi.nlm.nih.gov/pubmed/37728622?tool=bestpractice.com
Os esquemas dependem do genótipo e da presença ou ausência de cirrose.[94]American Association for the Study of Liver Diseases; Infectious Diseases Society of America. Hepatitis C guidance 2023 update: recommendations for testing, managing, and treating hepatitis C virus infection. Oct 2023 [internet publication].
https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciad319/7179952
Consulte as orientações locais. Consulte Hepatite C.
Os antivirais podem ser indicados para os pacientes com hepatite B crônica.[84]European Association for the Study of the Liver. EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection. J Hepatol. 2017 Aug;67(2):370-98.
https://www.journal-of-hepatology.eu/article/S0168-8278(17)30185-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/28427875?tool=bestpractice.com
[95]Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018 Apr;67(4):1560-99.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5975958
http://www.ncbi.nlm.nih.gov/pubmed/29405329?tool=bestpractice.com
Consulte Hepatite B.
A lesão hepática sobreposta pode ser prevenida através da evitação do consumo de bebidas alcoólicas e de outros medicamentos hepatotóxicos (por exemplo, anti-inflamatórios não esteroidais [AINEs] e altas doses de paracetamol [>2-3 g/dia]), da imunização contra hepatite A e B para pacientes suscetíveis, manejo dos fatores de risco metabólicos, manutenção de uma nutrição adequada e exercícios regulares.
Monitoramento de complicações
A cirrose está associada a complicações graves, incluindo hipertensão portal causando ascite (adicionalmente complicada por peritonite bacteriana espontânea e hidrotórax hepático), varizes gastroesofágicas e encefalopatia portossistêmica, lesão renal aguda e síndromes hepatopulmonares, hipertensão portopulmonar, HICA e carcinoma hepatocelular.
A detecção imediata e o tratamento dessas complicações são essenciais para minimizar a morbidade e a mortalidade relacionadas. Os exames de imagem incluem:
Ultrassonografia abdominal para detecção de ascite e vigilância para carcinoma hepatocelular
Endoscopia digestiva alta para a detecção de varizes gastroesofágicas
Ultrassonografia abdominal, tomografia computadorizada (TC) ou ressonância nuclear magnética (RNM) para a detecção de carcinoma hepatocelular.
Outros exames especializados podem ser exigidos, dependendo dos sintomas individuais.
Ascite
A complicação mais comum da cirrose.
Cada paciente com novo episódio de ascite deve ser submetido a paracentese diagnóstica: a celularidade com diferencial, a albumina e a proteína total devem ser medidas no líquido ascítico. O líquido ascítico também deve ser enviado para cultura e citologia.
O gradiente de albumina soro-ascite (GASA) deve ser calculado: um GASA ≥11 g/L com proteína total baixa no líquido ascítico é consistente com hipertensão portal secundária à cirrose.
A ascite se desenvolve em parte devido à ativação do sistema renina-angiotensina-aldosterona, resultando na retenção de sódio. As evidências sugerem que a restrição alimentar de sódio grave pode ser mais prejudicial do que benéfica, e muitos médicos aconselham uma dieta sem adição de sal, em vez de uma dieta com pouco sal.[101]Aithal GP, Palaniyappan N, China L, et al. Guidelines on the management of ascites in cirrhosis. Gut. 2021 Jan;70(1):9-29.
https://gut.bmj.com/content/70/1/9.long
http://www.ncbi.nlm.nih.gov/pubmed/33067334?tool=bestpractice.com
Isso significa excluir a adição de sal de mesa adicional aos alimentos e evitar alimentos com alto teor de sal, como batatas fritas e algumas refeições processadas. Isso resulta em uma restrição moderada de sódio, com ingestão diária de, no máximo, 5 a 6.5 g.
A escolha de primeira linha do diurético deve ser a espironolactona devido aos seus efeitos na aldosterona e de manutenção do potássio sérico normal.[101]Aithal GP, Palaniyappan N, China L, et al. Guidelines on the management of ascites in cirrhosis. Gut. 2021 Jan;70(1):9-29.
https://gut.bmj.com/content/70/1/9.long
http://www.ncbi.nlm.nih.gov/pubmed/33067334?tool=bestpractice.com
A furosemida pode ser adicionada para os pacientes que não responderem. A função renal e os eletrólitos devem ser cuidadosamente monitorados ao se iniciarem diuréticos e após aumentos de doses.
AINEs, IECAs e outras nefrotoxinas devem ser evitados em pacientes com ascite.[90]Flamm SL, Wong F, Ahn J, et al. AGA clinical practice update on the evaluation and management of acute kidney injury in patients with cirrhosis: expert review. Clin Gastroenterol Hepatol. 2022 Dec;20(12):2707-16.
https://www.cghjournal.org/article/S1542-3565(22)00829-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36075500?tool=bestpractice.com
Ascite refratária de grande volume
Alguns pacientes podem desenvolver ascite de grande volume refratária ao tratamento clínico devido à falta de eficácia, ou efeitos adversos ou complicações inaceitáveis. Esses pacientes podem necessitar de paracentese de grande volume (PGV) recorrente com reposição de albumina para controle dos sintomas.[102]Bernardi M, Caraceni P, Navickis RJ, et al. Albumin infusion in patients undergoing large-volume paracentesis: a meta-analysis of randomized trials. Hepatology. 2012 Apr;55(4):1172-81.
https://aasldpubs.onlinelibrary.wiley.com/doi/full/10.1002/hep.24786
http://www.ncbi.nlm.nih.gov/pubmed/22095893?tool=bestpractice.com
Os pacientes não adequados para transplante de fígado devem ser considerados para colocação de anastomose portossistêmica intra-hepática transjugular (TIPS).[103]Benmassaoud A, Freeman SC, Roccarina D, et al. Treatment for ascites in adults with decompensated liver cirrhosis: a network meta-analysis. Cochrane Database Syst Rev. 2020 Jan 16;1:CD013123.
https://www.doi.org/10.1002/14651858.CD013123.pub2
http://www.ncbi.nlm.nih.gov/pubmed/31978257?tool=bestpractice.com
Metanálises indicam que a TIPS é mais efetiva que a paracentese para o controle da ascite refratária, mas está associada a uma maior incidência de encefalopatia hepática.[103]Benmassaoud A, Freeman SC, Roccarina D, et al. Treatment for ascites in adults with decompensated liver cirrhosis: a network meta-analysis. Cochrane Database Syst Rev. 2020 Jan 16;1:CD013123.
https://www.doi.org/10.1002/14651858.CD013123.pub2
http://www.ncbi.nlm.nih.gov/pubmed/31978257?tool=bestpractice.com
[104]D'Amico G, Luca A, Morabito A, et al. Uncovered transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis. Gastroenterology. 2005 Oct;129(4):1282-93.
http://www.ncbi.nlm.nih.gov/pubmed/16230081?tool=bestpractice.com
[105]Saab S, Nieto JM, Lewis SK, et al. TIPS versus paracentesis for cirrhotic patients with refractory ascites. Cochrane Database Syst Rev. 2006 Oct 18;(4):CD004889.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004889.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/17054221?tool=bestpractice.com
[106]Albillos A, Bañares R, González M, et al. A meta-analysis of transjugular intrahepatic portosystemic shunt versus paracentesis for refractory ascites. J Hepatol. 2005 Dec;43(6):990-6.
http://www.ncbi.nlm.nih.gov/pubmed/16139922?tool=bestpractice.com
[107]Salerno F, Cammà C, Enea M, et al. Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patient data. Gastroenterology. 2007 Sep;133(3):825-34.
https://www.doi.org/10.1053/j.gastro.2007.06.020
http://www.ncbi.nlm.nih.gov/pubmed/17678653?tool=bestpractice.com
[108]Chen RP, Zhu Ge XJ, Huang ZM, et al. Prophylactic use of transjugular intrahepatic portosystemic shunt aids in the treatment of refractory ascites: metaregression and trial sequential meta-analysis. J Clin Gastroenterol. 2014 Mar;48(3):290-9.
http://www.ncbi.nlm.nih.gov/pubmed/24030734?tool=bestpractice.com
[109]Bai M, Qi XS, Yang ZP, et al. TIPS improves liver transplantation-free survival in cirrhotic patients with refractory ascites: an updated meta-analysis. World J Gastroenterol. 2014 Mar 14;20(10):2704-14.
https://www.doi.org/10.3748/wjg.v20.i10.2704
http://www.ncbi.nlm.nih.gov/pubmed/24627607?tool=bestpractice.com
A mortalidade global não parece diferir entre as duas intervenções, mas a TIPS pode oferecer um benefício modesto em relação à sobrevida livre de transplante.[103]Benmassaoud A, Freeman SC, Roccarina D, et al. Treatment for ascites in adults with decompensated liver cirrhosis: a network meta-analysis. Cochrane Database Syst Rev. 2020 Jan 16;1:CD013123.
https://www.doi.org/10.1002/14651858.CD013123.pub2
http://www.ncbi.nlm.nih.gov/pubmed/31978257?tool=bestpractice.com
[104]D'Amico G, Luca A, Morabito A, et al. Uncovered transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis. Gastroenterology. 2005 Oct;129(4):1282-93.
http://www.ncbi.nlm.nih.gov/pubmed/16230081?tool=bestpractice.com
[105]Saab S, Nieto JM, Lewis SK, et al. TIPS versus paracentesis for cirrhotic patients with refractory ascites. Cochrane Database Syst Rev. 2006 Oct 18;(4):CD004889.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004889.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/17054221?tool=bestpractice.com
[106]Albillos A, Bañares R, González M, et al. A meta-analysis of transjugular intrahepatic portosystemic shunt versus paracentesis for refractory ascites. J Hepatol. 2005 Dec;43(6):990-6.
http://www.ncbi.nlm.nih.gov/pubmed/16139922?tool=bestpractice.com
[107]Salerno F, Cammà C, Enea M, et al. Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patient data. Gastroenterology. 2007 Sep;133(3):825-34.
https://www.doi.org/10.1053/j.gastro.2007.06.020
http://www.ncbi.nlm.nih.gov/pubmed/17678653?tool=bestpractice.com
[108]Chen RP, Zhu Ge XJ, Huang ZM, et al. Prophylactic use of transjugular intrahepatic portosystemic shunt aids in the treatment of refractory ascites: metaregression and trial sequential meta-analysis. J Clin Gastroenterol. 2014 Mar;48(3):290-9.
http://www.ncbi.nlm.nih.gov/pubmed/24030734?tool=bestpractice.com
[109]Bai M, Qi XS, Yang ZP, et al. TIPS improves liver transplantation-free survival in cirrhotic patients with refractory ascites: an updated meta-analysis. World J Gastroenterol. 2014 Mar 14;20(10):2704-14.
https://www.doi.org/10.3748/wjg.v20.i10.2704
http://www.ncbi.nlm.nih.gov/pubmed/24627607?tool=bestpractice.com
A colocação de TIPS pode melhorar o estado nutricional dos pacientes com cirrose, indicado por um aumento no peso livre de ascite, no índice de massa corporal e na massa muscular.[110]Gazda J, Di Cola S, Lapenna L, et al. The impact of transjugular intrahepatic portosystemic shunt on nutrition in liver cirrhosis patients: a systematic review. Nutrients. 2023 Mar 27;15(7):1617.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10096634
http://www.ncbi.nlm.nih.gov/pubmed/37049459?tool=bestpractice.com
Uma metanálise de dados de pacientes individuais revelou que o tratamento com TIPS reduziu o risco global de descompensação adicional e melhorou a sobrevida em comparação com o tratamento padrão.[111]Larrue H, D'Amico G, Olivas P, et al. TIPS prevents further decompensation and improves survival in patients with cirrhosis and portal hypertension in an individual patient data meta-analysis. J Hepatol. 2023 Sep;79(3):692-703.
http://www.ncbi.nlm.nih.gov/pubmed/37141993?tool=bestpractice.com
Uma revisão sistemática Cochrane e uma metanálise em rede relataram que a certeza (qualidade) geral das evidências foi muito baixa, principalmente devido ao alto risco ou risco incerto de viés em ensaios clínicos que avaliaram as intervenções para o tratamento de ascite refratária em pacientes com cirrose.[103]Benmassaoud A, Freeman SC, Roccarina D, et al. Treatment for ascites in adults with decompensated liver cirrhosis: a network meta-analysis. Cochrane Database Syst Rev. 2020 Jan 16;1:CD013123.
https://www.doi.org/10.1002/14651858.CD013123.pub2
http://www.ncbi.nlm.nih.gov/pubmed/31978257?tool=bestpractice.com
[  ]
For adults with decompensated liver cirrhosis, how do treatments for ascites compare?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3068/fullMostre-me a resposta A gravidade da doença no momento da colocação da TIPS é um importante fator preditivo de desfechos.[112]Lebrec D, Giuily N, Hadengue A, et al. Transjugular intrahepatic portosystemic shunts: comparison with paracentesis in patients with cirrhosis and refractory ascites: a randomized trial. French Group of Clinicians and a Group of Biologists. J Hepatol. 1996 Aug;25(2):135-44.
http://www.ncbi.nlm.nih.gov/pubmed/8878773?tool=bestpractice.com
]
For adults with decompensated liver cirrhosis, how do treatments for ascites compare?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3068/fullMostre-me a resposta A gravidade da doença no momento da colocação da TIPS é um importante fator preditivo de desfechos.[112]Lebrec D, Giuily N, Hadengue A, et al. Transjugular intrahepatic portosystemic shunts: comparison with paracentesis in patients with cirrhosis and refractory ascites: a randomized trial. French Group of Clinicians and a Group of Biologists. J Hepatol. 1996 Aug;25(2):135-44.
http://www.ncbi.nlm.nih.gov/pubmed/8878773?tool=bestpractice.com
O prognóstico dos pacientes com ascite refratária é desfavorável. Se a TIPS/transplante não forem opções viáveis, a colocação de dreno de longo prazo para paracentese intermitente de pequeno volume pode ser considerada uma medida paliativa.[113]Macken L, Joshi D, Messenger J, et al. Palliative long-term abdominal drains in refractory ascites due to end-stage liver disease: a case series. Palliat Med. 2017 Jul;31(7):671-5.
http://www.ncbi.nlm.nih.gov/pubmed/27707955?tool=bestpractice.com
Ensaios clínicos randomizados e controlados prospectivos são justificados.
O uso de vaptans (antagonistas dos receptores da vasopressina V2) pode ter um leve efeito benéfico na ascite e na hiponatremia, mas eles não reduzem a mortalidade, complicações hepáticas ou insuficiência renal.[114]Dahl E, Gluud LL, Kimer N, et al. Meta-analysis: the safety and efficacy of vaptans (tolvaptan, satavaptan and lixivaptan) in cirrhosis with ascites or hyponatraemia. Aliment Pharmacol Ther. 2012 Oct;36(7):619-26.
http://www.ncbi.nlm.nih.gov/pubmed/22908905?tool=bestpractice.com
[115]Yan L, Xie F, Lu J, et al. The treatment of vasopressin V2-receptor antagonists in cirrhosis patients with ascites: a meta-analysis of randomized controlled trials. BMC Gastroenterol. 2015 Jun 9;15:65.
https://www.doi.org/10.1186/s12876-015-0297-z
http://www.ncbi.nlm.nih.gov/pubmed/26054761?tool=bestpractice.com
Varizes gastroesofágicas
As varizes estão presentes em 50% dos pacientes com cirrose. A hemorragia por varizes é uma complicação com risco à vida da cirrose, com uma mortalidade associada de 20% a 6 semanas.[116]Tripathi D, Stanley AJ, Hayes PC, et al. U.K. guidelines on the management of variceal haemorrhage in cirrhotic patients. Gut. 2015 Nov;64(11):1680-704.
http://www.ncbi.nlm.nih.gov/pmc/articles/pmid/25887380
http://www.ncbi.nlm.nih.gov/pubmed/25887380?tool=bestpractice.com
Historicamente, sempre foi oferecido aos pacientes com cirrose uma endoscopia digestiva alta para o rastreamento de varizes gastroesofágicas no momento do diagnóstico e a intervalos de 1 a 3 anos a partir de então.[56]National Institute for Health and Care Excellence. Cirrhosis in over 16s: assessment and management. Sep 2023 [internet publication].
https://www.nice.org.uk/guidance/ng50
No entanto, as recomendações das diretrizes variam em relação aos intervalos de rastreamento.
Os critérios do Baveno VII sugerem que o rastreamento por endoscopia pode ser reservado a um subgrupo de pacientes, com base na medida da rigidez hepática (MRH) e na contagem plaquetária.[54]de Franchis R, Bosch J, Garcia-Tsao G, et al. Baveno VII: renewing consensus in portal hypertension. J Hepatol. 2022 Apr;76(4):959-74.
https://www.journal-of-hepatology.eu/article/S0168-8278(21)02299-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35120736?tool=bestpractice.com
Em particular, os pacientes com cirrose compensada, que apresentam rigidez hepática <20 kPa (medida por elastografia transitória) e contagem plaquetária >150 × 10⁹ células/L, têm um risco muito baixo de apresentar varizes que requerem tratamento e podem evitar a endoscopia de rastreamento.[54]de Franchis R, Bosch J, Garcia-Tsao G, et al. Baveno VII: renewing consensus in portal hypertension. J Hepatol. 2022 Apr;76(4):959-74.
https://www.journal-of-hepatology.eu/article/S0168-8278(21)02299-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35120736?tool=bestpractice.com
Na prática, no entanto, muitos centros ainda oferecem endoscopia inicial a todos os pacientes com cirrose hepática.
Em pacientes compensados, sem varizes ou com varizes pequenas na endoscopia de rastreamento, os critérios expandidos do Baveno VI recomendam o rastreamento de varizes gastroesofágicas em intervalos de 1 a 3 anos a partir de então.[87]de Franchis R, Baveno VI Faculty. Expanding consensus in portal hypertension: report of the Baveno VI Consensus Workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015 Sep;63(3):743-52.
https://www.journal-of-hepatology.eu/article/S0168-8278(15)00349-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/26047908?tool=bestpractice.com
As diretrizes de consenso do Baveno VII concluem que os pacientes que evitarem o rastreamento por endoscopia podem ser acompanhados pela repetição precoce da elastografia transitória e da contagem plaquetária. Se a MRH aumentar (≥20 kPa) ou a contagem plaquetária diminuir (≤150 x 10⁹/L), esses pacientes devem ser submetidos a rastreamento por endoscopia.[54]de Franchis R, Bosch J, Garcia-Tsao G, et al. Baveno VII: renewing consensus in portal hypertension. J Hepatol. 2022 Apr;76(4):959-74.
https://www.journal-of-hepatology.eu/article/S0168-8278(21)02299-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35120736?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Varizes esofágicas em paciente com hipertensão portalDo acervo de Douglas G. Adler, MD [Citation ends].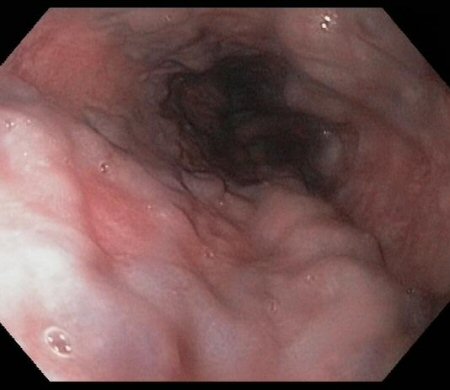
Profilaxia primária do sangramento
A profilaxia com qualquer betabloqueador não seletivo (propranolol, nadolol ou carvedilol) ou a ligação varicosa endoscópica (EVL), a qual exige várias sessões para obliterar as varizes, deve ser implementada se varizes esofágicas de alto risco estiverem presentes, devido ao aumento do risco de hemorragia por varizes.[57]Vadera S, Yong CWK, Gluud LL, et al. Band ligation versus no intervention for primary prevention of upper gastrointestinal bleeding in adults with cirrhosis and oesophageal varices. Cochrane Database Syst Rev. 2019 Jun 20;6:CD012673.
https://www.doi.org/10.1002/14651858.CD012673.pub2
http://www.ncbi.nlm.nih.gov/pubmed/31220333?tool=bestpractice.com
[  ]
How does band ligation compare with no intervention for adults with cirrhosis and esophageal varices in preventing upper gastrointestinal bleeding?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2700/fullMostre-me a resposta Varizes de alto risco incluem varizes com sinais vermelhos, varizes médias ou grandes, independentemente da classificação de Child-Pugh, ou varizes pequenas em pacientes com classificação de Child-Pugh C.[88]European Association for the Study of the Liver. EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018 Aug;69(2):406-60.
https://www.journal-of-hepatology.eu/article/S0168-8278(18)31966-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29653741?tool=bestpractice.com
]
How does band ligation compare with no intervention for adults with cirrhosis and esophageal varices in preventing upper gastrointestinal bleeding?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2700/fullMostre-me a resposta Varizes de alto risco incluem varizes com sinais vermelhos, varizes médias ou grandes, independentemente da classificação de Child-Pugh, ou varizes pequenas em pacientes com classificação de Child-Pugh C.[88]European Association for the Study of the Liver. EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018 Aug;69(2):406-60.
https://www.journal-of-hepatology.eu/article/S0168-8278(18)31966-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29653741?tool=bestpractice.com
Betabloqueadores não seletivos
As vantagens dos betabloqueadores não seletivos incluem o baixo custo e a facilidade de administração. Quando o paciente recebe um betabloqueador não seletivo, não há necessidade de se repetir a endoscopia digestiva alta (EDA), e os pacientes que apresentam resposta hemodinâmica a betabloqueadores não seletivos têm menor incidência de descompensação e morte. As desvantagens são: aproximadamente 15% dos pacientes podem ter contraindicações absolutas ou relativas à terapia, e outros 15% requerem redução da dose ou descontinuação em decorrência de efeitos adversos comuns (por exemplo, fadiga, fraqueza e dispneia) que remitem após a descontinuação, mas isso pode desestimular os pacientes e seus médicos a usarem esses medicamentos.
O monitoramento da resposta hemodinâmica ao se tratar um paciente com betabloqueadores está associado a menor risco de hemorragia por varizes, mas são necessários ensaios clínicos randomizados e controlados de grandes coortes para confirmar esses achados.[117]Kerbert AJ, Chiang FW, van der Werf M, et al. Hemodynamic response to primary prophylactic therapy with nonselective beta-blockers is related to a reduction of first variceal bleeding risk in liver cirrhosis: a meta-analysis. Eur J Gastroenterol Hepatol. 2017 Apr;29(4):380-7.
http://www.ncbi.nlm.nih.gov/pubmed/28002118?tool=bestpractice.com
Há um debate contínuo sobre a segurança dos betabloqueadores não seletivos em pacientes com cirrose e ascite refratária. Os critérios expandidos de Baveno VI propuseram que, em pacientes com ascite refratária e (i) pressão arterial sistólica <90 mmHg ou (ii) creatinina sérica >133 micromoles/L (>1.5 mg/dL) ou (iii) hiponatremia <130 milimoles/L, o betabloqueador deve ter sua dosagem reduzida ou até mesmo ser temporariamente descontinuado.[87]de Franchis R, Baveno VI Faculty. Expanding consensus in portal hypertension: report of the Baveno VI Consensus Workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015 Sep;63(3):743-52.
https://www.journal-of-hepatology.eu/article/S0168-8278(15)00349-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/26047908?tool=bestpractice.com
No entanto, há evidências que sugerem que o risco de danos pode não ser significativo.[118]Bossen L, Krag A, Vilstrup H, et al. Nonselective β-blockers do not affect mortality in cirrhosis patients with ascites: Post Hoc analysis of three randomized controlled trials with 1198 patients. Hepatology. 2016 Jun;63(6):1968-76.
http://www.ncbi.nlm.nih.gov/pubmed/26599983?tool=bestpractice.com
[119]Sinha R, Lockman KA, Mallawaarachchi N, et al. Carvedilol use is associated with improved survival in patients with liver cirrhosis and ascites. J Hepatol. 2017 Jul;67(1):40-6.
http://www.ncbi.nlm.nih.gov/pubmed/28213164?tool=bestpractice.com
[120]Leithead JA, Rajoriya N, Tehami N, et al. Non-selective beta-blockers are associated with improved survival in patients with ascites listed for liver transplantation. Gut. 2015 Jul;64(7):1111-9.
http://www.ncbi.nlm.nih.gov/pubmed/25281417?tool=bestpractice.com
[121]Zacharias AP, Jeyaraj R, Hobolth L, et al. Carvedilol versus traditional, non-selective beta-blockers for adults with cirrhosis and gastroesophageal varices. Cochrane Database Syst Rev. 2018 Oct 29;10:CD011510.
https://www.doi.org/10.1002/14651858.CD011510.pub2
http://www.ncbi.nlm.nih.gov/pubmed/30372514?tool=bestpractice.com
Ligação varicosa endoscópica (EVL)
A EVL é uma terapia local que envolve a colocação de faixas elásticas ao redor das varizes esofágicas até que sejam obliteradas. A EVL pode teoricamente ser realizada na mesma sessão da endoscopia de rastreamento, com quase nenhuma contraindicação. As desvantagens da EVL incluem os riscos associados com a sedação, além do risco de causar disfagia, ulceração esofágica, estenose e sangramento. Os efeitos adversos associados à EVL podem ser graves, com relatos de mortes resultantes de úlceras hemorrágicas induzidas pela EVL. A EVL não é capaz de prevenir complicações além da hemorragia varicosa. Endoscopias de vigilância são necessárias após a erradicação das varizes, pelo menos anualmente, para detectar a recorrência das varizes.[122]Gralnek IM, Camus Duboc M, Garcia-Pagan JC, et al. Endoscopic diagnosis and management of esophagogastric variceal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2022 Nov;54(11):1094-120.
http://www.ncbi.nlm.nih.gov/pubmed/36174643?tool=bestpractice.com
Child-Pugh classe C, ascite ou baixo índice de protrombina são indicadores de alto risco de sangramento precoce após uma EVL.[123]Garcia-Pagán JC, Bosch J. Endoscopic band ligation in the treatment of portal hypertension. Nat Clin Pract Gastroenterol Hepatol. 2005 Nov;2(11):526-35.
http://www.ncbi.nlm.nih.gov/pubmed/16355158?tool=bestpractice.com
A escolha sobre o uso de betabloqueadores não seletivos ou EVL deve se basear nos recursos e na experiência locais, na preferência e características do paciente, nas contraindicações e nos eventos adversos.[87]de Franchis R, Baveno VI Faculty. Expanding consensus in portal hypertension: report of the Baveno VI Consensus Workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015 Sep;63(3):743-52.
https://www.journal-of-hepatology.eu/article/S0168-8278(15)00349-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/26047908?tool=bestpractice.com
Uma metanálise que incluiu 1023 pacientes comparou a EVL profilática com betabloqueadores e constatou que não houve diferença entre os tratamentos em relação a hemorragia gastrointestinal, mortalidade por todas as causas ou mortalidade relacionada a hemorragia. Embora tenha havido uma redução na hemorragia por varizes com a EVL, em comparação com os betabloqueadores (risco relativo [RR] de 0.72, IC de 95%: 0.4 a 0.96), a hemorragia por varizes não foi significativamente diferente entre os dois grupos quando apenas os ensaios clínicos de alta qualidade foram considerados (RR de 0.84, IC de 95%: 0.60 a 1.17).[124]Li L, Yu C, Li Y. Endoscopic band ligation versus pharmacological therapy for variceal bleeding in cirrhosis: a meta-analysis. Can J Gastroenterol. 2011 Mar;25(3):147-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3076033
http://www.ncbi.nlm.nih.gov/pubmed/21499579?tool=bestpractice.com
Fatores subjetivos influenciam na escolha do médico ao selecionar betabloqueadores não seletivos versus a EVL, conforme mostrado em um estudo baseado em entrevistas, no qual os gastroenterologistas que passaram pelo menos metade da sua carreira realizando endoscopias tinham maior probabilidade de escolher a EVL, enquanto os médicos com prática menos baseada em procedimentos tinham maior probabilidade de escolher os betabloqueadores não seletivos.[125]Yan K, Bridges JF, Augustin S, et al. Factors impacting physicians' decisions to prevent variceal hemorrhage. BMC Gastroenterol. 2015 May 2;15:55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4423490
http://www.ncbi.nlm.nih.gov/pubmed/25934271?tool=bestpractice.com
Anastomose portossistêmica intra-hepática transjugular (TIPS)
A TIPS pode ser usada como uma opção de tratamento secundário para varizes esofágicas na cirrose, mas não é recomendada para a profilaxia primária de hemorragia varicosa.[2]Kaplan DE, Ripoll C, Thiele M, et al. AASLD practice guidance on risk stratification and management of portal hypertension and varices in cirrhosis. Hepatology. 2024 May 1;79(5):1180-211.
https://journals.lww.com/hep/fulltext/2024/05000/aasld_practice_guidance_on_risk_stratification_and.22.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37870298?tool=bestpractice.com
[126]Jing L, Zhang Q, Chang Z, et al. Nonsurgical secondary prophylaxis of Eesophageal variceal bleeding in cirrhotic patients: a systematic review and network meta-analysis. J Clin Gastroenterol. 2021 Feb 1;55(2):159-68.
http://www.ncbi.nlm.nih.gov/pubmed/33122601?tool=bestpractice.com
Evidências obtidas de ensaios clínicos sobre a terapia profilática com derivação cirúrgica mostram uma taxa consideravelmente maior de encefalopatia e uma tendência a maior mortalidade nos pacientes randomizados para a cirurgia de derivação.[127]D'Amico G, Pagliaro L, Bosch J. The treatment of portal hypertension: a meta-analytic review. Hepatology. 1995 Jul;22(1):332-54.
https://aasldpubs.onlinelibrary.wiley.com/doi/abs/10.1002/hep.1840220145
http://www.ncbi.nlm.nih.gov/pubmed/7601427?tool=bestpractice.com
[128]Li Y, Guo Y, Wang X, et al. Association between sarcopenia and hepatic encephalopathy after transjugular intrahepatic portosystemic shunt in patients with cirrhosis: a systematic review and meta-analysis. Abdom Radiol (NY). 2024 Feb;49(2):575-85.
http://www.ncbi.nlm.nih.gov/pubmed/37980601?tool=bestpractice.com
Devido a evidências de certeza muito baixa, não é possível chegar a conclusões sobre os benefícios e riscos da anastomose portossistêmica, em comparação com intervenções endoscópicas, para os indivíduos com cirrose e sangramento portal hipertensivo (ou seja profilaxia secundária).
[  ]
How do portosystemic shunts compare with endoscopic interventions for prevention of rebleeding in adults with cirrhosis?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3462/fullMostre-me a resposta
]
How do portosystemic shunts compare with endoscopic interventions for prevention of rebleeding in adults with cirrhosis?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3462/fullMostre-me a resposta
Varizes gástricas
Varizes gástricas estão presentes em cerca de 20% dos pacientes com cirrose e podem se apresentar como varizes gástricas isoladas ou como varizes gastroesofágicas.[129]Vine LJ, Subhani M, Acevedo JG. Update on management of gastric varices. World J Hepatol. 2019 Mar 27;11(3):250-60.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6447419
http://www.ncbi.nlm.nih.gov/pubmed/30967903?tool=bestpractice.com
Nestas últimas, as varizes esofágicas se estendem abaixo da cárdia, na curvatura menor do estômago (varizes gastroesofágicas de tipo 1 [VGE 1]) ou no fundo (varizes gastroesofágicas de tipo 2 [VGE 2]).[129]Vine LJ, Subhani M, Acevedo JG. Update on management of gastric varices. World J Hepatol. 2019 Mar 27;11(3):250-60.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6447419
http://www.ncbi.nlm.nih.gov/pubmed/30967903?tool=bestpractice.com
Elas têm fisiologia e características clínicas diferentes, em comparação com as varizes esofágicas. As varizes gástricas sangram com menos frequência, mas de maneira mais significativa que as varizes esofágicas. O sangramento está menos diretamente relacionado com o grau de hipertensão portal e mais relacionado com o tamanho da variz e a tensão na parede.[129]Vine LJ, Subhani M, Acevedo JG. Update on management of gastric varices. World J Hepatol. 2019 Mar 27;11(3):250-60.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6447419
http://www.ncbi.nlm.nih.gov/pubmed/30967903?tool=bestpractice.com
Há pouca literatura sobre o tratamento das varizes gástricas, em comparação com as varizes esofágicas. Assim, a maioria das recomendações se baseia na opinião de especialistas.[129]Vine LJ, Subhani M, Acevedo JG. Update on management of gastric varices. World J Hepatol. 2019 Mar 27;11(3):250-60.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6447419
http://www.ncbi.nlm.nih.gov/pubmed/30967903?tool=bestpractice.com
Atualmente, sugerem-se os betabloqueadores não seletivos para a prevenção primária da hemorragia por varizes de VGE 1 ou varizes gástricas isoladas. O tratamento para VGE 1 deve seguir as orientações acima para varizes esofágicas.
Hemorragia por varizes aguda
Um episódio de hemorragia varicosa aguda deve ser manejado como uma emergência médica com suporte do volume intravascular, transfusão de sangue (com o objetivo de manter a hemoglobina em cerca de 70-80 g/L [7-8 g/dL]) e uma combinação de tratamento endoscópico e farmacológico.[130]Odutayo A, Desborough MJ, Trivella M, et al. Restrictive versus liberal blood transfusion for gastrointestinal bleeding: a systematic review and meta-analysis of randomised controlled trials. Lancet Gastroenterol Hepatol. 2017 May;2(5):354-60.
http://www.ncbi.nlm.nih.gov/pubmed/28397699?tool=bestpractice.com
[131]Barkun AN, Almadi M, Kuipers EJ, et al. Management of nonvariceal upper gastrointestinal bleeding: guideline recommendations from the international consensus group. Ann Intern Med. 2019 Dec 3;171(11):805-22.
http://www.ncbi.nlm.nih.gov/pubmed/31634917?tool=bestpractice.com
A terlipressina (um análogo da vasopressina) ou a somatostatina (ou seu análogo octreotida) devem ser iniciados assim que houver suspeita de sangramento por varizes e continuadas por 2-5 dias se ele for confirmado.[132]Garcia-Tsao G, Abraldes JG, Rich NE, et al. AGA clinical practice update on the use of vasoactive drugs and intravenous albumin in cirrhosis: expert review. Gastroenterology. 2024 Jan;166(1):202-10.
https://www.gastrojournal.org/article/S0016-5085(23)05143-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37978969?tool=bestpractice.com
A endoscopia digestiva alta deve ser realizada dentro de 24 horas para confirmar o diagnóstico e permitir o tratamento com EVL ou escleroterapia.[133]Lau JYW, Yu Y, Tang RSY, et al. Timing of endoscopy for acute upper gastrointestinal bleeding. N Engl J Med. 2020 Apr 2;382(14):1299-308.
https://www.doi.org/10.1056/NEJMoa1912484
http://www.ncbi.nlm.nih.gov/pubmed/32242355?tool=bestpractice.com
A profilaxia com antibióticos em curto prazo (até 7 dias) deve ser instituída em todos os pacientes após uma hemorragia digestiva (independentemente da presença de ascite), pois foi demonstrado que isso diminui a taxa de infecções bacterianas e aumenta a sobrevida.[134]Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI, et al. Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding. Cochrane Database Syst Rev. 2010 Sep 8;(9):CD002907.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002907.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/20824832?tool=bestpractice.com
[  ]
In people with cirrhosis and upper gastrointestinal bleeding, how does antibiotic prophylaxis affect outcomes?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.869/fullMostre-me a resposta A ceftriaxona é a primeira escolha para os pacientes com cirrose descompensada, aqueles que já recebem profilaxia com uma fluoroquinolona e em cenários hospitalares com alta prevalência de infecções bacterianas resistentes a fluoroquinolonas. As fluoroquinolonas orais devem ser usadas nos demais pacientes.[135]Fernández J, Ruiz del Arbol L, Gómez C, et al. Norfloxacin vs ceftriaxone in the prophylaxis of infections in patients with advanced cirrhosis and hemorrhage. Gastroenterology. 2006 Oct;131(4):1049-56.
https://www.gastrojournal.org/article/S0016-5085(06)01535-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/17030175?tool=bestpractice.com
[136]Tandon P, Abraldes JG, Keough A, et al. Risk of bacterial infection in patients with cirrhosis and acute variceal hemorrhage, based on Child-Pugh class, and effects of antibiotics. Clin Gastroenterol Hepatol. 2015 Jun;13(6):1189-96.
https://www.cghjournal.org/article/S1542-3565(14)01710-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/25460564?tool=bestpractice.com
]
In people with cirrhosis and upper gastrointestinal bleeding, how does antibiotic prophylaxis affect outcomes?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.869/fullMostre-me a resposta A ceftriaxona é a primeira escolha para os pacientes com cirrose descompensada, aqueles que já recebem profilaxia com uma fluoroquinolona e em cenários hospitalares com alta prevalência de infecções bacterianas resistentes a fluoroquinolonas. As fluoroquinolonas orais devem ser usadas nos demais pacientes.[135]Fernández J, Ruiz del Arbol L, Gómez C, et al. Norfloxacin vs ceftriaxone in the prophylaxis of infections in patients with advanced cirrhosis and hemorrhage. Gastroenterology. 2006 Oct;131(4):1049-56.
https://www.gastrojournal.org/article/S0016-5085(06)01535-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/17030175?tool=bestpractice.com
[136]Tandon P, Abraldes JG, Keough A, et al. Risk of bacterial infection in patients with cirrhosis and acute variceal hemorrhage, based on Child-Pugh class, and effects of antibiotics. Clin Gastroenterol Hepatol. 2015 Jun;13(6):1189-96.
https://www.cghjournal.org/article/S1542-3565(14)01710-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/25460564?tool=bestpractice.com
O sangramento com risco à vida pode ser controlado com um tubo de Sengstaken-Blakemore ou um stent Danis até que a hemostasia possa ser alcançada endoscopicamente, ou com TIPS, com ou sem embolização.[137]Maiwall R, Jamwal KD, Bhardwaj A, et al. SX-Ella Stent Danis effectively controls refractory variceal bleed in patients with acute-on-chronic liver failure. Dig Dis Sci. 2018 Feb;63(2):493-501.
http://www.ncbi.nlm.nih.gov/pubmed/28780608?tool=bestpractice.com
Desnutrição e sarcopenia
É recomendável que os pacientes hospitalizados com cirrose recebam avaliação formal de um nutricionista, e devem ser tomadas medidas para minimizar o período de jejum antes dos procedimentos (por exemplo, oferecendo-se um lanche antes de dormir ou um lanche no início da manhã, se o procedimento for realizado no fim da tarde).[138]Lai JC, Tandon P, Bernal W, et al. Malnutrition, frailty, and sarcopenia in patients with cirrhosis: 2021 practice guidance by the American Association for the Study of Liver Diseases. Hepatology. 2021 Sep;74(3):1611-44.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9134787
http://www.ncbi.nlm.nih.gov/pubmed/34233031?tool=bestpractice.com
A suplementação parenteral pode ser necessária para os pacientes que não conseguirem atender suas necessidades de ingestão nutricional por via oral. A ingestão recomendada de proteínas para adultos com cirrose é de 1.2 a 1.5 g/kg (peso corporal ideal) ao dia, e 1.2 a 2 g/kg (peso corporal ideal) ao dia em caso de estado crítico.
Peritonite bacteriana espontânea
Uma contagem absoluta de neutrófilos do líquido peritoneal >250 células/mm³ é o critério aceito para o diagnóstico da peritonite bacteriana espontânea.[88]European Association for the Study of the Liver. EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018 Aug;69(2):406-60.
https://www.journal-of-hepatology.eu/article/S0168-8278(18)31966-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29653741?tool=bestpractice.com
O tratamento consiste na administração de antibióticos intravenosos, como a cefotaxima ou uma fluoroquinolona, e solução de albumina intravenosa humana. Foi demonstrado que a albumina reduz a mortalidade em pacientes com cirrose e peritonite bacteriana espontânea.[139]Sort P, Navasa M, Arroyo V, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med. 1999 Aug 5;341(6):403-9.
http://www.nejm.org/doi/full/10.1056/NEJM199908053410603#t=article
http://www.ncbi.nlm.nih.gov/pubmed/10432325?tool=bestpractice.com
[140]Leache L, Gutiérrez-Valencia M, Saiz LC, et al. Meta-analysis: efficacy and safety of albumin in the prevention and treatment of complications in patients with cirrhosis. Aliment Pharmacol Ther. 2023 Mar;57(6):620-34.
http://www.ncbi.nlm.nih.gov/pubmed/36524316?tool=bestpractice.com
Todos os pacientes que sobreviveram a um episódio de peritonite bacteriana espontânea necessitam de profilaxia secundária vitalícia com antibióticos.
Pacientes com ascite e um nível de proteína total no líquido ascítico de ≤10 g/L apresentam alto risco de desenvolver peritonite bacteriana espontânea e devem ser considerados para profilaxia primária com antibióticos.[88]European Association for the Study of the Liver. EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018 Aug;69(2):406-60.
https://www.journal-of-hepatology.eu/article/S0168-8278(18)31966-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29653741?tool=bestpractice.com
[141]Loomba R, Wesley R, Bain A, et al. Role of fluoroquinolones in the primary prophylaxis of spontaneous bacterial peritonitis: meta-analysis. Clin Gastroenterol Hepatol. 2009 Apr;7(4):487-93.
http://www.ncbi.nlm.nih.gov/pubmed/19250986?tool=bestpractice.com
[142]Kamal F, Khan MA, Khan Z, et al. Rifaximin for the prevention of spontaneous bacterial peritonitis and hepatorenal syndrome in cirrhosis: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2017 Oct;29(10):1109-17.
http://www.ncbi.nlm.nih.gov/pubmed/28763340?tool=bestpractice.com
Parece haver um aumento do risco de peritonite bacteriana espontânea com o uso de inibidores da bomba de prótons.[143]Hwang SJ, Lee DH, Koh SJ, et al. Correlation between proton pump inhibitors and the complications of liver cirrhosis: a systematic review and meta-analysis. Turk J Gastroenterol. 2022 Jan;33(1):44-52.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9128585
http://www.ncbi.nlm.nih.gov/pubmed/35040787?tool=bestpractice.com
Não há evidências de alta qualidade para essa intervenção, e são necessários estudos adicionais para estabelecer se a profilaxia com antibióticos é benéfica para os indivíduos com cirrose.[144]Iogna Prat L, Wilson P, Freeman SC, et al. Antibiotic treatment for spontaneous bacterial peritonitis in people with decompensated liver cirrhosis: a network meta-analysis. Cochrane Database Syst Rev. 2019 Sep 16;9:CD013120.
https://www.doi.org/10.1002/14651858.CD013120.pub2
http://www.ncbi.nlm.nih.gov/pubmed/31524949?tool=bestpractice.com
Consulte Peritonite bacteriana espontânea (Abordagem de tratamento).
Hidrotórax hepático
Ocorre em aproximadamente 5% a 10% dos pacientes com cirrose, geralmente nos pacientes com ascite.[145]Badillo R, Rockey DC. Hepatic hydrothorax: clinical features, management, and outcomes in 77 patients and review of the literature. Medicine (Baltimore). 2014 May;93(3):135-42.
https://www.doi.org/10.1097/MD.0000000000000025
http://www.ncbi.nlm.nih.gov/pubmed/24797168?tool=bestpractice.com
O hidrotórax hepático pode causar dispneia. O manejo é semelhante ao da ascite. Em alguns pacientes, são necessários cateteres pleurais de demora de longo prazo para o tratamento sintomático.[146]Baig MA, Majeed MB, Attar BM, et al. Efficacy and safety of indwelling pleural catheters in management of hepatic hydrothorax: a systematic review of literature. Cureus. 2018 Aug 6;10(8):e3110.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6175258
http://www.ncbi.nlm.nih.gov/pubmed/30338185?tool=bestpractice.com
[147]Avula A, Acharya S, Anwar S, et al. Indwelling pleural catheter (IPC) for the management of hepatic hydrothorax: the known and the unknown. J Bronchology Interv Pulmonol. 2022 Jul 1;29(3):179-85.
http://www.ncbi.nlm.nih.gov/pubmed/34753862?tool=bestpractice.com
Os pacientes com hidrotórax hepático devem ser avaliados para transplante de fígado.[148]Xiol X, Tremosa G, Castellote J, et al. Liver transplantation in patients with hepatic hydrothorax. Transpl Int. 2005 Jun;18(6):672-5.
https://onlinelibrary.wiley.com/doi/epdf/10.1111/j.1432-2277.2005.00116.x
http://www.ncbi.nlm.nih.gov/pubmed/15910292?tool=bestpractice.com
Encefalopatia hepática portossistêmica
Aproximadamente 11% dos pacientes com cirrose têm encefalopatia hepática no momento do diagnóstico de cirrose.[149]Jepsen P, Ott P, Andersen PK, et al. Clinical course of alcoholic liver cirrhosis: a Danish population-based cohort study. Hepatology. 2010 May;51(5):1675-82.
https://www.doi.org/10.1002/hep.23500
http://www.ncbi.nlm.nih.gov/pubmed/20186844?tool=bestpractice.com
Cerca de 30% a 40% dos pacientes com cirrose têm um episódio de encefalopatia hepática durante a doença, e existe um risco de 30% a 40% de recorrência no ano seguinte.[150]Sharma BC, Sharma P, Agrawal A, et al. Secondary prophylaxis of hepatic encephalopathy: an open-label randomized controlled trial of lactulose versus placebo. Gastroenterology. 2009 Sep;137(3):885-91, 891.e1.
https://www.doi.org/10.1053/j.gastro.2009.05.056
http://www.ncbi.nlm.nih.gov/pubmed/19501587?tool=bestpractice.com
A encefalopatia hepática é caracterizada por mudanças na consciência, comportamento e personalidade com desorientação, torpor, esquecimento, confusão, agitação e eventual coma. Fala indistinta, asterixis ("flapping"), aumento do tônus muscular e reflexos plantares extensores podem estar presentes.
Os fatores desencadeantes incluem hemorragia gastrointestinal, constipação, diarreia e vômitos, hipoglicemia e desequilíbrio eletrolítico; medicamentos (diuréticos, sedativos) e procedimentos médicos (paracentese, TIPS); infecção, anemia, hipóxia e hipotensão. As toxinas derivadas do intestino, como amônia e produtos bacterianos que induzem inflamação sistêmica, causam encefalopatia hepática.[3]Tapper EB, Parikh ND. Diagnosis and management of cirrhosis and its complications: a review. JAMA. 2023 May 9;329(18):1589-602.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10843851
http://www.ncbi.nlm.nih.gov/pubmed/37159031?tool=bestpractice.com
[18]Haj M, Rockey DC. Ammonia levels do not guide clinical management of patients with hepatic encephalopathy caused by cirrhosis. Am J Gastroenterol. 2020 May;115(5):723-8.
http://www.ncbi.nlm.nih.gov/pubmed/31658104?tool=bestpractice.com
Parece haver aumento do risco de encefalopatia hepática com o uso dos inibidores da bomba de prótons.[151]Shi D, Zhou Z, Dai Y, et al. Proton pump inhibitor therapy and hepatic encephalopathy risk in cirrhotic patients: a systematic review with meta-analysis. Clin Drug Investig. 2019 Sep;39(9):847-56.
http://www.ncbi.nlm.nih.gov/pubmed/31183628?tool=bestpractice.com
[152]Tantai XX, Yang LB, Wei ZC, et al. Association of proton pump inhibitors with risk of hepatic encephalopathy in advanced liver disease: a meta-analysis. World J Gastroenterol. 2019 Jun 7;25(21):2683-98.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6558434
http://www.ncbi.nlm.nih.gov/pubmed/31210719?tool=bestpractice.com
O tratamento envolve identificação e correção dos fatores precipitadores reversíveis e lactulose, usada de forma isolada ou em combinação com antibióticos como a rifaximina.[153]Sharma BC, Sharma P, Lunia MK, et al. A randomized, double-blind, controlled trial comparing rifaximin plus lactulose with lactulose alone in treatment of overt hepatic encephalopathy. Am J Gastroenterol. 2013 Sep;108(9):1458-63.
http://www.ncbi.nlm.nih.gov/pubmed/23877348?tool=bestpractice.com
[154]Gluud LL, Vilstrup H, Morgan MY. Non-absorbable disaccharides versus placebo/no intervention and lactulose versus lactitol for the prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev. 2016 May 6;(5):CD003044.
http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD003044.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27153247?tool=bestpractice.com
[155]Dhiman RK, Thumburu KK, Verma N, et al. Comparative efficacy of treatment options for minimal hepatic encephalopathy: a systematic review and network meta-analysis. Clin Gastroenterol Hepatol. 2020 Apr;18(4):800-12.e25.
https://www.cghjournal.org/article/S1542-3565(19)30969-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/31476436?tool=bestpractice.com
[156]Zacharias HD, Kamel F, Tan J, et al. Rifaximin for prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev. 2023 Jul 19;7(7):CD011585.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011585.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/37467180?tool=bestpractice.com
[157]Ahmed Z, Hassan M, Arif SF, et al. Comparative efficacy of treatment options for the prevention of post-TIPS hepatic encephalopathy: a systematic review and network meta-analysis. J Gastrointestin Liver Dis. 2023 Apr 1;32(1):70-6.
https://jgld.ro/jgld/index.php/jgld/article/view/4508
http://www.ncbi.nlm.nih.gov/pubmed/37004220?tool=bestpractice.com
[158]Nardelli S, Gioia S, Faccioli J, et al. Hepatic encephalopathy - recent advances in treatment and diagnosis. Expert Rev Gastroenterol Hepatol. 2023 Mar;17(3):225-35.
http://www.ncbi.nlm.nih.gov/pubmed/36843291?tool=bestpractice.com
[  ]
Can non-absorbable disaccharides help to prevent or treat hepatic encephalopathy in people with cirrhosis?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1475/fullMostre-me a resposta[Evidência B]0fa90b9d-1299-47be-9f9f-c8d6ff20452eccaBOs dissacarídeos não absorvíveis podem ajudar a prevenir ou tratar a encefalopatia hepática em pessoas com cirrose? O manejo da encefalopatia hepática não é afetado pelos níveis de amônia.[3]Tapper EB, Parikh ND. Diagnosis and management of cirrhosis and its complications: a review. JAMA. 2023 May 9;329(18):1589-602.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10843851
http://www.ncbi.nlm.nih.gov/pubmed/37159031?tool=bestpractice.com
[18]Haj M, Rockey DC. Ammonia levels do not guide clinical management of patients with hepatic encephalopathy caused by cirrhosis. Am J Gastroenterol. 2020 May;115(5):723-8.
http://www.ncbi.nlm.nih.gov/pubmed/31658104?tool=bestpractice.com
A restrição alimentar de proteínas não é recomendada.[159]Vilstrup H, Amodio P, Bajaj J, et al. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver. Hepatology. 2014 Aug;60(2):715-35.
http://www.ncbi.nlm.nih.gov/pubmed/25042402?tool=bestpractice.com
]
Can non-absorbable disaccharides help to prevent or treat hepatic encephalopathy in people with cirrhosis?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1475/fullMostre-me a resposta[Evidência B]0fa90b9d-1299-47be-9f9f-c8d6ff20452eccaBOs dissacarídeos não absorvíveis podem ajudar a prevenir ou tratar a encefalopatia hepática em pessoas com cirrose? O manejo da encefalopatia hepática não é afetado pelos níveis de amônia.[3]Tapper EB, Parikh ND. Diagnosis and management of cirrhosis and its complications: a review. JAMA. 2023 May 9;329(18):1589-602.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10843851
http://www.ncbi.nlm.nih.gov/pubmed/37159031?tool=bestpractice.com
[18]Haj M, Rockey DC. Ammonia levels do not guide clinical management of patients with hepatic encephalopathy caused by cirrhosis. Am J Gastroenterol. 2020 May;115(5):723-8.
http://www.ncbi.nlm.nih.gov/pubmed/31658104?tool=bestpractice.com
A restrição alimentar de proteínas não é recomendada.[159]Vilstrup H, Amodio P, Bajaj J, et al. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver. Hepatology. 2014 Aug;60(2):715-35.
http://www.ncbi.nlm.nih.gov/pubmed/25042402?tool=bestpractice.com
Consulte Encefalopatia hepática (Abordagem de tratamento).
Síndrome hepatorrenal - lesão renal aguda (SHR-LRA)
Em pacientes com cirrose, as causas da lesão renal aguda podem ser hipovolemia, necrose tubular aguda ou síndrome hepatorrenal com lesão renal aguda ou doença renal aguda. As investigações para determinar a causa incluem história detalhada, exame físico, bioquímica sérica, exame microscópico e análise química da urina, biomarcadores urinários selecionados e ultrassonografia renal.[90]Flamm SL, Wong F, Ahn J, et al. AGA clinical practice update on the evaluation and management of acute kidney injury in patients with cirrhosis: expert review. Clin Gastroenterol Hepatol. 2022 Dec;20(12):2707-16.
https://www.cghjournal.org/article/S1542-3565(22)00829-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36075500?tool=bestpractice.com
A SHR-LRA (antes conhecida como síndrome hepatorrenal do tipo 1) pode ser diagnosticada se os pacientes atenderem aos seguintes critérios, conforme definidos pelo International Club of Ascites (ICA):[89]Angeli P, Gines P, Wong F, et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. Gut. 2015 Apr;64(4):531-7.
https://www.doi.org/10.1136/gutjnl-2014-308874
http://www.ncbi.nlm.nih.gov/pubmed/25631669?tool=bestpractice.com
Cirrose com ascite
Diagnóstico de LRA, de acordo com os critérios do ICA-AKI (ou seja, aumento da creatinina sérica ≥26.4 micromoles/mL [≥0.3 mg/dL] em 48 horas; ou aumento percentual da creatinina sérica ≥50% em relação à basal, que tenha ocorrido, de maneira comprovada ou presumida, nos 7 dias anteriores); a American Gastroenterological Association (AGA) também inclui uma redução no débito urinário para menos de 0.5 mL/kg/h por >6 horas[90]Flamm SL, Wong F, Ahn J, et al. AGA clinical practice update on the evaluation and management of acute kidney injury in patients with cirrhosis: expert review. Clin Gastroenterol Hepatol. 2022 Dec;20(12):2707-16.
https://www.cghjournal.org/article/S1542-3565(22)00829-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36075500?tool=bestpractice.com
Ausência de resposta após 2 dias consecutivos de supressão de diurético e expansão do volume plasmático com albumina
Ausência de choque
Nenhum uso atual ou recente de medicamentos nefrotóxicos (AINEs, aminoglicosídeos ou meio de contraste iodado)
Ausência de sinais macroscópicos de lesão renal estrutural. A lesão renal estrutural é indicada por proteinúria (>500 mg/dia), micro-hematúria (>50 eritrócitos por campo de grande aumento) e/ou ultrassonografia renal anormal.
As diretrizes da European Association for the Study of the Liver recomendam o uso de um sistema de estadiamento adaptado para LRA que divide o estágio 1 em estágios 1A e 1B, de acordo com um valor de creatinina sérica de <133 micromoles/L (<1.5 mg/dL) ou ≥133 micromoles/L (≥1.5 mg/dL), respectivamente.[88]European Association for the Study of the Liver. EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018 Aug;69(2):406-60.
https://www.journal-of-hepatology.eu/article/S0168-8278(18)31966-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29653741?tool=bestpractice.com
Podem ser tomadas algumas medidas para prevenir o desenvolvimento de LRA-SHR nos pacientes com cirrose, e incluem:[90]Flamm SL, Wong F, Ahn J, et al. AGA clinical practice update on the evaluation and management of acute kidney injury in patients with cirrhosis: expert review. Clin Gastroenterol Hepatol. 2022 Dec;20(12):2707-16.
https://www.cghjournal.org/article/S1542-3565(22)00829-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36075500?tool=bestpractice.com
Orientar os pacientes para que evitem bebidas alcoólicas
Monitorar os níveis de creatinina e eletrólitos séricos ao se administrarem diuréticos, e evitar o excesso de diuréticos
Evitar paracenteses de grandes volumes sem reposição de albumina
Administrar antibióticos profiláticos quando houver forte suspeita de infecção (as investigações devem incluir a paracentese diagnóstica para avaliar a peritonite bacteriana espontânea)
Evitar o uso de betabloqueadores não seletivos e medicamentos nefrotóxicos (por exemplo, IECAs, antagonistas do receptor de angiotensina II e AINEs).
Após o diagnóstico, o tratamento da causa desencadeante deve ser iniciado, e todos os betabloqueadores não seletivos, diuréticos e AINEs devem ser suspensos ou interrompidos. As perdas de líquidos devem ser repostas, e o status hídrico deve ser monitorado.[90]Flamm SL, Wong F, Ahn J, et al. AGA clinical practice update on the evaluation and management of acute kidney injury in patients with cirrhosis: expert review. Clin Gastroenterol Hepatol. 2022 Dec;20(12):2707-16.
https://www.cghjournal.org/article/S1542-3565(22)00829-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36075500?tool=bestpractice.com
Vasoconstritores e albumina são recomendados para todos os pacientes, e devem ser usados de maneira imediata. A terlipressina associada a albumina deve ser considerada como opção terapêutica de primeira linha.[132]Garcia-Tsao G, Abraldes JG, Rich NE, et al. AGA clinical practice update on the use of vasoactive drugs and intravenous albumin in cirrhosis: expert review. Gastroenterology. 2024 Jan;166(1):202-10.
https://www.gastrojournal.org/article/S0016-5085(23)05143-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37978969?tool=bestpractice.com
A noradrenalina pode ser uma alternativa à terlipressina. No entanto, há várias limitações associadas ao seu uso. A midodrina associada a octreotida pode ser uma opção quando a terlipressina ou a noradrenalina não estiverem disponíveis, mas sua eficácia é muito menor que a da terlipressina.[88]European Association for the Study of the Liver. EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018 Aug;69(2):406-60.
https://www.journal-of-hepatology.eu/article/S0168-8278(18)31966-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29653741?tool=bestpractice.com
[160]Cavallin M, Kamath PS, Merli M, et al. Terlipressin plus albumin versus midodrine and octreotide plus albumin in the treatment of hepatorenal syndrome: a randomized trial. Hepatology. 2015 Aug;62(2):567-74.
https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.27709
http://www.ncbi.nlm.nih.gov/pubmed/25644760?tool=bestpractice.com
Em um ensaio clínico de fase 3 para confirmar a eficácia e a segurança da terlipressina associada a albumina em adultos com SHR-LRA, a terlipressina foi mais efetiva que o placebo na melhora da função renal, mas foi associada a eventos adversos graves, incluindo insuficiência respiratória e casos de sepse ou choque séptico.[161]Wong F, Pappas SC, Curry MP, et al. Terlipressin plus albumin for the treatment of type 1 hepatorenal syndrome. N Engl J Med. 2021 Mar 4;384(9):818-28.
https://www.nejm.org/doi/10.1056/NEJMoa2008290
http://www.ncbi.nlm.nih.gov/pubmed/33657294?tool=bestpractice.com
Para obter mais informações, consulte Síndrome hepatorrenal (Abordagem de tratamento).
Hiponatremia
Os pacientes com cirrose comumente desenvolvem hiponatremia, principalmente com a progressão da doença hepática. A hiponatremia é geralmente bem tolerada.
O manejo inicial consiste na descontinuação do tratamento com diuréticos uma vez que o sódio sérico estiver <130 mEq/L. A restrição de líquidos é geralmente necessária para níveis de sódio sérico <115-120 mEq/L.
Em pacientes com hiponatremia grave, o tratamento com vaptanos pode aumentar o sódio sérico, porém seu uso não reduz a mortalidade, as complicações hepáticas ou a falência renal.[88]European Association for the Study of the Liver. EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018 Aug;69(2):406-60.
https://www.journal-of-hepatology.eu/article/S0168-8278(18)31966-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29653741?tool=bestpractice.com
[114]Dahl E, Gluud LL, Kimer N, et al. Meta-analysis: the safety and efficacy of vaptans (tolvaptan, satavaptan and lixivaptan) in cirrhosis with ascites or hyponatraemia. Aliment Pharmacol Ther. 2012 Oct;36(7):619-26.
http://www.ncbi.nlm.nih.gov/pubmed/22908905?tool=bestpractice.com
Hipercalemia
A hipercalemia é observada com frequência nos pacientes com cirrose (12% a 14% dos pacientes hospitalizados com cirrose).[44]Cai JJ, Wang K, Jiang HQ, et al. Characteristics, risk factors, and adverse outcomes of hyperkalemia in acute-on-chronic liver failure patients. Biomed Res Int. 2019 Feb 27;2019:6025726.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6415283
http://www.ncbi.nlm.nih.gov/pubmed/30937312?tool=bestpractice.com
Ela pode indicar prognóstico desfavorável e pode representar um desafio ao tratamento.[44]Cai JJ, Wang K, Jiang HQ, et al. Characteristics, risk factors, and adverse outcomes of hyperkalemia in acute-on-chronic liver failure patients. Biomed Res Int. 2019 Feb 27;2019:6025726.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6415283
http://www.ncbi.nlm.nih.gov/pubmed/30937312?tool=bestpractice.com
[45]Wallerstedt S, Simrén M, Wahlin S, et al. Moderate hyperkalemia in hospitalized patients with cirrhotic ascites indicates a poor prognosis. Scand J Gastroenterol. 2013 Mar;48(3):358-65.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3581060
http://www.ncbi.nlm.nih.gov/pubmed/23298384?tool=bestpractice.com
O tratamento padrão com um protocolo insulina-glicose para reduzir o potássio sérico pode ser inefetivo em um cenário de cirrose e, portanto, os tratamentos adjuvantes podem ser preferíveis.[162]Lim AKH, Crnobrnja L, Metlapalli M, et al. Observational study of the relative efficacy of insulin-glucose treatment for hyperkalaemia in patients with liver cirrhosis. BMJ Open. 2021 Oct 22;11(10):e051201.
https://bmjopen.bmj.com/content/11/10/e051201.long
http://www.ncbi.nlm.nih.gov/pubmed/34686554?tool=bestpractice.com
Síndrome hepatopulmonar
Resulta da hipertensão portal e ocorre em pelo menos 5% dos pacientes que aguardam o transplante de fígado.[163]Rodríguez-Roisin R, Krowka MJ. Hepatopulmonary syndrome - a liver-induced lung vascular disorder. N Engl J Med. 2008 May 29;358(22):2378-87.
http://www.ncbi.nlm.nih.gov/pubmed/18509123?tool=bestpractice.com
Os sintomas incluem dispneia e platipneia. O diagnóstico inclui o achado de hipoxemia com o gradiente alveolar-arterial elevado, ortodeoxia, e a determinação de dilatação vascular intrapulmonar na ecocardiografia com contraste.
A presença da síndrome hepatopulmonar deve levar à avaliação imediata para transplante de fígado. A afecção geralmente remite após o transplante de fígado.[164]Grilo-Bensusan I, Pascasio-Acevedo JM. Hepatopulmonary syndrome: what we know and what we would like to know. World J Gastroenterol. 2016 Jul 7;22(25):5728-41.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4932208
http://www.ncbi.nlm.nih.gov/pubmed/27433086?tool=bestpractice.com
Hipertensão portopulmonar
Essa complicação é diagnosticada quando achados de hipertensão pulmonar sem explicação estiverem presentes em associação com hipertensão portal. Diferente da síndrome hepatopulmonar, essa afecção pode não se resolver completamente após o transplante de fígado.
Os pacientes com hipertensão pulmonar grave que não melhoram com o uso de vasodilatadores como epoprostenol, bosentana, iloprosta ou sildenafila não são candidatos ao transplante de fígado, em vista do alto risco de morte associado ao procedimento.
Em um ensaio clínico randomizado e controlado, o macitentana, um antagonista dos receptores da endotelina, reduziu significativamente a resistência vascular pulmonar em pacientes com hipertensão portopulmonar em comparação com o placebo.[165]Sitbon O, Bosch J, Cottreel E, et al. Macitentan for the treatment of portopulmonary hypertension (PORTICO): a multicentre, randomised, double-blind, placebo-controlled, phase 4 trial. Lancet Respir Med. 2019 Jul;7(7):594-604.
http://www.ncbi.nlm.nih.gov/pubmed/31178422?tool=bestpractice.com
Insuficiência hepática crônica agudizada
A IHCA é uma forma grave de cirrose agudamente descompensada com insuficiência orgânica e alto risco de mortalidade em curto prazo.[166]European Association for the Study of the Liver. European Association for the Study of the Liver. EASL clinical practice guidelines on acute-on-chronic liver failure. J Hepatol. 2023 Aug;79(2):461-91.
https://www.journal-of-hepatology.eu/article/S0168-8278(23)00244-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37364789?tool=bestpractice.com
É uma síndrome heterogênea; os pacientes afetados têm características de insuficiência hepática (coagulopatia, bilirrubina elevada) e também podem apresentar insuficiência orgânica extra-hepática (rim, pulmão, cérebro ou circulação). A IHCA pode ser desencadeada pelo uso de bebidas alcoólicas, hepatite viral, lesão hepática induzida por medicamento, cirurgia, isquemia ou infecção. Ela é uma condição potencialmente reversível que pode ocorrer em pessoas com doença hepática crônica.
O tratamento inclui ressuscitação, tratamento do fator desencadeante, suporte de órgãos com insuficiência e avaliação para tratamento precoce da infecção. Os pacientes devem ser tratados na unidade de terapia intensiva. Alguns pacientes podem se beneficiar do transplante de fígado.[167]Bajaj JS, O'Leary JG, Lai JC, et al. Acute-on-chronic liver failure clinical guidelines. Am J Gastroenterol. 2022 Feb 1;117(2):225-52.
https://www.doi.org/10.14309/ajg.0000000000001595
http://www.ncbi.nlm.nih.gov/pubmed/35006099?tool=bestpractice.com
O tratamento de choque na IHCA pode ser desafiador. As diretrizes da Society of Critical Care Medicine recomendam usar albumina como fluidoterapia em vez de outros fluidos, principalmente quando a albumina sérica estiver abaixo de 3 mg/dL.[168]Nanchal R, Subramanian R, Karvellas CJ, et al. Guidelines for the management of adult acute and acute-on-chronic liver failure in the ICU: cardiovascular, endocrine, hematologic, pulmonary, and renal considerations. Crit Care Med. 2020 Mar;48(3):e173-91.
https://journals.lww.com/ccmjournal/Fulltext/2020/03000/Guidelines_for_the_Management_of_Adult_Acute_and.29.aspx
http://www.ncbi.nlm.nih.gov/pubmed/32058387?tool=bestpractice.com
As diretrizes recomendam uma meta de pressão arterial média de 65 mmHg juntamente com o monitoramento hemodinâmico invasivo.[168]Nanchal R, Subramanian R, Karvellas CJ, et al. Guidelines for the management of adult acute and acute-on-chronic liver failure in the ICU: cardiovascular, endocrine, hematologic, pulmonary, and renal considerations. Crit Care Med. 2020 Mar;48(3):e173-91.
https://journals.lww.com/ccmjournal/Fulltext/2020/03000/Guidelines_for_the_Management_of_Adult_Acute_and.29.aspx
http://www.ncbi.nlm.nih.gov/pubmed/32058387?tool=bestpractice.com
[169]Karvellas CJ, Bajaj JS, Kamath PS, et al. AASLD practice guidance on acute-on-chronic liver failure and the management of critically ill patients with cirrhosis. Hepatology. 2024 Jun 1;79(6):1463-502.
https://journals.lww.com/hep/fulltext/2024/06000/aasld_practice_guidance_on_acute_on_chronic_liver.25.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37939273?tool=bestpractice.com
Nos pacientes com IHCA e hipotensão, albumina humana ou cristaloides devem ser usados para a fluidoterapia inicial.[166]European Association for the Study of the Liver. European Association for the Study of the Liver. EASL clinical practice guidelines on acute-on-chronic liver failure. J Hepatol. 2023 Aug;79(2):461-91.
https://www.journal-of-hepatology.eu/article/S0168-8278(23)00244-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37364789?tool=bestpractice.com
Se for necessário o uso de vasopressores, a noradrenalina é mais efetiva que a dopamina para reverter a hipotensão. A EASL recomenda não usar dopamina nos pacientes com IHCA.[166]European Association for the Study of the Liver. European Association for the Study of the Liver. EASL clinical practice guidelines on acute-on-chronic liver failure. J Hepatol. 2023 Aug;79(2):461-91.
https://www.journal-of-hepatology.eu/article/S0168-8278(23)00244-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37364789?tool=bestpractice.com
A vasopressina em baixas doses pode ser adicionada à noradrenalina nos pacientes com IHCA que continuarem hipotensos apesar da ressuscitação fluídica. A American Association for the Study of Liver Diseases (AASLD) e a EASL recomendam a noradrenalina como agente de primeira linha e a vasopressina como agente de segunda linha para o tratamento de pacientes com hipotensão.[166]European Association for the Study of the Liver. European Association for the Study of the Liver. EASL clinical practice guidelines on acute-on-chronic liver failure. J Hepatol. 2023 Aug;79(2):461-91.
https://www.journal-of-hepatology.eu/article/S0168-8278(23)00244-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37364789?tool=bestpractice.com
[169]Karvellas CJ, Bajaj JS, Kamath PS, et al. AASLD practice guidance on acute-on-chronic liver failure and the management of critically ill patients with cirrhosis. Hepatology. 2024 Jun 1;79(6):1463-502.
https://journals.lww.com/hep/fulltext/2024/06000/aasld_practice_guidance_on_acute_on_chronic_liver.25.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37939273?tool=bestpractice.com
O possível benefício de mortalidade com a adição da vasopressina deve ser ponderado em relação ao aumento do risco de isquemia digital. Além de abordar o tratamento do choque, as diretrizes também fornecem recomendações para o manejo das características endócrinas, hematológicas, pulmonares e renais da IHCA no cenário de uma unidade de terapia intensiva.[168]Nanchal R, Subramanian R, Karvellas CJ, et al. Guidelines for the management of adult acute and acute-on-chronic liver failure in the ICU: cardiovascular, endocrine, hematologic, pulmonary, and renal considerations. Crit Care Med. 2020 Mar;48(3):e173-91.
https://journals.lww.com/ccmjournal/Fulltext/2020/03000/Guidelines_for_the_Management_of_Adult_Acute_and.29.aspx
http://www.ncbi.nlm.nih.gov/pubmed/32058387?tool=bestpractice.com
[169]Karvellas CJ, Bajaj JS, Kamath PS, et al. AASLD practice guidance on acute-on-chronic liver failure and the management of critically ill patients with cirrhosis. Hepatology. 2024 Jun 1;79(6):1463-502.
https://journals.lww.com/hep/fulltext/2024/06000/aasld_practice_guidance_on_acute_on_chronic_liver.25.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37939273?tool=bestpractice.com
Transplante de fígado
Os pacientes que desenvolvem complicações da cirrose como carcinoma hepatocelular ou sinais de descompensação (ascite, icterícia, hemorragia varicosa, encefalopatia portossistêmica, síndrome hepatorrenal ou hepatopulmonar) devem ser encaminhados imediatamente para avaliação para transplante de fígado. A avaliação para transplante pode ser um processo prolongado e o encaminhamento precoce é preferível. Alguns pacientes com IHCA podem se beneficiar do transplante de fígado.[167]Bajaj JS, O'Leary JG, Lai JC, et al. Acute-on-chronic liver failure clinical guidelines. Am J Gastroenterol. 2022 Feb 1;117(2):225-52.
https://www.doi.org/10.14309/ajg.0000000000001595
http://www.ncbi.nlm.nih.gov/pubmed/35006099?tool=bestpractice.com
O transplante de fígado ortotópico continua sendo a única opção de tratamento curativa para pacientes com cirrose descompensada.
Os sistemas de alocação de fígados variam. Nos EUA, a alocação de fígados é baseada no escore Model of End-Stage Liver Disease (MELD), que faz uma estimativa do risco de mortalidade em 3 meses.[68]Kamath PS, Wiesner RH, Malinchoc M, et al. A model to predict survival in patients with end-stage liver disease. Hepatology. 2001 Feb;33(2):464-70.
http://www.ncbi.nlm.nih.gov/pubmed/11172350?tool=bestpractice.com
[
Escore MELDNa (para fins de listagem de transplantes de fígado, não é adequado para pacientes com menos de 12 anos de idade ) (unidades SI)
Opens in new window
]
Um benefício do transplante de fígado para a sobrevida é observado quando o escore de MELD é ≥15. Nas crianças com idade <12 anos, é usada uma versão complementar do escore de MELD, chamado escore de Paediatric End-Stage Liver Disease (PELD).[170]Lucey MR, Furuya KN, Foley DP. Liver transplantation. N Engl J Med. 2023 Nov 16;389(20):1888-900.
http://www.ncbi.nlm.nih.gov/pubmed/37966287?tool=bestpractice.com
Há, no entanto, uma escassez de doadores de órgãos. Em 2021, 9236 transplantes de fígado foram realizados nos EUA, com a lista de espera atual em 11,185 candidatos.[171]United Network for Organ Sharing. Transplant trends. 2022 [internet publication].
https://unos.org/data/transplant-trends
Como resultado, um número significativo de pacientes morre enquanto aguarda por um doador de órgãos.
A presença de sarcopenia ou fragilidade pode afetar os desfechos do transplante de fígado. Em um estudo, descobriu-se que a sarcopenia esteve associada a desfechos adversos após o transplante de fígado em pacientes com cirrose descompensada.[172]Zhou D, Zhang D, Zeng C, et al. Impact of sarcopenia on the survival of patients undergoing liver transplantation for decompensated liver cirrhosis. J Cachexia Sarcopenia Muscle. 2023 Dec;14(6):2602-12.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10751414
http://www.ncbi.nlm.nih.gov/pubmed/37735907?tool=bestpractice.com
Uma revisão sistemática de 34 estudos concluiu que os pacientes com fragilidade leve a moderada ou sarcopenia devem ser priorizados para transplante de fígado devido ao aumento da mortalidade na lista de espera mas, se a fragilidade ou sarcopenia for grave, os pacientes podem ser removidos da lista, pois o prognóstico é desfavorável.[173]Ferreira AP, Machado MV. Impact of pretransplant frailty and sarcopenia on the post-transplant prognosis of patients with liver cirrhosis: a systematic review. Eur J Gastroenterol Hepatol. 2021 Dec 1;33(1s suppl 1):e883-97.
http://www.ncbi.nlm.nih.gov/pubmed/35048655?tool=bestpractice.com
Cuidados paliativos
Como a cirrose é uma doença limitante da vida, os cuidados paliativos devem ser oferecidos junto com outras terapias curativas, e podem ser relevantes para os pacientes com cirrose compensada e com cirrose descompensada.[174]Tandon P, Walling A, Patton H, et al. AGA clinical practice update on palliative care management in cirrhosis: expert review. Clin Gastroenterol Hepatol. 2021 Apr;19(4):646-56.
https://www.cghjournal.org/article/S1542-3565(20)31561-5/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/33221550?tool=bestpractice.com
A American Gastroenterological Association e a AASLD publicaram diretrizes sobre cuidados paliativos em pacientes com cirrose. Elas promovem o planejamento antecipado dos cuidados, a avaliação e manejo dos sintomas (incluindo dor, dispneia, cãibras musculares, disfunção sexual, insônia, sonolência diurna, fadiga, prurido, ansiedade e depressão), o rastreamento para as necessidades do cuidador e acompanhamento precoce com equipes locais de cuidados paliativos.[174]Tandon P, Walling A, Patton H, et al. AGA clinical practice update on palliative care management in cirrhosis: expert review. Clin Gastroenterol Hepatol. 2021 Apr;19(4):646-56.
https://www.cghjournal.org/article/S1542-3565(20)31561-5/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/33221550?tool=bestpractice.com
[175]Rogal SS, Hansen L, Patel A, et al. AASLD practice guidance: palliative care and symptom-based management in decompensated cirrhosis. Hepatology. 2022 Sep;76(3):819-53.
https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32378
http://www.ncbi.nlm.nih.gov/pubmed/35103995?tool=bestpractice.com
Deve-se dar atenção especial ao manejo da dor crônica no contexto de uma função hepática reduzida e aos novos tratamentos para ascite refratária.[175]Rogal SS, Hansen L, Patel A, et al. AASLD practice guidance: palliative care and symptom-based management in decompensated cirrhosis. Hepatology. 2022 Sep;76(3):819-53.
https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32378
http://www.ncbi.nlm.nih.gov/pubmed/35103995?tool=bestpractice.com
 ]
A gravidade da doença no momento da colocação da TIPS é um importante fator preditivo de desfechos.[112]
]
A gravidade da doença no momento da colocação da TIPS é um importante fator preditivo de desfechos.[112]
 ]
Varizes de alto risco incluem varizes com sinais vermelhos, varizes médias ou grandes, independentemente da classificação de Child-Pugh, ou varizes pequenas em pacientes com classificação de Child-Pugh C.[88]
]
Varizes de alto risco incluem varizes com sinais vermelhos, varizes médias ou grandes, independentemente da classificação de Child-Pugh, ou varizes pequenas em pacientes com classificação de Child-Pugh C.[88] ]
]
 ]
A ceftriaxona é a primeira escolha para os pacientes com cirrose descompensada, aqueles que já recebem profilaxia com uma fluoroquinolona e em cenários hospitalares com alta prevalência de infecções bacterianas resistentes a fluoroquinolonas. As fluoroquinolonas orais devem ser usadas nos demais pacientes.[135][136]
]
A ceftriaxona é a primeira escolha para os pacientes com cirrose descompensada, aqueles que já recebem profilaxia com uma fluoroquinolona e em cenários hospitalares com alta prevalência de infecções bacterianas resistentes a fluoroquinolonas. As fluoroquinolonas orais devem ser usadas nos demais pacientes.[135][136] ]
[Evidência B] O manejo da encefalopatia hepática não é afetado pelos níveis de amônia.[3][18] A restrição alimentar de proteínas não é recomendada.[159]
]
[Evidência B] O manejo da encefalopatia hepática não é afetado pelos níveis de amônia.[3][18] A restrição alimentar de proteínas não é recomendada.[159]