Abordaje
El fracaso a la hora de identificar la obesidad en los niños, un factor de riesgo primario para la diabetes mellitus de tipo 2 (DMT2), resulta en la pérdida de oportunidades para realizar una evaluación de riesgos, realizar pruebas para la DMT2 y otras comorbilidades relacionadas con la obesidad y brindar asesoramiento sobre las modificaciones del estilo de vida.
Antecedentes
La mayoría de los niños con DMT2 tiene sobrepeso. Los niños con antecedentes raciales/étnicos de alto riesgo, incluidos los de raza negra y los indoasiáticos, se ven afectados con frecuencia.
Los niños con DMT2 a menudo padecen poliuria leve o ausente, nicturia y polidipsia en el momento de la presentación. También solo en ocasiones aisladas presentan pérdida de peso. Es posible que se quejen de fatiga, visión borrosa o infecciones por hongos en áreas intertriginosas. Se debe interrogar a los pacientes con obesidad grave acerca de los signos clínicos de la apnea obstructiva del sueño, incluida la fatiga durante el día, los ronquidos y las pausas nocturnas en la respiración >5 segundos. Si bien la cetoacidosis diabética es menos frecuente en la DMT2 que en la diabetes mellitus de tipo 1 (DMT1), la disfunción de las células beta debido a la insulinopenia por toxicidad glucosa resulta en cetosis en hasta un tercio de los niños, y en cetoacidosis en el 15% de los niños con DMT2 en el momento de la presentación. Puede haber antecedentes de infecciones urinarias o cutáneas recurrentes.
Pueden presentarse antecedentes positivos de DMT2 en un pariente de primer o segundo grado. Asimismo se deben obtener los antecedentes de obesidad maternal y diabetes gestacional, en caso de existir. El niño pudo haber presentado bajo peso al nacer y puede tener un antecedente de rápido crecimiento en la infancia. Se recomienda obtener una historia de las prácticas de alimentación en la infancia, ya que el período de lactancia materna reduce el odds ratio de la obesidad infantil aproximadamente un 20% en comparación con la lactancia con leche de fórmula.[41] Se puede interrogar a las niñas acerca de sus antecedentes menstruales para evaluar la posibilidad de síndrome del ovario poliquístico.
El cribado para la DMT2 se recomienda para cualquier persona isleña del Estrecho de Torres o aborigen de Australia >10 años (o que haya pasado el inicio de la pubertad) y que tenga sobrepeso u obesidad, tenga una historia familiar positiva de diabetes, tenga signos de resistencia a la insulina, tenga dislipidemia, haya recibido tratamiento con psicotrópicos o haya estado expuesta a un entorno intrauterino diabético.[54]
Exploración física
Los médicos de medicina general deben calcular y marcar el índice de masa corporal (IMC) en cada visita para identificar a los niños que tienen o están en riesgo de desarrollar obesidad (es decir, entrecruzamiento de percentiles en el gráfico del IMC). Se debe marcar la circunferencia de la cintura en el gráfico adecuado para la edad, género y grupo étnico, y se debe utilizar como indicador de distribución visceral de la grasa. La mayoría de los niños con DMT2 tendrá un IMC y una circunferencia de cintura >percentil 85.
Se puede examinar al paciente en busca de acantosis pigmentaria, observada en el 90% al 95% de los pacientes con DMT2. Esta es una manifestación cutánea de la resistencia a la insulina que se caracteriza por presentar la piel hiperpigmentada y aterciopelada, más a menudo en las áreas intertriginosas como la axila o el cuello. Sin embargo, la acantosis pigmentaria no es específica de la DMT2 y se puede observar también en niños con obesidad y DMT1. Otros cambios de la piel pueden incluir celulitis o abscesos. Se debe examinar al paciente en busca de infecciones por hongos, que se encuentran con mayor frecuencia en las áreas vaginal y peneana y entre los pliegues de la piel.
Se debe evaluar cuidadosamente el estado puberal, ya que un estado prepuberal en pacientes con DMT2 es infrecuente y debe despertar sospechas de DMT1.[Figure caption and citation for the preceding image starts]: Acantosis pigmentariaDe la colección de la Dra. Jennifer Miller [Citation ends].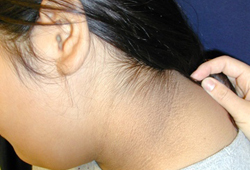 [Figure caption and citation for the preceding image starts]: Acantosis pigmentaria en un niño con obesidadDe la colección de la Dra. Jennifer Miller [Citation ends].
[Figure caption and citation for the preceding image starts]: Acantosis pigmentaria en un niño con obesidadDe la colección de la Dra. Jennifer Miller [Citation ends].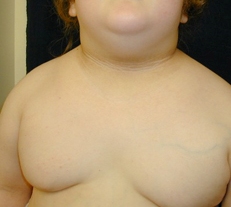 [Figure caption and citation for the preceding image starts]: Acantosis pigmentaria en los pliegues del cuelloDe la colección de la Dra. Jennifer Miller [Citation ends].
[Figure caption and citation for the preceding image starts]: Acantosis pigmentaria en los pliegues del cuelloDe la colección de la Dra. Jennifer Miller [Citation ends].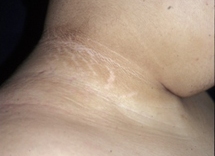 [Figure caption and citation for the preceding image starts]: Acantosis pigmentaria en la axilaDe la colección de la Dra. Jennifer Miller [Citation ends].
[Figure caption and citation for the preceding image starts]: Acantosis pigmentaria en la axilaDe la colección de la Dra. Jennifer Miller [Citation ends].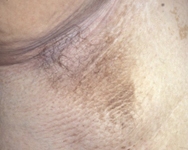
Pruebas diagnósticas
Se puede usar una de cuatro pruebas para confirmar la hiperglucemia y llegar al diagnóstico:[1]
Glucosa plasmática en ayunas ≥7.0 mmol/L (≥126 mg/dL)
Glucosa plasmática al azar ≥11.1 mmol/L (≥200 mg/dL) con síntomas típicos de hiperglucemia o crisis hiperglucémica
Glucosa plasmática ≥11.1 mmol/L (≥200 mg/dL) 2 horas después de 75 de glucosa oral
Hemoglobina A1c (HbA1c) ≥48 mmol/mol (6.5%).
En ausencia de una hiperglucemia inequívoca, el diagnóstico requiere dos resultados anormales en la misma muestra, o en dos muestras distintas.[1]
Pruebas diagnósticas adicionales
Se recomienda medir la HbA1c inicial en todos los pacientes en el momento del diagnóstico. Esta indica la glucemia promedio durante los 3 meses previos y es una prueba útil para monitorizar la diabetes.[1]
El péptido C se produce en cantidades iguales a las de la insulina y es la mejor medida de la secreción de insulina endógena en pacientes con diabetes. Las pruebas rutinarias del péptido C no son útiles para el diagnóstico de la diabetes, pero la medición del péptido C puede ser útil para diferenciar la DMT1 de la DMT2.[55] La prueba de péptido C mejor documentada es la prueba de estimulación con glucagón (GST), pero se ha demostrado que el péptido C en sangre "aleatorizada" sin ayuno se correlaciona con el péptido C en ayunas y las muestras post-GST en individuos con DMT1 o DMT2 bien definidas.[56] El desarrollo de una deficiencia absoluta de insulina es una característica clave de la DMT1, que se traduce en una baja (<0.2 nanomol/L) o no detectables de péptido C en plasma.[55] Un nivel de péptido C en sangre "aleatorio" en ayunas o sin ayuno >1 nanomol/L sugiere DMT2.[55] Los resultados del péptido C deben interpretarse en el contexto clínico de la duración de la enfermedad, las comorbilidades y los antecedentes familiares.[56]
Aunque el péptido C puede ser útil para evaluar la producción endógena de insulina, tanto la DMT1 como la DMT2 pueden asociarse a insulinopenia, y la producción endógena de insulina puede detectarse en algunos individuos con DMT1 durante periodos prolongados tras el diagnóstico. Por lo tanto, las pruebas de autoinmunidad son más útiles para identificar la diabetes inmunomediada, la forma más prevalente de DMT1.
Los autoanticuerpos contra la insulina, la descarboxilasa del ácido glutámico, las células de los islotes, los antígenos de los islotes y el transportador de zinc 8 deben medirse en todos los pacientes para excluir el diagnóstico de DMT1.[1] Los resultados de las pruebas de autoanticuerpos pancreáticos pueden no estar siempre disponibles al inicio del tratamiento. Será necesario ajustar el tratamiento si los pacientes dan positivo en autoanticuerpos pancreáticos y se confirma el diagnóstico de diabetes de tipo 1. Para más información, consulte Diabetes mellitus de tipo 1.
También es importante tener en cuenta la diabetes monogénica en el diferencial del tipo de diabetes, ya que representa hasta el 4% de los casos de diabetes pediátrica.[57] Ambas formas principales de diabetes monogénica son la diabetes del adulto joven (MODY) y la diabetes neonatal.[1] Las pruebas genéticas para detectar la MODY son necesarias en aquellas personas que no presentan los signos típicos de la DMT1 o la DMT2 (p. ej., ausencia de obesidad, autoanticuerpos negativos) y que presentan antecedentes familiares de diabetes en generaciones sucesivas.[1] Las pruebas genéticas para la diabetes neonatal son necesarias si a un individuo se le diagnostica diabetes en los primeros 6 meses de vida.[1]
Se recomienda que en el momento del diagnóstico se realice una medición de la presión arterial, un perfil lipídico en ayunas, una evaluación de la albuminuria, pruebas de la función hepática y un examen ocular con fundascopia dilatada.[1]
Hipertensión: se debe controlar la presión arterial en cada visita con un brazalete del tamaño adecuado, mientras el niño está sentado en reposo.[1][58] Los niveles deben compararse con los estándares adecuados según la edad, el género y la estatura. Con frecuencia, la hipertensión está presente en el momento del diagnóstico. La monitorización ambulatoria de la presión arterial debe considerarse seriamente si la presión arterial es alta (presión arterial ≥90 percentil para edad, sexo y altura o, en adolescentes de ≥13 años, ≥120/80 mmHg) en tres mediciones separadas.[1]
Dislipidemia: se debe controlar un lipidograma en ayunas y la alanina aminotransferasa (ALT) y la aspartato aminotransferasa (AST) para la hepatopatía esteatósica asociada a disfunción metabólica (anteriormente llamada enfermedad del hígado graso no alcohólico), en el momento del diagnóstico, después del diagnóstico y anualmente a partir de entonces.
Retinopatía diabética: debe realizarse una exploración ocular con fondo de ojo dilatado en el momento del diagnóstico, y posteriormente cada año en la mayoría de los pacientes. La exploración cada 2 años puede ser adecuada si se cumplen los objetivos glucémicos y el examen oftalmológico anterior es normal.
Nefropatía diabética: la relación albúmina/creatinina en orina y la tasa de filtración glomerular estimada deben evaluarse en el momento del diagnóstico y, posteriormente, cada año. La derivación a un especialista está justificada en presencia de un empeoramiento de la relación albúmina/creatinina o una disminución de la TFGe.
Neuropatía diabética: inspeccionar los pies, evaluar los pulsos del pie, realizar pruebas de punción y de sensibilidad con monofilamento de 10 g, comprobar la sensación de vibración con un diapasón de 128 Hz y comprobar los reflejos del tobillo en el momento del diagnóstico y posteriormente una vez al año.
Apnea obstructiva del sueño: debe realizarse un cribado de los síntomas en cada visita, con derivación a un especialista pediátrico del sueño para su evaluación y un polisomnograma si el cribado es positivo.[1]
Síndrome del ovario poliquístico: las adolescentes con DMT2 deben ser evaluadas para detectar síntomas de síndrome de ovario poliquístico en el momento del diagnóstico y en revisiones posteriores, con estudios de laboratorio cuando esté indicado.[1]
La evaluación psicosocial también es importante; en el momento del diagnóstico y durante la atención de seguimiento de rutina, detectar problemas psicosociales y factores estresantes familiares que podrían tener un impacto negativo en el control de la diabetes, como la angustia por la diabetes, los síntomas depresivos, los trastornos alimentarios, los factores familiares y los problemas de salud conductual. Remitir al paciente a un profesional de la salud mental con experiencia (preferiblemente con experiencia en diabetes infantil) si es necesario para una evaluación y un tratamiento adicionales.[1] Se recomienda un cribado específico del malestar psicosocial y relacionado con la diabetes en torno a los 7-8 años de edad.[1]
Se debe continuar con la monitorización y el tratamiento de las complicaciones.[1] Para más detalles sobre la monitorización continua, véase Monitorización.
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad