Enfermedades hereditarias frecuentes de depósito lisosomal
- Descripción general
- Teoría
- Diagnóstico
- Manejo
- Seguimiento
- Recursos
Algoritmo de tratamiento
Tenga en cuenta que las formulaciones/vías y dosis pueden diferir entre los nombres y marcas de los fármacos, las fórmulas de los fármacos o las localizaciones. Las recomendaciones de tratamiento son específicas para cada grupo de pacientes: ver aviso legal
enfermedad de Gaucher tipo 1
terapia de soporte
Como son enfermedades multisistémicas, un enfoque multidisciplinario es esencial; es posible que muchos especialistas distintos participen en el cuidado de los pacientes. Se recomienda la participación temprana de los centros especializados; los cuidados deben estar coordinados por el centro.
El médico debe monitorizar la presencia de enfermedades óseas, neoplasias hematológicas, anomalías endocrinas y metabólicas, enfermedad de Parkinson y cirrosis hepática, y tratar estas complicaciones a medida que surjan.
terapia de reposición enzimática
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
Se debe tratar a todos los pacientes bajo la supervisión de un especialista. La reducción de la dosis es posible una vez que los pacientes se han estabilizado.
El tratamiento de pacientes asintomáticos no está justificado.[99]Kaplan P, Baris H, De Meirleir L, et al. Revised recommendations for the management of Gaucher disease in children. Eur J Pediatr. 2013 Apr;172(4):447-58. http://www.ncbi.nlm.nih.gov/pubmed/22772880?tool=bestpractice.com Sin embargo, la terapia de reposición enzimática (TRE) debe considerarse en todos los niños sintomáticos y en los adultos con reducciones significativas en los recuentos sanguíneos (p. ej., nivel de hemoglobina <100 g/L [10 g/dL], plaquetas <100 x 10⁹/L), agrandamiento significativo de los órganos (p. ej., tamaño del bazo >10 veces el normal), la presencia de enfermedad esquelética demostrada en la resonancia magnética, y/o cualquier otro daño orgánico (p. ej., evidencia de daño pulmonar).[99]Kaplan P, Baris H, De Meirleir L, et al. Revised recommendations for the management of Gaucher disease in children. Eur J Pediatr. 2013 Apr;172(4):447-58. http://www.ncbi.nlm.nih.gov/pubmed/22772880?tool=bestpractice.com [100]Hughes D, Cappellini MD, Berger M, et al. Recommendations for the management of the haematological and onco-haematological aspects of Gaucher disease. Br J Haematol. 2007 Sep;138(6):676-86. https://onlinelibrary.wiley.com/doi/10.1111/j.1365-2141.2007.06701.x http://www.ncbi.nlm.nih.gov/pubmed/17655728?tool=bestpractice.com Se ha demostrado el beneficio de la TRE en la mejora de las alteraciones hematológicas, del dolor óseo y en la reducción del tamaño del hígado y del bazo. La densidad ósea, la función pulmonar y la calidad de vida también mejoran.[106]Barton NW, Brady RO, Dambrosia JM, et al. Replacement therapy for inherited enzyme deficiency - macrophage-targeted glucocerebrosidase for Gaucher's disease. N Engl J Med. 1991 May 23;324(21):1464-70. http://www.ncbi.nlm.nih.gov/pubmed/2023606?tool=bestpractice.com [107]Weinreb NJ, Charrow J, Andersson HC, et al. Effectiveness of enzyme replacement therapy in 1028 patients with type I Gaucher disease after 2 to 5 years of treatment: a report from the Gaucher Registry. Am J Med. 2002 Aug 1;113(2):112-9. http://www.ncbi.nlm.nih.gov/pubmed/12133749?tool=bestpractice.com [108]Gabrowski GA, Kolodny EH, Weinreb NJ, et al. Gaucher disease: phenotypic and genetic variation. In: Scriver CR, Beaudet AL, Sly WS, et al., eds. The metabolic and molecular basis of inherited disease. 9th ed. New York, NY: McGraw-Hill; 2006.
La taliglucerasa es una forma de TRE de origen vegetal. En 2012, la Administración de Medicamentos y Alimentos de Estados Unidos aprobó su uso para la enfermedad de Gaucher, pero el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) recomendó que no se autorizara su comercialización.
La TRE se ha asociado a reacciones de hipersensibilidad graves, anafilaxia y reacciones relacionadas con la infusión. Considere la posibilidad de premedicación con un antihistamínico, antipirético y/o corticosteroide.
Opciones primarias
imiglucerasa: niños y adultos: 60 unidades/kg por vía intravenosa cada 2 semanas inicialmente, ajuste según la respuesta
O
velaglucerasa alfa: niños ≥4 años de edad y adultos: 60 unidades/kg por vía intravenosa cada 2 semanas inicialmente, ajuste según la respuesta
O
taliglucerasa alfa: niños ≥4 años de edad y adultos: 60 unidades/kg por vía intravenosa cada 2 semanas inicialmente, ajuste según la respuesta
terapia de reducción de sustrato
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
Es adecuada para pacientes afectados de menor gravedad que no toleran el tratamiento por vía intravenosa o que son alérgicos a los preparados disponibles de terapia de reposición enzimática.
La terapia de reducción de sustrato ha demostrado mejorar la anemia, la trombocitopenia, el agrandamiento de hígado/bazo y la osteoporosis.[109]Mistry PK, Lukina E, Ben Turkia H, et al. Effect of oral eliglustat on splenomegaly in patients with Gaucher disease type 1: the ENGAGE randomized clinical trial. JAMA. 2015 Feb 17;313(7):695-706. http://jama.jamanetwork.com/article.aspx?articleid=2110969 http://www.ncbi.nlm.nih.gov/pubmed/25688781?tool=bestpractice.com [110]Cox TM, Aerts JM, Andria G, et al. The role of the iminosugar N-butyldeoxynorjirimycin (miglustat) in the management of type 1 (non-neuronopathic) Gaucher disease: a position statement. J Inherit Metab Dis. 2003;26(6):513-26. http://www.ncbi.nlm.nih.gov/pubmed/14605497?tool=bestpractice.com [111]Cox T, Lachmann R, Hollak C, et al. Novel oral treatment of Gaucher's disease with N-butyldeoxynojirimycin (OGT 918) to decrease substrate biosynthesis. Lancet. 2000 Apr 29;355(9214):1481-5. http://www.ncbi.nlm.nih.gov/pubmed/10801168?tool=bestpractice.com [112]Pastores GM, Giraldo P, Cherin P, et al. Goal-oriented therapy with miglustat in Gaucher disease. Curr Med Res Opin. 2009 Jan;25(1):23-37. http://www.ncbi.nlm.nih.gov/pubmed/19210136?tool=bestpractice.com [113]Poole RM. Eliglustat: first global approval. Drugs. 2014 Oct;74(15):1829-36. http://www.ncbi.nlm.nih.gov/pubmed/25239269?tool=bestpractice.com
Opciones primarias
miglustat: adultos: 100 mg por vía oral tres veces al día, ajustar según la respuesta
Más miglustatHay varias marcas de miglustat disponibles; asegúrese de utilizar la marca correcta para esta indicación.
O
eliglustat: adultos: la dosis depende del genotipo CYP2D6 y la coadministración de medicamentos que interactúan; consulte a un especialista para obtener información sobre la dosis
Más eliglustatAntes de iniciar el tratamiento, establezca el genotipo del paciente mediante una prueba validada que determine el genotipo CYP2D6.[169]National Institute for Health and Care Excellence. Eliglustat for treating type 1 Gaucher disease. Jun 2017 [internet publication]. https://www.nice.org.uk/guidance/hst5
enfermedad de Gaucher tipo 2
terapia de soporte
Como son enfermedades multisistémicas, un enfoque multidisciplinario es esencial; es posible que muchos especialistas distintos participen en el cuidado de los pacientes. Se recomienda la participación temprana de los centros especializados; los cuidados deben estar coordinados por el centro.
La enfermedad de Gaucher tipo 2 es prácticamente intratable. El especialista debe monitorizar y tratar las convulsiones, el retraso en el desarrollo neurológico y los trastornos del movimiento ocular.
La terapia de reposición enzimática no es eficaz.
enfermedad de Gaucher tipo 3
terapia de soporte
Como son enfermedades multisistémicas, un enfoque multidisciplinario es esencial; es posible que muchos especialistas distintos participen en el cuidado de los pacientes. Se recomienda la participación temprana de los centros especializados; los cuidados deben estar coordinados por el centro.
El especialista debe monitorizar y tratar las complicaciones de trastornos del movimiento ocular, retraso en el desarrollo neurológico y enfermedad esquelética.
terapia de reposición enzimática
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
El tratamiento de pacientes asintomáticos no está justificado.[99]Kaplan P, Baris H, De Meirleir L, et al. Revised recommendations for the management of Gaucher disease in children. Eur J Pediatr. 2013 Apr;172(4):447-58. http://www.ncbi.nlm.nih.gov/pubmed/22772880?tool=bestpractice.com Sin embargo, la terapia de reposición enzimática (TRE) debe considerarse en todos los niños sintomáticos y en los adultos con reducciones significativas en los recuentos sanguíneos (p. ej., nivel de hemoglobina <100 g/L [10 g/dL], plaquetas <100 x 10⁹/L), agrandamiento significativo de los órganos (p. ej., tamaño del bazo >10 veces el normal), la presencia de enfermedad esquelética demostrada en la resonancia magnética, y/o cualquier otro daño orgánico (p. ej., evidencia de daño pulmonar).[99]Kaplan P, Baris H, De Meirleir L, et al. Revised recommendations for the management of Gaucher disease in children. Eur J Pediatr. 2013 Apr;172(4):447-58. http://www.ncbi.nlm.nih.gov/pubmed/22772880?tool=bestpractice.com [100]Hughes D, Cappellini MD, Berger M, et al. Recommendations for the management of the haematological and onco-haematological aspects of Gaucher disease. Br J Haematol. 2007 Sep;138(6):676-86. https://onlinelibrary.wiley.com/doi/10.1111/j.1365-2141.2007.06701.x http://www.ncbi.nlm.nih.gov/pubmed/17655728?tool=bestpractice.com Los aspectos viscerales y esqueléticos de la enfermedad responden bien a la TRE, pero las manifestaciones neurológicas no mejoran, puesto que la TRE no puede atravesar la barrera hematoencefálica.[116]Vellodi A, Tylki-Szymanska A, Davies EH, et al. Management of neuronopathic Gaucher disease: revised recommendations. J Inherit Metab Dis. 2009 Oct;32(5):660-4. http://www.ncbi.nlm.nih.gov/pubmed/19655269?tool=bestpractice.com
La TRE se ha asociado a reacciones de hipersensibilidad graves, anafilaxia y reacciones relacionadas con la infusión. Considere la posibilidad de premedicación con un antihistamínico, antipirético y/o corticosteroide.
Opciones primarias
imiglucerasa: niños y adultos: 60 unidades/kg por vía intravenosa cada 2 semanas inicialmente, ajuste según la respuesta
O
velaglucerasa alfa: niños ≥4 años de edad y adultos: 60 unidades/kg por vía intravenosa cada 2 semanas inicialmente, ajuste según la respuesta
Enfermedad de Fabry
terapia de soporte
Como son enfermedades multisistémicas, un enfoque multidisciplinario es esencial; es posible que muchos especialistas distintos participen en el cuidado de los pacientes. Se recomienda la participación temprana de los centros especializados; los cuidados deben estar coordinados por el centro.
El manejo de esta enfermedad multisistémica incluye un gran número de aspectos de soporte generales.
reposición de enzimas o terapia con chaperonas
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
La terapia de reposición enzimática (TRE) provoca la producción de anticuerpos en hombres, pero se desconoce el impacto de esto en la eficacia del tratamiento. Las mujeres no desarrollan anticuerpos, quizás porque son heterocigóticas y tienen enzima circulante.
La TRE puede ralentizar el avance del daño orgánico en los riñones y el corazón, pero es posible que dichos órganos no recuperen su función normal. Los hombres deben tratarse tan pronto como se les diagnostique; las mujeres deben tratarse si presentan síntomas de afectación de órganos importantes.[67]Ortiz A, Germain DP, Desnick RJ, et al. Fabry disease revisited: management and treatment recommendations for adult patients. Mol Genet Metab. 2018 Apr;123(4):416-27. https://www.sciencedirect.com/science/article/pii/S1096719217307680 http://www.ncbi.nlm.nih.gov/pubmed/29530533?tool=bestpractice.com El inicio de la TRE debe considerarse en pacientes femeninas asintomáticas con evidencia de laboratorio, histológica o de imagen de afectación renal, cardíaca o del sistema nervioso central.[67]Ortiz A, Germain DP, Desnick RJ, et al. Fabry disease revisited: management and treatment recommendations for adult patients. Mol Genet Metab. 2018 Apr;123(4):416-27. https://www.sciencedirect.com/science/article/pii/S1096719217307680 http://www.ncbi.nlm.nih.gov/pubmed/29530533?tool=bestpractice.com
Tanto la agalsidasa alfa como la agalsidasa beta son eficaces para prevenir las complicaciones renales y cardiovasculares, en comparación con la ausencia de tratamiento. La agalsidasa beta se asocia a un menor riesgo de complicaciones cerebrovasculares, en comparación con la agalsidasa beta o la ausencia de tratamiento.[134]El Dib R, Gomaa H, Ortiz A, et al. Enzyme replacement therapy for Anderson-Fabry disease: a complementary overview of a Cochrane publication through a linear regression and a pooled analysis of proportions from cohort studies. PLoS One. 2017 Mar 15;12(3):e0173358. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0173358 http://www.ncbi.nlm.nih.gov/pubmed/28296917?tool=bestpractice.com La TRE es eficaz para reducir las puntuaciones de dolor y las concentraciones de globotriaosilceramida en plasma, riñón y corazón.[122]El Dib R, Gomaa H, Carvalho RP, et al. Enzyme replacement therapy for Anderson-Fabry disease. Cochrane Database Syst Rev. 2016 Jul 25;(7):CD006663. http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD006663.pub4/full http://www.ncbi.nlm.nih.gov/pubmed/27454104?tool=bestpractice.com
Se han publicado recomendaciones sobre el uso de la TRE en caso de escasez de la terapia.[170]Linthorst GE, Germain DP, Hollak CE, et al; European Medicines Agency. Expert opinion on temporary treatment recommendations for Fabry disease during the shortage of enzyme replacement therapy (ERT). Mol Genet Metab. 2011 Jan;102(1):99-102. http://www.ncbi.nlm.nih.gov/pubmed/21123099?tool=bestpractice.com Estas recomendaciones se publicaron en 2011, cuando surgieron algunos obstáculos en la producción de la agalsidasa beta (uno de los dos productos disponibles para la enfermedad de Fabry).
La pegunigalsidasa alfa es otra opción para tratar la enfermedad de Fabry en adultos y tiene la ventaja de una vida media plasmática más larga.[135]National Institute for Health and Care Excellence. Pegunigalsidase alfa for treating Fabry disease. Oct 2023 [internet publication]. https://www.nice.org.uk/guidance/ta915
La TRE se ha asociado a reacciones de hipersensibilidad graves, anafilaxia y reacciones relacionadas con la infusión. Considere la posibilidad de premedicación con un antihistamínico, antipirético y/o corticosteroide.
Migalastat es una terapia con una chaperona oral que aumenta la actividad de la enzima endógena alfa-galactosidasa A en pacientes con una mutación susceptible. Los ensayos han demostrado la seguridad y utilidad de esta terapia en pacientes con mutaciones susceptibles, y el tratamiento está ahora autorizado y disponible en Estados Unidos, Europa, Canadá, Japón y muchos otros países.[137]Germain DP, Hughes DA, Nicholls K, et al. Treatment of Fabry's disease with the pharmacologic chaperone migalastat. N Engl J Med. 2016 Aug 11;375(6):545-55. http://www.nejm.org/doi/full/10.1056/NEJMoa1510198 http://www.ncbi.nlm.nih.gov/pubmed/27509102?tool=bestpractice.com [138]National Institute for Health and Care Excellence. Migalastat for treating Fabry disease. Feb 2017 [internet publication]. https://www.nice.org.uk/guidance/hst4 [139]Hughes DA, Nicholls K, Shankar SP, et al. Oral pharmacological chaperone migalastat compared with enzyme replacement therapy in Fabry disease: 18-month results from the randomised phase III ATTRACT study. J Med Genet. 2017 Apr;54(4):288-96. [Erratum in: J Med Genet. 2018.] https://jmg.bmj.com/content/54/4/288.long http://www.ncbi.nlm.nih.gov/pubmed/27834756?tool=bestpractice.com [140]Schiffmann R, Bichet DG, Jovanovic A, et al. Migalastat improves diarrhea in patients with Fabry disease: clinical-biomarker correlations from the phase 3 FACETS trial. Orphanet J Rare Dis. 2018 Apr 27;13(1):68. https://ojrd.biomedcentral.com/articles/10.1186/s13023-018-0813-7 http://www.ncbi.nlm.nih.gov/pubmed/29703262?tool=bestpractice.com Los médicos deben confirmar que la mutación del paciente es susceptible. El fabricante recomienda que se evite si la tasa de filtración glomerular (TFGe) estimada es inferior a 30 mL/minuto/1.73 m². El migalastat es adecuado tanto para los pacientes nativos como para los que cambian de ERT.[141]Bichet DG, Hopkin RJ, Aguiar P, et al. Consensus recommendations for the treatment and management of patients with Fabry disease on migalastat: a modified Delphi study. Front Med (Lausanne). 2023 Sep 1:10:1220637. https://www.frontiersin.org/journals/medicine/articles/10.3389/fmed.2023.1220637/full http://www.ncbi.nlm.nih.gov/pubmed/37727761?tool=bestpractice.com
Opciones primarias
agalsidasa alfa: niños ≥7 años de edad y adultos: 0.2 mg/kg por vía intravenosa cada 2 semanas
O
agalsidasa beta: niños ≥8 años de edad y adultos: 1 mg/kg por vía intravenosa cada 2 semanas
O
pegunigalsidasa alfa: adultos: 1 mg/kg por vía intravenosa cada 2 semanas
O
migalastat: adultos: 123 mg por vía oral una vez al día en días alternos
profilaxis de accidente isquémico transitorio (AIT) y accidente cerebrovascular
Se recomienda el tratamiento para TODOS LOS pacientes en el grupo de pacientes seleccionados
El accidente cerebrovascular y el accidente isquémico transitorio (AIT) requieren cuidadosas medidas de prevención primaria y secundaria.
alivio del dolor
Se recomienda el tratamiento para TODOS LOS pacientes en el grupo de pacientes seleccionados
El alivio del dolor con gabapentina o pregabalina está indicado para el dolor neuropático. El uso de carbamazepina también está muy extendido.[67]Ortiz A, Germain DP, Desnick RJ, et al. Fabry disease revisited: management and treatment recommendations for adult patients. Mol Genet Metab. 2018 Apr;123(4):416-27. https://www.sciencedirect.com/science/article/pii/S1096719217307680 http://www.ncbi.nlm.nih.gov/pubmed/29530533?tool=bestpractice.com [117]Wanner C, Arad M, Baron R, et al. European expert consensus statement on therapeutic goals in Fabry disease. Mol Genet Metab. 2018 Jul;124(3):189-203. http://www.ncbi.nlm.nih.gov/pubmed/30017653?tool=bestpractice.com
Los antiinflamatorios no esteroideos se deben utilizar con moderación, ya que con frecuencia estos pacientes presentan nefropatía.
Opciones primarias
gabapentina: niños: consultar con el especialista para orientar la dosis; adultos: 1800-3600 mg/día por vía oral administrados en 3-4 dosis divididas
O
pregabalina: niños: consultar con el especialista para orientar la dosis; adultos: 150-300 mg/día por vía oral administrados en 3 dosis divididas
O
carbamazepina: niños: consultar al especialista para que oriente la dosis; adultos: 200-1600 mg/día por vía oral administrados en 3-4 dosis divididas
cirugía estética o tratamiento con láser
Se recomienda el tratamiento para TODOS LOS pacientes en el grupo de pacientes seleccionados
Las lesiones cutáneas pueden requerir cirugía estética o terapia con láser.[Figure caption and citation for the preceding image starts]: Lesiones cutáneas en la enfermedad de Fabry: (A) fosa lumbar, (B) genitales, (C) ombligo, (D) zona lumbar, (E) dedos de los piesOrteu CH, Jansen T, Lidove O, et al. Fabry disease and the skin: datos de FOS, the Fabry Outcome Survey. Br J Dermatol. Agosto 2007;157(2):331-7; usado con autorización [Citation ends].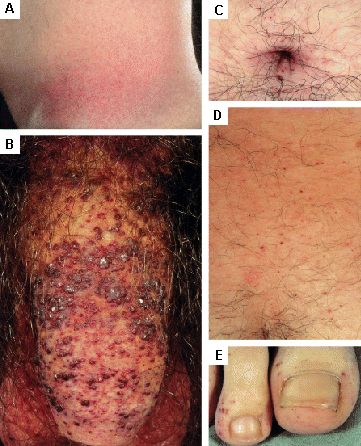 [Figure caption and citation for the preceding image starts]: Lesiones cutáneas en la enfermedad de Fabry: (A) palmas de las manos, (B) labios, (C) mucosa labialOrteu CH, Jansen T, Lidove O, et al. Fabry disease and the skin: datos de FOS, the Fabry Outcome Survey. Br J Dermatol. Agosto 2007;157(2):331-7; usado con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Lesiones cutáneas en la enfermedad de Fabry: (A) palmas de las manos, (B) labios, (C) mucosa labialOrteu CH, Jansen T, Lidove O, et al. Fabry disease and the skin: datos de FOS, the Fabry Outcome Survey. Br J Dermatol. Agosto 2007;157(2):331-7; usado con autorización [Citation ends].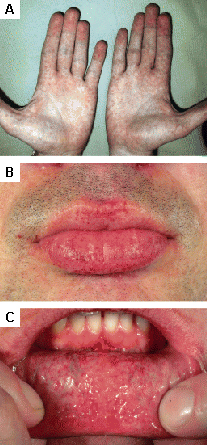
inhibidor de la enzima convertidora de angiotensina (IECA) o antagonista de los receptores de la angiotensina II
Se recomienda el tratamiento para TODOS LOS pacientes en el grupo de pacientes seleccionados
La presión arterial y la proteinuria deben monitorizarse regularmente con una intervención temprana.
Opciones primarias
enalapril: niños: consultar al especialista para que le oriente sobre la dosis; adultos: de 2.5 a 40 mg por vía oral una vez al día
O
irbesartán: niños: consultar al especialista para que le oriente sobre la dosis; adultos: 150-300 mg por vía oral una vez al día
marcapasos + evaluación para cirugía cardíaca
Se recomienda el tratamiento para TODOS LOS pacientes en el grupo de pacientes seleccionados
La revisión cardíaca es esencial en pacientes con enfermedad de Fabry. La detección temprana de la arritmia es importante y debe manejarse mediante un marcapasos. Además, se deben considerar todas las posibilidades quirúrgicas, incluida la colocación de marcapasos, la resección del tabique, el reemplazo de válvulas e incluso el trasplante cardíaco.[119]Linhart A, Elliott PM. The heart in Anderson-Fabry disease and other lysosomal storage diseases. Heart. 2007 Apr;93(4):528-35. http://www.ncbi.nlm.nih.gov/pubmed/17401074?tool=bestpractice.com
mucopolisacaridosis (MPS)
terapia de soporte
Como son enfermedades multisistémicas, un enfoque multidisciplinario es esencial; es posible que muchos especialistas distintos participen en el cuidado de los pacientes. Se recomienda la participación temprana de los centros especializados; los cuidados deben estar coordinados por el centro.
Los problemas musculoesqueléticos incluyen deformidad espinal, síndrome del túnel carpiano y neuropatía por compresión. Puede producirse la compresión de la médula espinal debido a estenosis en la región craneocervical.[145]Solanki GA, Alden TD, Burton BK, et al. A multinational, multidisciplinary consensus for the diagnosis and management of spinal cord compression among patients with mucopolysaccharidosis VI. Mol Genet Metab. 2012 Sep;107(1-2):15-24. http://www.sciencedirect.com/science/article/pii/S1096719212002740 http://www.ncbi.nlm.nih.gov/pubmed/22938833?tool=bestpractice.com Pueden darse hidrocefalia comunicante y convulsiones. Los pacientes también pueden experimentar valvulopatía cardíaca que requiere evaluación quirúrgica.
Todas estas alteraciones requieren una evaluación detallada. La fisioterapia, el uso de corsés y las inyecciones locales son todas posibles opciones; puede ser necesario un tratamiento quirúrgico.[144]van der Linden MH, Kruyt MC, Sakkers RJ, et al. Orthopaedic management of Hurler's disease after hematopoietic stem cell transplantation: a systematic review. J Inherit Metab Dis. 2011 Jun;34(3):657-69. http://link.springer.com/article/10.1007/s10545-011-9304-x/fulltext.html http://www.ncbi.nlm.nih.gov/pubmed/21416194?tool=bestpractice.com [145]Solanki GA, Alden TD, Burton BK, et al. A multinational, multidisciplinary consensus for the diagnosis and management of spinal cord compression among patients with mucopolysaccharidosis VI. Mol Genet Metab. 2012 Sep;107(1-2):15-24. http://www.sciencedirect.com/science/article/pii/S1096719212002740 http://www.ncbi.nlm.nih.gov/pubmed/22938833?tool=bestpractice.com
terapia de reposición enzimática
Se recomienda el tratamiento para TODOS LOS pacientes en el grupo de pacientes seleccionados
La terapia de reposición enzimática (TRE) tiene un beneficio establecido en las MPS I, II, IVA (síndrome de Morquio A), VI y tipo VII (síndrome de Sly).[148]Hendriksz CJ, Burton B, Fleming TR, et al.; STRIVE Investigators. Efficacy and safety of enzyme replacement therapy with BMN 110 (elosulfase alfa) for Morquio A syndrome (mucopolysaccharidosis IVA): a phase 3 randomised placebo-controlled study. J Inherit Metab Dis. 2014 Nov;37(6):979-90. http://link.springer.com/article/10.1007/s10545-014-9715-6/fulltext.html http://www.ncbi.nlm.nih.gov/pubmed/24810369?tool=bestpractice.com [149]Brunelli MJ, Atallah ÁN, da Silva EM. Enzyme replacement therapy with galsulfase for mucopolysaccharidosis type VI. Cochrane Database Syst Rev. 2021 Sep 17;(9):CD009806. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009806.pub3/full http://www.ncbi.nlm.nih.gov/pubmed/34533215?tool=bestpractice.com [150]Jameson E, Jones S, Remmington T. Enzyme replacement therapy with laronidase (Aldurazyme®) for treating mucopolysaccharidosis type I. Cochrane Database Syst Rev. 2019 Jun 18;6(6):CD009354. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009354.pub5/full http://www.ncbi.nlm.nih.gov/pubmed/31211405?tool=bestpractice.com [151]Wikman-Jorgensen PE, López Amorós A, Peris García J, et al. Enzyme replacement therapy for the treatment of Hunter disease: a systematic review with narrative synthesis and meta-analysis. Mol Genet Metab. 2020 Sep - Oct;131(1-2):206-10. http://www.ncbi.nlm.nih.gov/pubmed/32773276?tool=bestpractice.com [152]Gomes DF, Gallo LG, Leite BF, et al. Clinical effectiveness of enzyme replacement therapy with galsulfase in mucopolysaccharidosis type VI treatment: systematic review. J Inherit Metab Dis. 2019 Jan;42(1):66-76. http://www.ncbi.nlm.nih.gov/pubmed/30740728?tool=bestpractice.com Hay varias enzimas aprobadas para estas indicaciones. En el Reino Unido, el National Institute for Health and Care Excellence recomienda la elosulfasa alfa como opción para el tratamiento de la MPS IVA en personas de todas las edades, y solo está disponible bajo un acuerdo comercial.[153]National Institute for Health and Care Excellence. Elosulfase alfa for treating mucopolysaccharidosis type 4A: highly specialised technologies guidance. Apr 2022 [internet publication]. https://www.nice.org.uk/guidance/hst19 Se están realizando ensayos de fase 3 con vestronidasa alfa.[154]NHS; National Institute for Health Research (NIHR). NIHR Innovation Observatory evidence briefing. Vestronidase alfa (UX-003) for mucopolysaccharidosis type VII (MPS 7; Sly syndrome) NIHRIO (HSRIC) ID: 11463. Apr 2017 [internet publication]. http://www.io.nihr.ac.uk/wp-content/uploads/migrated_new/11463-Vestronidase-alfa-UX-003.pdf [155]ClinicalTrials.gov. A study of UX003 recombinant human beta-glucuronidase (rhGUS) enzyme replacement therapy in subjects with mucopolysaccharidosis type 7, Sly syndrome (MPS 7). Jul 2020 [internet publication]. https://clinicaltrials.gov/ct2/show/NCT02432144
La TRE se ha asociado a reacciones de hipersensibilidad graves, anafilaxia y reacciones relacionadas con la infusión. Considere la posibilidad de premedicación con un antihistamínico, antipirético y/o corticosteroide.
Opciones primarias
MPS I
laronidasa: Niños ≥5 años de edad y adultos: 0,58 mg/kg por vía intravenosa una vez por semana
O
MPS II
idursulfasa: Niños ≥5 años de edad y adultos: 0,5 mg/kg por vía intravenosa una vez por semana
O
MPS IVA (síndrome de Morquio A)
elosulfasa alfa: niños ≥5 años de edad y adultos: 2 mg/kg por vía intravenosa una vez por semana
O
MPS VI
galsulfasa: Niños ≥5 años de edad y adultos: 1 mg/kg por vía intravenosa una vez por semana
O
MPS VII
vestronidasa alfa: niños y adultos: 4 mg/kg por vía intravenosa cada 2 semanas
trasplante de células madre
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
Se debe considerar el trasplante de células madre para aquellos pacientes afectados de gravedad; su valor está demostrado, por ejemplo, en MPS I y MPS VI graves.[147]Boelens JJ. Trends in hematopoietic stem cell transplantation for inborn errors of metabolism. J Inherit Metab Dis. 2006 Apr-Jun;29(2-3):413-20. http://www.ncbi.nlm.nih.gov/pubmed/16763911?tool=bestpractice.com
Enfermedad de Pompe
terapia de soporte
Como son enfermedades multisistémicas, un enfoque multidisciplinario es esencial; es posible que muchos especialistas distintos participen en el cuidado de los pacientes. Se recomienda la participación temprana de los centros especializados; los cuidados deben estar coordinados por el centro.
Los cuidados generales y de soporte de neonatos son multidisciplinarios y engloban a neurólogos, anestesistas y cardiólogos.
La insuficiencia respiratoria y la apnea del sueño obstructiva pueden requerir distintos grados de soporte ventilatorio.
terapia de reposición enzimática
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
La terapia de reposición enzimática (TRE) para niños y adultos está autorizada. La avalglucosidasa es una opción para la enfermedad de Pompe de inicio tardío en niños de 1 año o más.
La cipaglucosidasa alfa es otra opción que está aprobada para el tratamiento de la enfermedad de Pompe de inicio tardío en adultos que no están mejorando su TRE actual. La cipaglucosidasa alfa solo está aprobada para el uso en combinación con miglustat (un estabilizador enzimático).[165]Blair HA. Cipaglucosidase alfa: first approval. Drugs. 2023 Jun;83(8):739-45. https://link.springer.com/article/10.1007/s40265-023-01886-5 http://www.ncbi.nlm.nih.gov/pubmed/37184753?tool=bestpractice.com
Las guías de práctica clínica de consenso europeas recomiendan un período inicial de 2 años de TRE para los adultos sintomáticos. La TRE puede continuar durante el embarazo y la lactancia. La función muscular y respiratoria debe evaluarse durante el tratamiento.[166]van der Ploeg AT, Kruijshaar ME, Toscano A, et al. European consensus for starting and stopping enzyme replacement therapy in adult patients with Pompe disease: a 10-year experience. Eur J Neurol. 2017 Jun;24(6):768-e31. http://www.ncbi.nlm.nih.gov/pubmed/28477382?tool=bestpractice.com
La TRE se ha asociado a reacciones de hipersensibilidad graves, anafilaxia y reacciones relacionadas con la infusión. Considere la posibilidad de premedicación con un antihistamínico, antipirético y/o corticosteroide.
Opciones primarias
alglucosidasa alfa: niños y adultos: 20 mg/kg por vía intravenosa cada 2 semanas
O
avalglucosidasa alfa: niños ≥1 año de edad y <30 kg: 40 mg/kg por vía intravenosa cada 2 semanas; niños ≥1 año de edad y ≥30 kg y adultos: 20 mg/kg por vía intravenosa cada 2 semanas
O
cipaglucosidasa alfa: adultos ≥40 kg de peso corporal: 20 mg/kg por vía intravenosa cada 2 semanas
Más cipaglucosidasa alfaComenzar 2 semanas después de la última dosis de terapia de reposición enzimática. Administrar 1 hora después de la dosis de miglustat (a más tardar 3 horas después de la dosis de miglustat).
y
miglustat: adultos ≥40 kg a <50 kg de peso corporal: 195 mg por vía oral cada 2 semanas; adultos ≥50 kg de peso corporal: 260 mg por vía oral cada 2 semanas
Más miglustatComenzar 2 semanas después de la última dosis de terapia de reposición enzimática. Administrar 1 hora antes de la dosis de cipaglucosidasa alfa.
Existen varias marcas de miglustat. Opfolda® es la marca aprobada para el uso en la enfermedad de Pompe, y debe utilizarse para esta indicación.
enfermedad de Tay-Sachs
terapia de soporte
Los cuidados paliativos solo se requieren en la forma infantil de la enfermedad.
Las formas de inicio juvenil y las formas crónicas o de inicio en la edad adulta requieren cuidados de soporte, evaluación de necesidades de educación especiales y evaluación neurológica. La demencia y la ataxia son complicaciones a largo plazo que se deben considerar en el manejo.
La terapia de reposición enzimática no está disponible para la enfermedad de Tay-Sachs.
enfermedad de Niemann-Pick
terapia de soporte
Solo se requieren cuidados paliativos en la forma infantil grave de la enfermedad de Niemann-Pick tipo A. Los cuidados de soporte están indicados para las formas menos graves.
La enfermedad de Niemann-Pick tipo B normalmente se presenta en adultos con enfermedad pulmonar y/o hepatoesplenomegalia.
La enfermedad de Niemann-Pick tipo C es extremadamente variable, pero la evaluación neurológica es generalmente importante. La terapia de reposición enzimática está disponible para el tipo C.
terapia de reducción de sustrato
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
La terapia de reducción de sustrato (TRS) solo está disponible para el Niemann-Pick tipo C.[54]Patterson MC, Clayton P, Gissen P, et al. Recommendations for the detection and diagnosis of Niemann-Pick disease type C: an update. Neurol Clin Pract. 2017 Dec;7(6):499-511. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5800709 http://www.ncbi.nlm.nih.gov/pubmed/29431164?tool=bestpractice.com Se ha demostrado que la SRT con miglustat estabiliza los síntomas neurodegenerativos, incluida la disfagia.[168]Pineda M, Walterfang M, Patterson MC. Miglustat in Niemann-Pick disease type C patients: a review. Orphanet J Rare Dis. 2018 Aug 15;13(1):140. https://ojrd.biomedcentral.com/articles/10.1186/s13023-018-0844-0 http://www.ncbi.nlm.nih.gov/pubmed/30111334?tool=bestpractice.com
Opciones primarias
miglustat: adultos: 100 mg por vía oral tres veces al día, ajustar según la respuesta
Más miglustatHay varias marcas de miglustat disponibles; asegúrese de utilizar la marca correcta para esta indicación.

Seleccione un grupo de pacientes para consultar nuestras recomendaciones
Tenga en cuenta que las formulaciones/vías y dosis pueden diferir entre los nombres y marcas de los fármacos, las fórmulas de los fármacos o las localizaciones. Las recomendaciones de tratamiento son específicas para cada grupo de pacientes. Véase el descargo de responsabilidad
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad