Etiologia
DECH aguda:
Os fatores de risco para desenvolvimento de DECH aguda incluem disparidade entre os antígenos leucocitários humanos (HLAs), idade avançada do receptor, disparidade entre gêneros do doador e do receptor, tipo e estado da doença subjacente, intensidade do esquema de condicionamento do transplante, compatibilidade ABO, escore de desempenho, raça branca/negra, condição sorológica do citomegalovírus (CMV) e doses de medicamentos profiláticos imunossupressores.[12][17][18][25][26][27][28][29][30][31][32][33][34][35]
DECH crônica:
Os fatores de risco para o desenvolvimento da DECH crônica incluem a DECH aguda prévia, idade avançada do receptor, doadoras mulheres (sobretudo se já tiverem dado à luz) com receptores homens, utilização de doadores incompatíveis ou não aparentados, infusão de leucócitos do doador e utilização de células-tronco do sangue periférico.[8][20][21][36][37][38]
Fisiopatologia
DECH aguda:
A fisiopatologia da DECH aguda é complexa, mas pode ser conceitualizada em 3 etapas ou fases sequenciais:
Ativação das células apresentadoras de antígenos (APCs)
Ativação, proliferação, diferenciação e migração das células T do doador
Destruição do tecido-alvo.
[Figure caption and citation for the preceding image starts]: Fisiopatologia da DECHCortesia do Dr James L.M. Ferrara, Professor, Blood and Marrow Transplantation Program, University of Michigan; uso autorizado [Citation ends].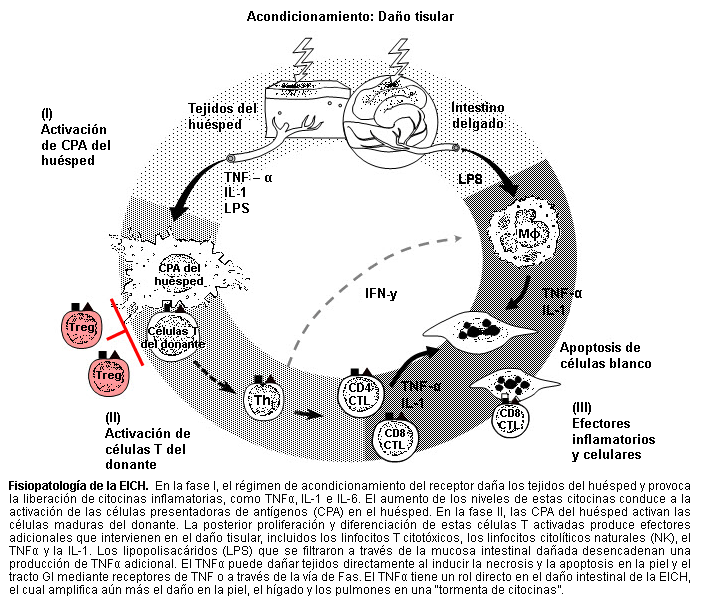
A ativação da Fase I das APCs é iniciada pela profunda lesão causada pela doença subjacente e pelas infecções resultantes, exacerbadas pelos esquemas de condicionamento do transplante de células hematopoéticas (HCT) (que envolvem a irradiação corporal total e/ou quimioterapia) administrados antes da infusão das células hematopoéticas do doador.
Na Fase II, as APCs ativadas interagem com as células T infundidas do doador, o que causa a ativação, proliferação, diferenciação e migração das células T alorreativas do doador.
A Fase III é uma complexa cascata de múltiplos efetores celulares e inflamatórios que modulam ainda mais as respostas um do outro, causando por fim, danos ao órgão-alvo da DECH aguda. Os mecanismos efetores podem ser agrupados em efetores celulares (por exemplo, linfócitos T citotóxicos) e efetores inflamatórios, como as citocinas.
DECH crônica:
Diferentemente da DECH aguda, a fisiopatologia da DECH crônica é pouco compreendida.[39] As células T alorreativas foram implicadas na patogênese; no entanto, o papel exato dos subconjuntos específicos de células T, dos autoantígenos, dos aloantígenos e das células B, bem como das interações das quimiocinas e citocinas não foi totalmente elucidado. As manifestações clínicas da DECH crônica são semelhantes a um processo autoimune, sugerindo uma fisiopatologia similar.
Classificação
Classificação clínica
Tipicamente, a doença do enxerto contra o hospedeiro (DECH) que aparece antes do dia 100 pós-transplante é denominada DECH aguda. Já a DECH que aparece depois do dia 100 pós-transplante é denominada DECH crônica.
No entanto, agora é reconhecido que a DECH aguda (caracterizada por exantema maculopapular, anorexia, diarreia profusa, náuseas, vômitos, íleo paralítico e hepatite colestática) pode ocorrer mais de 100 dias após o transplante; por exemplo, durante a redução gradual de medicamentos imunossupressores ou a infusão de linfócitos de um doador.
A DECH crônica é uma doença complexa, multissistêmica com uma variedade de manifestações que podem comprometer essencialmente qualquer órgão (por exemplo, aftas doloridas; lesões de pele hiperpigmentada; olhos ressecados, arenosos e doloridos). Portanto, hoje se reconhece que as características clínicas determinam se a DECH é classificada como aguda ou crônica e não a relação temporal com o transplante.[1] Alguns pacientes podem sofrer síndrome de sobreposição, na qual pelo menos uma manifestação de DECH aguda se desenvolve em um paciente com DECH crônica.[1]
O uso deste conteúdo está sujeito ao nosso aviso legal