O tratamento pode ser dividido em tratamento da exposição ocupacional ao organismo, profilaxia primária, tratamento da doença ativa e profilaxia secundária. A maioria das infecções em indivíduos saudáveis é leve e autolimitado, dispensando tratamento (salvo a doença oftalmológica).
Geralmente, os esquemas de tratamento para crianças são os mesmos dos adultos, embora as doses sejam diferentes; além disso, alguns esquemas recomendados para adultos não são necessariamente recomendados para crianças devido à falta de evidências. Consulte as diretrizes pediátricas locais para obter detalhes adicionais sobre o tratamento de crianças.
Exposição ocupacional
Este grupo inclui pacientes expostos a Toxoplasma gondii pelo contato com sangue infectado ou culturas de células.
O risco deve ser estratificado com base no tipo de exposição (picada profunda em comparação com picada superficial de agulha), concentração do organismo (altamente concentrado em comparação com fluido de baixa concentração) e genótipo (cepa virulenta do tipo I em comparação com outra cepa).
A imunoglobulina (Ig) G anti-Toxoplasma deve ser checada de maneira imediata para identificar as pacientes com risco de infecção aguda.
Todos os pacientes soronegativos expostos ou com sorologia desconhecida devem ser tratados. A maioria dos especialistas trata todos os indivíduos que apresentaram exposição definida.
Em pacientes sem anticorpos detectáveis, o tratamento é ministrado por 4 semanas, repetindo-se a sorologia. Se a soroconversão for documentada, será necessário acompanhar clinicamente os pacientes. Pacientes soropositivos ao início do tratamento ou positivos antes da exposição provavelmente estão parcialmente protegidos. A maioria dos especialistas trata durante 2 semanas exposições profundas a inoculados altos de uma cepa virulenta do tipo I. (As cepas do tipo I [RH, GT-1] são cepas de laboratório usadas com frequência, sendo altamente letais em camundongos. Esses genótipos foram correlacionados com surtos de retinite e de outras doenças sintomáticas sérias ocorridos em indivíduos imunocompetentes.)
Os benefícios do tratamento incluem a prevenção da infecção aguda. Os riscos incluem efeitos colaterais provocados pelos medicamentos.
É necessário verificar na linha basal as sorologias de mulheres que trabalham em locais onde o T gondii é usado. Se o resultado for negativo, elas deverão evitar a exposição na gestação ou se estiverem planejando engravidar.
Cabe observar que não há diretrizes nem estudos publicados mencionando tratamentos para a exposição ocupacional.
Profilaxia de pacientes com vírus da imunodeficiência humana (HIV)
O tratamento profilático é administrado para prevenir a reativação de doença latente em pacientes imunocomprometidos.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
[49]Department of Health and Human Services, Panel on Opportunistic Infections in Children with and Exposed to HIV. Guidelines for the prevention and treatment of opportunistic infections in children with and exposed to HIV. Aug 2023 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/pediatric-oi/guidelines-pediatric-oi.pdf
Todos os adultos e crianças com mais de 6 anos de idade infectados com HIV com contagens de linfócitos T CD4+ <100 células/microlitro e todas as crianças infectadas com HIV de até 6 anos de idade (inclusive) com CD4% <15%, com IgG anti-Toxoplasma detectável, devem receber profilaxia primária, sendo necessário fornecer orientação sobre como evitar infecções futuras (evitar carne malcozida ou contato com fezes de gato) àqueles sem IgG detectável.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
[49]Department of Health and Human Services, Panel on Opportunistic Infections in Children with and Exposed to HIV. Guidelines for the prevention and treatment of opportunistic infections in children with and exposed to HIV. Aug 2023 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/pediatric-oi/guidelines-pediatric-oi.pdf
A profilaxia de primeira linha é o sulfametoxazol/trimetoprima. Esse também é o esquema profilático recomendado para a pneumonia por Pneumocystis jiroveci (P carinii). Esse tratamento não pode ser usado na doença ativa, pois há um risco alto de falha do tratamento. As toxicidades incluem erupção cutânea, febre, leucopenia, trombocitopenia e hepatotoxicidade.
Se o paciente for alérgico a sulfonamidas ou demonstrar toxicidade relacionada (até 20% dos pacientes HIV-positivos desenvolvem erupção cutânea com compostos à base de sulfas), os esquemas profiláticos alternativos incluem: atovaquona; dapsona diária ou semanal associada a pirimetamina e folinato de cálcio; ou atovaquona associada a pirimetamina e folinato de cálcio.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
A profilaxia primária poderá ser descontinuada em crianças, adolescentes e adultos se o paciente estiver recebendo terapia antirretroviral (TAR) e tiver apresentado resposta com aumento na contagem de linfócitos T CD4+ acima de 200 células/microlitro (ou >15% para crianças com menos de 6 anos de idade) durante 3 ou mais meses.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
Além disso, a profilaxia primária poderá ser descontinuada nos pacientes adolescentes e adultos que estiverem recebendo TAR com contagem de linfócitos T CD4+ entre 100 e 200 células/microlitro se a carga viral plasmática do RNA do HIV permanecer abaixo do limite de detecção por, pelo menos, 3 a 6 meses.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
Profilaxia em receptores de transplante
O uso rotineiro de sulfametoxazol/trimetoprima para profilaxia de Pneumocystis após o transplante, independentemente da situação sorológica para Toxoplasma, levou à redução da taxa de toxoplasmose em receptores de transplantes, e é a profilaxia contra toxoplasmose usada com mais frequência entre os receptores de transplantes.[25]Hoz RM La, Morris MI; Infectious Diseases Community of Practice of the American Society of Transplantation. Tissue and blood protozoa including toxoplasmosis, Chagas disease, leishmaniasis, Babesia, Acanthamoeba, Balamuthia, and Naegleria in solid organ transplant recipients - guidelines from the American Society of Transplantation Infectious Diseases Community of Practice. Clin Transplant. 2019 Sep;33(9):e13546.
http://www.ncbi.nlm.nih.gov/pubmed/30900295?tool=bestpractice.com
A profilaxia durante toda a vida é recomendada para os receptores de transplantes cardíacos de alto risco (nos quais o doador for IgG anti-Toxoplasma positivo e o receptor for IgG anti-Toxoplasma negativo). Há muito poucos dados para apoiar esquemas profiláticos, além do sulfametoxazol/trimetoprima, para a toxoplasmose na população transplantada. Nos pacientes alérgicos a sulfas que não tiverem deficiência de glicose-6-fosfato desidrogenase, um esquema profilático alternativo é a dapsona associada a pirimetamina e folinato de cálcio. Em caso de contraindicação ao sulfametoxazol/trimetoprima, consulte um especialista em doenças infecciosas para obter orientação sobre esquemas alternativos.[25]Hoz RM La, Morris MI; Infectious Diseases Community of Practice of the American Society of Transplantation. Tissue and blood protozoa including toxoplasmosis, Chagas disease, leishmaniasis, Babesia, Acanthamoeba, Balamuthia, and Naegleria in solid organ transplant recipients - guidelines from the American Society of Transplantation Infectious Diseases Community of Practice. Clin Transplant. 2019 Sep;33(9):e13546.
http://www.ncbi.nlm.nih.gov/pubmed/30900295?tool=bestpractice.com
Tratamento da doença ativa em pacientes imunocomprometidos
O objetivo do tratamento é prevenir a morte decorrente de doença disseminada e prevenir/limitar lesões a órgãos específicos afetados pela doença.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
[49]Department of Health and Human Services, Panel on Opportunistic Infections in Children with and Exposed to HIV. Guidelines for the prevention and treatment of opportunistic infections in children with and exposed to HIV. Aug 2023 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/pediatric-oi/guidelines-pediatric-oi.pdf
Pirimetamina associada a sulfadiazina e folinato de cálcio é o tratamento de primeira escolha. Caso o paciente apresente sensibilidade à sulfadiazina, esta deve ser substituída pela clindamicina. Outros esquemas de tratamento incluem sulfametoxazol/trimetoprima; atovaquona associada a pirimetamina associada a folinato de cálcio; atovaquona associada a sulfadiazina; ou atovaquona isolada.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
Esses esquemas alternativos não foram rigorosamente estudados, devendo ser usados apenas após consulta com especialista em doenças infecciosas. Corticosteroides adjuvantes (por exemplo, dexametasona, prednisolona) só devem ser administrados para tratar efeito de massa ou edema associado, e devem ser descontinuados assim que for clinicamente viável.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
[49]Department of Health and Human Services, Panel on Opportunistic Infections in Children with and Exposed to HIV. Guidelines for the prevention and treatment of opportunistic infections in children with and exposed to HIV. Aug 2023 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/pediatric-oi/guidelines-pediatric-oi.pdf
A duração do tratamento inicial para todos os pacientes imunocomprometidos é de 6 semanas, podendo, porém, prolongar-se se não houver melhora significativa das lesões do sistema nervoso central (SNC).[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
Em receptores de transplante, é comum reduzir a terapia imunossupressora sempre que possível e permitir que o tratamento seja orientado pela ampla literatura sobre o tratamento de pacientes com HIV/AIDS.[25]Hoz RM La, Morris MI; Infectious Diseases Community of Practice of the American Society of Transplantation. Tissue and blood protozoa including toxoplasmosis, Chagas disease, leishmaniasis, Babesia, Acanthamoeba, Balamuthia, and Naegleria in solid organ transplant recipients - guidelines from the American Society of Transplantation Infectious Diseases Community of Practice. Clin Transplant. 2019 Sep;33(9):e13546.
http://www.ncbi.nlm.nih.gov/pubmed/30900295?tool=bestpractice.com
A ineficácia do tratamento é sugerida pelo agravamento clínico ou radiográfico (como no caso de aumento do tamanho das lesões cerebrais com encefalite) após 1 semana de terapia ou ausência de melhora clínica ou radiográfica após 2 semanas de tratamento. Se isso ocorrer, deve ser feita biópsia do cérebro. Se a biópsia subsequente confirmar encefalite toxoplásmica, considere trocar a terapia por um dos esquemas alternativos.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
Após a conclusão do tratamento inicial, os pacientes devem continuar recebendo profilaxia secundária para prevenir a reativação da doença enquanto continuam imunocomprometidos.[Figure caption and citation for the preceding image starts]: Ressonância nuclear magnética pré e pós-tratamento: cérebro da toxoplasmose no sistema nervoso centralDo acervo de Rima L. McLeod, MD; uso autorizado [Citation ends].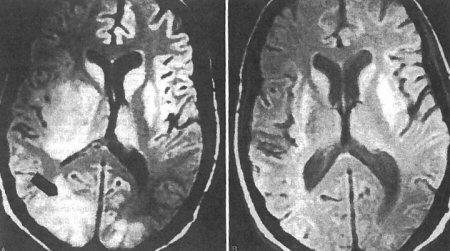
Gestantes com infecção aguda suspeita ou confirmada
O objetivo do tratamento é prevenir ou limitar a gravidade da infecção no feto nas gestações não concluídas.
As mulheres infectadas durante as primerias 18 semanas de gestação podem ser tratadas com espiramicina visando a diminuir o risco de transmissão ao feto.[11]Maldonado YA, Read JS, Committee on Infectious Diseases. Diagnosis, treatment, and prevention of congenital toxoplasmosis in the United States. Pediatrics. 2017 Feb;139(2):e20163860.
https://publications.aap.org/pediatrics/article/139/2/e20163860/59988/Diagnosis-Treatment-and-Prevention-of-Congenital
[50]Daffos F, Forestier F, Capella-Pavlovsky M, et al. Prenatal management of 746 pregnancies at risk for congenital toxoplasmosis. N Engl J Med. 1988 Feb 4;318(5):271-5.
http://www.ncbi.nlm.nih.gov/pubmed/3336419?tool=bestpractice.com
[51]Peyron F, L'ollivier C, Mandelbrot L, et al. Maternal and congenital toxoplasmosis: diagnosis and treatment recommendations of a French Multidisciplinary Working Group. Pathogens. 2019 Feb 18;8(1):24.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6470622
http://www.ncbi.nlm.nih.gov/pubmed/30781652?tool=bestpractice.com
A reação em cadeia da polimerase do líquido amniótico deve ser realizada ≥ 4 semanas após a infecção materna primária aguda e ≥ 18 semanas de gestação para reduzir o risco de resultados falsos-negativos. Se não houver infecção documentada no feto, a espiramicina deve ser mantida até o parto, pois a infecção placentária continua sendo um risco e a transmissão ainda pode ocorrer durante a gravidez.[11]Maldonado YA, Read JS, Committee on Infectious Diseases. Diagnosis, treatment, and prevention of congenital toxoplasmosis in the United States. Pediatrics. 2017 Feb;139(2):e20163860.
https://publications.aap.org/pediatrics/article/139/2/e20163860/59988/Diagnosis-Treatment-and-Prevention-of-Congenital
Estima-se que a espiramicina reduza em 60% a incidência da transmissão vertical.[16]Montoya JG, Liesenfeld O. Toxoplasmosis. Lancet. 2004 Jun 12;363(9425):1965-76.
http://www.ncbi.nlm.nih.gov/pubmed/15194258?tool=bestpractice.com
Cabe observar que a espiramicina não é uma monoterapia eficaz se a infecção já tiver atingido o feto.
Se a infecção materna ocorrer após 18 semanas de gestação, ou a transmissão fetal tiver sido documentada por reação em cadeia da polimerase no líquido amniótico a ≥18 semanas de gestação, a terapia com pirimetamina/sulfadiazina/folinato de cálcio deve ser iniciada.[11]Maldonado YA, Read JS, Committee on Infectious Diseases. Diagnosis, treatment, and prevention of congenital toxoplasmosis in the United States. Pediatrics. 2017 Feb;139(2):e20163860.
https://publications.aap.org/pediatrics/article/139/2/e20163860/59988/Diagnosis-Treatment-and-Prevention-of-Congenital
[52]Mandelbrot L, Kieffer F, Sitta R, et al. Prenatal therapy with pyrimethamine + sulfadiazine vs spiramycin to reduce placental transmission of toxoplasmosis: a multicenter, randomized trial. Am J Obstet Gynecol. 2018 Oct;219(4):386.e1-386.e9.
http://www.ncbi.nlm.nih.gov/pubmed/29870736?tool=bestpractice.com
A espiramicina não atravessa a placenta e, portanto, não é adequada para o tratamento do feto. O acompanhamento ultrassonográfico deve incluir o exame do feto a cada 4 semanas, com foco na avaliação do cérebro, dos olhos e do crescimento.[11]Maldonado YA, Read JS, Committee on Infectious Diseases. Diagnosis, treatment, and prevention of congenital toxoplasmosis in the United States. Pediatrics. 2017 Feb;139(2):e20163860.
https://publications.aap.org/pediatrics/article/139/2/e20163860/59988/Diagnosis-Treatment-and-Prevention-of-Congenital
[53]Khalil A, Sotiriadis A, Chaoui R, et al. ISUOG practice guidelines: role of ultrasound in congenital infection. Ultrasound Obstet Gynecol. 2020 Jul;56(1):128-51.
https://obgyn.onlinelibrary.wiley.com/doi/10.1002/uog.21991
http://www.ncbi.nlm.nih.gov/pubmed/32400006?tool=bestpractice.com
É necessário realizar monitoramento frequente com hemograma completo nos pacientes tratados com pirimetamina. Pode-se aumentar a dose de folinato de cálcio se o paciente desenvolver anemia megaloblástica, granulocitopenia ou trombocitopenia.
Doença congênita
O objetivo do tratamento é prevenir ou limitar a patologia no SNC e nos olhos. O tratamento iniciado precocemente (antes de 2.5 meses de idade) e continuado durante 12 meses aparentemente resulta em desfechos mais favoráveis, especialmente quanto à redução da probabilidade de perda auditiva neurossensorial.[54]Brown ED, Chau JK, Atashband S, et al. A systematic review of neonatal toxoplasmosis exposure and sensorineural hearing loss. Int J Pediatr Otorhinolaryngol. 2009 May;73(5):707-11.
http://www.ncbi.nlm.nih.gov/pubmed/19215990?tool=bestpractice.com
Os neonatos infectados devem ser tratados durante 1 ano com pirimetamina associada a sulfadiazina associada a folinato de cálcio.[11]Maldonado YA, Read JS, Committee on Infectious Diseases. Diagnosis, treatment, and prevention of congenital toxoplasmosis in the United States. Pediatrics. 2017 Feb;139(2):e20163860.
https://publications.aap.org/pediatrics/article/139/2/e20163860/59988/Diagnosis-Treatment-and-Prevention-of-Congenital
[49]Department of Health and Human Services, Panel on Opportunistic Infections in Children with and Exposed to HIV. Guidelines for the prevention and treatment of opportunistic infections in children with and exposed to HIV. Aug 2023 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/pediatric-oi/guidelines-pediatric-oi.pdf
[55]McLeod R, Boyer K, Karrison T, et al. Outcome of treatment for congenital toxoplasmosis, 1981-2004: the National Collaborative Chicago-Based, Congenital Toxoplasmosis Study. Clin Infect Dis. 2006 May 15;42(10):1383-94.
http://www.ncbi.nlm.nih.gov/pubmed/16619149?tool=bestpractice.com
Talvez seja necessário diminuir a dose de pirimetamina e aumentar a dose de folinato de cálcio se houver evidência de supressão da medula óssea ou incapacidade de tolerar o medicamento oral devido a efeitos colaterais gastrointestinais excessivos (náuseas, vômitos).
Um esquema alternativo para quem desenvolve alergia a sulfonamidas inclui a pirimetamina associada ao folinato de cálcio com clindamicina.[56]Centers for Disease Control and Prevention. Toxoplasmosis: clinical care of toxoplasmosis. Jan 2024 [internet publication].
https://www.cdc.gov/toxoplasmosis/hcp/clinical-care/index.html
Há apenas dados clínicos bastante limitados que permitam outras recomendações.
A prednisolona pode ser administrada com pirimetamina associada a sulfadiazina em pacientes com proteínas elevadas no líquido cefalorraquidiano (>10 g/L [1 g/dL]) ou quando a coriorretinite aguda ameaça a visão.[11]Maldonado YA, Read JS, Committee on Infectious Diseases. Diagnosis, treatment, and prevention of congenital toxoplasmosis in the United States. Pediatrics. 2017 Feb;139(2):e20163860.
https://publications.aap.org/pediatrics/article/139/2/e20163860/59988/Diagnosis-Treatment-and-Prevention-of-Congenital
Corticosteroides são administrados até a resolução do índice elevado de proteínas no LCR ou da coriorretinite aguda, ocasião em que devem ser desmamados de forma rápida.
Doença oftalmológica
O objetivo do tratamento é limitar as lesões da área afetada do olho e limitar a duração dos sintomas. Há alguns ensaios clínicos controlados e randomizados relativos ao tratamento da coriorretinite toxoplásmica. Uma revisão sistemática concluiu que o tratamento com antibióticos provavelmente reduza o risco de coriorretinite toxoplásmica recorrente, mas não há evidências suficientes de que os antibióticos resultaram em melhores desfechos visuais, nem dados para avaliar os efeitos dos corticosteroides adjuvantes.[57]Pradhan E, Bhandari S, Gilbert RE, et al. Antibiotics versus no treatment for toxoplasma retinochoroiditis. Cochrane Database Syst Rev. 2016 May 20;(5):CD002218.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002218.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/27198629?tool=bestpractice.com
[58]Jasper S, Vedula SS, John SS, et al. Corticosteroids as adjuvant therapy for ocular toxoplasmosis. Cochrane Database Syst Rev. 2017 Jan 26;(1):CD007417.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5369355
http://www.ncbi.nlm.nih.gov/pubmed/28125765?tool=bestpractice.com
Apesar da falta de evidências para embasar o tratamento rotineiro com antibióticos, o tratamento é necessário em caso de lesões graves ou persistentes que envolvam a mácula ou o nervo óptico, lesões retinianas extensas com inflamação grave ou qualquer lesão em indivíduos imunocomprometidos.[57]Pradhan E, Bhandari S, Gilbert RE, et al. Antibiotics versus no treatment for toxoplasma retinochoroiditis. Cochrane Database Syst Rev. 2016 May 20;(5):CD002218.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002218.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/27198629?tool=bestpractice.com
[58]Jasper S, Vedula SS, John SS, et al. Corticosteroids as adjuvant therapy for ocular toxoplasmosis. Cochrane Database Syst Rev. 2017 Jan 26;(1):CD007417.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5369355
http://www.ncbi.nlm.nih.gov/pubmed/28125765?tool=bestpractice.com
[59]Stanford MR, See SE, Jones LV, et al. Antibiotics for toxoplasmic retinochoroiditis: an evidence-based systematic review. Ophthalmology. 2003 May;110(5):926-31;quiz 931-2.
http://www.ncbi.nlm.nih.gov/pubmed/12750091?tool=bestpractice.com
Há certa controvérsia em torno do tratamento de lesões retinianas periféricas pequenas em pessoas imunocompetentes.
Em pacientes imunocompetentes, as doenças oculares congênita e adquirida são tratadas com pirimetamina, sulfadiazina, folinato de cálcio e prednisolona.
Corticosteroides são administrados até que a inflamação ceda (geralmente em 1 a 2 semanas) e, em seguida, são rapidamente desmamados. Deve-se continuar a administração de pirimetamina e sulfadiazina durante 1 a 2 semanas após a remissão dos sinais e dos sintomas de doença ativa nas pessoas imunocompetentes. O folinato de cálcio deve ser administrado durante 1 semana após a cessação da pirimetamina. Não há tratamento confirmado para prevenir a recorrência da doença, que pode ocorrer em até 10% dos casos, embora o tratamento com sulfametoxazol/trimetoprima tenha sido usado com algum resultado para supressão crônica.[60]Silveira C, Belfort R, Muccioli C, et al. The effect of long-term intermittent trimethoprim/sulfamethoxazole treatment on recurrences of toxoplasmic retinochoroiditis. Am J Ophthalmol. 2002 Jul;134(1):41-6.
http://www.ncbi.nlm.nih.gov/pubmed/12095806?tool=bestpractice.com
[61]Kim SJ, Scott IU, Brown GC, et al. Interventions for toxoplasma retinochoroiditis: a report by the American Academy of Ophthalmology. Ophthalmology. 2013 Feb;120(2):371-8.
http://www.ncbi.nlm.nih.gov/pubmed/23062648?tool=bestpractice.com
Pacientes imunocomprometidos com doença oftalmológica isolada devem receber o tratamento acima, seguido por terapia de supressão crônica enquanto perdurar a imunossupressão.[Figure caption and citation for the preceding image starts]: Retinocoroidite pré e pós-tratamentoDo acervo de Rima L. McLeod, MD, e publicado em: Roberts F, McLeod R. Pathogenesis of toxoplasmic retinochoroiditis. Parasitol Today. 1999 Feb;15(2):51-7; usado com permissão [Citation ends].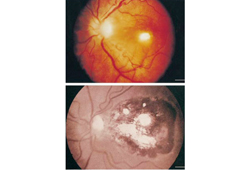
Prevenção de recorrência
Os pacientes imunossuprimidos que tiverem concluído a terapia inicial para toxoplasmose devem continuar recebendo profilaxia secundária por toda a vida, salvo se houver reconstituição imunológica em pacientes infectados pelo HIV em decorrência da TAR ou da suspensão de medicamentos imunossupressores. A adesão à terapia de manutenção crônica é muitas vezes difícil para os pacientes, pois é composta por vários medicamentos com esquemas de dosagens frequentes.
O esquema recomendado na profilaxia secundária é a pirimetamina associada a sulfadiazina e folinato de cálcio. O sulfametoxazol/trimetoprima também é uma opção. Os esquemas alternativos para pacientes alérgicos a sulfonamidas incluem clindamicina associada a pirimetamina e folinato de cálcio, atovaquona associada a sulfadiazina ou atovaquona combinada ou não com pirimetamina e folinato de cálcio.[24]Department of Health and Human Services, Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. May 2024 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/guidelines-adult-adolescent-oi.pdf
Se ocorrer reconstituição imunológica após o início da TAR com contagens constantes de linfócitos T CD4+ >200 células/microlitro durante 6 meses ou mais, considere a suspensão da terapia de manutenção crônica. A segurança da suspensão da terapia de manutenção em crianças não foi estudada, mas as diretrizes dos EUA sugerem considerar a interrupção da terapia de manutenção crônica nas crianças com menos de 6 anos de idade com linfócitos T CD4+ sustentados >15% e nas crianças de 6 anos de idade ou mais com contagem constante de linfócitos T CD4+ >200 por 6 meses ou mais.[49]Department of Health and Human Services, Panel on Opportunistic Infections in Children with and Exposed to HIV. Guidelines for the prevention and treatment of opportunistic infections in children with and exposed to HIV. Aug 2023 [internet publication].
https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/pediatric-oi/guidelines-pediatric-oi.pdf

