Investigações
Primeiras investigações a serem solicitadas
eletrocardiograma (ECG)
Exame
Um ECG de 12 derivações em repouso é recomendado na primeira consulta clínica em todos os indivíduos com cardiomiopatia hipertrófica (CMH) conhecida ou suspeita e deve ser repetido sempre que houver alteração nos sintomas em pacientes com diagnóstico estabelecido.[1] A maioria dos pacientes apresenta anormalidades eletrocardiográficas; elas não são específicas da CMH, mas devem levar a investigações adicionais com ecocardiografia. Um ECG anormal pode anteceder o achado de hipertrofia na ecocardiografia.[23]
Anormalidades de repolarização são comuns. A inversão da onda T comumente envolve as derivações inferior e lateral e as ondas T são profundas e frequentemente precedidas por infradesnivelamento do segmento ST.[24] Ondas T profundamente invertidas nas derivações precordiais são sugestivas de CMH apical.[25]
Ondas Q anormais proeminentes podem ser observadas nas derivações inferiores (II, III, aVF) e/ou laterais (I, aVL, V5-6), refletindo hipertrofia septal.[25]
Podem estar presentes voltagens elevadas do intervalo QRS indicando hipertrofia ventricular esquerda (HVE). Elas estão quase sempre associadas a outras anormalidades eletrocardiográficas na CMH.[24] A presença de critérios isolados de voltagem do intervalo QRS para HVE na ausência de outros marcadores de ECG está presente em menos de 2% dos pacientes com CMH.[26]
Podem ser observados sinais de ECG de aumento atrial esquerdo e direito e prolongamento da onda P (um conhecido preditor de fibrilação atrial). Raramente ocorrem isoladamente; outras anormalidades eletrocardiográficas, tais como alterações de repolarização ou sinais de HVE, estão geralmente presentes. O aumento do átrio esquerdo reflete disfunção diastólica, altas pressões de enchimento, obstrução do fluxo de saída e regurgitação mitral funcional. Dilatação e disfunção atrial esquerda são marcadores de prognóstico adverso.[24]
Desvio do eixo esquerdo (causado por HVE) e pré-excitação ventricular também podem ser observados.[24]
Alguns pacientes podem apresentar arritmias, por exemplo, fibrilação atrial ou taquicardia supraventricular.[24]
O ECG é normal apenas em uma pequena proporção (5% a 10%) dos pacientes na apresentação.[1][25] Foi relatado que esses pacientes apresentam uma evolução clínica mais favorável do que aqueles com anormalidades eletrocardiográficas.[26]
[Figure caption and citation for the preceding image starts]: Eletrocardiografia (ECG) mostrando alterações associadas à hipertrofia ventricular esquerda (HVE)Do acervo de Melanie Everitt, MD, Heart Failure & Transplantation Program, Primary Children's Medical Center, Salt Lake City, UT; usado com permissão [Citation ends].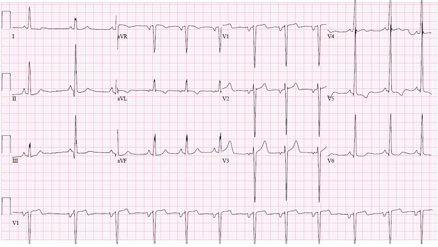 [Figure caption and citation for the preceding image starts]: Inversão de onda T giganteDo acervo do Dr Anji T. Yetman, MD, University of Utah [Citation ends].
[Figure caption and citation for the preceding image starts]: Inversão de onda T giganteDo acervo do Dr Anji T. Yetman, MD, University of Utah [Citation ends].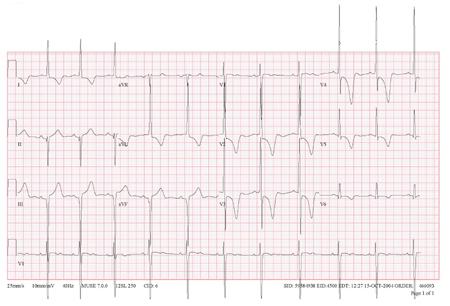
Resultado
Anormalidades das ondas ST-T; ondas Q proeminentes; HVE; anormalidades da onda P; desvio do eixo para a esquerda; pré-excitação ventricular; pode ser normal
creatina quinase (CK)
Exame
As diretrizes dos EUA não recomendam exames laboratoriais como parte da investigação inicial.[2] No entanto, as diretrizes europeias recomendam que todos os pacientes com suspeita ou confirmação de cardiomiopatia hipertrófica (CMH) sejam submetidos a exames laboratoriais de rotina para estabelecer a etiologia, avaliar a gravidade da doença, auxiliar na detecção de manifestações extracardíacas e avaliação de disfunção orgânica secundária.[1]
Os níveis elevados de CK são uma pista útil ao tentar estabelecer a etiologia; distúrbios metabólicos como doença de Danon ou mitocondrial, que podem mimetizar a CMH, devem ser considerados.[50] Quando a CK está persistentemente elevada, um exame detalhado por um neurologista deve ser considerado.[1]
Resultado
normal; níveis elevados devem levantar suspeita de distúrbios metabólicos
testes da função hepática
Exame
As diretrizes dos EUA não recomendam exames laboratoriais como parte da investigação inicial.[2] No entanto, as diretrizes europeias recomendam que todos os pacientes com suspeita ou confirmação de cardiomiopatia hipertrófica (CMH) sejam submetidos a exames laboratoriais de rotina para estabelecer a etiologia, avaliar a gravidade da doença, auxiliar na detecção de manifestações extracardíacas e avaliação de disfunção orgânica secundária.[1]
A disfunção hepática é prevalente em pacientes com insuficiência cardíaca crônica.[51] Testes da função hepática anormais também podem ser uma pista útil ao tentar estabelecer a etiologia; distúrbios metabólicos como a doença de Danon, que pode mimetizar a CMH, devem ser considerados.[50]
Resultado
normal; pode ser anormal em pacientes com insuficiência cardíaca crônica
testes de função renal
Exame
As diretrizes dos EUA não recomendam exames laboratoriais como parte da investigação inicial.[2] No entanto, as diretrizes europeias recomendam que todos os pacientes com suspeita ou confirmação de cardiomiopatia hipertrófica sejam submetidos a exames laboratoriais de rotina para estabelecer a etiologia, avaliar a gravidade da doença, auxiliar na detecção de manifestações extracardíacas e avaliação de disfunção orgânica secundária.[1]
A insuficiência renal pode ser observada com disfunção ventricular esquerda grave.[52]
Resultado
pode ser anormal em pacientes com disfunção ventricular esquerda grave; normal
Fragmento N-terminal do peptídeo natriurético tipo B (NT-proPNB)
Exame
As diretrizes dos EUA não recomendam exames laboratoriais como parte da investigação inicial.[2] No entanto, as diretrizes europeias recomendam que todos os pacientes com suspeita ou confirmação de cardiomiopatia hipertrófica sejam submetidos a exames laboratoriais de rotina para estabelecer a etiologia, avaliar a gravidade da doença, auxiliar na detecção de manifestações extracardíacas e avaliação de disfunção orgânica secundária.[1]
Níveis elevados de NT-proPNB estão associados a eventos cardiovasculares, insuficiência cardíaca e morte, e podem ter valor diagnóstico, prognóstico e para monitoramento terapêutico.[1]
Resultado
aumentado na insuficiência cardíaca; pode ser normal
troponina
Exame
As diretrizes dos EUA não recomendam exames laboratoriais como parte da investigação inicial.[2] No entanto, as diretrizes europeias recomendam que todos os pacientes com suspeita ou confirmação de cardiomiopatia hipertrófica sejam submetidos a exames laboratoriais de rotina para estabelecer a etiologia, avaliar a gravidade da doença, auxiliar na detecção de manifestações extracardíacas e avaliação de disfunção orgânica secundária.[1]
Os níveis elevados de troponina estão associados a maior risco de eventos cardiovasculares, insuficiência cardíaca e morte, podendo ter valor diagnóstico, prognóstico e para monitoramento terapêutico.
Resultado
níveis elevados indicam aumento do risco de eventos cardiovasculares; pode ser normal
urinálise
Exame
As diretrizes dos EUA não recomendam exames laboratoriais como parte da investigação inicial.[2] No entanto, as diretrizes europeias recomendam que todos os pacientes com suspeita ou confirmação de cardiomiopatia hipertrófica devem ser submetidos a urinálise para detectar proteínas; a proteinúria é sugestiva de comprometimento renal.[1]
Resultado
proteinúria; normal
radiografia torácica
Exame
Esse exame não é particularmente sensível. Os pacientes podem ter cardiomegalia secundária à hipertrofia ventricular esquerda ou aumento do átrio esquerdo, ou a radiografia torácica pode ser normal.[4][Figure caption and citation for the preceding image starts]: Radiografia torácica de paciente com cardiomiopatia hipertrófica (CMH) demonstrando cardiomegaliaDo acervo de Melanie Everitt, MD, Heart Failure & Transplantation Program, Primary Children's Medical Center, Salt Lake City, UT; usado com permissão [Citation ends].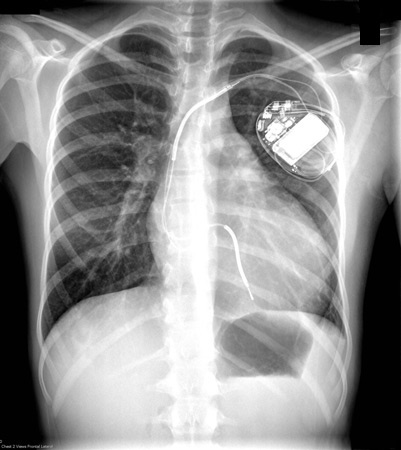
Resultado
cardiomegalia; normal
ecocardiografia transtorácica com Doppler
Exame
Na avaliação inicial de todos os pacientes com cardiomiopatia hipertrófica (CMH), recomenda-se a ecocardiografia transtorácica 2D e Doppler. O achado clássico é a hipertrofia ventricular esquerda (HVE), tipicamente hipertrofia assimétrica do septo.[4][27]
A ecocardiografia também é usada para rastreamento familiar de um indivíduo afetado e para avaliação de risco de morte súbita cardíaca (MSC) em pacientes com diagnóstico conhecido de CMH.
O diagnóstico clínico de CMH é confirmado quando a espessura máxima da parede diastólica final ≥15 mm é obtida em qualquer parte do ventrículo esquerdo (VE). Hipertrofia mais limitada (≥13 mm) pode ser diagnóstica quando presente em familiares de um paciente com CMH ou em conjunto com um teste genético positivo.[2][27]
O movimento anterior sistólico da valva mitral também pode ser observado, juntamente com a insuficiência mitral.
Obstrução da via de saída do VE pode estar presente.[2] Por convenção, a obstrução da via de saída do VE é definida como um pico de gradiente de via de saída do VE no Doppler instantâneo de ≥30 mmHg, mas o limiar para tratamento invasivo é geralmente considerado ≥50 mmHg.[1]
Pode haver também anormalidades da função diastólica (presentes em 80% dos pacientes, independentemente da presença de obstrução da via de saída do VE).[2] A disfunção diastólica deve ser avaliada por Doppler tecidual como parte do exame de rastreamento ecocardiográfico dos parentes de primeiro grau, pois essa anormalidade pode preceder o início de HVE evidente.[27][28]
Resultado
HVE, hipertrofia septal tipicamente assimétrica; obstrução da via de saída do ventrículo esquerdo pode ou não estar presente; disfunção diastólica pode ou não estar presente
Investigações a serem consideradas
eletrocardiografia de esforço
Exame
O teste ergométrico é realizado para auxiliar na estratificação de risco.
Dentre as anormalidades associadas ao risco elevado de morte súbita estão: resposta anormal da PA sistólica atenuada de <20 mmHg ao exercício físico, arritmias ventriculares, infradesnivelamento progressivo do segmento ST e sintomas.[29][30]
Resultado
pode ser normal ou pode demonstrar redução no consumo máximo de oxigênio, resposta da pressão arterial (PA) anormal, infradesnivelamento do segmento ST, arritmias
monitoramento com Holter
Exame
Arritmias ventriculares estão associadas a um risco elevado de morte súbita.
Resultado
pode ser normal ou demonstrar arritmias supraventriculares ou ventriculares
teste ergométrico com cintilografia
Exame
Os pacientes com dor torácica por esforço ou taquicardia ventricular no monitoramento com Holter devem ser submetidos a testes nucleares com tomografia computadorizada por emissão de fóton único ou tomografia por emissão de pósitrons.[27] A cintilografia de perfusão miocárdica pode demonstrar defeitos de perfusão mesmo na ausência de lesões obstrutivas.[2] Os pacientes podem ter defeitos fixos ou reversíveis. Pacientes com defeitos reversíveis devem ser submetidos a cateterismo cardíaco para a identificação das possíveis causas da isquemia.
A medicina nuclear também pode desempenhar um papel no diagnóstico; é particularmente útil no diagnóstico etiológico da amiloidose cardíaca.[1]
Resultado
pode ser evidência de isquemia
ressonância nuclear magnética cardíaca (RNMC)
Exame
A RNMC com contraste pode ser um complemento útil em pacientes com cardiomiopatia hipertrófica (CMH) na avaliação inicial.[1][2] Pode auxiliar no diagnóstico e contribuir para a estratificação e manejo de risco. A espessura da parede do ventrículo esquerdo (VE) pode ser avaliada; o uso da RNMC pode, assim, aumentar o rendimento diagnóstico em pacientes com suspeita de CMH que apresentam má visualização pela ecocardiografia das paredes ou ápice do VE.[1][2][27]
A função sistólica e diastólica também pode ser avaliada, bem como a função da valva mitral, a obstrução da via de saída do VE e as dimensões do átrio esquerdo.[1]
O uso de técnicas de realce tardio com gadolínio pode identificar áreas da fibrose miocárdica, podendo ser um marcador para desfechos adversos ou auxiliando na diferenciação da CMH do coração de atleta.[31]
A RNMC está surgindo como forma de identificar pacientes com aumento do risco de arritmias. Vários estudos consideraram a presença de fibrose miocárdica por realce tardio com gadolínio associada à ocorrência de arritmias ventriculares, bem como um fator de risco independente para morte.[2][32][33][34][35][36][37]
A caracterização tecidual na RNMC pode fornecer pistas sobre a etiologia, uma vez que achados característicos estão associados a certas doenças, por exemplo, na CMH sarcomérica, é típica uma parede média irregular em áreas hipertrofiadas, enquanto na hipertrofia cardíaca relacionada à amiloidose, realce tardio com gadolínio subendocárdico difuso é observado. Esses achados devem ser avaliados coletivamente com resultados genéticos e outras características clínicas por operadores especialistas em imagens cardíacas e na avaliação de doenças do músculo cardíaco.[1]
A RNMC de acompanhamento em série, a cada 2-5 anos, dependendo da gravidade inicial e da evolução clínica, pode ajudar na avaliação da progressão da doença, bem como dos benefícios da terapia.[1]
Resultado
HVE; pode apresentar obstrução da via de saída do ventrículo esquerdo, anormalidades estruturais da valva mitral e do músculo papilar, disfunção sistólica e/ou diastólica e aumento do átrio esquerdo; mais tarde na evolução da doença: pode demonstrar fibrose miocárdica
Tomografia computadorizada cardíaca (TC)
Exame
Embora não seja comumente usada, a TC pode fornecer informações importantes quando a ecocardiografia é tecnicamente limitada e o exame de imagem é contraindicado ou está indisponível.[2] A TC cardíaca fornece uma definição clara da estrutura do ventrículo esquerdo (incluindo padrão de hipertrofia, medição da espessura da parede, detecção de membrana subaórtica e trombo intracardíaco) e função. As desvantagens da TC são o uso de radiação e contraste de radioiodo e resolução temporal inferior em comparação com a ecocardiografia.[2]
Resultado
HVE; pode mostrar movimento anterior sistólico da valva mitral, trombos intracardíacos e realce tardio com iodo irregular ou difuso
arteriografia coronariana por tomografia computadorizada (TC)
cateterismo cardíaco
Exame
Em pacientes sintomáticos com cardiomiopatia hipertrófica e imagens cardíacas não invasivas inconclusivas, o cateterismo cardíaco esquerdo e direito pode ser considerado para avaliar a gravidade da obstrução da via de saída do ventrículo esquerdo e para medir as pressões de enchimento do VE.[1][2]
Pacientes com dor torácica por esforço, isquemia no teste nuclear ou probabilidade aumentada de doença arterial coronariana baseada em fatores de risco devem ser submetidos a cateterismo cardíaco para descartar a coexistência de doença coronariana aterosclerótica ou de ponte miocárdica.[2] Também recomendado para pacientes candidatos à terapia de redução septal.[2]
Resultado
geralmente normal; pode ser evidência de doença arterial coronariana aterosclerótica
ecocardiografia sob estresse
Exame
Pode ser útil em pacientes selecionados para avaliar isquemia miocárdica.[1]
Resultado
normal; isquemia miocárdica
ecocardiografia por esforço
Exame
Pode ser útil para identificar obstrução da via de saída do ventrículo esquerdo provocada e regurgitação mitral induzida por exercício em pacientes sintomáticos com cardiomiopatia hipertrófica.[1]
Resultado
normal; isquemia miocárdica
ecocardiografia transesofágica
Exame
Limitada a indicações selecionadas, como a exclusão de trombos atriais relacionados à fibrilação atrial, a investigação do método de obstrução em pacientes com obstrução da via de saída do ventrículo esquerdo quando isso não é óbvio, a elucidação do mecanismo da regurgitação mitral ou o planejamento de intervenções invasivas, como miectomia.[1]
Resultado
HVE; pode mostrar outras anormalidades, como trombos atriais ou anomalia intrínseca da valva mitral
biópsia endomiocárdica
Exame
Geralmente não é recomendada para o diagnóstico de cardiomiopatia hipertrófica, mas pode ser considerada em raras ocasiões, especialmente quando o padrão de hipertrofia é difuso e há suspeita de outras cardiomiopatias que apresentam hipertrofia.[1]
Resultado
pode apresentar características de causa alternativa para hipertrofia do VE, como doença de armazenamento (por exemplo, doença de Fabry) ou processo infiltrante (por exemplo, amiloidose)
análise de mutações genéticas
Exame
Acredita-se que os genes causadores da doença identificados atualmente sejam responsáveis por 80% dos casos, e a sensibilidade do teste genético disponível no mercado pode ser menor dependendo do número de genes rastreados pelo laboratório em questão. Quando as oito mutações mais comuns do sarcômero são rastreadas, a sensibilidade clínica aproxima-se de 60%.[17] Em até 40% dos pacientes com cardiomiopatia hipertrófica (CMH), nenhuma variante do sarcômero é identificada e não há história familiar da doença.[43] A ausência de uma variante monogênica causadora de doença nos testes genéticos convencionais deixa três possibilidades: (i) existe uma causa monogênica que não foi identificada (ou seja, não detectada ou reconhecida como causadora pelos testes atuais); (ii) a cardiomiopatia não tem etiologia genética; ou (iii) a cardiomiopatia é atribuível aos efeitos de múltiplas variantes de efeito individualmente menor.[1]
Quando uma mutação é identificada, o teste genético é útil no rastreamento de outros parentes para que se determine a necessidade de acompanhamento cardiológico contínuo. Parentes com mutação identificada devem continuar o rastreamento para o desenvolvimento clínico de CMH. O desenvolvimento de doença clinicamente aparente pode ocorrer tardiamente na idade adulta, então o rastreamento deverá ser vitalício. Os parentes negativos para o gene podem ser assegurados de que não têm a mutação causadora da doença e de que não necessitam de rastreamento adicional.[1][2][43][44]
A variabilidade clínica existe apesar das mutações genéticas. O risco de morte súbita pode ser menor ou maior para a mesma mutação.[46]
O aconselhamento genético deve estar disponível para todos os pacientes aos quais são oferecidos testes genéticos, para informar a tomada de decisões e garantir que os resultados possam ser revistos e o seu significado clínico determinado de forma adequada.[1] A importância das potenciais implicações psicológicas, sociais, legais, éticas e profissionais de ter uma doença genética também deve ser discutida e deve ser fornecido apoio adequado.[2]
O aconselhamento genético pré-natal deve ser oferecido aos pais que tiveram um filho previamente afetado com CMH hereditária devido a uma ou mais variantes patogênicas, ou a casais onde um ou ambos os parceiros são portadores de uma variante patogênica conhecida.[1][47] O risco de transmissão da doença deve ser discutido, bem como possíveis opções reprodutivas (por exemplo, fertilização in vitro com diagnóstico genético pré-implantacional, rastreamento genético pré-natal e testes genéticos pós-parto).[2][43]
Os avanços na tecnologia de sequenciamento genético e o aumento da acessibilidade aos testes levaram a um número crescente de variantes genéticas identificadas incidentalmente associadas à CMH. Interpretar a relevância clínica de tais achados pode ser um desafio; a American Heart Association produziu orientações sobre como manejá-los, com ênfase em uma abordagem de equipe multidisciplinar.[48] O American College of Medical Genetics and Genomics recomendou que os genes associados à cardiomiopatia sejam avaliados quanto a achados secundários sempre que um sequenciamento clínico amplo for realizado, independentemente da indicação inicial para o teste.[49] No entanto, atualmente não há consenso internacional em torno dessa recomendação.[1]
Resultado
mutação em 1 dos genes identificados
O uso deste conteúdo está sujeito ao nosso aviso legal