Abordaje
La investigación del síndrome antifosfolípido (SAF) debe sustentarse en un fuerte índice de sospecha. No existen criterios diagnósticos para el SAF. Sin embargo, los criterios de clasificación (formulados originalmente con fines de investigación en Sapporo, Japón, y posteriormente actualizados por ACR/EULAR) se utilizan a menudo como guía para el diagnóstico del SAF.[1][2][3] Estos criterios de clasificación se basan en criterios clínicos, incluida la trombosis y/o la morbilidad del embarazo, y en factores de laboratorio que incluyen pruebas de anticuerpos SAF persistentemente positivas.[1][2] Los criterios ACR/EULAR se consideran más específicos para el SAF, lo que significa que un paciente tiene una alta probabilidad de padecer SAF si se cumplen los criterios. Los criterios de Sapporo son más sensibles, lo que significa que es menos probable que pasen por alto a los pacientes con SAF. Los pacientes que cumplen los criterios de Sapporo, pero no los criterios ACR/EULAR, pueden seguir teniendo SAF y se debe utilizar el juicio clínico para determinar la mejor estrategia de tratamiento.[29]
Aquellos con al menos una prueba de anticuerpos antifosfolípidos (aPL) positiva en los 3 años siguientes a un criterio clínico asociado al aPL pueden clasificarse con los criterios ACR/EULAR.[2]
Hay seis dominios clínicos (tromboembolia venosa macrovascular, trombosis arterial macrovascular, microvascular, obstétrica, valvular cardíaca y hematológica) y dos dominios de laboratorio (pruebas aPL por ensayo de coagulación y ensayo en fase sólida) en la clasificación ACR/EULAR.[2]
Los elementos de cada uno de los ocho dominios reciben una puntuación entre 1 y 7. Las personas que obtienen al menos 3 puntos tanto en el dominio clínico como en el de laboratorio se clasifican como portadoras de SAF.[2]
En los criterios ACR/EULAR, las trombosis venosas o arteriales que se producen como resultado de riesgos conocidos y factores provocadores se puntúan más abajo. Si hay factores de riesgo fuertes o múltiples, se desaconseja la realización de pruebas de SAF.
Los pacientes con anticuerpos IgM reciben una puntuación más baja y, de forma aislada, no cumplirían con el umbral de puntuación de laboratorio para el diagnóstico de SAF en los nuevos criterios ACR/EULAR. Existe controversia sobre el riesgo trombótico de estos pacientes, con una necesidad reconocida de más investigación para determinar el tratamiento adecuado.
Anamnesis y exploración física
Los factores clave de la anamnesis que apoyan el diagnóstico incluyen lo siguiente.[1][2]
Un evento trombótico documentado (venoso, arterial o microvascular).[Figure caption and citation for the preceding image starts]: Imagen por resonancia magnética directa del trombo de una trombosis venosa profunda (TVP) proximal bilateralDe la colección personal para enseñanza del profesor Hunt, usado con autorización [Citation ends].

Antecedentes de pérdida recurrente del embarazo <10 semanas de gestación o pérdida del embarazo entre la semana 10 de gestación y la semana 34 de gestación o complicaciones relacionadas con el embarazo (eclampsia, preeclampsia grave, restricción del crecimiento intrauterino o insuficiencia placentaria) que resultan en el nacimiento prematuro de un recién nacido morfológicamente normal antes de la semana 34 de gestación.
Se requiere una prueba de anticuerpos para el síndrome antifosfolípido (SAF) en casos de eventos tromboembólicos venosos aparentemente espontáneos y pacientes jóvenes (<50 años) con accidente cerebrovascular (ACV), trombo en la arteria coronaria o eventos arteriales periféricos.
Infarto de miocardio trombótico: se debe asumir que los pacientes con esta presentación tienen SAF hasta que se confirme lo contrario.
Alteraciones de las válvulas cardíacas, como el engrosamiento de las válvulas que de otro modo sería inexplicable o la presencia de vegetaciones.
Antecedentes de alteraciones hematológicas, como trombocitopenia o anemia hemolítica que de otro modo serían inexplicables.
El SAF que se produce junto con un trastorno reumático o del tejido conectivo subyacente se conocía anteriormente como SAF secundario. Antecedentes de lupus o de un síndrome similar al lupus son un factor de riesgo para el SAF pero no son un criterio de diagnóstico clínico. Otras manifestaciones de la enfermedad incluyen otros trastornos reumatológicos o enfermedades autoinmunes, como el síndrome de Sjögren y la artritis reumatoide. Varias manifestaciones clínicas asociadas con el SAF no se incluyen en los criterios de clasificación específicos e incluyen livedo reticularis, erupción cutánea (que a menudo es inespecífica), vasculitis, nefropatía, edema y proteinuria, y hemorragia pulmonar.[4][30][Figure caption and citation for the preceding image starts]: Livedo reticularisDe la colección personal para enseñanza del profesor Hunt, usado con autorización [Citation ends].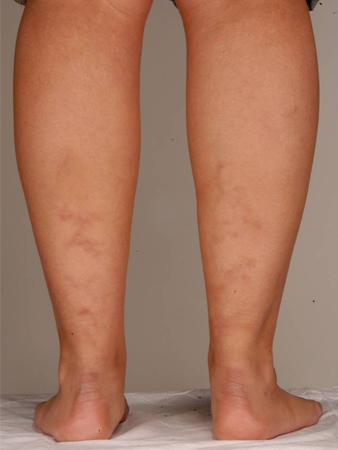 [Figure caption and citation for the preceding image starts]: Livedo reticularisDe la colección personal para enseñanza del profesor Hunt, usado con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Livedo reticularisDe la colección personal para enseñanza del profesor Hunt, usado con autorización [Citation ends].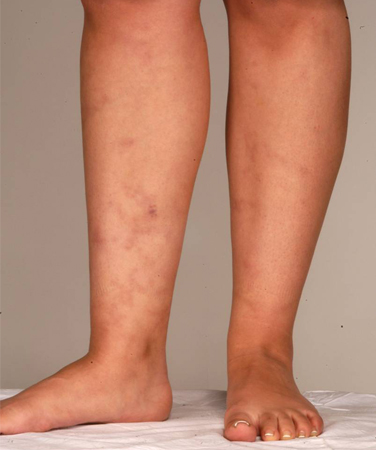
En casos raros, la nefropatía (que se manifiesta como edema y proteinuria) puede ser el resultado de una trombosis microangiopática secundaria al síndrome antifosfolípido (SAF).[31] Las manifestaciones neurológicas incluyen convulsiones, cefalea, pérdida de memoria y mielopatía transversa.[32][33] Los pacientes también pueden presentar artralgia o artritis. Se debe prestar atención a los signos de síndrome posflebítico, como inflamación de las piernas, venas varicosas, decoloración de la piel y ulceración.[34]
Análisis clínicos
El cribado de los anticuerpos antifosfolípidos debe realizarse si existe una sospecha clínica de APS. Para el diagnóstico se requiere la confirmación por parte del laboratorio de la presencia de antifosfolípidos incidentales (aFL) en 2 ocasiones con un intervalo mínimo de 12 semanas.[35] Los anticuerpos aFL incluyen: anticoagulante lúpico, anticuerpos anticardiolipina y anticuerpo anti-beta2-glucoproteína I (anticuerpo anti-B2GP-I).[2] La presencia de aFL puede ser transitoria debido a infecciones, trastornos linfoproliferativos y exposiciones a fármacos. En una proporción significativa de pacientes, la detección de aFL es un hallazgo incidental en pacientes aparentemente sanos, y el riesgo de trombosis en estos pacientes es relativamente bajo. Por dicho motivo, el SAF se confirma después de 2 pruebas con un intervalo de 12 semanas.
El diagnóstico de anticoagulantes lúpicos se basa en los ensayos de coagulación e involucra una etapa inicial de detección, seguida de una etapa de confirmación.[36][37] El principio del ensayo es la prolongación de una prueba de coagulación dependiente de fosfolípidos por parte del anticuerpo. En la fase de confirmación, el agregado de fosfolípido cargado negativamente fija el anticuerpo y, por tanto, se acorta el tiempo de coagulación. Siempre que sea posible, las pruebas de anticoagulantes lúpicos deben realizarse antes de iniciar la anticoagulación, ya que los anticoagulantes pueden dar lugar a resultados falsos positivos. Cuando esto no sea posible, las pruebas pueden realizarse con heparina no fraccionada o heparina de bajo peso molecular, siempre que el ensayo contenga un neutralizador de heparina y los niveles de fármaco no sean supraterapéuticos.[38] No se recomienda realizar pruebas de detección de anticoagulantes lúpicos en pacientes que tomen anticoagulantes orales directos, a menos que se hayan retirado o neutralizado. Los anticuerpos anticardiolipina y los anticuerpos anti-B2GP-I se detectan mediante inmunoensayo en fase sólida (ensayo inmunoenzimático normalizado [ELISA]) y no se ven afectados por la anticoagulación. Los anticuerpos anticardiolipina deben ser de isotipo inmunoglobulina (Ig) G y/o IgM en suero o plasma, presentes en título medio o alto (es decir, >40 unidades de fosfolípido IgG [GPL] o de fosfolípido IgM [MPL] o >99º percentil).[1][2][39] El anticuerpo anti-B2GP-I debe ser de isotipo IgG y/o IgM en suero o plasma (en título >percentil 99).[2]
Hay que destacar que solo un tercio de los pacientes con SAF presenta anticuerpos anticoagulantes lúpicos, anticardiolipina y antibeta2-glicoproteína I (es decir, son triplemente positivos). Varios pacientes pueden ser positivos solamente para el anticoagulante lúpico o para el anticuerpo anticardiolipina aislado. Por lo tanto, una evaluación inicial adecuada del síndrome antifosfolípido (SAF) debe incluir todas las pruebas de laboratorio.
Otras pruebas de laboratorio deben incluir las siguientes: hemograma completo para descartar trombocitopenia y anemia, creatinina y urea para la función renal, y detección de trastornos autoinmunes si se sospecha clínicamente. En los pacientes que presentan una tromboembolia venosa a una edad temprana y con antecedentes familiares de trombosis, debe considerarse la realización de una prueba de trombofilia hereditaria que mida los niveles de proteína C, proteína S, antitrombina y factor V Leiden y/o la reacción en cadena de la polimerasa para detectar una mutación del gen de la protrombina (G-20210-A) para excluir una trombofilia hereditaria subyacente.
En pacientes con anticuerpos antifosfolípidos o con antecedentes de morbilidad relacionada con el embarazo (SAF obstétrico), las pruebas para detectar otros trastornos trombofílicos sólo deben realizarse si existe un alto índice de sospecha de trombofilia hereditaria, como antecedentes familiares de tromboembolia venosa.
Estudios por imágenes
Se deben realizar investigaciones radiológicas adecuadas en pacientes con características clínicas que sugieran un evento tromboembólico arterial o venoso. Debe realizarse un Doppler venoso o una tomografía computarizada o una resonancia magnética (RM) para confirmar una trombosis venosa profunda.[Figure caption and citation for the preceding image starts]: Imagen por resonancia magnética directa del trombo de una trombosis venosa profunda (TVP) proximal bilateralDe la colección personal para enseñanza del profesor Hunt, usado con autorización [Citation ends]. La angiografía por tomografía computarizada del tórax o la gammagrafía de ventilación/perfusión (V/P) son necesarias para la confirmación en aquellos casos en los que se sospecha un émbolo pulmonar. Se requieren estudios por imágenes con IRM en pacientes con accidente cerebrovascular. La ecocardiografía está indicada en pacientes con características clínicas indicativas de lesiones o vegetaciones de las válvulas cardiacas (es decir, tromboembolia arterial inexplicada o soplo cardiaco). El ecocardiograma transoesofágico es el estudio más sensible para identificar estas lesiones y debe realizarse si existe un alto índice de sospecha.
La angiografía por tomografía computarizada del tórax o la gammagrafía de ventilación/perfusión (V/P) son necesarias para la confirmación en aquellos casos en los que se sospecha un émbolo pulmonar. Se requieren estudios por imágenes con IRM en pacientes con accidente cerebrovascular. La ecocardiografía está indicada en pacientes con características clínicas indicativas de lesiones o vegetaciones de las válvulas cardiacas (es decir, tromboembolia arterial inexplicada o soplo cardiaco). El ecocardiograma transoesofágico es el estudio más sensible para identificar estas lesiones y debe realizarse si existe un alto índice de sospecha.
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad