Etiología
La presencia de anticuerpos antifosfolípidos (aFL) persistentemente elevados con varias proteínas plasmáticas de unión a fosfolípidos puede resultar en el desarrollo de trombosis venosa, arterial y microvascular, y/o morbilidad asociada al embarazo. No está claro qué conduce al desarrollo de estos anticuerpos adquiridos; puede ser que el mimetismo molecular se produzca a través de la exposición a una infección viral o bacteriana.[Figure caption and citation for the preceding image starts]: Tinción tricrómica de una biopsia renal que muestra características consistentes con microangiopatía trombóticaDe la colección personal para enseñanza del profesor Hunt, usado con autorización [Citation ends]. [Figure caption and citation for the preceding image starts]: Inmunotinción de la fibrina de una biopsia renal que muestra características consistentes con microangiopatía trombóticaDe la colección personal para enseñanza del profesor Hunt, usado con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Inmunotinción de la fibrina de una biopsia renal que muestra características consistentes con microangiopatía trombóticaDe la colección personal para enseñanza del profesor Hunt, usado con autorización [Citation ends].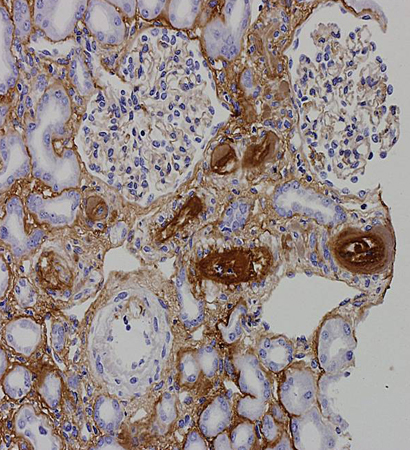
Fisiopatología
Los aFL son autoanticuerpos que reconocen una variedad de proteínas plasmáticas de unión a fosfolípidos tales como beta2-glucoproteína I, protrombina, anexina A5 y fosfolípidos expresados en las plaquetas, monocitos y células trofoblásticas. Se han propuesto varios mecanismos para describir la trombosis mediada por anticuerpos antifosfolípidos y la morbilidad del embarazo, pero no existe un mecanismo unificador ampliamente aceptado para describir todos los fenómenos de la enfermedad.[13][14][15]La beta2-glucoproteína I, una proteína de control del complemento construida con cinco dominios, está reconocida como la principal diana del antígeno de los anticuerpos SAF. Se ha descubierto que los anticuerpos que reconocen un epítopo específico en el dominio I de la beta2-glucoproteína I están asociados a un mayor riesgo de trombosis.[16]
Otros mecanismos propuestos para el papel de los anticuerpos del SAF en la trombosis incluyen unión endotelial, resistencia a la proteína C, y activación del complemento.[17][18][19][20] Puede que varios mecanismos trombóticos y mediados por inflamación inducidos por la unión de aFL sean la causa subyacente de la patogénesis de los anticuerpos antifosfolípidos en las complicaciones relacionadas con el embarazo.[21] En particular, el sistema del complemento se ha implicado en la patogénesis de la trombosis y la pérdida fetal en el SAF en ratones, y la resistencia a la anexina A5 también puede ser un mecanismo significativo.[22][23][24][25][26]
Clasificación
Declaración de consenso internacional sobre la actualización de los criterios de clasificación para el síndrome antifosfolípido (SAF) definido.[1]
No existen criterios diagnósticos para el SAF. Sin embargo, los criterios de clasificación (formulados originalmente en Sapporo, Japón, con fines de investigación) se utilizan a menudo como guía para el diagnóstico del SAF.[1][3] Los criterios de Sapporo tienen una especificidad del 86% y una sensibilidad del 99%.[1] Se diagnostica SAF si presenta por lo menos uno de los criterios clínicos de trombosis vascular o morbilidad del embarazo en asociación con la presencia de anticuerpos antifosfolípidos en dos o más ocasiones, con un intervalo de 12 semanas.[1] La trombosis vascular se define como uno o más episodios clínicos de trombosis arterial, venosa o de vasos pequeños, en cualquier tejido u órgano.
La morbilidad del embarazo se define como la pérdida de tres o más embriones antes de la 10ª semana de gestación y/o una o más muertes fetales no explicadas entre la 10ª semana de gestación y la 34ª semana de gestación, y/o el nacimiento prematuro de un neonato morfológicamente normal antes de la 34ª semana de gestación debido a eclampsia, preeclampsia grave, restricción del crecimiento intrauterino o insuficiencia placentaria.[1]
Criterios de clasificación del síndrome antifosfolípido del American College of Rheumatology (ACR)/Alianza Europea de Asociaciones de Reumatología (EULAR)[2]
Los criterios de clasificación de ACR/EULAR actualizan los criterios de Sapporo anteriores, al ampliar el alcance de los síntomas y signos clínicos para incluir dominios clínicos y de laboratorio independientes agrupados y ponderados jerárquicamente.[2] Los nuevos criterios, diseñados para mejorar la investigación relacionada con el SAF, tienen una especificidad del 99% y una sensibilidad del 84%.[2] Aquellos con al menos una prueba de aPL positiva en los 3 años siguientes a un criterio clínico asociado a aPL pueden clasificarse con los criterios ACR/EULAR. En la actualidad, las características clínicas se dividen en seis dominios (tromboembolia venosa macrovascular, trombosis arterial macrovascular, microvascular, obstétrica, valvular cardíaca y hematológica) y también hay dos dominios de laboratorio (pruebas de aPL por ensayo de coagulación y ensayo en fase sólida). Los elementos de cada uno de estos ocho dominios reciben una puntuación entre 1 y 7. Las personas que obtienen al menos 3 puntos en los dominios clínicos y al menos 3 puntos en los dominios de laboratorio se clasifican como portadoras de SAF.[2] Al igual que los criterios de Sapporo, la clasificación ACR/EULAR está destinada principalmente a identificar grupos homogéneos con una alta probabilidad de SAF con fines de investigación, en lugar de ser diagnóstica, pero es una guía útil para los médicos en la evaluación de individuos aPL positivos.
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad