Los pacientes hemodinámicamente inestables requieren reperfusión primaria urgente, anticoagulación y cuidados de soporte.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Para los pacientes con riesgo intermedio de un desenlace desfavorable, se requiere anticoagulación y una monitorización continua. La reperfusión se emplea generalmente como terapia de rescate si se produce una descompensación.
A los pacientes con bajo riesgo de un desenlace desfavorable se les puede tratar como pacientes externos, teniendo en cuenta las circunstancias personales del paciente y siempre que se cumplan todos los criterios siguientes:[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Clínicamente estable con buena reserva cardiopulmonar
No hay contraindicaciones como sangrado reciente, enfermedad renal o hepática grave o trombocitopenia grave (es decir, <50,000/mm³)
Cumplimiento esperado del tratamiento
El paciente se siente lo suficientemente bien como para seguir el tratamiento en su casa.
Los pacientes a los que se les diagnostica incidentalmente una EP asintomática deben recibir la misma anticoagulación inicial y a largo plazo que aquellos con una EP sintomática comparable.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Clasificación de la gravedad
Se han empleado varios sistemas de clasificación para describir la gravedad de la EP, y la mortalidad a corto plazo puede evaluarse mediante herramientas de predicción clínica como el Pulmonary Embolism Severity Index (PESI) o las puntuaciones simplificadas del PESI.[154]Tong C, Zhang Z. Evaluation factors of pulmonary embolism severity and prognosis. Clin Appl Thromb Hemost. 2015 Apr;21(3):273-84.
https://www.doi.org/10.1177/1076029613501540
http://www.ncbi.nlm.nih.gov/pubmed/24023267?tool=bestpractice.com
El término "submasivo" se ha aplicado a la EP con una extensión anatómica significativa, pero con normotensión, y masivo describe la EP anatómicamente extensa complicada con shock o hipotensión.
La European Society of Cardiology cataloga la EP como:
Alto riesgo cuando se presenta con inestabilidad hemodinámica (shock o hipotensión)
Riesgo intermedio-alto cuando se presenta sin inestabilidad hemodinámica pero con evidencia de disfunción del ventrículo derecho (VD) en los estudios por imágenes, biomarcadores cardíacos anormales y parámetros clínicos de gravedad (como una puntuación PESI alta)
Riesgo intermedio-bajo cuando se presenta sin inestabilidad hemodinámica, con evidencia de disfunción del VD en los estudios por imágenes o con biomarcadores cardíacos elevados (pero no ambos) y parámetros clínicos de gravedad (como una puntuación PESI alta)
Riesgo bajo cuando no se presenta ninguno de estos factores.
Sospecha de EP con shock o hipotensión
Los pacientes de alto riesgo (que presentan shock o hipotensión [es decir, PA sistólica <90 mmHg]) requieren un tratamiento agresivo con reperfusión primaria, anticoagulación y terapia de soporte.
Se deben iniciar sin demora terapias de soporte y anticoagulación empírica (a menos que estén contraindicadas).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
La heparina no fraccionada (HNF) puede ser preferible en esta población; la mayoría de los estudios clínicos de terapias intervencionistas han utilizado heparina como componente anticoagulante del régimen.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Terapias de soporte
Deben seguirse los protocolos locales de reanimación.
Soporte respiratorio
Se debe administrar oxigenoterapia a alta concentración para alcanzar saturaciones de oxígeno de entre 94% y 98% (o de 88% a 92% en pacientes con riesgo de insuficiencia respiratoria hipercápnica).[155]O'Driscoll BR, Howard LS, Earis J, et al; British Thoracic Society Emergency Oxygen Guideline Group; BTS Emergency Oxygen Guideline Development Group. BTS guideline for oxygen use in adults in healthcare and emergency settings. Thorax. 2017 Jun;72(Suppl 1):ii1-90.
https://www.brit-thoracic.org.uk/document-library/clinical-information/oxygen/2017-emergency-oxygen-guideline/bts-guideline-for-oxygen-use-in-adults-in-healthcare-and-emergency-settings
http://www.ncbi.nlm.nih.gov/pubmed/28507176?tool=bestpractice.com
Puede que sea necesario intubar y ventilar mecánicamente en pacientes con insuficiencia respiratoria/hipoxemia grave. La ventilación mecánica puede ocasionar hipotensión, de modo que se deberá realizar una monitorización estrecha de la PA.
Fluidoterapia intravenosa
Si la presión arterial sistólica es <90 mmHg, debe administrarse fluidoterapia intravenosa. La insuficiencia ventricular derecha que provoca un bajo gasto sistémico es la causa principal de muerte en pacientes con EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Los estudios indican que la expansión excesiva de volumen no ofrece ningún beneficio, e incluso puede empeorar la función ventricular derecha al causar una sobredistensión mecánica, o mediante mecanismos reflejos que deprimen la contractilidad. Sin embargo, puede que sea beneficiosa una sobrecarga líquida modesta (es decir, 500 ml de cristaloide) en pacientes con EP, un índice cardíaco bajo y una PA normal.[159]Mercat A, Diehl JL, Meyer G, et al. Hemodynamic effects of fluid loading in acute massive pulmonary embolism. Crit Care Med. 1999 Mar;27(3):540-4.
http://www.ncbi.nlm.nih.gov/pubmed/10199533?tool=bestpractice.com
Fármacos vasoactivos
Si la presión arterial sistólica es <90 mmHg, se deben administrar vasopresores. Con frecuencia es necesario el uso de vasopresores con (o durante el período de espera de) tratamientos farmacológicos, quirúrgicos o de reperfusión intervencionista.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
La noradrenalina (norepinefrina) puede mejorar la función ventricular derecha y la perfusión coronaria ventricular derecha.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Sin embargo, su uso probablemente debe limitarse a pacientes hipotensos.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
La dobutamina mejora la contractilidad, provocando un aumento del volumen sistólico y el gasto cardíaco. No obstante, su efecto vasodilatador sistémico puede conducir a hipotensión.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
La epinefrina (adrenalina) combina las propiedades beneficiosas de la noradrenalina (norepinefrina) (vasoconstricción con aumento de la perfusión ventricular derecha, inotropismo positivo) y la dobutamina (inotropismo positivo), pero sin los efectos vasodilatadores sistémicos de esta última.[160]Layish DT, Tapson VF. Pharmacologic hemodynamic support in massive pulmonary embolism. Chest. 1997 Jan;111(1):218-24.
http://www.ncbi.nlm.nih.gov/pubmed/8996020?tool=bestpractice.com
Anticoagulación en fase de inicio (5-21 días)
Los pacientes que presentan una sospecha de EP deben recibir un anticoagulante dosificado según la fase de iniciación del tratamiento (el período inicial tras el diagnóstico de EP, que dura entre 5 y 21 días según el fármaco seleccionado), a menos que esté contraindicado.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[161]Willoughby L, Adams DM, Evans RS, et al. Preemptive anticoagulation in patients with a high pretest probability of pulmonary embolism: are guidelines followed? Chest. 2018 May;153(5):1153-9.
https://www.doi.org/10.1016/j.chest.2017.11.007
http://www.ncbi.nlm.nih.gov/pubmed/29154971?tool=bestpractice.com
Si posteriormente se excluye la embolia pulmonar (EP), puede suspenderse la anticoagulación. En los pacientes con EP confirmada, la anticoagulación debe ajustarse a la dosis de la fase de tratamiento después de completar la fase de inicio, y debe continuar durante al menos 3 meses.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Anticoagulación parenteral
La anticoagulación parenteral en fase de inicio debe iniciarse en pacientes con probabilidad clínica (prueba previa) de EP alta o intermedia en espera de los resultados de los estudios por imágenes del diagnóstico. Si se prescribe un anticoagulante parenteral (HNF, heparina de bajo peso molecular [HBPM] o fondaparinux), debe solaparse con el inicio de un antagonista de la vitamina K (AVK). La anticoagulación parenteral con HNF durante un mínimo de 5 días se reserva para los pacientes con EP de alto riesgo en los que se considera la reperfusión primaria (es decir, el tratamiento trombolítico sistémico o la embolectomía).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
En los pacientes con EP de riesgo intermedio a alto o intermedio a bajo, la HBPM o el fondaparinux son los anticoagulantes parenterales de elección en la fase de inicio debido a las menores tasas de sangrados mayores y de trombocitopenia inducida por la heparina.
La anticoagulación parenteral puede interrumpirse, una vez que se haya establecido una relación internacional normalizada (INR) terapéutica de 2.0 a 3.0 y haya transcurrido al menos 5 días de solapamiento con los AVK.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
La HNF tiene una vida media corta, es fácil de monitorizar y se revierte rápidamente con protamina.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Anticoagulantes orales directos (DOAC)
Se pueden recetar dos de los anticoagulantes orales de acción directa, rivaroxabán y apixabán, sin necesidad de tratamiento previo con un anticoagulante parenteral. Sin embargo, tanto dabigatrán, como edoxabán requieren de terapia puente con anticoagulante parenteral durante 5 a 10 días.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Un metanálisis reveló que los anticoagulantes orales de acción directa tienen una eficacia similar a un régimen de heparina/AVK, pero con un menor riesgo de sangrado grave (riesgo relativo 0.61, IC del 95%: 0.21 a 0.68).[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
[162]van Es N, Coppens M, Schulman S, et al. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood. 2014 Sep 18;124(12):1968-75.
http://www.bloodjournal.org/content/124/12/1968.long
http://www.ncbi.nlm.nih.gov/pubmed/24963045?tool=bestpractice.com
Del mismo modo, un análisis de red informó escasas diferencias estadísticamente significativas entre una combinación de HBPM/AVK otras estrategias de tratamiento anticoagulante (para el tromboembolismo venoso [TEV]); sin embargo, la HNF/AVK puede ser la estrategia menos eficaz, y el inicio de apixabán puede estar asociado con el menor riesgo de sangrado.[163]Castellucci LA, Cameron C, Le Gal G, et al. Clinical and safety outcomes associated with treatment of acute venous thromboembolism: a systematic review and meta-analysis. JAMA. 2014 Sep 17;312(11):1122-35.
https://www.doi.org/10.1001/jama.2014.10538
http://www.ncbi.nlm.nih.gov/pubmed/25226478?tool=bestpractice.com
Los anticoagulantes orales directos (DOAC) no requieren una monitorización del nivel del fármaco ni de la hemostasia, tienen un rápido inicio de acción y son de corta duración. No interactúan con los alimentos, pero pueden interactuar con otros agentes farmacoterapéuticos y requieren la monitorización de la creatinina sérica. El dabigatrán se puede revertir con idarucizumab. El andexanet alfa está aprobado por la Administración de Medicamentos y Alimentos de EE.UU. y la Agencia Europea del Medicamento para revertir la anticoagulación mediada por apixabán y rivaroxabán en pacientes con sangrados potencialmente mortales o incontroladas. Por el momento, no se ha aprobado ningún antídoto para el edoxabán.
Hay pocos o ningún dato que respalde el uso de los anticoagulantes orales directos (DOAC) junto con el tratamiento trombolítico durante la fase de inicio. Una vez estabilizado el paciente, los médicos deben adoptar un proceso de decisión compartida para seleccionar la anticoagulación en fase de tratamiento en esta población de pacientes, teniendo en cuenta, tanto las limitaciones de la evidencia, como la pragmática de los cuidados.
Poblaciones específicas de pacientes
Se recomienda un AVK para los pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 mL/minuto).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
El apixaban también es adecuado para su uso en pacientes con disfunción renal grave o enfermedad renal terminal, aunque la evidencia para su uso en esta población de pacientes es limitada.[164]Pathak R, Pandit A, Karmacharya P, et al. Meta-analysis on risk of bleeding with apixaban in patients with renal impairment. Am J Cardiol. 2015 Feb 1;115(3):323-7.
https://www.doi.org/10.1016/j.amjcard.2014.10.042
http://www.ncbi.nlm.nih.gov/pubmed/25527282?tool=bestpractice.com
El American College of Chest Physicians (ACCP) recomienda apixabán, edoxabán o rivaroxabán en lugar de HBPM para la fase de inicio en pacientes con cáncer activo (trombosis asociada al cáncer).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Los DOAC (especialmente edoxabán y rivaxobarán) se asocian a un mayor riesgo de sangrado gastrointestinal que las HBPM. En pacientes con cáncer gastrointestinal luminal, la ACCP recomienda apixaban o HBPM como fármacos de elección.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[  ]
How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2813/fullMostrarme la respuesta La American Society of Hematology (ASH) recomienda rivaroxabán, apixabán o HBPM para la anticoagulación en la fase inicial en pacientes con cáncer activo; la ASH reconoce que esta recomendación es condicional y se basa en evidencias de muy baja certeza.[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
]
How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2813/fullMostrarme la respuesta La American Society of Hematology (ASH) recomienda rivaroxabán, apixabán o HBPM para la anticoagulación en la fase inicial en pacientes con cáncer activo; la ASH reconoce que esta recomendación es condicional y se basa en evidencias de muy baja certeza.[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
Se prefiere la HBPM en pacientes con insuficiencia hepática grave y coagulopatía.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Los profesionales de salud deben consultar la etiqueta y/o los vademécum locales antes de prescribir un anticoagulante oral directo a un paciente con insuficiencia renal o hepática.
El fondaparinux conlleva un bajo riesgo de inducir trombocitopenia inducida por heparina (TIH) y parece ser eficaz en pacientes con TIH sospechada o confirmada.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[166]Kang M, Alahmadi M, Sawh S, et al. Fondaparinux for the treatment of suspected heparin-induced thrombocytopenia: a propensity score-matched study. Blood. 2015 Feb 5;125(6):924-9.
http://www.bloodjournal.org/content/125/6/924.long
http://www.ncbi.nlm.nih.gov/pubmed/25515959?tool=bestpractice.com
Está contraindicado en pacientes con insuficiencia renal grave.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Embarazo
Se recomienda HBPM para las mujeres que están embarazadas (dosis ajustada según el peso) o que puedan estarlo.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[167]Bates SM, Greer IA, Middeldorp S, et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012 Feb;141(2 Suppl):e691S-736S.
https://journal.chestnet.org/article/S0012-3692(12)60136-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/22315276?tool=bestpractice.com
No cruza la placenta y generalmente no es necesaria monitorización de rutina.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[168]Royal College of Obstetricians and Gynaecologists. Reducing the risk of venous thromboembolism during pregnancy and the puerperium. Green-top guideline No. 37a. Apr 2015 [internet publication].
https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf
[169]Bates SM, Rajasekhar A, Middeldorp S, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy. Blood Adv. 2018 Nov 27;2(22):3317-59.
https://www.doi.org/10.1182/bloodadvances.2018024802
http://www.ncbi.nlm.nih.gov/pubmed/30482767?tool=bestpractice.com
Otros anticoagulantes, incluidos los AVK, pueden atravesar la placenta con el consiguiente riesgo de efectos adversos para el feto.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Los DOAC están contraindicados en el embarazo.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[170]Cohen H, Arachchillage DR, Middeldorp S, et al. Management of direct oral anticoagulants in women of childbearing potential: guidance from the SSC of the ISTH. J Thromb Haemost. 2016 Aug;14(8):1673-6.
https://www.doi.org/10.1111/jth.13366
http://www.ncbi.nlm.nih.gov/pubmed/27346676?tool=bestpractice.com
Se recomienda la vigilancia clínica en lugar de la anticoagulación en los pacientes con EP subsegmentaria (es decir, sin afectación de las arterias pulmonares más proximales) que no presentan trombosis venosa profunda (TVP) proximal en las piernas y que presentan un bajo riesgo de TEV recurrente. La vigilancia clínica consiste en informar a los pacientes sobre los signos y síntomas clínicos de trombosis progresiva a los que hay que prestar atención y sobre la necesidad de reevaluarse si están presentes.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Reperfusión primaria en pacientes con shock o hipotensión
El tratamiento trombolítico sistémico (preferiblemente con alteplasa o reteplasa; la tenecteplasa es una alternativa) se recomienda en pacientes con compromiso hemodinámico (shock, sistólica <90 mmHg, o necesidad de vasopresores para mantener la PA sistólica >90 mmHg), ya que este grupo de pacientes presenta una alta tasa de mortalidad.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
[171]Zuo Z, Yue J, Dong BR, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2021 Apr 15;4:CD004437.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004437.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/33857326?tool=bestpractice.com
[172]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.
https://jamanetwork.com/journals/jama/fullarticle/1881311
http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com
[173]Ortel TL, Neumann I, Ageno W, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv. 2020 Oct 13;4(19):4693-738.
https://www.doi.org/10.1182/bloodadvances.2020001830
http://www.ncbi.nlm.nih.gov/pubmed/33007077?tool=bestpractice.com
[174]Meyer G, Vicaut E, Danays T, et al; PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014 Apr 10;370(15):1402-11.
https://www.nejm.org/doi/10.1056/NEJMoa1302097
http://www.ncbi.nlm.nih.gov/pubmed/24716681?tool=bestpractice.com
[175]Kline JA, Hernandez-Nino J, Jones AE. Tenecteplase to treat pulmonary embolism in the emergency department. J Thromb Thrombolysis. 2007 Apr;23(2):101-5.
https://www.doi.org/10.1007/s11239-006-9018-3
http://www.ncbi.nlm.nih.gov/pubmed/17221330?tool=bestpractice.com
La ACCP recomienda el tratamiento trombolítico sistémico (a menos que esté contraindicado) utilizando una vena periférica para los pacientes con TEP aguda asociada a hipotensión que no tengan un alto riesgo de sangrado. La ACCP no emite recomendaciones específicas sobre los fármacos de elección debido a la falta de datos comparativos.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
El tratamiento trombolítico sistémico se asocia a una menor mortalidad por todas las causas que la anticoagulación en solitario en pacientes con EP de alto riesgo (masiva) (EP aguda con hipotensión sostenida [es decir, PA sistólica <90 mmHg durante al menos 15 minutos]).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[171]Zuo Z, Yue J, Dong BR, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2021 Apr 15;4:CD004437.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004437.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/33857326?tool=bestpractice.com
[172]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.
https://jamanetwork.com/journals/jama/fullarticle/1881311
http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com
[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
Lo ideal es que la EP se confirme mediante estudios por imágenes antes de administrar el tratamiento trombolítico.[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Sin embargo, si el paciente se encuentra en riesgo de sufrir un paro cardíaco inminente, el tratamiento puede iniciarse únicamente por razones clínicas.[96]British Thoracic Society Standards of Care Committee Pulmonary Embolism Guideline Development Group. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax. 2003 Jun;58(6):470-83.
http://thorax.bmj.com/content/58/6/470.long
http://www.ncbi.nlm.nih.gov/pubmed/12775856?tool=bestpractice.com
El tratamiento trombolítico sistémico induce una rápida disolución de los coágulos y mejora la función ventricular derecha, el flujo sanguíneo pulmonar y la perfusión de los pulmones.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
En un metanálisis de pacientes con EP aguda, la trombólisis más heparina se asoció con una reducción significativa de la mortalidad a 30 días en comparación con la heparina en solitario (2.3% [24/1033] frente a 3.9% [40/1024], respectivamente; odds ratio [OR] agrupado 0.59, IC del 95%: 0.36 a 0.96, P = 0.03).[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
Sin embargo, la trombólisis se asocia a un riesgo significativamente mayor de sangrados mayores y menores, incluido el ictus hemorrágico.[171]Zuo Z, Yue J, Dong BR, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2021 Apr 15;4:CD004437.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004437.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/33857326?tool=bestpractice.com
[172]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.
https://jamanetwork.com/journals/jama/fullarticle/1881311
http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com
[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
Un número superior de pacientes que recibían tratamiento trombolítico más heparina experimentaron un episodio de sangrado grave en comparación con los que recibían un tratamiento anticoagulante solo (9.9% [96/974] frente a 3.6% [35/961], respectivamente; OR 2.91, IC del 95%: 1.95 a 4.36).[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
La incidencia informada de hemorragia intracraniana o mortal fue de 1.7% en el grupo de trombólisis y de 0.3% en el grupo de anticoagulante.[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
Las contraindicaciones absolutas para la trombólisis incluyen: accidente cerebrovascular hemorrágico o accidente cerebrovascular de origen desconocido en cualquier momento; accidente cerebrovascular isquémico en los 6 meses anteriores; daño o neoplasias en el sistema nervioso central; traumatismo importante/cirugía/lesión en la cabeza reciente (en las 3 semanas anteriores); sangrado gastrointestinal durante el último mes; riesgo de sangrado conocido.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[177]Van de Werf F, Ardissino D, Betriu A, et al; task force on the management of acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2003 Jan;24(1):28-66.
https://academic.oup.com/eurheartj/article/24/1/28/562262
http://www.ncbi.nlm.nih.gov/pubmed/12559937?tool=bestpractice.com
Las contraindicaciones relativas para la trombólisis incluyen: accidente isquémico transitorio en los 6 meses anteriores; tratamiento anticoagulante oral; embarazo o primera semana tras el parto; reanimación traumática (en relación con este episodio de EP); hipertensión refractaria (PA sistólica >180 mmHg); hepatopatía avanzada; endocarditis infecciosa; úlcera péptica activa.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[177]Van de Werf F, Ardissino D, Betriu A, et al; task force on the management of acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2003 Jan;24(1):28-66.
https://academic.oup.com/eurheartj/article/24/1/28/562262
http://www.ncbi.nlm.nih.gov/pubmed/12559937?tool=bestpractice.com
El tratamiento trombolítico no suele recomendarse en pacientes hemodinámicamente estables con EP aguda.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
En un ensayo aleatorizado doble ciego, el tratamiento trombolítico de reperfusión primaria más heparina en pacientes normotensos con EP de riesgo intermedio (disfunción ventricular derecha aguda y lesión miocárdica sin compromiso hemodinámico manifiesto) evitó la descompensación hemodinámica en comparación con la heparina en solitario, pero aumentó el riesgo de sangrado mayor y de accidente cerebrovascular.[174]Meyer G, Vicaut E, Danays T, et al; PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014 Apr 10;370(15):1402-11.
https://www.nejm.org/doi/10.1056/NEJMoa1302097
http://www.ncbi.nlm.nih.gov/pubmed/24716681?tool=bestpractice.com
Embolectomía quirúrgica o terapia asistida por catéter
El tratamiento trombolítico sistémico aumenta el riesgo de sangrado, incluido el de sangrado intracraneal.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
La embolectomía pulmonar quirúrgica y la terapia dirigida por catéter (que suele implicar una combinación de fragmentación mecánica y farmacoterapéutica del trombo) presentan probablemente un menor riesgo de sangrado que la terapia sistémica.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[178]Dolovich LR, Ginsberg JS, Douketis JD, et al. A meta-analysis comparing low-molecular-weight heparins with unfractionated heparin in the treatment of venous thromboembolism: examining some unanswered questions regarding location of treatment, product type, and dosing frequency. Arch Intern Med. 2000 Jan 24;160(2):181-8.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/485206
http://www.ncbi.nlm.nih.gov/pubmed/10647756?tool=bestpractice.com
[179]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.
http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com
[180]Goldberg JB, Giri J, Kobayashi T, et al. Surgical management and mechanical circulatory support in high-risk pulmonary embolisms: historical context, current status, and future directions: a scientific statement from the American Heart Association. Circulation. 2023 Feb 28;147(9):e628-e47.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000001117
http://www.ncbi.nlm.nih.gov/pubmed/36688837?tool=bestpractice.com
La embolectomía pulmonar quirúrgica se recomienda en pacientes en los que el tratamiento trombolítico sistémico ha fallado o está contraindicado de forma absoluta.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[180]Goldberg JB, Giri J, Kobayashi T, et al. Surgical management and mechanical circulatory support in high-risk pulmonary embolisms: historical context, current status, and future directions: a scientific statement from the American Heart Association. Circulation. 2023 Feb 28;147(9):e628-e47.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000001117
http://www.ncbi.nlm.nih.gov/pubmed/36688837?tool=bestpractice.com
Las tasas de mortalidad tras la embolectomía pulmonar oscilan entre el 4% y el 27%.[181]Fukuda I, Daitoku K. Surgical Embolectomy for Acute Pulmonary Thromboembolism. Ann Vasc Dis. 2017 Jun 25;10(2):107-114.
https://www.doi.org/10.3400/avd.ra.17-00038
http://www.ncbi.nlm.nih.gov/pubmed/29034035?tool=bestpractice.com
En una cohorte de pequeño tamaño muestral de pacientes que se sometieron a la embolectomía pulmonar quirúrgica para tromboembolia pulmonar masiva, la tasa de supervivencia a 10 años fue del 84%.[182]Fukuda I, Taniguchi S, Fukui K, et al. Improved outcome of surgical pulmonary embolectomy by aggressive intervention for critically ill patients. Ann Thorac Surg. 2011 Mar;91(3):728-32.
https://www.doi.org/10.1016/j.athoracsur.2010.10.086
http://www.ncbi.nlm.nih.gov/pubmed/21352987?tool=bestpractice.com
El tratamiento dirigido por catéter, que suele consistir en una combinación de fragmentación mecánica y farmacoterapéutica del trombo, puede considerarse para los pacientes con TEP aguda asociada a hipotensión que también presentan un alto riesgo de sangrado, un fracaso de la trombólisis sistémica o un shock que probablemente cause la muerte antes de que la trombólisis sistémica pueda surtir efecto (p. ej., en cuestión de horas), si se dispone de la experiencia y los recursos adecuados.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
La terapia dirigida por catéter utiliza una dosis menor de fármaco trombolítico (aproximadamente un tercio de la dosis completa del tratamiento trombolítico sistémico) y se cree que reduce el riesgo de sangrado en sitios remotos (p. ej., sangrado intracraneal o gastrointestinal).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Un metanálisis de ensayos no aleatorizados de tratamientos asistidos por catéter informó una tasa de éxito clínico del 87% con un riesgo asociado de complicaciones mayores y menores de 2% y 8%, respectivamente.[183]Kuo WT, Gould MK, Louie JD, at al. Catheter-directed therapy for the treatment of massive pulmonary embolism: systematic review and meta-analysis of modern techniques. J Vasc Interv Radiol. 2009 Nov;20(11):1431-40.
http://www.ncbi.nlm.nih.gov/pubmed/19875060?tool=bestpractice.com
Las evidencias son limitadas por los estudios pequeños, el diseño de los estudios (es decir, no aleatorizados) y el uso de criterios de valoración de la eficacia intermedios.[184]Jimenez D, Martin-Saborido C, Muriel A, et al. Efficacy and safety outcomes of recanalisation procedures in patients with acute symptomatic pulmonary embolism: systematic review and network meta-analysis. Thorax. 2018 May;73(5):464-71.
https://www.doi.org/10.1136/thoraxjnl-2017-210040
http://www.ncbi.nlm.nih.gov/pubmed/29133351?tool=bestpractice.com
Filtros de la vena cava inferior
Se puede colocar un filtro de vena cava inferior (VCI) en los pacientes:[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[179]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.
http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com
Con EP aguda y una contraindicación absoluta al tratamiento anticoagulante, como un sangrado mayor activo
Con embolia pulmonar (EP) recurrente confirmada a pesar de una anticoagulación adecuada.
Las guías de práctica clínica de la ACCP recomiendan el uso de un filtro de la VCI solo para pacientes con EP aguda (p. ej., diagnosticada en el último mes) y una contraindicación absoluta para el tratamiento anticoagulante (p. ej., sangrado grave activa, trombocitopenia grave, alto riesgo de sangrado, lesión del sistema nervioso central). La ACCP desaconseja el uso de filtros de la VCI además de la anticoagulación en pacientes con EP aguda.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Otros consideran que las indicaciones relativas para el uso del filtro de la VCI incluyen la EP masiva con trombo venoso profundo residual en un paciente con riesgo de sufrir otra EP, un trombo iliofemoral o VCI flotante y una enfermedad cardiopulmonar grave y trombosis venosa profunda (TVP) (p. ej., cor pulmonale con hipertensión pulmonar).[185]American College of Radiology; Society of Interventional Radiology. ACR-SIR-SPR practice parameter for the performance of inferior vena cava (IVC) filter placement for the prevention of pulmonary embolism. 2021 [internet publication].
https://www.acr.org/-/media/ACR/Files/Practice-Parameters/ivc-fliterplacement.pdf
En algunos centros se insertan filtros de la VCI intraoperatoriamente o en el postoperatorio inmediato en pacientes que se someten a embolectomía pulmonar quirúrgica.[186]Leacche M, Unic D, Goldhaber SZ, et al. Modern surgical treatment of massive pulmonary embolism: Results in 47 consecutive patients after rapid diagnosis and aggressive surgical approach. J Thorac Cardiovasc Surg. 2005 May;129(5):1018-23.
http://www.ncbi.nlm.nih.gov/pubmed/15867775?tool=bestpractice.com
[187]Aklog L, Williams CS, Byrne JG, et al. Acute pulmonary embolectomy: a contemporary approach. Circulation. 2002 Mar 26;105(12):1416-9.
http://circ.ahajournals.org/content/105/12/1416.long
http://www.ncbi.nlm.nih.gov/pubmed/11914247?tool=bestpractice.com
[188]Greelish JP, Leacche M, Solenkova NS, et al. Improved midterm outcomes for type A (central) pulmonary emboli treated surgically. J Thorac Cardiovasc Surg. 2011 Dec;142(6):1423-9.
https://www.jtcvs.org/article/S0022-5223(11)00280-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/21481423?tool=bestpractice.com
La colocación del filtro de la VCI se debe realizar lo antes posible si es el único tratamiento que puede iniciarse. Existe poca evidencia disponible que sugiera el momento ideal para la colocación. Sin embargo, el riesgo de muerte es más alto dentro de las 2 primeras horas después de presentarse la afección, lo cual puede indicar que este es un período de tiempo razonable para la colocación del filtro.[189]Tow DE, Wagner HN. Urokinase pulmonary embolism trial: Phase I results. JAMA. 1970 Dec 21;214(12):2163-72.
https://jamanetwork.com/journals/jama/article-abstract/358702
Los estudios observacionales sugieren que la inserción de un filtro venoso podría reducir las tasas de mortalidad relacionadas con la EP en la fase aguda, pero con un aumento asociado del riesgo de TEV relacionado con el filtro.[190]Stein PD, Matta F, Keyes DC, et al. Impact of vena cava filters on in-hospital case fatality rate from pulmonary embolism. Am J Med. 2012 May;125(5):478-84.
https://www.amjmed.com/article/S0002-9343(11)00481-5/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/22310013?tool=bestpractice.com
[191]Muriel A, Jiménez D, Aujesky D, et al. Survival effects of inferior vena cava filter in patients with acute symptomatic venous thromboembolism and a significant bleeding risk. J Am Coll Cardiol. 2014 Apr 29;63(16):1675-83.
http://www.ncbi.nlm.nih.gov/pubmed/24576432?tool=bestpractice.com
Las complicaciones relacionadas con los filtros de la vena cava inferior (VCI) permanentes son frecuentes, aunque rara vez son mortales.[191]Muriel A, Jiménez D, Aujesky D, et al. Survival effects of inferior vena cava filter in patients with acute symptomatic venous thromboembolism and a significant bleeding risk. J Am Coll Cardiol. 2014 Apr 29;63(16):1675-83.
http://www.ncbi.nlm.nih.gov/pubmed/24576432?tool=bestpractice.com
En general, se producen complicaciones tempranas (que incluyen la trombosis en el sitio de inserción) aproximadamente en el 10% de los pacientes. Las complicaciones tardías son más frecuentes, e incluyen trombosis venosa profunda (TVP) recurrente (aproximadamente el 20% de los pacientes) y el síndrome postrombótico (hasta el 40% de los pacientes).[192]Rajasekhar A, Streiff MB. Vena cava filters for management of venous thromboembolism: a clinical review. Blood Rev. 2013 Sep;27(5):225-41.
http://www.ncbi.nlm.nih.gov/pubmed/23932118?tool=bestpractice.com
[193]PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prévention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study. Circulation. 2005 Jul 19;112(3):416-22.
http://circ.ahajournals.org/content/112/3/416.long
http://www.ncbi.nlm.nih.gov/pubmed/16009794?tool=bestpractice.com
La oclusión de la vena cava inferior (VCI) afecta aproximadamente al 22% de los pacientes a los 5 años y al 33% a los 9 años, independientemente del uso y la duración de la anticoagulación.[193]PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prévention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study. Circulation. 2005 Jul 19;112(3):416-22.
http://circ.ahajournals.org/content/112/3/416.long
http://www.ncbi.nlm.nih.gov/pubmed/16009794?tool=bestpractice.com
La anticoagulación posterior al filtro se debe considerar según cada caso, de acuerdo con las contraindicaciones relativas y absolutas.[194]Decousus H, Leizorovicz A, Parent F, et al; Prévention du Risque d'Embolie Pulmonaire par Interruption Cave Study Group. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. N Engl J Med. 1998 Feb 12;338(7):409-15.
https://www.nejm.org/doi/10.1056/NEJM199802123380701
http://www.ncbi.nlm.nih.gov/pubmed/9459643?tool=bestpractice.com
La anticoagulación debe iniciarse si se resuelve la contraindicación o si un análisis de los riesgos/beneficios sugiere que esta es una medida razonable.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Cuando se utilizan filtros recuperables, éstos se deberán eliminar en cuanto sea seguro utilizar anticoagulantes.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Estratificación del pronóstico de pacientes con EP confirmada sin shock, ni hipotensión: Pulmonary Embolism Severity Index
Los pacientes con EP confirmada que no presentan shock ni hipotensión precisan una estratificación del riesgo más desarrollada con, por ejemplo, el Índice de Gravedad de Embolia Pulmonar (PESI) o el Índice de Gravedad de Embolia Pulmonar simplificado (sPESI).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
La escala PESI clasifica a los pacientes con EP confirmada sin choque ni hipotensión en 1 de 5 categorías de riesgo asociadas con un aumento de la mortalidad a 30 días. La categoría de riesgo en el PESI se deriva de la suma de los puntos asignados a 11 criterios clínicos; sPESI solo tiene 6 criterios y reporta la estratificación del riesgo de forma dicotómica (riesgo bajo [0 puntos] o riesgo alto [≥1 punto(s)] de mortalidad a 30 días).
Los estudios indican que PESI y sPESI predicen la mortalidad a corto plazo con precisión comparable, pero esta última es más fácil de usar.[195]Vinson DR, Ballard DW, Mark DG, et al; MAPLE Investigators of the KP CREST Network. Risk stratifying emergency department patients with acute pulmonary embolism: does the simplified Pulmonary Embolism Severity Index perform as well as the original? Thromb Res. 2016 Dec;148:1-8.
http://www.ncbi.nlm.nih.gov/pubmed/27764729?tool=bestpractice.com
[196]Zhou XY, Ben SQ, Chen HL, et al. The prognostic value of pulmonary embolism severity index in acute pulmonary embolism: a meta-analysis. Respir Res. 2012 Dec 4;13:111.
https://respiratory-research.biomedcentral.com/articles/10.1186/1465-9921-13-111
http://www.ncbi.nlm.nih.gov/pubmed/23210843?tool=bestpractice.com
Un metanálisis que evaluó la utilidad pronóstica de PESI/sPESI para la mortalidad por cualquier causa informó una sensibilidad agrupada y una especificidad agrupada del 91% y el 41%, respectivamente.[196]Zhou XY, Ben SQ, Chen HL, et al. The prognostic value of pulmonary embolism severity index in acute pulmonary embolism: a meta-analysis. Respir Res. 2012 Dec 4;13:111.
https://respiratory-research.biomedcentral.com/articles/10.1186/1465-9921-13-111
http://www.ncbi.nlm.nih.gov/pubmed/23210843?tool=bestpractice.com
El índice PESI se ha utilizado para identificar a aquellos pacientes elegibles para la atención ambulatoria en estudios prospectivos.[197]Roy PM, Moumneh T, Penaloza A, et al. Outpatient management of pulmonary embolism. Thromb Res. 2017 Jul;155:92-100.
https://www.doi.org/10.1016/j.thromres.2017.05.001
http://www.ncbi.nlm.nih.gov/pubmed/28525830?tool=bestpractice.com
[198]Bledsoe JR, Woller SC, Stevens SM, et al. Management of Low-Risk Pulmonary Embolism Patients Without Hospitalization: The Low-Risk Pulmonary Embolism Prospective Management Study. Chest. 2018 Aug;154(2):249-256.
https://www.doi.org/10.1016/j.chest.2018.01.035
http://www.ncbi.nlm.nih.gov/pubmed/29410163?tool=bestpractice.com
Basándose en los antecedentes sociales y el cumplimiento probable del tratamiento, la guía de práctica clínica de la European Society of Cardiology sugiere que se puede considerar a los pacientes de bajo riesgo (PESI clase I o clase II), y potencialmente los que tienen un resultado de sPESI de 0, para un alta temprana y para un manejo de forma ambulatoria.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Criterios y estratificación del riesgo del índice PESICreado por BMJ Knowledge Centre [Citation ends].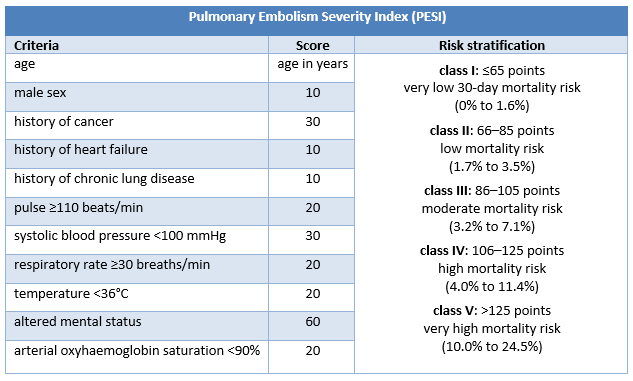 [Figure caption and citation for the preceding image starts]: Criterios y estratificación del riesgo del índice sPESICreado por BMJ Knowledge Centre [Citation ends].
[Figure caption and citation for the preceding image starts]: Criterios y estratificación del riesgo del índice sPESICreado por BMJ Knowledge Centre [Citation ends].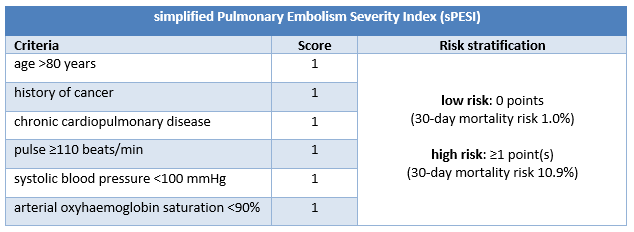
Trombólisis de rescate
La función ventricular derecha evaluada mediante ecocardiografía y la prueba de troponina cardíaca se debe considerar en pacientes con una estratificación del riesgo PESI ≥III o sPESI ≥1.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
En pacientes con EP confirmada sin shock, ni hipotensión: la disfunción ventricular derecha es un factor predictivo de un resultado adverso y permite una mayor estratificación del riesgo; el aumento de niveles de troponina se asocian con un mayor riesgo de mortalidad a corto plazo, una mortalidad relacionada con la EP y eventos adversos graves.[130]Vanni S, Polidori G, Vergara R, et al. Prognostic value of ECG among patients with acute pulmonary embolism and normal blood pressure. Am J Med. 2009 Mar;122(3):257-64.
http://www.ncbi.nlm.nih.gov/pubmed/19272487?tool=bestpractice.com
[131]Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation. 2011 Apr 26;123(16):1788-830.
http://circ.ahajournals.org/content/123/16/1788.long
http://www.ncbi.nlm.nih.gov/pubmed/21422387?tool=bestpractice.com
[132]Weekes AJ, Thacker G, Troha D, et al. Diagnostic accuracy of right ventricular dysfunction markers in normotensive emergency department patients with acute pulmonary embolism. Ann Emerg Med. 2016 Sep;68(3):277-91.
http://www.ncbi.nlm.nih.gov/pubmed/26973178?tool=bestpractice.com
[199]Bajaj A, Saleeb M, Rathor P, et al. Prognostic value of troponins in acute nonmassive pulmonary embolism: A meta-analysis. Heart Lung. 2015 Jul-Aug;44(4):327-34.
https://www.doi.org/10.1016/j.hrtlng.2015.03.007
http://www.ncbi.nlm.nih.gov/pubmed/25976228?tool=bestpractice.com
[200]Becattini C, Vedovati MC, Agnelli G. Prognostic value of troponins in acute pulmonary embolism: a meta-analysis. Circulation. 2007 Jul 24;116(4):427-33.
https://www.doi.org/10.1161/CIRCULATIONAHA.106.680421
http://www.ncbi.nlm.nih.gov/pubmed/17606843?tool=bestpractice.com
Pacientes de alto riesgo intermedio
Los pacientes con estratificación de riesgo PESI ≥III, o índice sPESI ≥1, con disfunción ventricular derecha y una prueba de troponina cardíaca positiva pertenecen a un grupo de riesgo intermedio alto.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Se puede indicar trombólisis de rescate en pacientes de riesgo intermedio a alto y en pacientes con otras características clínicas de insuficiencia cardiopulmonar (p. ej., frecuencia cardíaca, frecuencia respiratoria o presión venosa yugular elevadas) que han iniciado un tratamiento anticoagulante, y en:[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[179]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.
http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com
Se están deteriorando (según la disminución de la PA sistólica, el aumento de la frecuencia cardíaca, el empeoramiento del intercambio de gases, los signos de perfusión inadecuada, el empeoramiento de la función del VD o el aumento de los biomarcadores cardíacos), pero aún no han desarrollado hipotensión[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Presentan signos de descompensación hemodinámica (p. ej., PA sistólica <90 mmHg durante al menos 15 minutos, o caída de la PA sistólica de al menos 40 mmHg durante al menos 15 minutos con signos de hipoperfusión de órganos diana).
Considerar el riesgo de sangrado servirá para tomar una decisión informada acerca del tratamiento trombolítico.
Pacientes de bajo riesgo intermedio
Los pacientes normotensos con estratificación de riesgo PESI ≥III, o sPESI ≥1, con ecocardiograma y/o prueba de troponina cardíaca normales se consideran de bajo riesgo intermedio.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Se debe monitorizar a los pacientes con riesgo intermedio a alto si la prueba de troponina cardíaca es positiva (incluso en ausencia de disfunción ventricular derecha); el tratamiento anticoagulante se debe mantener en todos los pacientes con riesgo intermedio a bajo.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Otros índices pronósticos
Los criterios RIETE (Registro Informatizado de la Enfermedad Tromboembólica venosa) y HESTIA pueden ser útiles para seleccionar a los pacientes (con TEV que presentan un riesgo de resultado clínico adverso bajo) y que podrían ser tratados como pacientes ambulatorios.[201]Trujillo-Santos J, Lozano F, Lorente MA, et al. A prognostic score to identify low-risk outpatients with acute deep vein thrombosis in the lower limbs. Am J Med. 2015 Jan;128(1):90.e9-15.
https://www.doi.org/10.1016/j.amjmed.2014.08.023
http://www.ncbi.nlm.nih.gov/pubmed/25242230?tool=bestpractice.com
[202]Zondag W, Vingerhoets LM, Durian MF, et al. Hestia criteria can safely select patients with pulmonary embolism for outpatient treatment irrespective of right ventricular function. J Thromb Haemost. 2013 Apr;11(4):686-92.
https://www.doi.org/10.1111/jth.12146
http://www.ncbi.nlm.nih.gov/pubmed/23336721?tool=bestpractice.com
[203]Weeda ER, Kohn CG, Peacock WF, et al. External Validation of the Hestia Criteria for Identifying Acute Pulmonary Embolism Patients at Low Risk of Early Mortality. Clin Appl Thromb Hemost. 2017 Oct;23(7):769-774.
https://www.doi.org/10.1177/1076029616651147
http://www.ncbi.nlm.nih.gov/pubmed/27225840?tool=bestpractice.com
Tratamiento anticoagulante en fase de tratamiento
Las guías de práctica clínica de la ACCP recomiendan que los pacientes que no presentan una contraindicación reciban una fase de tratamiento de 3 meses de anticoagulación. Se recomienda el uso de apixabán, dabigatrán, edoxabán o rivaroxabán en lugar de un AVK.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Una vez completada la fase de tratamiento, todos los pacientes deben ser evaluados para una terapia de fase extendida.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Tratamiento anticoagulante de fase prolongada
El objetivo de la continuación del tratamiento anticoagulante en la fase ampliada (es decir, más allá de los 3 primeros meses y sin fecha de interrupción programada) es la prevención secundaria de la TEV.
Las guías de práctica clínica de la ACCP recomiendan que los siguientes pacientes reciban anticoagulación en fase ampliada:[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Aquellos con PE diagnosticada en ausencia de provocación transitoria (PE no provocada o PE provocada por un factor de riesgo persistente). Estos pacientes deben recibir un DOAC
Las personas con PE diagnosticada en ausencia de factor de riesgo transitorio (PE no provocada o PE provocada por un factor de riesgo persistente) que no pueden recibir un DOAC. Estos pacientes deben recibir un AVK.
No se recomienda la anticoagulación en fase prolongada en pacientes con EP diagnosticada en el contexto de un factor de riesgo mayor o menor transitorio.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
La decisión de iniciar o continuar el tratamiento prolongado debe basarse en la preferencia del paciente y en el riesgo previsto de TEV o sangrado recurrente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
La predicción precisa del riesgo de TEV recurrente después de un evento inicial es un reto. La presencia o ausencia de factores provocadores temporales es el predictor más potente de la recurrencia. Los pacientes con una provocación transitoria importante (p. ej., una intervención quirúrgica) en los 3 meses anteriores al evento de TEV presentan el menor riesgo de recurrencia. Los factores de riesgo transitorios menores (p. ej., el ingreso hospitalario médico, el uso de estrógenos, los viajes largos) en los dos meses siguientes al diagnóstico predicen un riesgo intermedio de recurrencia. Los pacientes sin un factor de riesgo identificable para la TEV (es decir, la TEV no provocada) o una provocación persistente (p. ej., el cáncer) presentan un alto riesgo de recurrencia.[20]Kearon C, Ageno W, Cannegieter SC, et al. Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH. J Thromb Haemost. 2016 Jul;14(7):1480-3.
https://www.doi.org/10.1111/jth.13336
http://www.ncbi.nlm.nih.gov/pubmed/27428935?tool=bestpractice.com
Se cree que los pacientes con una EP recurrente no provocada y una TVP proximal presentan un riesgo especialmente alto de sufrir una nueva recurrencia.[173]Ortel TL, Neumann I, Ageno W, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv. 2020 Oct 13;4(19):4693-738.
https://www.doi.org/10.1182/bloodadvances.2020001830
http://www.ncbi.nlm.nih.gov/pubmed/33007077?tool=bestpractice.com
Al evaluar el riesgo de sangrado, deben tenerse en cuenta los siguientes factores: edad >65 años (especialmente >75 años), sangrado previo, cáncer, insuficiencia renal, insuficiencia hepática, trombocitopenia, accidente cerebrovascular previo, diabetes mellitus, anemia, terapia antiplaquetaria, mal control de los anticoagulantes, comorbilidad con capacidad funcional reducida, cirugía reciente, caídas frecuentes, abuso de alcohol, uso de antiinflamatorios no esteroideos.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Los pacientes sin ninguno de estos factores de riesgo se consideran de bajo riesgo; un factor de riesgo otorga un riesgo moderado al paciente; y dos o más factores de riesgo otorgan un riesgo alto al paciente.
Varios modelos de predicción del riesgo han intentado identificar a los pacientes con provocación no causada y/o transitoria menor que presentan un bajo riesgo de TEV recurrente. De ellos, se ha evaluado el modelo HER-DOO2 en una serie de estudios prospectivos de validación clínica y se ha utilizado para identificar una subpoblación de pacientes con un bajo riesgo de recurrencia tras la interrupción de la terapia anticoagulante (tras la finalización de la fase de tratamiento).[204]Rodger MA, Le Gal G, Anderson DR, et al. Validating the HERDOO2 rule to guide treatment duration for women with unprovoked venous thrombosis: multinational prospective cohort management study. BMJ. 2017 Mar 17;356:j1065.
https://www.doi.org/10.1136/bmj.j1065
http://www.ncbi.nlm.nih.gov/pubmed/28314711?tool=bestpractice.com
Elección del fármaco
En los pacientes que reciben un tratamiento anticoagulante de fase prolongada, no suele ser necesario cambiar el anticoagulante oral inicial. Las guías de práctica clínica de la ACCP recomiendan utilizar dosis reducidas de apixabán o rivaroxabán para los pacientes que reciben apixabán o rivaroxabán; la elección de un fármaco y una dosis concretos debe tener en cuenta el índice de masa corporal del paciente, la función renal y el cumplimiento previsto a la pauta de dosificación.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Las dosis más bajas, tanto de apixabán, como de rivaroxabán son igualmente eficaces para el tratamiento anticoagulante de fase prolongada, y se asocian a una modesta reducción de los sangrados no graves, en comparación con las dosis de tratamiento.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[205]Agnelli G, Buller HR, Cohen A, et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med. 2013 Feb 21;368(8):699-708.
https://www.doi.org/10.1056/NEJMoa1207541
http://www.ncbi.nlm.nih.gov/pubmed/23216615?tool=bestpractice.com
[206]Weitz JI, Lensing AW, Prins MH, et al; EINSTEIN CHOICE Investigators. Rivaroxaban or aspirin for extended treatment of venous thromboembolism. N Engl J Med. 2017 Mar 30;376(13):1211-22.
https://www.nejm.org/doi/10.1056/NEJMoa1700518
http://www.ncbi.nlm.nih.gov/pubmed/28316279?tool=bestpractice.com
La evidencia de estudios de duración ≥ 6 meses sugiere que no hay diferencias entre los anticoagulantes orales directos y la anticoagulación convencional para el manejo de la EP.[207]Li M, Li J, Wang X, et al. Oral direct thrombin inhibitors or oral factor Xa inhibitors versus conventional anticoagulants for the treatment of pulmonary embolism. Cochrane Database Syst Rev. 2023 Apr 14;4(4):CD010957.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010957.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/37057837?tool=bestpractice.com
[208]Becattini C, Agnelli G. Risk stratification and management of acute pulmonary embolism. Hematology Am Soc Hematol Educ Program. 2016 Dec 2;2016(1):404-12.
http://asheducationbook.hematologylibrary.org/content/2016/1/404.long
http://www.ncbi.nlm.nih.gov/pubmed/27913508?tool=bestpractice.com
[  ]
How do oral direct thrombin inhibitors (DTIs) and oral factor Xa inhibitors compare with conventional anticoagulation for the treatment of pulmonary embolism?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4357/fullMostrarme la respuesta[Evidencia B]120fe7b2-87cd-4301-a316-38128bb67120ccaBCómo se comparan los inhibidores directos de la trombina orales y los inhibidores del factor Xa orales con la anticoagulación convencional para el tratamiento de la embolia pulmonar?
]
How do oral direct thrombin inhibitors (DTIs) and oral factor Xa inhibitors compare with conventional anticoagulation for the treatment of pulmonary embolism?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4357/fullMostrarme la respuesta[Evidencia B]120fe7b2-87cd-4301-a316-38128bb67120ccaBCómo se comparan los inhibidores directos de la trombina orales y los inhibidores del factor Xa orales con la anticoagulación convencional para el tratamiento de la embolia pulmonar?
El uso continuado de la anticoagulación en fase prolongada debe reevaluarse al menos anualmente y en cualquier momento en que se produzca un cambio significativo en el estado clínico del paciente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
La evidencia para continuar la terapia extendida más allá de los 4 años es incierta. Las guías de práctica clínica de la ACCP recomiendan la toma de decisiones compartida, teniendo en cuenta los valores y preferencias del paciente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Se debe evaluar a los pacientes periódicamente en cuanto al riesgo de sangrado, la carga del tratamiento y cualquier cambio de valores y preferencias.
Si la decisión es suspender la anticoagulación en fase prolongada, las guías de práctica clínica de la ACCP recomiendan administrar ácido acetilsalicílico (a menos que esté contraindicada) para prevenir la TEV recurrente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Los beneficios del uso del ácido acetilsalicílico deben sopesarse con el riesgo de sangrado y los inconvenientes de su uso. El ácido acetilsalicílico no debe considerarse una alternativa razonable para los pacientes que están dispuestos a someterse a un tratamiento anticoagulante prolongado, ya que el ácido acetilsalicílico es mucho menos eficaz. El uso del ácido acetilsalicílico siempre debe reevaluarse cuando un paciente abandona la terapia anticoagulante (porque el tratamiento con ácido acetilsalicílico podría haberse suspendido al inicio de la terapia anticoagulante).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Cáncer activo
Para los pacientes con cáncer activo, las guías de práctica clínica de la ACCP recomiendan apixabán, edoxabán o rivaroxabán en lugar de HBPM para la anticoagulación en fase prolongada.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Los DOAC (especialmente edoxabán y rivaxobarán) se asocian a un mayor riesgo de sangrado gastrointestinal que las HBPM. En pacientes con cáncer gastrointestinal luminal, la ACCP recomienda apixaban o HBPM como fármacos de elección.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[  ]
How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2813/fullMostrarme la respuesta La ASH recomienda el uso de DOAC o HBPM para la fase extendida; la ASH reconoce que esta recomendación es condicional y está basada en evidencia de muy baja certeza.[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
]
How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2813/fullMostrarme la respuesta La ASH recomienda el uso de DOAC o HBPM para la fase extendida; la ASH reconoce que esta recomendación es condicional y está basada en evidencia de muy baja certeza.[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
En estos pacientes se recomienda el tratamiento anticoagulante en fase prolongada (es decir, sin fecha prevista de interrupción) mientras el cáncer siga activo.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
Embarazo
El tratamiento anticoagulante debe administrarse durante al menos 6 semanas postnatales en mujeres con alto riesgo de TEV postnatal y durante una duración mínima del tratamiento global de 3 meses desde el diagnóstico inicial de EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[168]Royal College of Obstetricians and Gynaecologists. Reducing the risk of venous thromboembolism during pregnancy and the puerperium. Green-top guideline No. 37a. Apr 2015 [internet publication].
https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf
La HBPM se utiliza durante el preparto, ya que otros anticoagulantes, incluidos los AVK, pueden atravesar la placenta con el consiguiente riesgo de efectos adversos para el feto.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
La continuación de la HBPM o los AVK son una opción para las madres lactantes. Los DOAC no se recomiendan a las madres lactantes porque se excretan en la leche materna y no se ha establecido su seguridad para el bebé lactante.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Insuficiencia renal grave
El ACCP recomienda un AVK para los pacientes que tengan insuficiencia renal grave (esto es, un aclaramiento de creatinina <30 mL/minuto).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
El apixaban también es adecuado para su uso en pacientes con disfunción renal grave o enfermedad renal terminal, aunque la evidencia para su uso en esta población de pacientes es limitada.[164]Pathak R, Pandit A, Karmacharya P, et al. Meta-analysis on risk of bleeding with apixaban in patients with renal impairment. Am J Cardiol. 2015 Feb 1;115(3):323-7.
https://www.doi.org/10.1016/j.amjcard.2014.10.042
http://www.ncbi.nlm.nih.gov/pubmed/25527282?tool=bestpractice.com
Insuficiencia hepática y coagulopatía
Las guías de práctica clínica del ACCP recomiendan HBPM en esta población de pacientes.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Los profesionales de salud deben consultar la etiqueta y/o los vademécum locales antes de prescribir un anticoagulante oral directo (DOAC) a un paciente con insuficiencia hepática.
Síndrome antifosfolípido
En los pacientes con síndrome antifosfolípido, las guías de práctica clínica de la ACCP y de la International Society on Thrombosis and Haemostasis recomiendan un AVK como fármaco de elección.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[209]Zuily S, Cohen H, Isenberg D, et al. Use of direct oral anticoagulants in patients with thrombotic antiphospholipid syndrome: guidance from the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost. 2020 Sep;18(9):2126-37.
https://www.doi.org/10.1111/jth.14935
http://www.ncbi.nlm.nih.gov/pubmed/32881337?tool=bestpractice.com
Los datos de los ensayos controlados aleatorizados indican que los DOAC pueden no ser tan eficaces como los AVK para el tratamiento de la trombosis entre los pacientes con síndrome antifosfolípido. Por lo tanto, las guías de práctica clínica de la ACCP recomiendan evitar los DOAC en estos pacientes.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Pacientes con TEV recurrente en tratamiento anticoagulante
La TEV recurrente es inusual entre los pacientes que reciben tratamiento anticoagulante a dosis terapéuticas, con la excepción del cáncer (7% a 9% de recurrencia en terapia con HBPM).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[210]Posch F, Königsbrügge O, Zielinski C, et al. Treatment of venous thromboembolism in patients with cancer: a network meta-analysis comparing efficacy and safety of anticoagulants. Thromb Res. 2015 Sep;136(3):582-9.
https://www.doi.org/10.1016/j.thromres.2015.07.011
http://www.ncbi.nlm.nih.gov/pubmed/26210891?tool=bestpractice.com
Además de establecer definitivamente la presencia de EP recurrente, se deberá considerar el cumplimiento del tratamiento anticoagulante o la presencia de neoplasia maligna subyacente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Las guías de práctica clínica del ACCP recomiendan un cambio temporal a HBPM (durante al menos 1 mes) para los pacientes con EP recurrente que se piense que cumplen con un anticoagulante no HBPM (o dentro del rango terapéutico si reciben tratamiento AVK).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Aumentar la dosis de HBPM (de un cuarto a un tercio) es adecuado para pacientes con una EP recurrente que hayan estado recibiendo HBPM.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
La TEV recurrente tras la interrupción del tratamiento anticoagulante
Para los pacientes que ya no reciben tratamiento anticoagulante y sufren una segunda embolia pulmonar sin factor de riesgo identificable (es decir, no provocada), las guías de práctica clínica recomiendan las siguientes duraciones de tratamiento anticoagulante:[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Riesgo de sangrado bajo o moderado: tratamiento anticoagulante prolongado con reevaluaciones de riesgos periódicas para revisar la ratio riesgo-beneficio
Alto riesgo de sangrado: suspender la anticoagulación después de 3 meses.
 ]
La American Society of Hematology (ASH) recomienda rivaroxabán, apixabán o HBPM para la anticoagulación en la fase inicial en pacientes con cáncer activo; la ASH reconoce que esta recomendación es condicional y se basa en evidencias de muy baja certeza.[165]
]
La American Society of Hematology (ASH) recomienda rivaroxabán, apixabán o HBPM para la anticoagulación en la fase inicial en pacientes con cáncer activo; la ASH reconoce que esta recomendación es condicional y se basa en evidencias de muy baja certeza.[165] [Figure caption and citation for the preceding image starts]: Criterios y estratificación del riesgo del índice sPESICreado por BMJ Knowledge Centre [Citation ends].
[Figure caption and citation for the preceding image starts]: Criterios y estratificación del riesgo del índice sPESICreado por BMJ Knowledge Centre [Citation ends].
 ]
[Evidencia B]
]
[Evidencia B] ]
La ASH recomienda el uso de DOAC o HBPM para la fase extendida; la ASH reconoce que esta recomendación es condicional y está basada en evidencia de muy baja certeza.[165]
]
La ASH recomienda el uso de DOAC o HBPM para la fase extendida; la ASH reconoce que esta recomendación es condicional y está basada en evidencia de muy baja certeza.[165]