Abordagem
Durante os períodos de grande prevalência de COVID-19, para os pacientes com suspeita ou confirmação de pneumonia por COVID-19 com sintomas e sinais que tiverem começado em qualquer momento após a internação hospitalar, consulte Doença do coronavírus 2019 (COVID-19).
Considere que todos os pacientes com tosse, febre ou outros sintomas sugestivos têm COVID-19 até prova em contrário. A pneumonia devida à COVID-19 não é abordada neste tópico.
Para pacientes com sintomas e sinais consistentes com pneumonia bacteriana (não secundária à COVID-19), que começam nos dias 1 ou 2 após a internação hospitalar, consulte Pneumonia adquirida na comunidade (não COVID-19).
O diagnóstico de pneumonia hospitalar exige uma combinação de imagens anormais e 2 das 3 características clínicas a seguir: febre >38 °C (100.4 °F), leucocitose ou leucopenia ou secreções purulentas.[1] Os outros sintomas podem incluir tosse, dor torácica ou mal-estar.Os sinais ao exame físico podem incluir expansão assimétrica do tórax, menor ressonância, ausculta anormal dos pulmões (egofonia, pectorilóquia áfona, estertores ou roncos) ou taquicardia.Os pacientes imunocomprometidos podem não apresentar sinais clínicos típicos.Os critérios diagnósticos propostos para pneumonia em hospedeiro imunocomprometido incluem suspeita clínica de infecção pulmonar, com ou sem sinais e sintomas clínicos compatíveis, e com evidências radiográficas de um infiltrado pulmonar novo ou piorado.[54]
As informações obtidas pelas imagens, uma toracocentese, oxigenação e coloração de Gram devem ser melhoradas.
É importante que a suspeita de pneumonia hospitalar/pneumonia associada à ventilação mecânica (PAVM) seja alta, pois a mortalidade é menor quando o tratamento correto é iniciado mais cedo. Os critérios clínicos somente, sem o auxílio da proteína C-reativa ou do Clinical Pulmonary Infection Score, devem ser usados para se determinar se deve ser iniciada terapêutica antimicrobiana para pneumonia hospitalar ou PAVM.[1]
Anamnese e exame físico
A história deve estabelecer se o paciente corre risco de pneumonia causada por patógenos resistentes a múltiplos medicamentos (por exemplo, Pseudomonas aeruginosa, Klebsiella pneumoniae e MRSA). É importante estabelecer esse fato, pois afeta as opções de antibióticos empíricos. Os fatores de risco para pneumonia causada por patógenos resistentes a múltiplos medicamentos são:
Terapêutica antimicrobiana nos últimos 90 dias
Choque séptico durante a PAVM
Síndrome do desconforto respiratório agudo antes da PAVM
Hospitalização atual há 5 dias ou mais
Terapia renal substitutiva aguda antes do início da PAVM.
Imagem do tórax e toracocentese diagnóstica
Uma imagem do tórax mostrando opacidade, focal ou difusa, é necessária para o diagnóstico. Geralmente, as radiografias torácicas são realizadas para todos os pacientes, independente de estarem internados na enfermaria ou na unidade de terapia intensiva (UTI). A imagem de preferência é a postero-anterior com uma visão lateral. Uma tomografia computadorizada (TC) pode ser necessária, particularmente se a radiografia for de má qualidade, ou na presença de uma opacidade mal definida. Uma ultrassonografia pode ser considerada.[55] O American College of Physicians recomenda a realização da ultrassonografia no local de atendimento se houver incerteza diagnóstica em pacientes com dispneia aguda.[56]
Se for observado líquido pleural na radiografia torácica em quantidade considerada maior que a mínima, uma toracocentese diagnóstica deve ser realizada. Os exames do líquido pleural que indicam que o espaço pleural precisa ser drenado são: pH <7.20, nível de glicose <2.2 mmol/L (<40 mg/dL) e LDH >1000 U/L.
[Figure caption and citation for the preceding image starts]: Radiografia torácica portátil de paciente com pneumonia hospitalar. Observe a cúpula diafragmática esquerda obscurecida por causa de opacidade no lobo inferior esquerdo e uma borda cardíaca obscurecida devido a opacidade no lobo superior esquerdo ou na língula pulmonarConsentimento obtido na University of Louisville, Louisville, KY [Citation ends].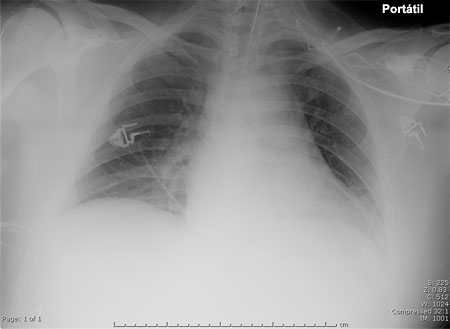 [Figure caption and citation for the preceding image starts]: Tomografia computadorizada mostrando opacidades bibasilares de paciente com pneumonia hospitalarConsentimento obtido na University of Louisville, Louisville, KY [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada mostrando opacidades bibasilares de paciente com pneumonia hospitalarConsentimento obtido na University of Louisville, Louisville, KY [Citation ends]. [Figure caption and citation for the preceding image starts]: Tomografia computadorizada de paciente com um infiltrado grande e denso no lobo inferior esquerdoConsentimento obtido na University of Louisville, Louisville, KY [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada de paciente com um infiltrado grande e denso no lobo inferior esquerdoConsentimento obtido na University of Louisville, Louisville, KY [Citation ends]. [Figure caption and citation for the preceding image starts]: TC de paciente com um infiltrado no lobo inferior esquerdo (seta azul), derrames pleurais bilaterais (pontas de seta amarelas) e atelectasia basilar direita; note a linha separando as duas sombras de cinza, representando o infiltrado e o fluidoConsentimento obtido na University of Louisville, Louisville, KY [Citation ends].
[Figure caption and citation for the preceding image starts]: TC de paciente com um infiltrado no lobo inferior esquerdo (seta azul), derrames pleurais bilaterais (pontas de seta amarelas) e atelectasia basilar direita; note a linha separando as duas sombras de cinza, representando o infiltrado e o fluidoConsentimento obtido na University of Louisville, Louisville, KY [Citation ends].
Nível de oxigenação
O método preferível para determinar o status de oxigenação é a gasometria arterial. Medir a saturação de oxigênio em um local periférico pode dar uma falsa ideia de oxigenação adequada, particularmente no contexto dos sinais e sintomas de pneumonia hospitalar, quando a vascularização pode estar perifericamente restrita. A obtenção da gasometria arterial antes da elevação da FiO₂ reflete o status de oxigenação de forma mais precisa; obviamente, porém, o aumento do volume de oxigênio não deve ser retirado se o paciente estiver instável.
coloração de Gram
Uma coloração de Gram pode ser realizada a partir de um aspirado traqueal, amostra de lavagem broncoalveolar (LBA), escovado brônquico protegido ou escarro expectorado.[1][57] Se for necessário usar antimicrobianos antes de uma broncoscopia planejada (o que pode impedir o crescimento de patógenos na cultura), deve-se coletar uma amostra endotraqueal por sucção (LBA não broncoscópico) ou um escarro expectorado para cultura. Algumas evidências sugerem que o tratamento baseado em um aspirado endotraqueal tem desfechos equivalentes àqueles baseados em uma amostra de LBA.[58]
Exames de sangue
Nenhum diagnóstico infeccioso deve ser feito com base apenas na contagem de leucócitos, mas uma contagem de leucócitos elevada acompanhada de granulocitose e proporção de bastonetes elevadas pode estar associada com pneumonia hospitalar em um contexto de opacidade na radiografia torácica e outros sinais e sintomas. A leucopenia pode indicar doença mais grave ou até mesmo sepse.
O papel da proteína C-reativa é minimizado nas diretrizes de 2016 da Infectious Diseases Society of America e da American Thoracic Society (IDSA/ATS) para pneumonia hospitalar/PAVM, que recomendam que a proteína C-reativa auxilie o exame clínico como parte da decisão de iniciar a terapêutica antimicrobiana.[1]
Tomada de decisão sobre antibióticos guiada por biomarcadores
A Food and Drug Administration dos EUA aprovou a procalcitonina como um teste para orientar a antibioticoterapia nos pacientes com infecções agudas do trato respiratório. Estudos constataram que a procalcitonina pode ajudar na tomada das decisões sobre antibióticos nos pacientes com pneumonia hospitalar.[59] As diretrizes IDSA/ATS 2016 para pneumonia hospitalar/PAVM afirmam especificamente que a procalcitonina não auxilia na tomada de decisão para iniciar a terapêutica antimicrobiana, mas ela deve ser usada ao decidir descontinuá-la (reduzi-la) em pacientes cujo diagnóstico inicial não parece ser válido aproximadamente 3 dias após obtenção de novas informações clínicas.[1]
Evidências de um ensaio clínico randomizado e controlado dão suporte ao uso de concentrações de interleucina-1 beta e interleucina-8 no líquido da lavagem broncoalveolar para melhorar a administração de antibióticos em pacientes com suspeita de PAVM.[60]
Swab nasal para MRSA
O swab nasal está sendo cada vez mais usado para rastrear MRSA em ambientes hospitalares. No contexto de pneumonia hospitalar/PAVM, o rastreamento por swab nasal de MRSA pode ser usado para orientar o desescalonamento da terapia anti-MRSA empírica. Em uma metanálise de 22 estudos, incluindo 5163 participantes, a especificidade do swab nasal de MRSA para PAVM de MRSA foi de 94%; o valor preditivo negativo foi de 95%.[61] No entanto, as diretrizes da IDSA não incluem uma recomendação sobre o uso de swabs nasais para o rastreamento de MRSA em pacientes com pneumonia hospitalar/PAVM.[1]
O uso deste conteúdo está sujeito ao nosso aviso legal