Etiologia
Alterações genéticas são a base da maioria dos cânceres de tireoide.
Nos cânceres de tireoide diferenciados (papilar, folicular), as mutações em BRAF (homólogo B de fibrossarcoma rapidamente acelerado) e RAS (vírus do sarcoma de rato) ou rearranjos RET/PTC (REarranjado durante a Transfecção/câncer papilar da tireoide) são as alterações genéticas mais comuns.[26]
Os carcinomas papilares da tireoide são geralmente caracterizados por mutações em BRAF (por exemplo, substituição BRAF V600E) e por rearranjos RET/PTC que ativam a sinalização efetora por meio de uma proteína quinase ativada por mitógenos (MAPK).[27][28]
Os carcinomas foliculares da tireoide estão associados a mutações RAS ou têm uma translocação cromossômica que funde o gene 8 box-pareado com o gene gama PPAR (receptor ativado por proliferadores de peroxissoma), o oncogene de fusão PAX8::PPARG.[27]
O carcinoma anaplásico da tireoide (CAT) tem um cenário molecular heterogêneo, incluindo mutações em TP53 (proteína tumoral P53), TERT (transcriptase reversa da telomerase), BRAF e RAS.[28] Outras mutações no CAT incluem: alterações genéticas na via da fosfatidilinositol 3-quinase (PI3K), como mutações em PTEN (fosfatase homóloga à tensina) e PI3KCA; genes envolvidos na regulação epigenética, como o complexo de remodelação da cromatina SWI/SNF (SWItch/sacarose não fermentável) e metiltransferases de histonas; genes envolvidos na regulação do ciclo celular (CDKN2A, CDKN2B e CCNE1); e genes de regulação imunológica tumoral (PDL1, PDL2 e JAK2).[27][13][28]
O câncer medular de tireoide (CMT) é esporádico ou hereditário (associado à síndrome da neoplasia endócrina múltipla [NEM] ou como forma familiar isolada).[4] Quase todos os casos de CMT hereditário, e aproximadamente 50% dos casos de CMT esporádico, estão associados às mutações no proto-oncogene RET (REarranjado durante a Transfecção), que é codificado para um receptor da tirosina quinase expresso nos tecidos derivados da crista neural.[4][29] O CMT esporádico pode estar associado a mutações de RAS em até 23% dos casos.[28]
O linfoma de tireoide primário está vinculado à estimulação crônica de antígenos, como observado na tireoidite linfocítica crônica (doença de Hashimoto), e é postulado como resultado do desenvolvimento de tecido linfoide intratireoidiano.[6] O subtipo de linfoma mais comum é o linfoma difuso de grandes células B (mais de 50% dos casos), seguido por linfoma de tecido linfoide associado à mucosa (entre 10% e 23%).[5] Consulte Linfoma não Hodgkin e Linfoma MALT.
Fisiopatologia
Os cânceres de tireoide derivam das células epiteliais foliculares da tireoide ou das células parafoliculares C (câncer medular de tireoide).[14]
As células foliculares são heterogêneas, com folículos tireoidianos apresentando capacidade de crescimento variável e sensibilidade ao hormônio estimulante da tireoide; se ocorrerem mutações somáticas, os tireócitos ganham diferentes potenciais de crescimento.[30] Os cânceres de tireoide de origem folicular podem ser diferenciados (papilar, folicular, oncocítico), pouco diferenciados ou indiferenciados (anaplásicos).[7][8] As células oncocíticas (antes conhecidas como células de Hürthle) são células foliculares da tireoide com aspecto oncocítico, caracterizadas por núcleos hipercromáticos com nucléolos proeminentes e citoplasma eosinofílico granular.[31]
As mutações que fornecem uma vantagem de crescimento seletivo, promovendo assim o desenvolvimento do câncer, são identificadas em mais de 90% dos cânceres de tireoide.[28] A maioria dos cânceres de tireoide abriga mutações ao longo das vias da proteína quinase ativada por mitógenos (MAPK) e fosfatidilinositol-3 quinase/proteína quinase B (PI3K/Akt).[14][28] Mutações de ativação comuns na via MAPK incluem os rearranjos RET/PTC e NTRK (receptor de tirosina quinase neurotrófico) e mutações em RAS e BRAF.[28]
O comportamento fisiológico depende do tipo de tumor
Acredita-se que o câncer de tireoide reflita uma continuidade do tipo bem diferenciado para anaplásico, caracterizado por eventos genéticos precoces e tardios.[32]
O carcinoma da tireoide pouco diferenciado (CTPD) é uma neoplasia folicular que apresenta evidências limitadas de diferenciação das células foliculares. Ele se situa morfológica e comportamentalmente entre carcinomas diferenciados (papilar, folicular, oncocítico) e carcinomas de tireoide anaplásicos. Os cânceres de tireoide diferenciados ou CTPDs que perdem sua capacidade de captar e concentrar radioiodo (e, em alguns casos, de produzir tireoglobulina) durante a evolução do tumor são comumente chamados de cânceres de tireoide desdiferenciados.[33] Até dois terços dos pacientes com câncer de tireoide diferenciado apresentam desdiferenciação tumoral.[34]
O carcinoma papilar tende a se disseminar para os linfonodos locais, enquanto o carcinoma folicular e oncocítico costuma se disseminar de modo hematogênico. O carcinoma de tireoide anaplásico é agressivo, com alta propensão para invasão local e disseminação metastática. A disseminação nodal é comum com linfomas tireoidianos primários.[Figure caption and citation for the preceding image starts]: Radiografia do crânio mostrando metástases extensivas de carcinoma folicular da tireoideWani AM, Hussain WM, Fatani MI, et al. Skull metastases from thyroid carcinoma. BMJ Case Reports. 2009; doi:10.1136/bcr.02.2009.1578 [Citation ends].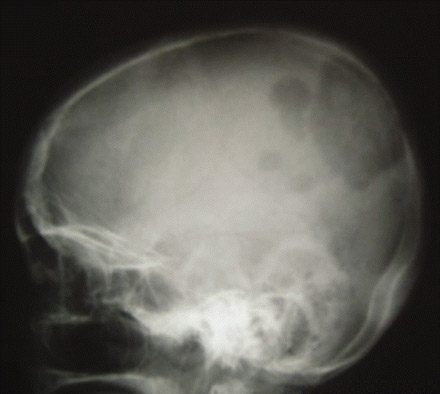
O carcinoma medular de tireoide (CMT) é esporádico (75%) ou hereditário (25%).[28] A CMT hereditária pode ocorrer como componente de neoplasia endócrina múltipla (NEM) tipo 2A (NEM2A) ou NEM2B, ou pode ocorrer de forma familiar isolada.[4] Quase todos os pacientes com NEM2A, NEM2B ou CMT familiar isolado têm mutação das linhas germinativas no proto-oncogene RET (que codifica um receptor de tirosina quinase expresso em tecidos derivados da crista neural), e aproximadamente 50% dos CMTs esporádicos têm mutações de RET somáiticas.[4] As mutações em RAS estão presentes em até 23% dos casos esporádicos de CMT.[28] Em pacientes com CMT esporádico, a presença de mutações em RET está associada a um desfecho mais desfavorável (estadiamento tumoral mais elevado, categoria T mais alta e presença de linfonodos e metástases à distância); aqueles com mutações em RAS apresentaram um fenótipo menos agressivo e um melhor prognóstico.[35]
Classificação
Tipos de câncer de tireoide
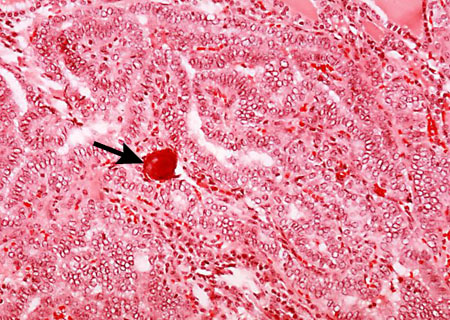
Papilar: o tipo mais comum e responsável por 80% dos casos de câncer de tireoide.[1] Geralmente, é bem diferenciado com uma tendência a multicentricidade e envolvimento de linfonodos.[Figure caption and citation for the preceding image starts]: Histopatologia de carcinoma papilar, tireoide: um corpo de psammoma visível (seta)CDC Image Library/Dr Edwin P. Ewing, Jr [Citation ends].
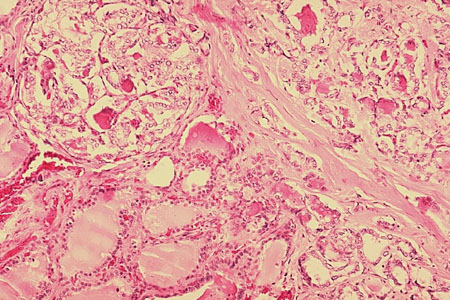
Folicular: responsável por aproximadamente 10% dos casos de câncer de tireoide.[1] Carcinomas foliculares de tireoide são tumores foliculares malignos com invasão capsular e/ou vascular. Eles se disseminam por invasão hematogênica direta, não pelos linfonodos. Formas iniciais são indolentes, enquanto formas extremamente invasivas são agressivas.[Figure caption and citation for the preceding image starts]: Histopatologia de carcinoma folicular, tireoideCDC Image Library/Dr Edwin P. Ewing, Jr [Citation ends].
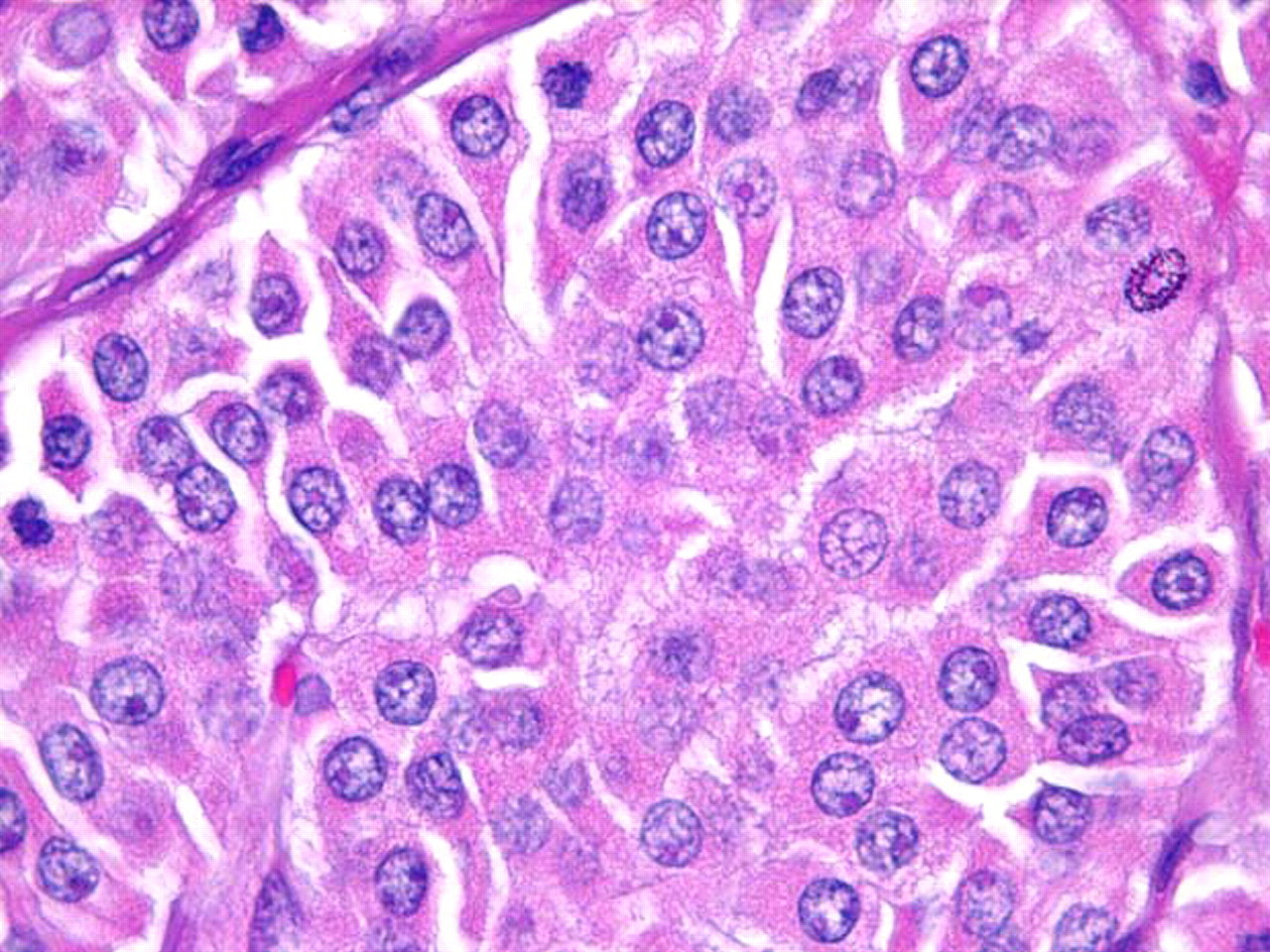
Oncocítico (antes conhecido como célula de Hürthle): representa 3% a 4% dos cânceres de tireoide.[2] As células oncocíticas têm aspecto citológico clássico de grandes células com abundante citoplasma eosinofílico, granular e grandes núcleos hipercromáticos com nucléolos proeminentes. Os carcinomas de tireoide oncocíticos são tumores malignos com invasão capsular e/ou vascular, metástases linfonodais ou metástases à distância e são considerados mais agressivos do que os carcinomas foliculares não oncocíticos da tireoide.[2]
[Figure caption and citation for the preceding image starts]: Células oncocíticas (antes conhecidas como células de Hürthle) com abundante citoplasma granular e eosinofílico, e nucléolos “rosa cerejaSandoval MAS et al. Case Reports 2011;2011:bcr1120103536; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Carcinoma oncocítico (antes conhecido como carcinoma de células de Hürthle): presença de células tumorais dentro de uma veia, indicativas de invasão vascularSandoval MAS et al. Case Reports 2011;2011:bcr1120103536; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Carcinoma oncocítico (antes conhecido como carcinoma de células de Hürthle): presença de células tumorais dentro de uma veia, indicativas de invasão vascularSandoval MAS et al. Case Reports 2011;2011:bcr1120103536; usado com permissão [Citation ends].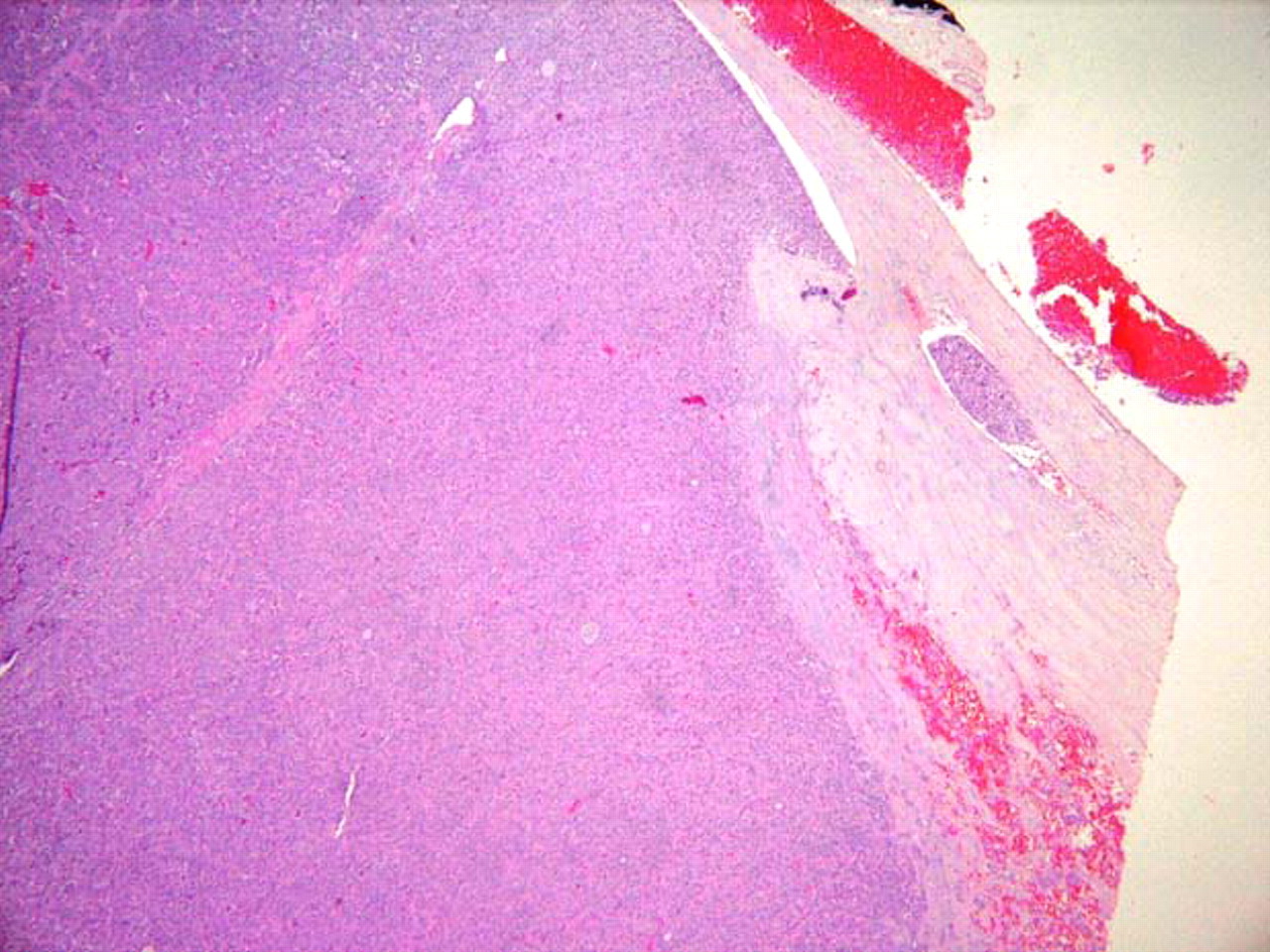
Anaplásico: uma neoplasia não diferenciada com invasão vascular. Costuma se manifestar com invasão local no nervo laríngeo recorrente e na traqueia, no músculo e/ou no esôfago.[3]
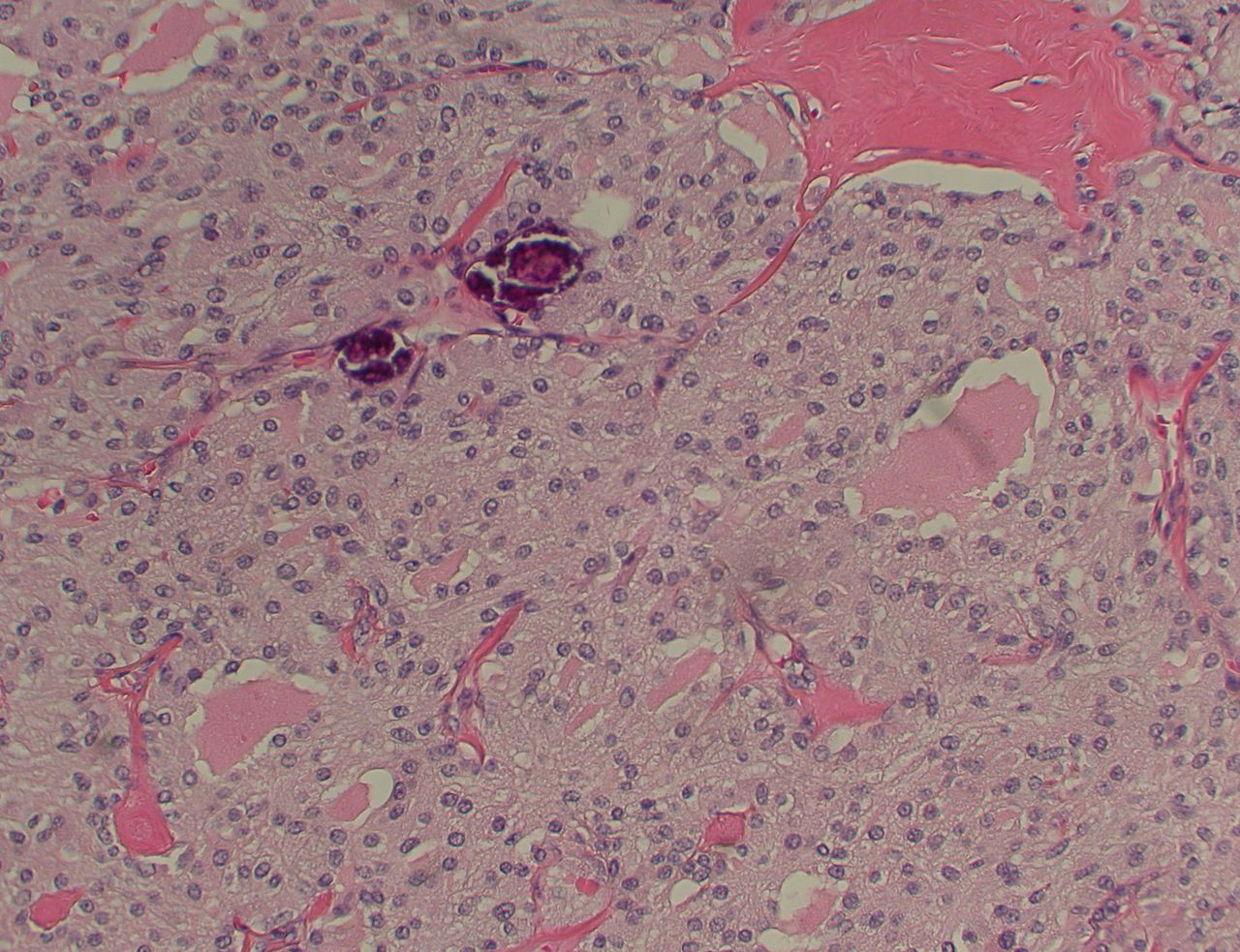
Medular: origina-se nas células C parafoliculares da tireoide, sendo responsável por aproximadamente 1% a 3% dos casos de câncer de tireoide.[4] Ocorre esporadicamente, ou pode ser hereditário. Uma minoria dos casos (cerca de um quarto) é hereditária: por exemplo, parte da síndrome de neoplasia endócrina múltipla (NEM). Existe uma tendência para multicentricidade e disseminação precoce para o linfonodo.[Figure caption and citation for the preceding image starts]: Câncer medular de tireoide: coloração de H&E mostrando ninhos de células tumoraisMohan V et al. BMJ Case Reports CP 2019;12:e230446; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Câncer medular de tireoide: coloração de calcitoninaMohan V et al. BMJ Case Reports CP 2019;12:e230446; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Câncer medular de tireoide: coloração de calcitoninaMohan V et al. BMJ Case Reports CP 2019;12:e230446; usado com permissão [Citation ends].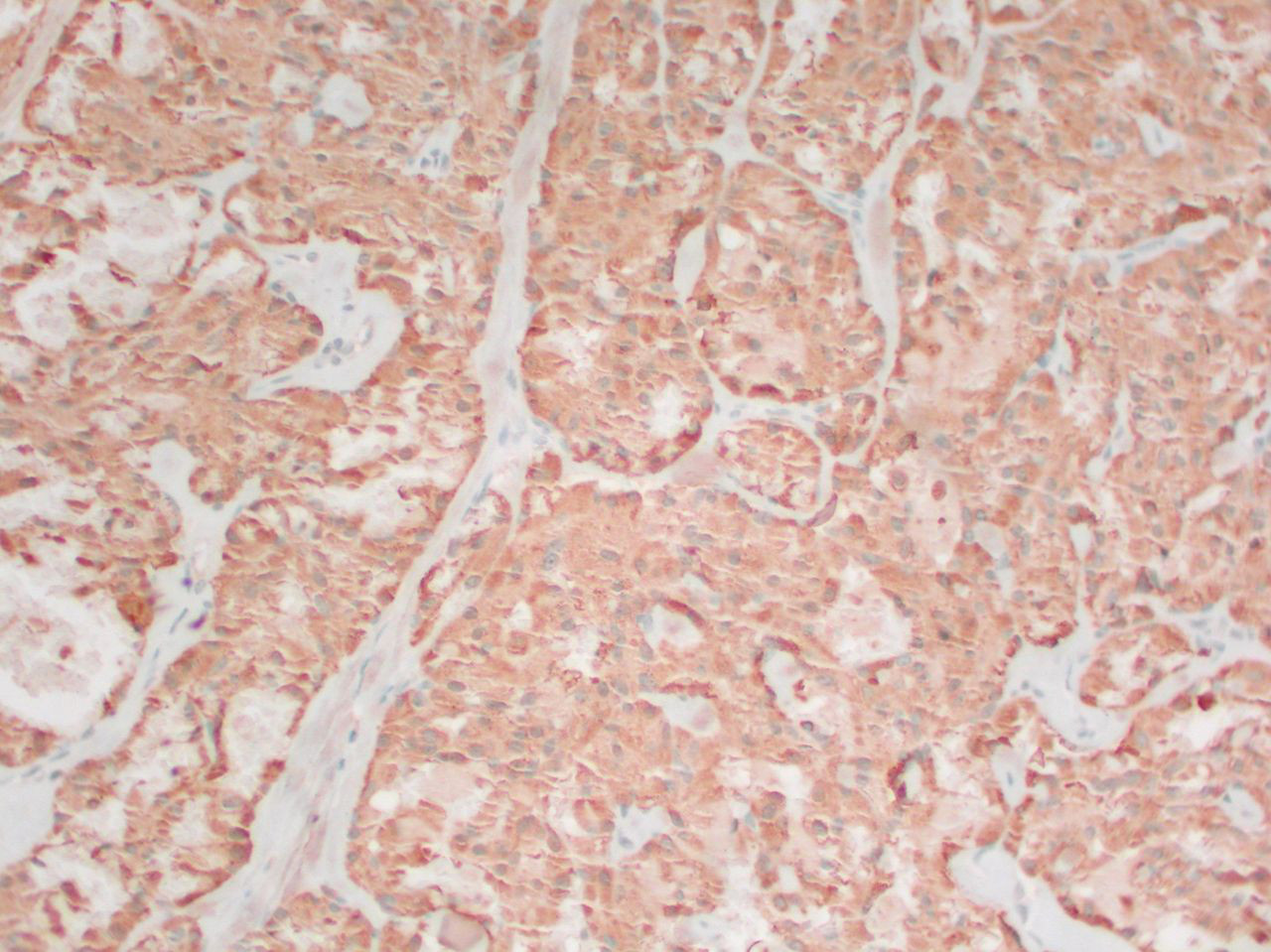
Linfoma: geralmente um linfoma não Hodgkin de célula B.[5] Costuma aparecer no quadro de tireoidite de Hashimoto preexistente.[6] Consulte Linfoma não Hodgkin e Linfoma MALT.
Classificação de 2022 da Organização Mundial da Saúde (OMS): tumores da tireoide[7]
Neoplasias foliculares derivadas de células
Tumores benignos
Doença nodular folicular
Adenoma folicular
Adenoma folicular com arquitetura papilar
Adenoma oncocítico
Neoplasias de baixo risco
Neoplasia folicular não invasiva com características nucleares semelhantes às papilares
Tumores de potencial maligno incerto
Tumor folicular de potencial maligno incerto
Tumor bem diferenciado de potencial maligno incerto
Tumor trabecular hialinizante
Neoplasias malignas
Carcinoma folicular
Carcinoma papilar encapsulado de variante folicular invasivo
Carcinoma papilar
Carcinoma oncocítico
Carcinomas derivados de células foliculares, alto grau
Carcinoma pouco diferenciado
Carcinoma diferenciado de alto grau
Carcinoma anaplásico derivado de células foliculares
Carcinoma de tireoide derivado de célula C
Carcinoma medular da tireoide
Sistema Bethesda para o relato de citopatologia da tireoide de 2023[8]
Um sistema de relatório padronizado com seis categorias diagnósticas para amostras de aspiração com agulha fina (AAF) da tireoide. Cada categoria apresenta um risco implícito de câncer que recomenda a próxima etapa do manejo clínico.
Categorias diagnósticas com base na citologia por AAF:
Não diagnóstico
Cisto preenchido com fluido
Amostra virtualmente acelular
Outro (sangue obscurecido, artefato de coagulação, artefato de secagem, etc.)
Benigno
Consistente com doença nodular folicular (inclui nódulo adenomatoide, nódulo coloide, etc.)
Consistente com tireoidite linfocítica crônica (Hashimoto) no contexto clínico adequado
Consistente com tireoidite granulomatosa (subaguda)
Outra
Atipia de significado indeterminado (ASI)
Especificar se há atipia de significado indeterminado/atipia nuclear ou atipia de significado indeterminado/outra
Neoplasia folicular
Especificar se é do tipo oncocítico (antiga célula de Hürthle)
Suspeita de neoplasia maligna
Suspeita de carcinoma papilar da tireoide
Suspeita de carcinoma medular da tireoide
Suspeita de carcinoma metastático
Suspeita de linfoma
Outra
Neoplásica
Carcinoma papilar da tireoide
Carcinoma derivado de células foliculares de alto grau
Carcinoma medular da tireoide
Carcinoma (anaplásico) não diferenciado
Carcinoma de células escamosas
Carcinoma com características mistas (especificar)
Neoplasia metastática
Linfoma não Hodgkin
Outra
Estadiamento TNM do câncer de tireoide[9][10]
A classificação de estadiamento TNM do American Joint Committee on Cancer (AJCC) e da Union for International Cancer Control (UICC) para carcinoma de tireoide diferenciado, anaplásico e medular baseia-se nos fatores anatômicos a seguir:
Tamanho e extensão do tumor primário (T)
Envolvimento do linfonodo regional (N)
Presença ou ausência de metástases à distância (M)
O estadiamento do carcinoma de tireoide diferenciado é ainda categorizado por idade inferior a 55 anos e superior a 55 anos.
Thyroid Imaging, Reporting, and Data System do American College of Radiology (ACR TI-RADS)[11]
Um sistema de estratificação de risco para nódulos tireoidianos com base em características da ultrassonografia (composição, ecogenicidade, formato, margem, focos ecogênicos, tamanho do nódulo) para orientar as decisões relativas à aspiração com agulha fina (AAF) ou acompanhamento.
Composição (selecione 1)
Cístico ou quase completamente cístico: 0 pontos
Espongiforme: 0 pontos
Misto cístico e sólido: 1 ponto
Sólido ou quase completamente sólido: 2 pontos
Ecogenicidade (selecione 1)
Anecoico: 0 pontos
Hiperecoico ou isoecoico: 1 ponto
Hipoecoico: 2
Muito hipoecoico: 3 pontos
Formato (selecione 1)
Mais largo que alto: 0 pontos
Mais alto que largo: 3 pontos
Margem (selecione 1):
Lisa: 0 pontos
Mal definida: 0 pontos
Lobulada ou irregular: 2 pontos
Extensão extra-tireoidiana: 3 pontos
Focos ecogênicos (selecione todos os que se aplicam)
Nenhum ou artefatos em "cauda de cometa" grandes: 0 pontos
Microcalcificações: 1 ponto
Calcificações periféricas (borda): 2 pontos
Focos ecogênicos ponteados: 3 pontos
O número total de pontos de todas as características da ultrassonografia (categorias) determina a estratificação de risco TI-RADS (TR1 a TR5)
TR1 (benigno): 0 pontos
TR2 (não suspeito): 2 pontos
TR3 (levemente suspeito): 3 pontos
TR4 (moderadamente suspeito): 4 a 6 pontos
TR5 (altamente suspeito): 7 pontos ou mais
As recomendações para AAF ou acompanhamento são baseadas na estratificação de risco TI-RADS e no tamanho do nódulo
TR1: sem AAF
TR2: sem AAF
TR3: AAF se o nódulo for ≥2.5 cm, ou acompanhamento se for ≥1.5 cm
TR4: AAF se o nódulo for ≥1.5 cm, ou acompanhamento se for ≥1 cm
TR5: AAF se o nódulo for ≥1 cm, ou acompanhamento se for ≥0.5 cm. A AAF dos nódulos TR5 de 0.5 a 0.9 cm pode ser adequada para os microcarcinomas papilares em determinadas circunstâncias
O uso deste conteúdo está sujeito ao nosso aviso legal