Abordaje
La mayoría de los casos de aspergilosis invasiva sucede en pacientes con inmunodeficiencia subyacente. Se debe prestar especial atención al estado inmunitario del paciente. Los pacientes con alto riesgo de aspergilosis invasiva son aquellos con neutropenia grave y prolongada (>10 días), al igual que los receptores de trasplantes alogénicos de células madre con enfermedad de injerto contra huésped (EICH) crónica o aguda.
También se debe considerar la aspergilosis invasiva en:
Receptores de trasplante de órgano sólido (en particular, los receptores de pulmón y/o corazón).
Pacientes con enfermedad granulomatosa crónica (EGC).
Pacientes que reciben corticosteroides en dosis altas u otros fármacos inmunosupresores.
Pacientes con diabetes mellitus mal controlada.
Pacientes con trastornos de inmunodeficiencia primaria.
La falta de características clínicas específicas impide el diagnóstico. El diagnóstico temprano es de suma importancia para reducir la mortalidad y la morbilidad. En el paciente de alto riesgo con signos clínicos y síntomas de sospecha de aspergilosis invasiva, resultan de ayuda en el diagnóstico una exploración por tomografía computarizada (TC) de alta resolución/resonancia magnética (IRM), los biomarcadores séricos (p. ej., el galactomanano de Aspergillus, el beta-D-glucano sérico), la exploración de esputo, la exploración del líquido del lavado broncoalveolar (LBA) y la biopsia de tejido para histopatología y el cultivo de microorganismos.
Las pruebas moleculares como la reacción en cadena de la polimerasa (PCR) del líquido del LBA y/o la muestra de tejido son útiles en el diagnóstico temprano de la aspergilosis invasiva.[66]
[  ]
]
La aspergilosis pulmonar crónica (CPA) debe considerarse en pacientes con enfermedad pulmonar crónica y las radiografías que muestran lesiones en la masa intracavitaria. Estos suelen ser hallazgos incidentales en una radiografía de tórax (RT) de rutina o durante la evaluación de hemoptisis. Las guías de práctica clínica sugieren que el diagnóstico de CPA requiere estudios por imágenes, evidencia directa de infección por Aspergillus o una respuesta inmunológica a Aspergillus y la exclusión de otros diagnósticos, con enfermedad presente durante al menos 3 meses.[2][3] Ver Criterios diagnósticos.
Manifestaciones clínicas
La aspergilosis pulmonar invasiva se presenta con fiebre, tos no productiva leve a moderada y dolor torácico pleurítico. El dolor torácico pleurítico en un paciente neutropénico o en un receptor de células madre con enfermedad injerto contra huésped (EICH) debe despertar una fuerte sospecha de aspergilosis invasiva. La hemoptisis puede estar presente y sugerir la presencia de una lesión pulmonar que erosiona dentro de un vaso sanguíneo vecino. Puede producirse hemoptisis catastrófica, sobre todo con la recuperación de los neutrófilos después de la quimioterapia. Puede estar presente la disnea, lo que sugiere una amplia afectación del pulmón, y puede observarse con rechazo del pulmón trasplantado.
La sinusitis invasiva puede presentarse con cefalea, congestión, dolor facial con o sin drenaje sinusal, o sensibilidad sinusal. Puede ocurrir afectación concomitante del seno y los pulmones.
La extensión de la sinusitis hacia el ojo o cerebro puede conducir a proptosis, parálisis del par craneal, alteración del estado mental y convulsiones.
La afectación cutánea no es infrecuente en la aspergilosis invasiva. Los nódulos distintos, eritematosos, ligeramente sensibles al tacto, únicos o múltiples, de diferentes tamaños con un centro necrótico y con frecuencia ulcerado (ectima gangrenoso) se observan sobre todo en pacientes inmunocomprometidos. Pueden ocurrir en la enfermedad diseminada o tras invasión local a un traumatismo. En ocasiones, las quemaduras o heridas quirúrgicas pueden infectarse con Aspergillus.
Los síntomas de la CPA incluyen tos crónica, dificultad para respirar, molestias en el pecho, pérdida de peso y malestar general.[4] El aspergiloma simple es mayormente asintomático. Se puede presentar como una hemoptisis leve de resolución espontánea. No obstante, puede darse una hemoptisis grave.
Estudios por imágenes
Aspergilosis invasiva pulmonar:
La radiografía de tórax (RT) puede revelar nódulos, consolidación o, con frecuencia, infiltrados inespecíficos. A menudo, la RT no muestra alteraciones. Si el índice de sospecha es alto, se debe obtener una exploración por tomografía computarizada (TC) de tórax.
El método radiológico preferido es la exploración por TC de alta resolución del pecho, debido a que es útil en la detección de lesiones tempranas sugestivas de aspergilosis pulmonar. La exploración puede mostrar nódulos únicos o múltiples dispersos en uno o ambos pulmones, generalmente en la periferia de los campos pulmonares. Los nódulos más pequeños (<1 cm), las opacidades en vidrio esmerilado y la consolidación son características no específicas y no necesariamente sugieren aspergilosis invasiva pulmonar.[67] La presencia de macronódulos (de 1 cm o más grandes) en un paciente de alto riesgo es sumamente sugestiva de aspergilosis invasiva. Puede observarse en otras afecciones que incluyen otras infecciones fúngicas invasivas, tuberculosis, nocardiosis e infecciones bacterianas.[67] En el paciente leucémico con neutropenia, la enfermedad en fase inicial se caracteriza por una nebulosidad que representa la hemorragia o el edema que rodea a los nódulos ("signo de halo").[68] El signo de halo puede que desaparezca con la mejoría clínica (p. ej., la reversión de la inmunodeficiencia subyacente). En su lugar, puede observarse el "signo de creciente aéreo" . Es indicativo de una lesión necrótica contraída a partir del tejido pulmonar viable, que crea una cavidad dentro donde el aire queda atrapado. El signo de halo es indicativo de la enfermedad en fase inicial y por lo tanto es útil en el diagnóstico temprano, mientras que el signo de creciente aéreo indica que la enfermedad ha estado presente por >6 a 7 días. La terapia que se inició en pacientes con signo de halo se asocia a un mejor desenlace.[69] Durante la terapia, las lesiones nodulares inicialmente se agrandan, lo que sugiere que el proceso podría estar empeorando. No obstante, después de aproximadamente 7 días de terapia, las exploraciones por TC muestran mejoría. Los macronódulos pulmonares, el signo de halo y el signo de creciente aéreo se estudiaron en pacientes con aspergilosis invasiva y neoplasia maligna hematológica o trasplante de células madre. Las características radiológicas no están tan bien caracterizados en otros contextos con aspergilosis invasiva.[Figure caption and citation for the preceding image starts]: Signo de "halo" en la aspergilosis pulmonar tempranaDe la colección del Dr. P. Chandrasekar; utilizada con autorización [Citation ends].
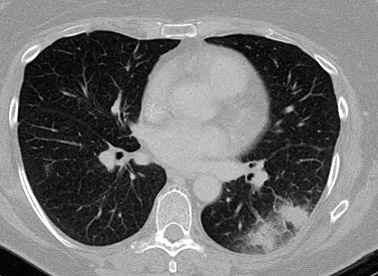 [Figure caption and citation for the preceding image starts]: Signo de "creciente aéreo" en la aspergilosis pulmonar tardíaDe la colección del Dr. P. Chandrasekar; utilizada con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Signo de "creciente aéreo" en la aspergilosis pulmonar tardíaDe la colección del Dr. P. Chandrasekar; utilizada con autorización [Citation ends].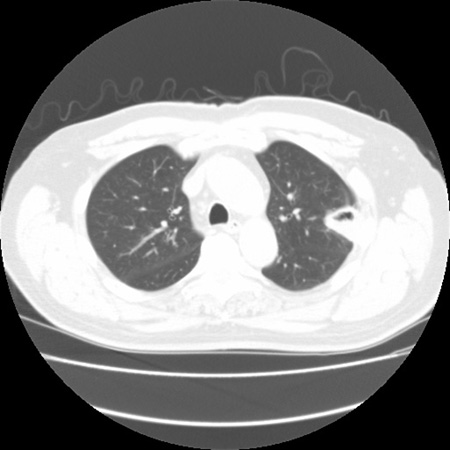
La aspergilosis invasiva en otras áreas (p. ej., la piel, el cerebro, los senos)
La aspergilosis invasiva que se presume en otras localizaciones, tales como los senos y el cerebro, también puede evaluarse con la exploración por TC o IRM. Las radiografías de los senos no son de ayuda. La TC es la modalidad de imagenología preferida.[68][67] La presencia de sinusitis, además de la opacidad/masa dentro de la cavidad sinusal, la erosión ósea de las paredes del seno circundantes es altamente sugerente de una infección agresiva. En caso de enfermedad cerebral, pueden observarse lesiones que ocupan espacio con edema circundante, abscesos y hemorragia.
CPA
La radiografía de tórax puede revelar una o más cavidades pulmonares con o sin aspergiloma, infiltrados, nódulos, engrosamiento pleural, daño parenquimatoso y fibrosis.[3][4][70] La radiografía es el método de diagnóstico por imágenes inicial, pero la tomografía computarizada puede proporcionar una mejor definición y ubicación de los hallazgos.[3]
Aspergiloma
Las lesiones únicas del lóbulo superior son los hallazgos más comunes en las RT. Rara vez, se observan lesiones múltiples. Una masa intracavitaria móvil en el lóbulo superior con un creciente aéreo en la periferia (signo de Monod) sugiere fuertemente aspergiloma. Por lo general, las radiografías simples son adecuadas. De vez en cuando, se requiere la TC de tórax. En las radiografías, un cambio en la posición de la bola fúngica podría observarse con un cambio en la posición del paciente.[71] La realización periódica de RT es adecuada para el seguimiento del aspergiloma asintomático.
Serología/lavado broncoalveolar (LBA)
Aspergilosis invasiva
El diagnóstico de la aspergilosis invasiva sigue suponiendo un desafío debido a la presentación clínica inespecífica de la misma, la baja sensibilidad de la microscopía y el cultivo de muestras de vías respiratorias inferiores, junto con la dificultad para obtener tejido para la histopatología en pacientes en estado crítico. Como resultado, se evaluaron recientemente biomarcadores, tales como el antígeno galactomanano (GM) de Aspergillus y el beta-D-glucano sérico, mayormente en receptores de células madre y pacientes leucémicos con neutropenia.[72][73][74]
Antígeno galactomanano (GM)
El antígeno GM es un componente de la pared celular de los polisacáridos de las especies de Aspergillus que se libera dentro de la circulación sistémica durante el crecimiento fúngico en el tejido.
Existe un método de ensayo de inmunoabsorción enzimática (ELISA) de doble sándwich para la detección de GM (un índice de densidad óptica de 0.5 o superior en 2 ocasiones es positivo).[75][76]
La combinación de un paciente de alto riesgo con hallazgos clínicos y radiológicos (exploración por tomografía computarizada [TC]) sugerentes y un GM sérico positivo podría considerarse adecuada para establecer el diagnóstico de aspergilosis invasiva "probable"; evitándose así procedimientos invasivos, tales como la biopsia de tejido (pulmonar).[77][78]
La sensibilidad y especificidad del GM sérico en serie es de 67% a 100% en pacientes con leucemia aguda y 86% a 98% en receptores de células madre, respectivamente.[76][77]
La monitorización en serie de GM detectó la aspergilosis invasiva entre 6 y 14 días antes que los hallazgos radiológicos.[79]
Se observan resultados falsos positivos con otros hongos como pueden ser las especies Histoplasma, Blastomyces, Geotrichum y Penicillium, y bacterias (p. ej., Bifidobacterium).[72][80] El uso de antibióticos betalactámicos, tales como la piperacilina/tazobactam y la amoxicilina/ácido clavulánico, pueden arrojar resultados falsos positivos.[81] En presencia de fármacos con actividad frente a mohos que se utilizan como profilaxis o tratamiento, se reduce la sensibilidad del ensayo GM. La sensibilidad puede ser más baja en pacientes no neutropénicos, posiblemente debido a una menor carga fúngica.
El uso combinado del ensayo con antígeno GM sérico y la TC de tórax mejora la detección de aspergilosis invasiva pulmonar, lo que permite un comienzo de la terapia en una fase más temprana.[78] Los datos sugieren que las mediciones de antígenos GM en el líquido del LBA son más sensibles que las del GM sérico y presentan un mejor valor predictivo, y la prueba de antígenos GM del LBA se ha convertido ahora en un método aceptado para el diagnóstico.[82][83] La medición del antígeno GM del líquido del LBA de un índice de densidad óptica de 1.5 o superior parece ser un fuerte predictor de aspergilosis invasiva en pacientes inmunocomprometidos (especificidad >90%).[84]
Beta-D-glucano sérico (1-3)
El beta-D-glucano (1-3) es un componente de la pared celular de muchos hongos (con excepción de Zigomicetos y Cryptococcus) al mismo tiempo que un método de diagnóstico serológico para hongos invasivos.[73][74]
Esta prueba es una variación del ensayo de limulus que se utilizó para detectar endotoxinas. La presencia de glucano sérico no es específica para el Aspergillus y pueden darse resultados falsos positivos debido a tubos de extracción de sangre, gasas y filtros de membrana contaminados.
Una revisión de la Cochrane encontró una amplia variación en la sensibilidad y especificidad de las pruebas disponibles comercialmente para el (1-3)-beta-D-glucano sérico en la detección de infecciones fúngicas invasivas seleccionadas, incluida la aspergilosis. La sensibilidad varió del 27% al 100% y la especificidad varió del 0% al 100%; por lo tanto, no se pudo determinar la exactitud del diagnóstico.[85] [
 ]
]
Reacción en cadena de la polimerasa (PCR)
El diagnóstico de la reacción en cadena de la polimerasa, basado en la amplificación de los genes fúngicos específicos de Aspergillus (normalmente el ADN ribosómico) en la sangre y el líquido del LBA, ha demostrado ser muy prometedor para el diagnóstico temprano. En el líquido del LBA, dos resultados positivos de las pruebas PCR presentan un mayor valor predictivo positivo para incluir la aspergilosis invasiva.[66] [
 ]
Las pruebas de PCR en especímenes de histopatología también aumentan el rendimiento del diagnóstico.[66] Los resultados de las pruebas basadas en la PCR pueden ser falsamente positivos debido a la presencia ubicua de Aspergillus conidia. La combinación de la prueba basada en la PCR con otros métodos de diagnóstico no invasivos basados en el cultivo (es decir, la prueba de GM sérico y el ensayo de beta-D-glucano sérico) es un área importante para el diagnóstico temprano de la aspergilosis invasiva.
]
Las pruebas de PCR en especímenes de histopatología también aumentan el rendimiento del diagnóstico.[66] Los resultados de las pruebas basadas en la PCR pueden ser falsamente positivos debido a la presencia ubicua de Aspergillus conidia. La combinación de la prueba basada en la PCR con otros métodos de diagnóstico no invasivos basados en el cultivo (es decir, la prueba de GM sérico y el ensayo de beta-D-glucano sérico) es un área importante para el diagnóstico temprano de la aspergilosis invasiva.
CPA
En pacientes con estudios por imágenes y antecedentes sugestivos de CPA, el diagnóstico puede confirmarse con inmunoglobulina G (IgG) sérica de Aspergillus o precipitinas, o antígeno de Aspergillus o ADN en fluidos respiratorios.[3]
Anticuerpos contra Aspergillus
La prueba de anticuerpos IgG contra Aspergillus es la prueba más sensible para la aspergilosis pulmonar cavitaria crónica (CCPA).[2] Los anticuerpos séricos IgG contra Aspergillus o precipitinas son positivos en la mayoría de los pacientes con CPA.
Se pueden observar casos de falsos negativos en pacientes que reciben tratamiento con corticosteroides o en aquellos con aspergiloma debido a especies distintas de A fumigatus.[86]
Antígeno GM
Cuando se utiliza en el diagnóstico de la CPA, se debe utilizar líquido del LBA (no suero). La especificidad y sensibilidad es menor que la de las pruebas de anticuerpos contra Aspergillus.[3]
reacción en cadena de la polimerasa (PCR)
Microbiología
Aspergilosis invasiva pulmonar:
La tos generalmente es no productiva en estos pacientes. El esputo, cuando está disponible, suele dar resultado negativo en pruebas de tinción para aislamiento y cultivo de hongos. Un hallazgo positivo resulta altamente significativo en un paciente de alto riesgo (inmunocomprometido).[11] No obstante, en un paciente de bajo riesgo (inmunocompetente), el Aspergillus en esputo puede tan solo representar colonización sin necesidad de intervención adicional.[11][88]
Las especies de Aspergillus crecen bien en medios estándar y se pueden identificar a nivel de especie en la mayoría de los laboratorios. El cultivo de un área estéril permite diagnosticar aspergilosis invasiva. Los hemocultivos resultan generalmente negativos, incluso en casos diseminados.
Los procedimientos de diagnóstico invasivos normalmente utilizados son:
Broncoscopia con LBA y/o biopsia
Aspiración con aguja guiada por tomografía computarizada (TC) percutánea transtorácica
Cirugía transtorácica asistida por vídeo.
Las muestras obtenidas podrían, tras cultivo, presentar hifas típicamente angulares, con ramificación dicotómica, y tabicadas y especies de Aspergillus. La confirmación por cultivo es fundamental para distinguir al Aspergillus de otros hongos con características morfológicas similares, tales como el Fusarium y el Scedosporium.[17] Los resultados falsos negativos ocurren con las muestras que se obtienen de áreas no afectadas, después de muestreo inadecuado y en pacientes que ya reciben tratamiento antimicótico. Por lo tanto, la falta de frotis fúngico positivo o el cultivo no descarta el diagnóstico de aspergilosis invasiva. También, la realización de procedimientos invasivos puede no ser posible en pacientes en estado crítico o en aquellos con trombocitopenia.[Figure caption and citation for the preceding image starts]: Tinción con plata metenamina de Gomori (GMS) del tejido pulmonar que muestra hifas septadas con ramificación por dicotomía de Aspergillus.De la colección del Dr. P. Chandrasekar; utilizada con autorización [Citation ends].
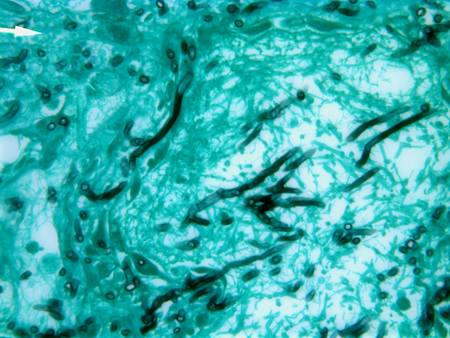
La aspergilosis invasiva en otras áreas (p. ej., la piel, el cerebro, los senos)
Las muestras de tejido adecuadas que se obtuvieron por biopsia deben someterse a prueba de tinción (plata metenamina de Gomori) para aislamiento y cultivo de hongos. La tinción de Gram que se utiliza para detectar bacterias es inadecuada para la detección fúngica. Los abrillantadores ópticos que se utilizan para la tinción blanca son útiles para evidenciar los elementos fúngicos.
CPA
La microscopía directa o el cultivo fúngico de muestras respiratorias pueden identificar la presencia de Aspergillus. Sin embargo, las tasas de positividad del cultivo varían ampliamente y los resultados deben interpretarse con cautela.[3][89] El análisis de múltiples muestras aumenta la probabilidad de un cultivo o una prueba de microscopía positivos, pero la mayoría de los pacientes tienen cultivos de esputo negativos.[2] Además, como los Aspergillus son ubicuos en el medio ambiente, su presencia en el esputo no es necesariamente diagnóstica.[89]
Histopatología
Aspergilosis invasiva
La biopsia de tejido es el método más definitivo de diagnóstico. Se puede obtener la biopsia por medio de:
Aspiración con aguja guiada por TC (tomografía computarizada) transbronquial (para lesiones periféricas)
Biopsia por cirugía toracoscópica asistida por video (CTAV)
Biopsia abierta de pulmón.
LA CTAV es el método preferido debido a que la biopsia se obtiene bajo visión directa y es menos invasiva en comparación con la biopsia abierta de pulmón. La muestra que se obtiene por técnica guiada por TC o transbronquial no es generalmente óptima y puede asociarse con complicaciones, tales como el sangrado no controlado o neumotórax. La trombocitopenia es común en la leucemia y en los receptores de células madre, lo que hace que los procedimientos invasivos sean peligrosos. Con frecuencia, un procedimiento de biopsia no se puede realizar en vista de trombocitopenia refractaria a la transfusión de plaquetas o enfermedad grave, lo que lleva a los médicos a optar por tratamiento empíricos.
Otras localizaciones para biopsia pueden incluir piel, tejido sinusal, cerebro o, excepcionalmente, hueso, corazón, pericardio u órganos abdominales.
Las muestras que se obtienen por biopsia se deben enviar en solución salina para el cultivo microbiológico y en formol para patología. La presencia de hifas ramificadas en ángulo agudo, tabicadas y estrechas con invasión tisular y rodeadas de infiltrados inflamatorios junto con necrosis son hallazgos que sugieren aspergilosis invasiva.[17] Debido a que el Aspergillus es angioinvasivo, el organismo se encuentra con frecuencia dentro de la vasculatura, lo que causa trombosis, infarto tisular y necrosis coagulativa. Otros hongos tales como el Fusarium y el Scedosporium (Pseudoallescheria) pueden tener características similares y requieren confirmación por cultivo del organismo.
CPA
En ciertos casos, el examen microscópico del tejido obtenido por biopsia es necesario para el diagnóstico.
En la CCPA, la biopsia puede mostrar células inflamatorias, fibrosis, granulomas e hifas.[2] Si las hifas invaden el parénquima pulmonar, se diagnostica aspergilosis invasiva aguda o subaguda.[3]
El examen del aspergiloma muestra micelios fúngicos, células inflamatorias, restos de tejidos, fibrina y moco.[4]
Los nódulos de Aspergillus se diagnostican después de una biopsia por escisión, generalmente después de la sospecha de malignidad. Es posible que los nódulos individuales que se extirpan por completo no necesiten ningún tratamiento adicional.[3][4]
[Figure caption and citation for the preceding image starts]: Algoritmo diagnóstico para la sospecha de aspergilosis invasivaCreado por los autores [Citation ends].
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad