Criterios
Definiciones consensuadas de enfermedad fúngica invasiva de la Organización Europea para la Investigación y el Tratamiento del Cáncer y el Consorcio de Educación e Investigación del Grupo de Estudio de Micosis[95]
La Organización Europea para la Investigación y el Tratamiento del Cáncer y el Grupo de Estudio de las Micosis proporcionan definiciones consensuadas para las enfermedades fúngicas invasivas "comprobadas", "probables" y "posibles" (incluida la aspergilosis invasiva). Las categorías "probable" y "posible" se aplican solo a pacientes inmunocomprometidos, mientras que la categoría "comprobada" puede aplicarse a cualquier paciente, independientemente de si está inmunocomprometido.
Criterios para la enfermedad fúngica invasiva comprobada:
Examen histopatológico, citopatológico o microscópico directo de una muestra obtenida por aspiración con aguja o biopsia en el que se observan hifas acompañadas de evidencia de daño tisular
Cultivo de una muestra obtenida mediante un procedimiento estéril de un sitio normalmente estéril y clínica o radiológicamente anormal compatible con un proceso de enfermedad infecciosa, excluyendo el líquido del lavado broncoalveolar (LBA), una muestra de cavidad del seno paranasal o mastoideo y orina
Hemocultivo que produce un moho (p. ej., especies de Fusarium) en el contexto de un proceso de enfermedad infecciosa compatible
Amplificación del ADN fúngico mediante reacción en cadena de la polimerasa (PCR) combinada con secuenciación del ADN cuando se observan mohos en tejido fijado en formol e incluido en parafina
Probable enfermedad invasiva de moho pulmonar:
Requiere la presencia de un factor del huésped, una característica clínica y evidencia micológica (ver más abajo).
Posible enfermedad invasiva de moho pulmonar:
Presencia de un factor del huésped y una característica clínica, pero no se ha encontrado evidencia micológica.
Factores del huésped
Antecedentes recientes de neutropenia (<0.5 × 10⁹ neutrófilos/L [<500 neutrófilos/mm³] durante >10 días) relacionados temporalmente con la aparición de enfermedades fúngicas
Neoplasia maligna hematológica
Receptor de un trasplante alogénico de células madre
Recepción de un trasplante de órgano sólido
Uso prolongado de corticosteroides (excepto en pacientes con aspergilosis broncopulmonar alérgica) a una dosis terapéutica de ≥0.3 mg/kg/día durante ≥3 semanas en los últimos 60 días
Tratamiento con otros inmunosupresores de células T reconocidos, como inhibidores de la calcineurina, bloqueadores del factor de necrosis tumoral alfa, anticuerpos monoclonales específicos de linfocitos, análogos nucleosídicos inmunosupresores durante los últimos 90 días
Tratamiento con inmunosupresores de linfocitos B reconocidos, como los inhibidores de la tirosina cinasa de Bruton, p. ej., ibrutinib
Inmunodeficiencia hereditaria grave (como la enfermedad granulomatosa crónica o la inmunodeficiencia combinada grave)
Enfermedad aguda de injerto contra huésped de grado III o IV que afecta el intestino, los pulmones o el hígado y que es refractario al tratamiento de primera línea con esteroides.
Características clínicas
Aspergilosis pulmonar (presencia de uno de los siguientes cuatro patrones en la TC):
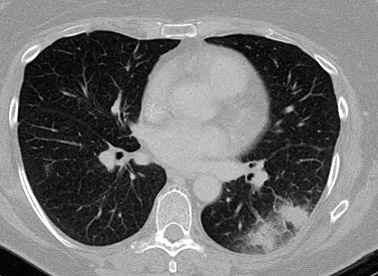
Lesiones bien circunscritas, densas con o sin un signo de halo[Figure caption and citation for the preceding image starts]: Signo de "halo" en la aspergilosis pulmonar tempranaDe la colección del Dr. P. Chandrasekar; utilizada con autorización [Citation ends].
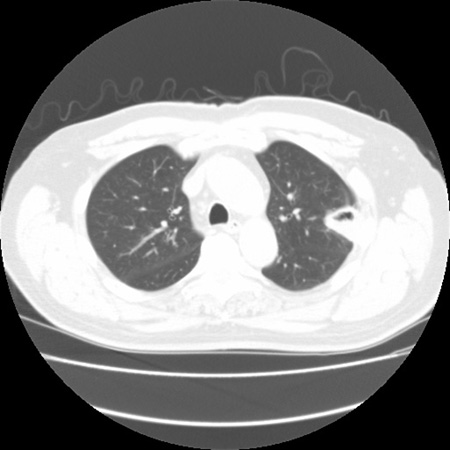
Signo de creciente aéreo[Figure caption and citation for the preceding image starts]: Signo de "creciente aéreo" en la aspergilosis pulmonar tardíaDe la colección del Dr. P. Chandrasekar; utilizada con autorización [Citation ends].
Cavidad
Consolidación en forma de cuña y segmentaria o lobular
Traqueobronquitis:
ulceración traqueobronquial, nódulo, presencia de pseudomembranas, placas o escaras tras análisis broncoscópico
Infección sinonasal:
Dolor agudo localizado (incluye dolor que se irradia al ojo)
Úlcera nasal con escara negra
Extensión desde los senos paranasales a través de las barreras óseas, incluyendo hasta la órbita
Infección del sistema nervioso central (uno de los dos signos siguientes):
Lesiones focales en exámenes de imagen
Mejoría meníngea en imagen por resonancia magnética (IRM) o TC.
Evidencias micológicas
Aspergillus recuperado por cultivo de esputo, líquido del LBA, cepillo bronquial o aspirado
Detección microscópica de elementos fúngicos que indican la presencia de moho en el esputo, el líquido del LBA, el cepillo bronquial o el aspirado
Antígeno galactomanano de Aspergillus detectado en plasma, suero, líquido del LBA o líquido cefalorraquídeo
Dos o más pruebas de PCR consecutivas positivas en plasma, suero o sangre total, o dos o más pruebas de PCR duplicadas en líquido del LBA positivas, o al menos una prueba de PCR positiva en plasma, suero o sangre total y una prueba de PCR positiva en líquido del LBA.
Criterios diagnósticos de la aspergilosis pulmonar crónica de la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas y la Sociedad Respiratoria Europea[3]
Aspergiloma simple
Cavidad pulmonar única que contiene una bola fúngica, con evidencia serológica o microbiológica que implica especies de Aspergillus en un paciente no inmunocomprometido con síntomas leves o sin progresión radiológica durante al menos 3 meses de observación.
Aspergilosis pulmonar cavitaria crónica (CCPA)
Una o más cavidades pulmonares (con una pared delgada o gruesa) que posiblemente contengan uno o más aspergilomas o material intraluminal irregular, con evidencia serológica o microbiológica que implique a especies de Aspergillus con síntomas pulmonares y/o sistémicos significativos y avance radiológico manifiesto (nuevas cavidades, aumento de infiltrados pericavitarios o aumento de fibrosis) durante al menos 3 meses de observación.
Aspergilosis pulmonar fibrosante crónica (CFPA)
Destrucción fibrótica grave de al menos dos lóbulos del pulmón que complica la CCPA y conduce a una pérdida importante de la función pulmonar. La destrucción fibrótica grave de un lóbulo con una cavidad se conoce simplemente como CCPA que afecta a ese lóbulo. Por lo general, la fibrosis se manifiesta como consolidación, pero se pueden observar grandes cavidades con fibrosis circundante.
Nódulo de Aspergillus
Uno o más nódulos que pueden cavitar o no son una forma inusual de CPA. Pueden imitar el tuberculoma, el carcinoma de pulmón, la coccidioidomicosis y otros diagnósticos y solo se pueden diagnosticar definitivamente en función de la histología. No se ha demostrado invasión tisular, aunque es frecuente la necrosis.
Aspergilosis invasiva subaguda
Aspergilosis invasiva, generalmente en pacientes levemente inmunocomprometidos, que se produce durante 1-3 meses, con características radiológicas variables que incluyen cavitación, nódulos, consolidación progresiva con "formación de abscesos". La biopsia muestra hifas en el tejido pulmonar invasor y las pruebas diagnósticas microbiológicas reflejan las de la aspergilosis invasiva, en particular el antígeno galactomanano de Aspergillus positivo en sangre (o fluidos respiratorios).
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad