El manejo de la diabetes de tipo 2 implica una variedad de intervenciones conductuales y farmacológicas para prevenir o retrasar las complicaciones y optimizar la calidad de vida.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
El manejo debe individualizarse teniendo en cuenta las necesidades y circunstancias particulares del paciente, discutiéndose y acordándose con él los objetivos de glucemia. La dieta y el estilo de vida son fundamentales para este manejo. Se debe ofrecer educación estructurada al paciente (y/o a sus familiares o cuidadores) en el momento del diagnóstico y en torno a él, con un refuerzo y una revisión anuales.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La educación continuada para el automanejo por parte de una enfermera o dietista especializada en educación diabética fomenta e cuidado personal de la diabetes y ayuda a introducir los cambios beneficiosos en el estilo de vida.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[103]Sherifali D, Bai JW, Kenny M, et al. Diabetes self-management programmes in older adults: a systematic review and meta-analysis. Diabet Med. 2015 Nov;32(11):1404-14.
https://onlinelibrary.wiley.com/doi/full/10.1111/dme.12780
http://www.ncbi.nlm.nih.gov/pubmed/25865179?tool=bestpractice.com
[104]Pillay J, Armstrong MJ, Butalia S, et al. Behavioral programs for type 2 diabetes mellitus: a systematic review and network meta-analysis. Ann Intern Med. 2015 Dec 1;163(11):848-60.
http://annals.org/aim/article/2446188/behavioral-programs-type-2-diabetes-mellitus-systematic-review-network-meta
http://www.ncbi.nlm.nih.gov/pubmed/26414227?tool=bestpractice.com
[105]Chatterjee S, Davies MJ, Heller S, et al. Diabetes structured self-management education programmes: a narrative review and current innovations. Lancet Diabetes Endocrinol. 2018 Feb;6(2):130-42.
http://www.ncbi.nlm.nih.gov/pubmed/28970034?tool=bestpractice.com
Esto requiere conocimientos generales sobre nutrición y estilo de vida saludable y planes de ejercicio y nutrición individualizados a partir de una evaluación inicial y los objetivos del tratamiento.
Las intervenciones que mejoran el automanejo también pueden reducir las dificultades de la diabetes de manera significativa.[106]Fisher L, Hessler D, Glasgow RE, et al. REDEEM: a pragmatic trial to reduce diabetes distress. Diabetes Care. 2013 Sep;36(9):2551-8.
http://care.diabetesjournals.org/content/36/9/2551.long
http://www.ncbi.nlm.nih.gov/pubmed/23735726?tool=bestpractice.com
La atención a los adultos con diabetes de tipo 2 debe incluir el manejo inmediato de todos los principales factores de riesgo cardiovascular con objetivos individualizados. Además del control glucémico, esto incluye el abandono del hábito de fumar, controlar la presión arterial, controlar los lípidos, considerar el uso de antiplaquetarios para los pacientes con alto riesgo de enfermedad cardiovascular (ECV) y medidas para reducir el avance de la enfermedad renal relacionada con la diabetes.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[107]Cheng J, Zhang W, Zhang X, et al. Effect of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers on all-cause mortality, cardiovascular deaths, and cardiovascular events in patients with diabetes mellitus: a meta-analysis. JAMA Intern Med. 2014 May;174(5):773-85.
http://www.ncbi.nlm.nih.gov/pubmed/24687000?tool=bestpractice.com
El uso de fármacos antihiperglucémicos es clave para el manejo de la diabetes de tipo 2. La selección de fármacos se basa en factores como las circunstancias clínicas y las preferencias del paciente; la eficacia del fármaco en términos de respuesta metabólica y, lo que es más importante, de protección cardiovascular y renal; así como sus requisitos de seguridad, tolerabilidad y seguimiento.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Además, se deben dar consideraciones especiales a las personas con diabetes de tipo 2 y enfermedad renal crónica, como el uso de inhibidores de la ECA o antagonistas de los receptores de angiotensina II e inhibidores del cotransportador de sodio-glucosa-2 (SGLT2) cuando hay proteinuria.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Atención individualizada
Adopte un enfoque individualizado del manejo que se adapte a las necesidades y circunstancias específicas de su paciente. Tenga en cuenta lo siguiente del paciente:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Preferencias personales
Comorbilidades
Riesgos de la polifarmacia
Capacidad de beneficiarse de intervenciones a largo plazo
Discapacidades (p. ej., discapacidad visual).
Esto es especialmente importante en el contexto de la multimorbilidad.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Analizar y acordar un objetivo individual de HbA1c con el paciente.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Para determinar el objetivo de HbA1c más adecuado para su paciente, compruebe los protocolos locales y consulte a un especialista si es necesario. Considere relajar el nivel objetivo de HbA1c caso por caso, si es adecuado para su paciente individual, con especial consideración para aquellos que son ancianos o frágiles (ver más abajo).[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Alentar al paciente a alcanzar su objetivo y mantenerlo, a menos que los efectos adversos resultantes (incluida la hipoglucemia) o el esfuerzo necesario para alcanzar sus objetivos afecten su calidad de vida.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Aproveche cada revisión para reevaluar las necesidades y circunstancias del paciente y considere la posibilidad de suspender cualquier medicamento que no sea eficaz.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Intente realizar una evaluación rutinaria de la fragilidad siempre que revise a una persona mayor con diabetes.[83]Strain WD, Hope SV, Green A, et al. Type 2 diabetes mellitus in older people: a brief statement of key principles of modern day management including the assessment of frailty – a national collaborative stakeholder initiative. Diabet Med. 2018 Jul;35(7):838-45.
https://onlinelibrary.wiley.com/doi/10.1111/dme.13644
http://www.ncbi.nlm.nih.gov/pubmed/29633351?tool=bestpractice.com
[84]Sinclair A, Gallagher A. Managing frailty and associated comorbidities in older adults with diabetes: position statement on behalf of the Association of British Clinical Diabetologists (ABCD). 2019 [internet publication].
https://abcd.care/sites/abcd.care/files/site_uploads/Resources/Position-Papers/ABCD-Position-Paper-Frailty.pdf
[85]Strain WD, Down S, Brown P, et al. Diabetes and frailty: an expert consensus statement on the management of older adults with type 2 diabetes. Diabetes Ther. 2021 May;12(5):1227-47.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8099963
http://www.ncbi.nlm.nih.gov/pubmed/33830409?tool=bestpractice.com
Utilice una herramienta validada (p. ej., el índice de fragilidad electrónico [eFI], la puntuación de fragilidad de Rockwood o el Timed Up and Go) para confirmar la sospecha clínica de fragilidad.[84]Sinclair A, Gallagher A. Managing frailty and associated comorbidities in older adults with diabetes: position statement on behalf of the Association of British Clinical Diabetologists (ABCD). 2019 [internet publication].
https://abcd.care/sites/abcd.care/files/site_uploads/Resources/Position-Papers/ABCD-Position-Paper-Frailty.pdf
[85]Strain WD, Down S, Brown P, et al. Diabetes and frailty: an expert consensus statement on the management of older adults with type 2 diabetes. Diabetes Ther. 2021 May;12(5):1227-47.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8099963
http://www.ncbi.nlm.nih.gov/pubmed/33830409?tool=bestpractice.com
Los pacientes frágiles necesitan un enfoque de tratamiento personalizado; la reducción de la intensidad de la terapia es tan importante como la intensificación. En particular, tenga en cuenta que:[83]Strain WD, Hope SV, Green A, et al. Type 2 diabetes mellitus in older people: a brief statement of key principles of modern day management including the assessment of frailty – a national collaborative stakeholder initiative. Diabet Med. 2018 Jul;35(7):838-45.
https://onlinelibrary.wiley.com/doi/10.1111/dme.13644
http://www.ncbi.nlm.nih.gov/pubmed/29633351?tool=bestpractice.com
Los objetivos glucémicos recomendados para un buen control en personas jóvenes con buena forma física son demasiado estrictos para los pacientes mayores frágiles.[83]Strain WD, Hope SV, Green A, et al. Type 2 diabetes mellitus in older people: a brief statement of key principles of modern day management including the assessment of frailty – a national collaborative stakeholder initiative. Diabet Med. 2018 Jul;35(7):838-45.
https://onlinelibrary.wiley.com/doi/10.1111/dme.13644
http://www.ncbi.nlm.nih.gov/pubmed/29633351?tool=bestpractice.com
[84]Sinclair A, Gallagher A. Managing frailty and associated comorbidities in older adults with diabetes: position statement on behalf of the Association of British Clinical Diabetologists (ABCD). 2019 [internet publication].
https://abcd.care/sites/abcd.care/files/site_uploads/Resources/Position-Papers/ABCD-Position-Paper-Frailty.pdf
Consulte sus protocolos locales y considere consultar a un especialista.
Los regímenes farmacológicos más adecuados para un paciente frágil, incluyendo la elección del fármaco y la dosis óptima, deberán considerarse cuidadosamente.[83]Strain WD, Hope SV, Green A, et al. Type 2 diabetes mellitus in older people: a brief statement of key principles of modern day management including the assessment of frailty – a national collaborative stakeholder initiative. Diabet Med. 2018 Jul;35(7):838-45.
https://onlinelibrary.wiley.com/doi/10.1111/dme.13644
http://www.ncbi.nlm.nih.gov/pubmed/29633351?tool=bestpractice.com
"Empiece poco a poco" en la dosificación y ajuste de los medicamentos en adultos frágiles de edad avanzada .[83]Strain WD, Hope SV, Green A, et al. Type 2 diabetes mellitus in older people: a brief statement of key principles of modern day management including the assessment of frailty – a national collaborative stakeholder initiative. Diabet Med. 2018 Jul;35(7):838-45.
https://onlinelibrary.wiley.com/doi/10.1111/dme.13644
http://www.ncbi.nlm.nih.gov/pubmed/29633351?tool=bestpractice.com
Equilibre el beneficio previsto del tratamiento con el riesgo de los efectos adversos del tratamiento.[108]Hambling CE, Khunti K, Cos X, et al. Factors influencing safe glucose-lowering in older adults with type 2 diabetes: a PeRsOn-centred ApproaCh To IndiVidualisEd (PROACTIVE) glycemic goals for older people: a position statement of Primary Care Diabetes Europe. Prim Care Diabetes. 2019 Aug;13(4):330-52.
https://www.primary-care-diabetes.com/article/S1751-9918(18)30300-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30792156?tool=bestpractice.com
En la práctica, a menos que se indique lo contrario por una necesidad clínica específica o un régimen de dosificación, deje pasar de 3 a 6 meses para evaluar el impacto de cualquier intervención destinada a mejorar el control glucémico, ya sea farmacológica o no farmacológica. Tenga en cuenta que este período de tiempo variará según el paciente individual y los niveles iniciales de glucosa en sangre; considere cuidadosamente cuánto riesgo podría representar la HbA1c del paciente y pase a intervenciones más intensas con mayor rapidez si es necesario.
Dieta, actividad física y sueño
El asesoramiento nutricional debe adaptarse a las necesidades de cada paciente y ser proporcionado por un profesional de salud con experiencia y competencias específicas en el campo de la nutrición.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Las guías de práctica clínica de la Asociación Europea para el Estudio de la Diabetes (EASD) para el manejo dietético de la diabetes señalan que una variedad de alimentos y patrones dietéticos son adecuados para el manejo de la diabetes.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
El National Institute for Health and Care Excellence (NICE) del Reino Unido y la EASD recomiendan animar al paciente a seguir los mismos consejos de alimentación saludable que la población general.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
En particular, anime al paciente a:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
Incluir en su dieta fuentes de carbohidratos mínimamente procesados, ricos en fibra y con bajo índice glucémico, como frutas, verduras, nueces, semillas, cereales integrales y legumbres
Consumir productos lácteos bajos en grasa y pescado azul
Limitar su consumo de alimentos que contienen ácidos grasos saturados y trans
Minimizar el consumo de carnes rojas y procesadas, sodio, bebidas azucaradas y cereales refinados.
Ofrezca recomendaciones individualizadas sobre la ingesta de carbohidratos y alcohol, y los patrones alimenticios.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Reducir el riesgo de hipoglucemia debe ser un objetivo particular para una persona que utiliza insulina o un secretagogo de insulina.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Fomentar una ingesta de azúcares libres o añadidos inferior al 10% de la ingesta energética total.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
Se pueden utilizar edulcorantes no nutritivos para sustituir los azúcares en alimentos y bebidas.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
Aunque se permite la sustitución limitada de alimentos que contienen sacarosa por otros carbohidratos en el plan de comidas, aconseje al paciente que tenga cuidado de evitar el exceso de ingesta energética.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La ingesta de fibra dietética debe ser de al menos 35 g/día, considerándose alimentos enriquecidos con fibra y suplementos de fibra cuando no se puede obtener una ingesta suficiente solo con la dieta.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
Desaconseje al paciente el consumo de alimentos comercializados específicamente para personas con diabetes.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Existe un debate en curso sobre el papel potencial de las dietas bajas en carbohidratos en personas con diabetes tipo 2. Las evidencias indican que estas dietas pueden ser seguras y eficaces a corto plazo para manejar el peso y mejorar el control glucémico y el riesgo cardiovascular.[109]Diabetes UK. Position statement: low carb diets for people with diabetes. May 2021 [internet publication].
https://www.diabetes.org.uk/professionals/position-statements-reports/food-nutrition-lifestyle/low-carb-diets-for-people-with-diabetes
Un metanálisis no encontró diferencias en los efectos de reducción de la glucosa, el peso o los niveles de colesterol de lipoproteínas de baja densidad (LDL) entre las dietas bajas y altas en carbohidratos al cabo de un año o más.[110]Snorgaard O, Poulsen GM, Andersen HK, et al. Systematic review and meta-analysis of dietary carbohydrate restriction in patients with type 2 diabetes. BMJ Open Diabetes Res Care. 2017 Feb 23;5(1):e000354.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5337734
http://www.ncbi.nlm.nih.gov/pubmed/28316796?tool=bestpractice.com
Otro metanálisis concluyó que había evidencias moderada a baja calidad de que algunos pacientes pueden lograr la remisión de su diabetes tipo 2 siguiendo una dieta baja en carbohidratos durante 6 meses.[111]Goldenberg JZ, Day A, Brinkworth GD, et al. Efficacy and safety of low and very low carbohydrate diets for type 2 diabetes remission: systematic review and meta-analysis of published and unpublished randomized trial data. BMJ. 2021 Jan 13;372:m4743.
https://www.bmj.com/content/372/bmj.m4743.long
http://www.ncbi.nlm.nih.gov/pubmed/33441384?tool=bestpractice.com
La EASD no recomienda dietas cetogénicas muy bajas en carbohidratos.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
La American Diabetes Association (ADA) recomienda considerar la reducción de la ingesta total de carbohidratos en los adultos para mejorar el control glucémico.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
La EASD recomienda una variedad de patrones dietéticos, que abarcan algunos de los principios clave descritos anteriormente, incluidas las dietas mediterránea, nórdica y vegetariana/vegana.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
La Sociedad Europea de Cardiología (ESC) también recomienda los patrones dietéticos mediterráneos o basados en plantas con alto contenido de grasas insaturadas para reducir el riesgo cardiovascular, y los primeros también son recomendados por la ADA.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Cada vez hay más pruebas de que las dietas mediterránea y vegetariana/vegana mejoran la glucemia y otros factores de riesgo cardiometabólico en personas con diabetes de tipo 2, mientras que la dieta nórdica mejora el IMC y otros factores de riesgo cardiometabólico.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
[112]Papamichou D, Panagiotakos DB, Itsiopoulos C. Dietary patterns and management of type 2 diabetes: a systematic review of randomised clinical trials. Nutr Metab Cardiovasc Dis. 2019 Jun;29(6):531-43.
https://www.primary-care-diabetes.com/article/S1751-9918(18)30300-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30952576?tool=bestpractice.com
[113]Pollakova D, Andreadi A, Pacifici F, et al. The impact of vegan diet in the prevention and treatment of type 2 diabetes: a systematic review. Nutrients. 2021 Jun 21;13(6):2123.
https://www.mdpi.com/2072-6643/13/6/2123
http://www.ncbi.nlm.nih.gov/pubmed/34205679?tool=bestpractice.com
[114]Tosatti JAG, Alves MT, Gomes KB. The role of the mediterranean dietary pattern on metabolic control of patients with diabetes mellitus: a narrative review. Adv Exp Med Biol. 2021;1307:115-28.
http://www.ncbi.nlm.nih.gov/pubmed/32253710?tool=bestpractice.com
Sin embargo, se requiere cuidado para evitar la exclusión a largo plazo de nutrientes importantes.
No hay evidencia suficiente para recomendar el uso rutinario de suplementos y micronutrientes a base de hierbas (p. ej. canela, curcumina, vitamina D, aloe vera) para mejorar el control glucémico en pacientes con diabetes.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Integre el asesoramiento dietético con un plan personalizado de control de la diabetes que incluya otros aspectos de la modificación del estilo de vida, como el aumento de la actividad física y la pérdida de peso.[28]World Gastroenterology Organisation and International Federation for the Surgery of Obesity and Metabolic Diseases. IFSO-WGO guidelines on obesity. 2023 [internet publication].
https://www.worldgastroenterology.org/guidelines/obesity/obesity-english
[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[115]National Institute for Health and Care Excellence. Preventing excess weight gain. March 2015 [internet publication].
https://www.nice.org.uk/guidance/ng7
[116]National Institute for Health and Care Excellence. Weight management: lifestyle services for overweight or obese adults. May 2014 [internet publication].
https://www.nice.org.uk/guidance/ph53
[117]National Institute for Health and Care Excellence. Obesity: identification, assessment and management. July 2023 [internet publication].
https://www.nice.org.uk/guidance/cg189
[118]National Institute for Health and Care Excellence. Physical activity: brief advice for adults in primary care. May 2013 [internet publication].
https://www.nice.org.uk/guidance/ph44
En cuanto a la actividad física, anime al paciente a:
Reducir el comportamiento sedentario y ser más activo físicamente.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[115]National Institute for Health and Care Excellence. Preventing excess weight gain. March 2015 [internet publication].
https://www.nice.org.uk/guidance/ng7
Incorporar la actividad a su vida diaria (p. ej., caminar a paso ligero, trabajar en el jardín o montar en bicicleta).[115]National Institute for Health and Care Excellence. Preventing excess weight gain. March 2015 [internet publication].
https://www.nice.org.uk/guidance/ng7
[117]National Institute for Health and Care Excellence. Obesity: identification, assessment and management. July 2023 [internet publication].
https://www.nice.org.uk/guidance/cg189
De este modo, el paciente puede aumentar gradualmente la cantidad e intensidad de la actividad que realiza.[115]National Institute for Health and Care Excellence. Preventing excess weight gain. March 2015 [internet publication].
https://www.nice.org.uk/guidance/ng7
Realizar entre 45 y 60 minutos de actividad de intensidad moderada al día, sobre todo si no reducen su aporte energético, para prevenir la obesidad. Aconseje a las personas que han vivido con obesidad y han perdido peso que es posible que necesiten realizar entre 60 y 90 minutos de actividad al día para evitar recuperar peso.[117]National Institute for Health and Care Excellence. Obesity: identification, assessment and management. July 2023 [internet publication].
https://www.nice.org.uk/guidance/cg189
Una revisión sistemática y un metanálisis de estudios observacionales concluyeron que la actividad física, incluso por debajo de las cantidades recomendadas, se asociaba con una menor incidencia de complicaciones relacionadas con la diabetes.[119]Rietz M, Lehr A, Mino E, et al. Physical activity and risk of major diabetes-related complications in individuals with diabetes: a systematic review and meta-analysis of observational studies. Diabetes Care. 2022 Dec 1;45(12):3101-11.
https://link.springer.com/chapter/10.1007/5584_2020_513
http://www.ncbi.nlm.nih.gov/pubmed/36455117?tool=bestpractice.com
Tanto la ADA como la ESC recomiendan aconsejar a los pacientes sobre los niveles mínimos semanales óptimos de ejercicio aeróbico: 150 minutos por semana a intensidad moderada o 75 minutos por semana a intensidad vigorosa (si no hay contraindicaciones).[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Además, recomiendan que, además del ejercicio aeróbico, el ejercicio de resistencia se realice al menos dos veces por semana (siempre que no esté contraindicado) para obtener un beneficio adicional.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Ambas aconsejan que se debe alentar a todas las personas con diabetes a aumentar sus niveles de cualquier actividad física (por ejemplo, caminar, jardinería, tareas domésticas, yoga, bailar, nadar) por encima del valor inicial, incluso si no cumplen con los niveles óptimos de ejercicio recomendados.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Además, la ESC recomienda lo siguiente con respecto a la actividad física en las personas con diabetes de tipo 2:[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Las intervenciones con ejercicios deben adaptarse a cualquier comorbilidad y/o complicación de la diabetes (p. ej., fragilidad, neuropatía, retinopatía).
Considere intervenciones basadas en la teoría del comportamiento (p. ej., establecimiento de metas) para fomentar conductas de ejercicio.
Uso de intervenciones de ejercicio estructurado para pacientes con ECV establecida para beneficiar el control metabólico, la capacidad de ejercicio y la calidad de vida, y reducir los eventos cardiovasculares. Se debe considerar una prueba de esfuerzo con ejercicio en estos pacientes antes de iniciar un programa de ejercicio estructurado.
Si el paciente tiene sobrepeso:
El NICE recomienda un objetivo inicial de pérdida de peso corporal del 5% al 10%.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La evidencia sugiere que la pérdida de peso de >5% en adultos con sobrepeso u obesidad mejora el control glucémico, los niveles de lípidos y la presión arterial.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Los programas de manejo de la pérdida de peso con un plan de alimentación saludable y actividad física que resulta en un déficit de energía tienen el potencial para la remisión de la diabetes tipo 2.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
[49]Evert AB, Dennison M, Gardner CD, et al. Nutrition therapy for adults with diabetes or prediabetes: a consensus report. Diabetes Care. 2019 May;42(5):731-54.
https://care.diabetesjournals.org/content/42/5/731.long
http://www.ncbi.nlm.nih.gov/pubmed/31000505?tool=bestpractice.com
[120]Lean ME, Leslie WS, Barnes AC, et al. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. Lancet. 2018 Feb 10;391(10120):541-51.
http://www.ncbi.nlm.nih.gov/pubmed/29221645?tool=bestpractice.com
[121]Gregg EW, Chen H, Wagenknecht LE, et al; Look AHEAD Research Group. Association of an intensive lifestyle intervention with remission of type 2 diabetes. JAMA. 2012 Dec 19;308(23):2489-96.
https://jamanetwork.com/journals/jama/fullarticle/1486829
http://www.ncbi.nlm.nih.gov/pubmed/23288372?tool=bestpractice.com
La EASD recomienda un programa de sustitución de una dieta total baja en energía (p. ej. 3500 kJ/día [840 kcal/día] durante 12-20 semanas), proporcionados por profesionales de la salud capacitados, con medicamentos hipoglucemiantes y antihipertensivos cuidadosamente ajustados, para proporcionar una pérdida de peso suficiente para inducir la remisión de la diabetes de tipo 2 (10% a 15 % de peso corporal o mayor).[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
El Diabetes Remission Clinical Trial (DiRECT) sobre el control de la pérdida de peso con apoyo para personas diagnosticadas de diabetes de tipo 2 en los últimos 6 años y con un índice de masa corporal (IMC) de 27 kg/m² a 45 kg/m², encontró que casi la mitad de los participantes lograron la remisión a un estado no diabético y dejaron de tomar fármacos antidiabéticos a los 12 meses.[120]Lean ME, Leslie WS, Barnes AC, et al. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. Lancet. 2018 Feb 10;391(10120):541-51.
http://www.ncbi.nlm.nih.gov/pubmed/29221645?tool=bestpractice.com
A los dos años, más de un tercio de los participantes en el ensayo habían mantenido la remisión.[122]Lean ME, Leslie WS, Barnes AC, et al. Durability of a primary care-led weight-management intervention for remission of type 2 diabetes: 2-year results of the DiRECT open-label, cluster-randomised trial. Lancet Diabetes Endocrinol. 2019 May;7(5):344-55.
http://www.ncbi.nlm.nih.gov/pubmed/30852132?tool=bestpractice.com
Apoyar al paciente con tratamientos basados en la evidencia para lograr y mantener la pérdida de peso. Con la ayuda de profesionales de la salud capacitados, se pueden utilizar una variedad de tipos de dietas para bajar de peso y composiciones de macronutrientes, siempre que cumplan con otras recomendaciones dietéticas.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
Esto incluye productos de fórmula nutricionalmente completos y de bajo contenido energético; sin embargo, la EASD no recomienda dietas cetogénicas extremadamente altas en carbohidratos ni muy bajas en carbohidratos.[45]Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based European recommendations for the dietary management of diabetes. Diabetologia. 2023 Jun;66(6):965-85.
https://link.springer.com/article/10.1007/s00125-023-05894-8
http://www.ncbi.nlm.nih.gov/pubmed/37069434?tool=bestpractice.com
Tras el éxito de un plan piloto, el Servicio Nacional de Salud de Inglaterra está ampliando su programa de sopas y batidos sustitutivos de la dieta total durante 3 meses para personas diagnosticadas con diabetes de tipo 2 en los últimos 6 meses.[123]NHS England. NHS to expand soups and shakes for people with type 2 diabetes. April 2023 [internet publication].
https://www.england.nhs.uk/2023/04/nhs-to-expand-soups-and-shakes-for-people-with-type-2-diabetes
Considere la posibilidad de realizar pruebas de detección de la salud del sueño, incluidos los síntomas de trastornos del sueño, la interrupción del sueño debido a síntomas de diabetes o necesidades de control, y preocuparse por el sueño.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Considere consultar a un especialista en sueño.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
La obesidad y la diabetes son factores de riesgo para la apnea del sueño, y el sueño inadecuado puede afectar el control glucémico.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Los estudios han demostrado que la adherencia a un estilo de vida saludable (p. ej., dieta favorable, actividad física, no fumar, consumo moderado de alcohol y peso normal) se asocia con un riesgo relativo reducido de mortalidad en personas con diabetes de tipo 2.[48]Schlesinger S, Neuenschwander M, Ballon A, et al. Adherence to healthy lifestyles and incidence of diabetes and mortality among individuals with diabetes: a systematic review and meta-analysis of prospective studies. J Epidemiol Community Health. 2020 May;74(5):481-487.
http://www.ncbi.nlm.nih.gov/pubmed/32075860?tool=bestpractice.com
Manejo del riesgo cardiovascular
Presión arterial (PA)
Consulte los protocolos locales. Las guías de práctica clínica difieren en cuanto a los objetivos de presión arterial recomendados para las personas con diabetes de tipo 2.
En las encuestas más recientes de EUROASPIRE (EAIV 2012/13 y EAV 2016/17), el 80% de los hombres y el 87% de las mujeres con diagnóstico de diabetes también tenían antecedentes de hipertensión.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
El control óptimo de la PA reduce el riesgo de complicaciones tanto microvasculares como macrovasculares.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
El NICE recomienda mantener la PA con cambios en el estilo de vida o tratamiento farmacológico para lograr objetivos de:[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
Por debajo de 135/85 mmHg para los adultos menores de 80 años, según la monitorización ambulatoria o domiciliaria de la PA (o <140/90 mmHg según la PA clínica)
Por debajo de 145/85 mmHg para los pacientes de 80 años o más, según la monitorización ambulatoria o domiciliaria de la PA (o <150/90 mmHg según la PA clínica)
Por debajo de 130/80 mmHg (PA clínica) para pacientes con enfermedad renal crónica (ERC) y cociente albúmina/creatinina (ACR) de 70 mg/mmol o más; por debajo de 140/90 mmHg (PA clínica) para aquellos con ERC y ACR <70 mg/mmol.
Aunque el NICE recomienda utilizar el criterio clínico para pacientes con fragilidad o multimorbilidad, su comité de directrices concluyó que no había evidencia que sugiriera que los objetivos de la presión arterial debieran ser diferentes en personas con diabetes de tipo 2; por lo tanto, estas recomendaciones para los objetivos de la presión arterial se aplican a personas con y sin diabetes de tipo 2.[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
El NICE también recomienda utilizar los mismos objetivos de presión arterial para personas con y sin enfermedad cardiovascular.[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
El NICE también subraya la importancia de medir la presión arterial de pie, además de en posición acostada/sentada, en las personas con diabetes de tipo 2, basándose en la opinión de los expertos de que este grupo de pacientes tiene un riesgo mayor de lo habitual de sufrir hipotensión postural:[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
Si hay una caída en la lectura sistólica después de estar de pie durante al menos un minuto (después de estar acostado o sentado) de 20 mmHg o más (o 10 mmHg o más en la lectura diastólica), se deben considerar y tratar adecuadamente las causas probables (incluidos los medicamentos actuales) (p. ej., medidas de prevención de caídas) y se deben tomar de pie las PA futuras.
Se debe considerar una evaluación adicional del especialista si los síntomas persisten a pesar de estas medidas, o si las mediciones de la PA (realizadas acostado y de pie) no han confirmado la hipotensión postural a pesar de que los síntomas sean sugerentes.
Si el paciente tiene una caída postural significativa de la presión arterial o síntomas de hipotensión postural (p. ej., caídas, mareos posturales), el NICE recomienda que la hipertensión se trate hasta un objetivo basado en las mediciones de pie.
La guía de práctica clínica de la ESC 2023 sobre el tratamiento de las ECV en la diabetes recomienda un enfoque individualizado para tratar la hipertensión en las personas con diabetes:[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
En personas de hasta 65 años: PA sistólica (PAS) objetivo a 130 mmHg y <130 mmHg si se tolera (pero no menos de 120 mmHg)
En personas de edad avanzada (>65 años): objetivo de la PAS en un rango de 130 a 139 mmHg
La PAS dirigida a <130 mmHg para reducir aún más el riesgo de accidente cerebrovascular en pacientes que tienen un riesgo particularmente alto de un evento cerebrovascular.
Independientemente del objetivo específico de la presión arterial, pueden ser necesarios tanto los cambios en el estilo de vida como la medicación antihipertensiva para lograr el control de la PA. Se ha demostrado que la reducción de la ingesta de sodio (a <100 mmol/día) y el consumo elevado de frutas, verduras y productos lácteos bajos en grasa mejoran el control de la PA.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Estas medidas de estilo de vida están respaldadas por la ESC para las personas con diabetes de tipo 2 e hipertensión, además de la restricción del alcohol, el aumento del ejercicio y la pérdida de peso cuando corresponda.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
En el Reino Unido, el NICE recomienda un enfoque gradual para el tratamiento farmacológico de la hipertensión en personas sin ERC, o con ERC y una RAC ≤30 mg/mmol (categorías RAC A1 y A2), como sigue.[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
[86]National Institute for Health and Care Excellence. Chronic kidney disease: assessment and management. November 2021 [internet publication].
https://www.nice.org.uk/guidance/ng203
Para recomendaciones sobre la elección del agente hipertensivo en personas con ERC y una RAC >30 mg/mmol (categoría RAC A3 o superior), consulte a continuación el apartado Consideraciones farmacoterapéuticas específicas para pacientes con ERC.
Fase 1[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
Para el tratamiento inicial, administrar:
Fase 2[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
Si la hipertensión sigue sin controlarse con los tratamientos de primera línea:
Fase 3[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
Antes de considerar el siguiente paso del tratamiento, comente el cumplimiento con el paciente y revise sus medicamentos para asegurarse de que se toman en las dosis óptimas toleradas.
Si la presión arterial del paciente sigue sin estar controlada a pesar de las terapias del segundo paso, ofrezca una combinación de terapia triple de:
Un inhibidor IECA o un antagonista del receptor de la angiotensina II, y
Un bloqueador del canal de calcio, y
Un diurético tipo tiazida
Fase 4[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
Si la presión arterial no se controla a pesar de las dosis óptimas toleradas de los medicamentos de la triple terapia del paso 3, considere que el paciente tiene hipertensión resistente. Antes de considerar un tratamiento adicional, confirme las mediciones clínicas elevadas de presión arterial mediante registros de presión arterial ambulatorios o domiciliarios, evalúe la hipotensión postural y analice el cumplimiento. Para las personas con hipertensión resistente confirmada, considere agregar un cuarto fármaco antihipertensivo o derivar a estos pacientes a un especialista en hipertensión. Considere también las posibles causas secundarias de la hipertensión (por ejemplo, adenoma de Conn, feocromocitoma, hipertensión renovascular): en las personas con signos y síntomas que sugieren una causa secundaria, considere la necesidad de investigaciones especializadas y/o derivación. Los pacientes cuya PA sigue sin estar controlada con cuatro fármacos antihipertensivos deben ser remitidos a un especialista.
Para las personas con enfermedades cardiovasculares, siga las recomendaciones para la indicaciones específicas de la enfermedad en la guía de práctica clínica del NICE para su enfermedad.[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
Si su presión arterial permanece descontrolada, ofrézcale tratamiento farmacológico antihipertensivo según la terapia gradual descrita anteriormente.[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
La guía de práctica clínica de la ESC adopta un enfoque muy similar al del NICE, pero destaca otros mensajes principales:[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Existen evidencias sólidas que respaldan el uso de un inhibidor IECA o de un antagonista de los receptores de la angiotensina II, especialmente en los pacientes que presentan microalbuminuria, proteinuria o hipertrofia ventricular izquierda. Estos fármacos presentan propiedades renoprotectoras que van más allá de sus efectos antihipertensivos.
La terapia dual se recomienda como tratamiento de primera línea porque la mayoría de los pacientes no consiguen controlar la PA con un solo antihipertensivo. Estos pueden administrarse como una formulación combinada patentada (si está disponible) para mejorar el cumplimiento y lograr un control más rápido de la PA. Se recomienda una combinación de un IECA o un antagonista de los receptores de angiotensina II, con un antagonista del calcio o un diurético similar a la tiazida.
Los betabloqueantes deben considerarse en cualquier etapa del tratamiento de la hipertensión si existe una indicación específica (p. ej., enfermedad de las arterias coronarias, fibrilación auricular, insuficiencia cardíaca).
Cada vez es más frecuente incorporar el uso de la monitorización domiciliaria de la presión arterial en el diagnóstico y el manejo de la hipertensión en adultos, incluidos los diabéticos.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[124]Margolis KL, Asche SE, Bergdall AR, et al. Effect of home blood pressure telemonitoring and pharmacist management on blood pressure control: a cluster randomized clinical trial. JAMA. 2013 Jul 3;310(1):46-56.
https://jamanetwork.com/journals/jama/fullarticle/1707720
http://www.ncbi.nlm.nih.gov/pubmed/23821088?tool=bestpractice.com
Lípidos
Consulte los protocolos locales. Las guías de práctica clínica recomiendan diferentes enfoques para la terapia de modificación de los lípidos.
El NICE recomienda:
Utilizar una herramienta de evaluación de riesgos validada como QRISK3 para evaluar el riesgo de ECV en los próximos 10 años en personas con diabetes de tipo 2 de entre 25 y 84 años (se debe considerar que las personas de 85 años o más tienen un mayor riesgo de ECV solo por la edad, especialmente si fuman y/o tienen la PA elevada).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
QRISK®3 calculator
Opens in new window
En su guía de práctica clínica sobre diabetes de tipo 2 (actualizada por última vez en 2022), el NICE recomienda utilizar QRISK2 para evaluar el riesgo de enfermedad cardiovascular en adultos con diabetes de tipo 2.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Sin embargo, la guía de práctica clínica del NICE de 2023 sobre ECV recomienda el uso de QRISK3.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
El NICE reconoce que puede ser necesario utilizar QRISK2 hasta que los sistemas clínicos electrónicos se actualicen con QRISK3.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
En función de la disponibilidad local, tanto QRISK2 como QRISK3 son herramientas razonables para evaluar el riesgo de ECV en adultos con diabetes de tipo 2.
El NICE especifica determinadas poblaciones para las que se debe usar QRISK3 (ya que QRISK2 puede subestimar el riesgo de ECV en estos pacientes), incluidas las personas con enfermedades mentales graves, lupus eritematoso sistémico, migraña o disfunción eréctil, y las personas que toman corticosteroides o antipsicóticos atípicos.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
El NICE también señala que las herramientas de riesgo de ECV (incluido el QRISK3) pueden subestimar el riesgo en algunos grupos (por ejemplo, los tratados por el VIH, los que han dejado de fumar recientemente, etc.) y enfatizan que se necesita un juicio clínico para interpretar las puntuaciones de riesgo.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
El NICE no recomienda el uso de una herramienta de evaluación de riesgos para las personas con alto riesgo de ECV, incluidas aquellas con una tasa de filtración glomerular estimada (TFGe) <60 ml/min/1.73 m² y/o albuminuria, o un trastorno hereditario del metabolismo lipídico (p. ej., hipercolesterolemia familiar).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Ofrecer tratamiento con estatinas de alta intensidad (es decir, atorvastatina en el extremo inferior del rango de dosis de alta intensidad) para la prevención primaria de las ECV en personas con (y sin) diabetes de tipo 2 que tienen un riesgo del ≥10% a 10 años (estimado mediante QRISK3) de desarrollar ECV.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
El NICE señala que no se debe descartar el tratamiento con atorvastatina para la prevención primaria solo porque la puntuación de riesgo a 10 años del paciente sea inferior al 10% si tiene una preferencia informada por tomar una estatina o existe la preocupación de que el riesgo pueda subestimarse.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
El NICE también recomienda considerar este tratamiento para las personas de 85 años o más, con conciencia de los factores que pueden hacer que el tratamiento sea inadecuado (p. ej., esperanza de vida, fragilidad, comorbilidades u otros medicamentos actuales).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Ofrecer tratamiento con estatinas de alta intensidad (es decir, atorvastatina en el extremo superior del rango de dosis de alta intensidad) para la prevención secundaria en personas con (y sin) diabetes con ECV establecida, independientemente de su nivel de colesterol y siempre que tengan una función renal normal.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Se debe ofrecer una dosis más baja para la prevención secundaria si la persona tiene un alto riesgo de sufrir efectos adversos de las estatinas o está tomando otros medicamentos que podrían interactuar con la estatina, o si prefiere una dosis más baja.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
A las personas con ERC que requieren prevención secundaria de ECV se les debe ofrecer atorvastatina en el extremo inferior del rango de dosis de alta intensidad (es decir, lo mismo que para la prevención primaria).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
La decisión de iniciar (o intensificar) la terapia hipolipemiante debe tomarse con el paciente después de una discusión informada sobre los riesgos y beneficios del tratamiento, teniendo en cuenta los factores individuales del paciente (p. ej., preferencias, comorbilidades, otros medicamentos).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Las estatinas están contraindicadas en el embarazo. Las estatinas deben suspenderse 3 meses antes de que la paciente intente concebir y no deben reiniciarse hasta que se termine la lactancia materna.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Antes de iniciar el tratamiento con modificación de lípidos, se debe realizar una evaluación clínica que incluya una revisión del tabaquismo y el estado de la diabetes, el consumo de alcohol, la PA y el IMC (u otra medida de la obesidad).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Se deben realizar análisis de sangre iniciales, que incluyan la función renal, el nivel de transaminasas hepáticas y el perfil lipídico completo (es decir, colesterol total y niveles de colesterol y triglicéridos de lipoproteínas de alta densidad [HDL], a partir de los cuales se calculan el colesterol no HDL y el colesterol de lipoproteínas de baja densidad [LDL]; no se necesita una muestra en ayunas).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Se deben solicitar análisis de sangre para determinar el nivel de hormona estimulante de la tiroides (TSH) si hay síntomas de disfunción tiroidea, y se deben realizar niveles de creatinina cinasa si la persona ha tenido síntomas musculares generalizados persistentes e inexplicados (dolor, sensibilidad o debilidad).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Los hallazgos clínicos, el perfil lipídico completo y los antecedentes familiares deben utilizarse para evaluar la probabilidad de un trastorno lipídico familiar (en lugar de basar la decisión únicamente en los valores lipídicos).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Los trastornos lipídicos familiares están fuera del alcance de este tema: para obtener más información sobre cuándo sospechar y cómo diagnosticar la hipercolesterolemia familiar, consulte el apartado Hipercolesterolemia.
Disponga la evaluación por un especialista de las personas con una concentración de colesterol total superior a 9.0 mmol/L o una concentración de colesterol no-HDL superior a 7.5 mmol/L, incluso en ausencia de antecedentes familiares de cardiopatía coronaria prematura.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Las comorbilidades y las causas secundarias de dislipidemia deben tratarse (y, si procede, se deben analizar los cambios en el estilo de vida) al mismo tiempo que se inicia el tratamiento con estatinas para la prevención secundaria (o antes de iniciar una estatina para la prevención primaria).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Datos consistentes han demostrado la eficacia de las estatinas en la prevención de eventos cardiovasculares y la reducción de la mortalidad cardiovascular en pacientes con diabetes, sin evidencia de diferencias de sexo; su uso se asocia con un número limitado de eventos adversos.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
En términos de seguimiento, el NICE recomienda lo siguiente:[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
A los 2-3 meses después de iniciar o cambiar un tratamiento hipolipemiante, realizar un perfil lipídico completo y un nivel de transaminasas hepáticas (las transaminasas hepáticas deben controlarse de nuevo a los 12 meses; no es necesario repetir las pruebas de transaminasas hepáticas a menos que esté clínicamente indicado).
En aquellos que toman estatinas para la prevención primaria, aspire a una reducción de más del 40% en el colesterol no HDL, y en aquellos que usan una estatina para la prevención secundaria, aspiren a un colesterol LDL de 2.0 mmol/L o menos (o colesterol no HDL de 2.6 mmol/L o menos). Si no se alcanza el objetivo lipídico adecuado:
Comente el cumplimiento y el horario de las dosis
Optimice el cumplimiento a la dieta y a las medidas de estilo de vida
Considere aumentar la intensidad/dosis de estatinas si corresponde. Si la persona tiene ERC y la TFG estimada es de 30 mL/min/1.73 m² o más, se debe aumentar la dosis de atorvastatina (si la TFGe es de <30 mL/min/1.73 m², cualquier aumento de la dosis debe ser acordado con un especialista renal).
Si se reportan efectos adversos con la terapia con estatinas de alta intensidad, considere las siguientes opciones con el paciente:
suspender la estatina y volver a introducirla una vez que los síntomas se resuelvan para verificar si están relacionados con las estatinas; o
cambiar a una estatina alternativa de alta intensidad; o
reducir la dosis; o
cambiar a una estatina de menor intensidad.
Revise la medicación anualmente. Utilice estas revisiones para comentar el cumplimento del tratamiento y la modificación del estilo de vida y para abordar los factores de riesgo de ECV. A las personas que reciben prevención secundaria se les debe ofrecer un perfil lipídico completo anual para informar la conversación (y esto también debe tenerse en cuenta para las personas que reciben prevención primaria).
No suspenda el uso de estatinas por un aumento del nivel de glucemia o de la HbA1c.
Las guías de práctica clínica de la ESC recomiendan examinar a los pacientes con diabetes para detectar daños en los órganos diana (DOD) graves y evaluar los síntomas y los antecedentes médicos que sugieran enfermedad cardiovascular aterosclerótica (ASCVD) para comprender su riesgo cardiovascular.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
En los casos en los que no hay ni ASCVD sintomática ni DOD graves, recomiendan el uso de la herramienta SCORE2-Diabetes para estimar el riesgo de ECV a 10 años.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
El ESC clasifica a los pacientes con diabetes de tipo 2 según estas evaluaciones en los siguientes grupos de riesgo cardiovascular (utilizados para guiar el tratamiento):[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Riesgo muy elevado
Riesgo alto
Riesgo moderado
Basándose en estas categorías, la ESC recomienda para pacientes con diabetes de tipo 2 que:[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Con bajo riesgo cardiovascular: no se pueden hacer recomendaciones claras debido a la falta de evidencia
En riesgo cardiovascular moderado: un objetivo de colesterol LDL de <2.6 mmol/L (<100 mg/dL)
Con alto riesgo cardiovascular: un objetivo de colesterol LDL de <1.8 mmol/L (<70 mg/dL) y una reducción del colesterol LDL de al menos el 50%; un objetivo secundario de colesterol no HDL de <2.6 mmol/L (<100 mg/dL)
Con un riesgo cardiovascular muy elevado: un objetivo de colesterol LDL de <1.4 mmol/L (<55 mg/dL) y una reducción del colesterol LDL de al menos el 50%; un objetivo secundario de un colesterol no HDL de <2.2 mmol/L (<85 mg/dL).
La ESC recomienda las estatinas como tratamiento hipolipemiante de primera línea en pacientes con diabetes y niveles elevados de colesterol LDL.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
El perfil de riesgo cardiovascular (muy alto, alto, moderado) de cada paciente y los correspondientes niveles objetivo de colesterol LDL (o colesterol no HDL) deben utilizarse para determinar la necesidad de administración de estatinas.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
La ESC recomienda una reducción intensiva del colesterol LDL con estatinas para las personas con ERC.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Los regímenes específicos para otros tratamientos hipolipemiantes están fuera del alcance de este tema: consulte el apartado Hipercolesterolemia para obtener más información. La siguiente es una orientación general.
Tanto las guías de práctica clínica de la NICE como las de la ESC recomiendan que si no se alcanza el objetivo lipídico adecuado en una persona con ASCVD establecida con el tratamiento con estatinas de máxima tolerancia, se debe considerar la intensificación del tratamiento hipolipemiante (es decir, terapias hipolipemiantes adicionales) de forma individual en colaboración con el paciente.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Para algunos pacientes con diabetes y ECV establecida que tienen un nivel persistentemente elevado de colesterol LDL a pesar de la terapia con estatinas tolerada al máximo, la adición de ezetimiba o un anticuerpo monoclonal inhibidor de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9) puede conferir un beneficio clínico.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[126]Giugliano RP, Cannon CP, Blazing MA, et al; IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) Investigators. Benefit of adding ezetimibe to statin therapy on cardiovascular outcomes and safety in patients with versus without diabetes mellitus: results From IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial). Circulation. 2018 Apr 10;137(15):1571-82.
http://www.ncbi.nlm.nih.gov/pubmed/29263150?tool=bestpractice.com
[127]Sabatine MS, Giugliano RP, Keech AC, et al; FOURIER Steering Committee and Investigators. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med. 2017 May 4;376(18):1713-22.
https://www.nejm.org/doi/10.1056/NEJMoa1615664
http://www.ncbi.nlm.nih.gov/pubmed/28304224?tool=bestpractice.com
[128]Squizzato A, Suter MB, Nerone M, et al. PCSK9 inhibitors for treating dyslipidemia in patients at different cardiovascular risk: a systematic review and a meta-analysis. Intern Emerg Med. 2017 Oct;12(7):1043-53.
http://www.ncbi.nlm.nih.gov/pubmed/28695455?tool=bestpractice.com
[129]Lee YJ, Cho JY, You SC, et al. Moderate-intensity statin with ezetimibe vs. high-intensity statin in patients with diabetes and atherosclerotic cardiovascular disease in the RACING trial. Eur Heart J. 2023 Mar 14;44(11):972-83.
https://academic.oup.com/eurheartj/article/44/11/972/6931821?login=false
http://www.ncbi.nlm.nih.gov/pubmed/36529993?tool=bestpractice.com
The BMJ: PCSK9 inhibitors and ezetimibe for the reduction of cardiovascular events: a clinical practice guideline with risk-stratified recommendations
Opens in new window
Además, el NICE recomienda considerar la adición de ezetimiba (al tratamiento con estatinas máximo tolerado) en pacientes con ECV establecida para reducir aún más su riesgo de ECV, incluso si el objetivo de lípidos para la prevención secundaria se cumple con una estatina sola.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
La ESC recomienda un tratamiento combinado con estatinas y ezetimiba para los pacientes que no alcanzan su objetivo de colesterol LDL solo con el tratamiento con estatinas (no se especifica la categoría de riesgo cardiovascular para esta recomendación), o como una opción para la reducción intensiva del colesterol LDL en pacientes con diabetes y ERC.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
También se deben considerar otros tratamientos hipolipemiantes de forma individual si el tratamiento con estatinas está contraindicado o no se tolera a ninguna intensidad/dosis, y pueden ser necesarios además del tratamiento con estatinas si el paciente tiene indicaciones adicionales para el tratamiento hipolipemiante (p. ej., hipertrigliceridemia, un trastorno lipídico familiar).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Abandono del hábito de fumar
Si el paciente fuma, ofrézcale consejos para el abandono del hábito de fumar e infórmele sobre cómo acceder a los servicios para dejar de fumar.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[130]National Institute for Health and Care Excellence. Tobacco: preventing uptake, promoting quitting and treating dependence. January 2023 [internet publication].
https://www.nice.org.uk/guidance/ng209
La ESC recomienda que se consideren las tratamientos farmacológicos (p. ej., tratamiento sustitutivo con nicotina, vareniclina, bupropión), así como el asesoramiento, para mejorar la tasa de éxito del abandono del hábito.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Terapia antiplaquetaria
Las personas con diabetes de tipo 2 y ECV necesitarán terapia antiplaquetaria para la prevención secundaria. Por lo general, esto será en forma de dosis bajas de ácido acetilsalicílico o clopidogrel.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Se ha comprobado que el tratamiento antiplaquetario reduce el riesgo de ictus, infarto de miocardio o muerte vascular.[131]Antithrombotic Trialists' Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002 Jan 12;324(7329):71-86.
http://www.bmj.com/content/324/7329/71.full
http://www.ncbi.nlm.nih.gov/pubmed/11786451?tool=bestpractice.com
El papel de los antiplaquetarios en la prevención primaria de la ECV no está claro y las guías de práctica clínica difieren en sus recomendaciones. Consulte los protocolos locales.
El NICE desaconseja la terapia antiplaquetaria rutinaria (ácido acetilsalicílico o clopidogrel) como prevención primaria en adultos con diabetes de tipo 2 sin ECV.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Esto se debe a que se considera que el aumento del riesgo de sangrado grave supera los posibles beneficios de la prevención primaria.[132]Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-337.
https://academic.oup.com/eurheartj/article/42/34/3227/6358713
http://www.ncbi.nlm.nih.gov/pubmed/34458905?tool=bestpractice.com
El ensayo ASCEND comparó dosis bajas de ácido acetilsalicílico con placebo entre 15,480 adultos con diabetes pero sin ECV evidente. El estudio reveló que los beneficios del uso del ácido acetilsalicílico en la prevención de eventos vasculares graves se vieron ampliamente contrarrestados por el mayor riesgo de eventos hemorrágicos importantes durante un seguimiento medio de 7.4 años.[133]ASCEND Study Collaborative Group; Bowman L, Mafham M, Wallendszus K, et al. Effects of aspirin for primary prevention in persons with diabetes mellitus. N Engl J Med. 2018 Oct 18;379(16):1529-39.
https://www.nejm.org/doi/10.1056/NEJMoa1804988
http://www.ncbi.nlm.nih.gov/pubmed/30146931?tool=bestpractice.com
Sin embargo, la ESC recomienda que se pueda considerar la ácido acetilsalicílico en dosis bajas en dosis bajas para la prevención del primer evento vascular grave en adultos con diabetes de tipo 2 sin antecedentes de ASCVD sintomática o revascularización, siempre que no existan contraindicaciones claras.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Reconocen que el tratamiento debe ser individualizado, ya que las personas con mayor riesgo cardiovascular pueden beneficiarse más de la terapia antiplaquetaria.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Recomiendan el uso de ácido acetilsalicílico en dosis bajas en pacientes con ERC y ASCVD.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
La ESC también recomienda que se considere el uso concomitante de un inhibidor de la bomba de protones adecuado (en función del riesgo de hemorragia individual del paciente) para los pacientes que toman un solo fármaco antiplaquetario (p. ej., ácido acetilsalicílico en dosis bajas) para reducir el riesgo de hemorragia gastrointestinal destacado por el ensayo ASCEND (en el que tres cuartas partes de los pacientes no tomaban un inhibidor de la bomba de protones).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Hacen la misma recomendación para aquellos que toman un solo anticoagulante.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Además, recomiendan que se utilice un inhibidor de la bomba de protones adecuado cuando se esté tomando una combinación de fármacos antitrombóticos.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Consideraciones farmacoterapéuticas específicas para pacientes con ERC
Si su paciente con diabetes tipo 2 presenta una enfermedad renal crónica (ERC) o la desarrolla en cualquier momento después del diagnóstico, el NICE recomienda:
Administre un antagonista de los receptores de la angiotensina II o un inhibidor de la ECA (ajustado a la dosis más alta autorizada que la persona pueda tolerar) si la relación albúmina creatinina (RAC) es de 3 mg/mmol o más (es decir, proteinuria clínicamente importante).[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[86]National Institute for Health and Care Excellence. Chronic kidney disease: assessment and management. November 2021 [internet publication].
https://www.nice.org.uk/guidance/ng203
Administre un inhibidor de SGLT2 (además del antagonista de los receptores de la angiotensina-II o el inhibidor IECA) si el paciente ya está tomando un antagonista de los receptores de la angiotensina-II o un inhibidor IECA (titulado a la dosis más alta autorizada que pueda tolerar) y:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[Evidencia A]61a0123d-3704-47cf-8cd7-ef9b0668234eguidelineA¿Cuál es la efectividad clínica de los inhibidores del cotransportador de sodio-glucosa-2 (SGLT2) como farmacoterapia complementaria para adultos con enfermedad renal crónica (ERC) y diabetes de tipo 2?[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La relación albúmina/creatinina (RAC) es más de 30 mg/mmol y
El paciente cumple los criterios de la autorización de comercialización (incluidos los umbrales pertinentes de la tasa de filtración glomerular estimada [TFG estimada]).
Considere la opción de un inhibidor de SGLT2 (además del antagonista de los receptores de la angiotensina-II o el inhibidor IECA) si el paciente ya está tomando un antagonista de los receptores de la angiotensina-II o un inhibidor IECA (titulado a la dosis más alta autorizada que pueda tolerar) y:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[Evidencia A]61a0123d-3704-47cf-8cd7-ef9b0668234eguidelineA¿Cuál es la efectividad clínica de los inhibidores del cotransportador de sodio-glucosa-2 (SGLT2) como farmacoterapia complementaria para adultos con enfermedad renal crónica (ERC) y diabetes de tipo 2?[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La RAC está entre 3 y 30 mg/mmol y
El paciente cumple los criterios de la autorización de comercialización (incluidos los umbrales pertinentes de la tasa de filtración glomerular estimada [TFG estimada]).
Si el paciente tiene ERC en etapa 3 o 4 (es decir, con una TFG estimada <60 ml/min/1.73 m²) asociado con diabetes de tipo 2 con albuminuria, considere finerenona (un antagonista de los receptores de mineralocorticoides no esteroides) si:[134]National Institute for Health and Care Excellence. Finerenone for treating chronic kidney disease in type 2 diabetes. March 2023 [internet publication].
https://www.nice.org.uk/guidance/ta877
Se utiliza como complemento de la atención estándar optimizada (que debe incluir, a menos que no sean adecuadas, las dosis autorizadas más altas toleradas de IECA o antagonistas de los receptores de la angiotensina II e inhibidores de SGLT2) y
El paciente tiene una TFG estimada de ≥25 ml/min/1.73 m².
Si el paciente tiene ERC y requiere un fármaco antihipertensivo:
Siga las recomendaciones descritas en el apartado Manejo del riesgo cardiovascular, que también se aplican a personas sin ERC, si el paciente tiene una RAC ≤30 mg/mmol (categorías RAC A1 y A2).[86]National Institute for Health and Care Excellence. Chronic kidney disease: assessment and management. November 2021 [internet publication].
https://www.nice.org.uk/guidance/ng203
Administre un antagonista de los receptores de la angiotensina II o un IECA (ajustado a la dosis más alta autorizada que la persona pueda tolerar) si el paciente tiene un RAC >30 mg/mmol (categoría RAC A3 o superior).[86]National Institute for Health and Care Excellence. Chronic kidney disease: assessment and management. November 2021 [internet publication].
https://www.nice.org.uk/guidance/ng203
Siempre que sea posible, trate la hipertensión en personas con ERC con fármacos que se toman solo una vez al día.[82]National Institute for Health and Care Excellence. Hypertension in adults: diagnosis and management. Nov 2023 [internet publication].
https://www.nice.org.uk/guidance/ng136
Estos fármacos deben agregarse a la atención estándar optimizada (ver sección de farmacoterapia antihiperglucémica).
Los inhibidores de SGLT2 no son adecuados para todo el mundo y solo deben utilizarse dentro de su autorización de comercialización; algunos inhibidores de SGLT2 no están autorizados para esta indicación en algunas regiones, incluido el Reino Unido.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Estas recomendaciones del NICE se basan en la evidencia de los ensayos controlados aleatorizados que mostraron que:
Los inhibidores de SGLT2 reducen el riesgo de avance de la ERC, la mortalidad y los eventos cardiovasculares en adultos con diabetes tipo 2 y ERC.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[Evidencia A]61a0123d-3704-47cf-8cd7-ef9b0668234eguidelineA¿Cuál es la efectividad clínica de los inhibidores del cotransportador de sodio-glucosa-2 (SGLT2) como farmacoterapia complementaria para adultos con enfermedad renal crónica (ERC) y diabetes de tipo 2?[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Los antagonistas de los receptores de la angiotensina II reducen el riesgo de enfermedad renal terminal e insuficiencia cardíaca.[86]National Institute for Health and Care Excellence. Chronic kidney disease: assessment and management. November 2021 [internet publication].
https://www.nice.org.uk/guidance/ng203
No hay una diferencia clara entre los inhibidores IECA y los antagonistas de los receptores de la angiotensina II en una serie de resultados, como la enfermedad renal terminal, la mortalidad por cualquier causa, la mortalidad cardiovascular y el ingreso hospitalario.[86]National Institute for Health and Care Excellence. Chronic kidney disease: assessment and management. November 2021 [internet publication].
https://www.nice.org.uk/guidance/ng203
Las recomendaciones de farmacoterapia para pacientes con diabetes de tipo 2 y ERC proporcionadas por la guía de práctica clínica Kidney Disease: Improving Global Outcomes (KDIGO) de 2022 están alineadas en gran medida con las guías de práctica clínica del NICE descritas anteriormente.[135]Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2022 Clinical Practice Guideline for diabetes management in chronic kidney disease. Kidney Int. 2022 Nov;102(5s):S1-127.
https://www.kidney-international.org/article/S0085-2538(22)00507-5/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36272764?tool=bestpractice.com
También sugieren que se considere un antagonista del receptor de mineralocorticoides no esteroides con beneficio renal o cardiovascular comprobado para pacientes con diabetes de tipo 2, TGF estimada ≥25 ml/min/1.73 m², concentración sérica normal de potasio y proteinuria clínicamente importante, a pesar de la dosis máxima tolerada de un antagonista de los receptores de la angiotensina II o un IECA.[135]Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2022 Clinical Practice Guideline for diabetes management in chronic kidney disease. Kidney Int. 2022 Nov;102(5s):S1-127.
https://www.kidney-international.org/article/S0085-2538(22)00507-5/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36272764?tool=bestpractice.com
La United Kingdom Kidney Association (UKKA) recomienda en 2023 el uso de un inhibidor de SGLT2 en personas con diabetes de tipo 2 y ERC (independientemente de la enfermedad renal primaria, pero excluyendo a aquellas con enfermedad renal poliquística o receptores de trasplantes renales) que tengan:[136]Herrington WG, Frankel AH. UK Kidney Association clinical practice guideline: sodium-glucose co-transporter-2 (SGLT-2) inhibition in adults with kidney disease. Apr 2023 [internet publication].
https://guidelines.ukkidney.org
Una TFGe de 20-45 mL/min/1.73 m², o
Una TFGe de >45 mL/min/1.73 m² y un cociente de albúmina-creatinina en orina (CACu) de ≥25 mg/mmol (el cociente proteína/creatinina urinario de 35 mg/mmol puede considerarse equivalente), o
insuficiencia cardíaca sintomática, independientemente de la fracción de eyección, o
enfermedad coronaria establecida.
La UKKA también sugiere que, en las personas con diabetes de tipo 2 y ERC (excluyendo a los receptores de trasplantes renales), un inhibidor de SGLT2 debe ser:[136]Herrington WG, Frankel AH. UK Kidney Association clinical practice guideline: sodium-glucose co-transporter-2 (SGLT-2) inhibition in adults with kidney disease. Apr 2023 [internet publication].
https://guidelines.ukkidney.org
Se inicia si la TFG estimada es de >45-60 mL/min/1.73 m² y CACu es de <25 mg/mmol para modificar el riesgo cardiovascular y ralentizar la tasa de deterioro de la función renal (reconociendo que los efectos sobre el control glucémico serán limitados).
Se considera si la TFGe es de <20 mL/min/1.73 m² para retrasar el avance de la enfermedad renal, basándose en la evidencia de que este beneficio todavía se observa con una TFGe baja.
La UKKA recomienda que los inhibidores de SGLT2 se continúen hasta que se requiera diálisis.[136]Herrington WG, Frankel AH. UK Kidney Association clinical practice guideline: sodium-glucose co-transporter-2 (SGLT-2) inhibition in adults with kidney disease. Apr 2023 [internet publication].
https://guidelines.ukkidney.org
Las guías de la ESC de 2023 sobre el tratamiento de las ECV en la diabetes recomiendan tratar a los pacientes con diabetes de tipo 2 y ERC con un inhibidor de SGLT2 y/o finerenona, ya que estos reducen el riesgo cardiovascular y el riesgo de insuficiencia renal además de la atención estándar (p. ej., IECA o antagonista de los receptores de la angiotensina II).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
En concreto, además del uso de un IECA o un antagonista de los receptores de la angiotensina II, recomiendan el uso de:[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
En una actualización de 2023 de sus guías de práctica clínica sobre insuficiencia cardíaca, la ESC también hace recomendaciones para los inhibidores de SGLT2 y la finerenona en pacientes con diabetes de tipo 2 y ERC para reducir el riesgo de hospitalización por insuficiencia cardíaca (tanto inhibidores de SGLT2 como de finerenona) o muerte cardiovascular (inhibidores de SGLT2).[137]McDonagh TA, Metra M, Adamo M, et al. 2023 focused update of the 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2023 Oct 1;44(37):3627-39.
https://academic.oup.com/eurheartj/article/44/37/3627/7246292?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622666?tool=bestpractice.com
Niveles objetivo de glucemia y autocontrol
Los objetivos de HbA1c deben ser individualizados en todas las etapas del tratamiento; el paciente debe estar implicado en cualquier decisión sobre su objetivo individual de glucemia.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[138]Laiteerapong N, Cooper JM, Skandari MR, et al. Individualized glycemic control for US adults with type 2 diabetes: a cost-effectiveness analysis. Ann Intern Med. 2018 Feb 6;168(3):170-8.
http://www.ncbi.nlm.nih.gov/pubmed/29230472?tool=bestpractice.com
[139]Ismail-Beigi F, Moghissi E, Tiktin M, et al. Individualizing glycemic targets in type 2 diabetes mellitus: implications of recent clinical trials. Ann Intern Med. 2011 Apr 19;154(8):554-9.
http://www.ncbi.nlm.nih.gov/pubmed/21502652?tool=bestpractice.com
Los objetivos individualizados de HbA1c mejoran la calidad de vida en comparación con un control estricto y uniforme.[139]Ismail-Beigi F, Moghissi E, Tiktin M, et al. Individualizing glycemic targets in type 2 diabetes mellitus: implications of recent clinical trials. Ann Intern Med. 2011 Apr 19;154(8):554-9.
http://www.ncbi.nlm.nih.gov/pubmed/21502652?tool=bestpractice.com
En el Reino Unido, el NICE recomienda:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si el paciente maneja su diabetes de tipo 2 con el estilo de vida y la dieta, o con el estilo de vida y la dieta combinados con un único fármaco que no se asocie a la hipoglucemia, ayúdele a conseguir un nivel de HbA1c de 48 mmol/mol (6.5%)
Si el paciente está tomando un fármaco asociado a la hipoglucemia, ayúdele a alcanzar un nivel de HbA1c de 53 mmol/mol (7.0%).
La ESC recomienda un control glucémico estricto (HbA1c <7.0%; si es adecuado/capaz) para reducir las complicaciones microvasculares, y aconsejan considerar lo mismo para reducir la arteriopatía coronaria a largo plazo (preferiblemente utilizando fármacos con beneficio cardiovascular comprobado).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Considere un nivel de HbA1c ligeramente más elevado en cada caso para:[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Pacientes de edad avanzada o frágiles
Pacientes con pocas probabilidades de obtener beneficios de reducción de riesgo a largo plazo (p. ej., aquellos con una esperanza de vida reducida)
Pacientes para los que un control glucémico estricto supone un alto riesgo de sufrir las consecuencias de la hipoglucemia, incluidas personas con riesgo de caídas; personas con una conciencia reducida de la hipoglucemia; personas que conducen o manejan maquinaria como parte de su trabajo
Pacientes para los que el manejo intensivo no es adecuado (p. ej., personas con comorbilidades significativas).
Hay que tener en cuenta que los regímenes farmacológicos más adecuados para un paciente frágil, incluyendo la elección del fármaco y la dosis óptima, necesitarán una cuidadosa consideración y es probable que difieran de los recomendados para pacientes más jóvenes y en forma.[83]Strain WD, Hope SV, Green A, et al. Type 2 diabetes mellitus in older people: a brief statement of key principles of modern day management including the assessment of frailty – a national collaborative stakeholder initiative. Diabet Med. 2018 Jul;35(7):838-45.
https://onlinelibrary.wiley.com/doi/10.1111/dme.13644
http://www.ncbi.nlm.nih.gov/pubmed/29633351?tool=bestpractice.com
La ADA recomienda el uso de medicamentos con bajo riesgo de hipoglucemia para los adultos mayores, y la desintensificación y/o simplificación de los planes de tratamiento (dentro de los objetivos glucémicos individualizados) en esta población cuando los daños o las cargas del tratamiento puedan superar los beneficios.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Si el paciente conduce, asegúrese de que conoce los consejos locales pertinentes sobre el nivel de glucosa plasmática. En el Reino Unido, la Driver and Vehicle Licensing Agency aconseja alcanzar un nivel de al menos 5 mmol/L (90 mg/dL) antes de conducir.[140]Driver and Vehicle Licensing Agency. Information for drivers with diabetes. June 2021 [internet publication].
https://www.gov.uk/government/publications/information-for-drivers-with-diabetes
El autocontrol de los niveles de glucosa puede ayudar con el autocontrol y el ajuste de la medicación, especialmente en personas que toman insulina. Puede dar una idea del impacto del estilo de vida y del manejo de la medicación sobre la glucemia y los síntomas, especialmente cuando se combina con la educación y el soporte; los planes de la monitorización glucémica deben ser individualizados.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Tradicionalmente, el autocontrol implica medir los niveles de glucosa a partir de muestras de sangre capilar (autocontrol de la glucemia, SMBG) mediante pruebas de glucemia por punción en el dedo.
El NICE y la European Association for the Study of Diabetes/American Diabetes Association (EASD/ADA) recomiendan la SMBG como opción para las personas con diabetes de tipo 2 que utilizan insulina.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
El NICE también recomienda ofrecer sistemáticamente la SMBG a los adultos con diabetes de tipo 2 si:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Hay evidencia de episodios de hipoglucemia, o
El paciente está tomando una medicación oral que puede aumentar su riesgo de hipoglucemia mientras conduce o maneja maquinaria, o
La paciente está embarazada o planea quedarse embarazada.
El NICE recomienda considerar la SMBG a corto plazo en adultos con diabetes tipo 2 (y revisar el tratamiento según sea necesario):[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Al iniciar el tratamiento con corticoides orales o intravenosos, o bien
Para confirmar la sospecha de hipoglucemia.
Actualmente también se utiliza la nueva tecnología de monitorización continua de la glucosa (MCG). La MCG implica un dispositivo pequeño y desechable con un sensor subcutáneo constantemente adherido a la piel, que mide los niveles de glucosa en el líquido intersticial y envía las lecturas a un dispositivo de visualización o dispositivo inteligente.[141]Lewis DM, Oser TK, Wheeler BJ. Continuous glucose monitoring. BMJ. 2023 Mar 3;380:e072420.
http://www.ncbi.nlm.nih.gov/pubmed/36868576?tool=bestpractice.com
Los dispositivos de MCG pueden proporcionar datos en tiempo real (MCGtr) o datos escaneados de forma intermitente (MCGei). El MCG puede proporcionar más información que el SMBG, pero es posible que no esté disponible en todas las regiones para las personas con diabetes de tipo 2.
El NICE recomienda ofrecer MCG a adultos con diabetes de tipo 2 si:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La EASD/ADA también afirma que el MCG proporciona más información y tiene claras ventajas sobre la SMBG y puede ser útil para personas con diabetes de tipo 2, particularmente aquellas tratadas con insulina.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
La ADA recomienda el uso de MCG para las personas con diabetes que tienen un alto riesgo de hipoglucemia.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
El NICE señala que el MCG debe ser proporcionado por un equipo con experiencia en su uso y que se brinde apoyo y educación adecuados al paciente.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Aún será necesario realizar mediciones de glucosa en sangre capilar para verificar la precisión del dispositivo de MCG y deberán estar disponibles como respaldo en caso de que el dispositivo de MCG falle.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Farmacoterapia antihiperglucémica: principios generales
Si el paciente no puede alcanzar su objetivo individualizado de HbA1c con intervenciones sobre el estilo de vida, se recomienda la farmacoterapia para reducir el riesgo de complicaciones microvasculares (nefropatía, retinopatía, neuropatía) y macrovasculares (enfermedad de las arterias coronarias, cerebrovascular y vascular periférica).[142]UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. 1998 Sep 12;352(9131):854-65.
http://www.ncbi.nlm.nih.gov/pubmed/9742977?tool=bestpractice.com
[143]Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008 Oct 9;359(15):1577-89.
https://www.nejm.org/doi/full/10.1056/NEJMoa0806470
http://www.ncbi.nlm.nih.gov/pubmed/18784090?tool=bestpractice.com
En general, las estrategias farmacoterapéuticas globales han cambiado para centrarse en la mejora de los resultados de las enfermedades cardiovasculares y renales en lugar de estar dirigidas únicamente por el control glucémico. Esto se basa en evidencia de ensayos aleatorizados de alta calidad que demuestran los beneficios de algunos agentes en la enfermedad cardiovascular aterosclerótica (ECV), la insuficiencia cardíaca y la enfermedad renal crónica (ERC), en gran medida independientemente de su potencial para reducir la glucosa.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
En particular, los inhibidores de SGLT2 parecen tener beneficios en pacientes con diabetes de tipo 2 que tienen múltiples factores de riesgo de ECV, y tanto los inhibidores de SGLT2 como los agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) parecen beneficiosos en aquellos con ECV establecida y/o enfermedad renal.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[144]Patel A, MacMahon S, et al; ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. 2008 Jun 6;358(24):2560-72.
https://www.nejm.org/doi/full/10.1056/NEJMoa0802987
http://www.ncbi.nlm.nih.gov/pubmed/18539916?tool=bestpractice.com
[145]Gerstein HC, Miller ME, Byington RP, et al; Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. 2008 Jun 12;358(24):2545-59.
https://www.nejm.org/doi/full/10.1056/NEJMoa0802743
http://www.ncbi.nlm.nih.gov/pubmed/18539917?tool=bestpractice.com
[146]Li S, Vandvik PO, Lytvyn L, et al. SGLT-2 inhibitors or GLP-1 receptor agonists for adults with type 2 diabetes: a clinical practice guideline. BMJ. 2021 May 11;373:n1091.
https://www.bmj.com/content/373/bmj.n1091.long
http://www.ncbi.nlm.nih.gov/pubmed/33975892?tool=bestpractice.com
Además, la metformina probablemente tenga beneficios cardiovasculares.[147]Griffin SJ, Leaver JK, Irving GJ. Impact of metformin on cardiovascular disease: a meta-analysis of randomised trials among people with type 2 diabetes. Diabetologia. 2017 Sep;60(9):1620-9.
https://link.springer.com/article/10.1007%2Fs00125-017-4337-9
http://www.ncbi.nlm.nih.gov/pubmed/28770324?tool=bestpractice.com
En línea con las tendencias globales, el NICE ahora recomienda un enfoque para controlar la diabetes de tipo 2 que se aleja de uno que se centra únicamente en lograr objetivos individualizados de HbA1c, a uno que incorpora tratamientos que no solo reducen los niveles de glucemia, sino que también tienen beneficios cardiovasculares y renales comprobados.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Las recomendaciones de este tema se basan principalmente en el enfoque del NICE.
Cabe señalar que en estudios más antiguos, como ACCORD, ADVANCE y el Veterans Affairs Diabetes Trial (VADT), el uso de múltiples fármacos para lograr una HbA1c casi normal no fue beneficioso, o bien aumentó la mortalidad en pacientes con diabetes de tipo 2 con ECV o alto riesgo de ECV.[144]Patel A, MacMahon S, et al; ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. 2008 Jun 6;358(24):2560-72.
https://www.nejm.org/doi/full/10.1056/NEJMoa0802987
http://www.ncbi.nlm.nih.gov/pubmed/18539916?tool=bestpractice.com
[145]Gerstein HC, Miller ME, Byington RP, et al; Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. 2008 Jun 12;358(24):2545-59.
https://www.nejm.org/doi/full/10.1056/NEJMoa0802743
http://www.ncbi.nlm.nih.gov/pubmed/18539917?tool=bestpractice.com
[148]Gerstein HC, Miller ME, Genuth S, et al; ACCORD Study Group. Long-term effects of intensive glucose lowering on cardiovascular outcomes. N Engl J Med. 2011 Mar 3;364(9):818-28.
http://www.ncbi.nlm.nih.gov/pubmed/21366473?tool=bestpractice.com
[149]Reaven PD, Emanuele NV, Wiitala WL, et al; VADT Investigators. Intensive glucose control in patients with type 2 diabetes - 15-year follow-up. N Engl J Med. 2019 Jun 6;380(23):2215-24.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6706253
http://www.ncbi.nlm.nih.gov/pubmed/31167051?tool=bestpractice.com
[150]Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med. 2009 Jan 8;360(2):129-39.
https://www.nejm.org/doi/full/10.1056/NEJMoa0808431
http://www.ncbi.nlm.nih.gov/pubmed/19092145?tool=bestpractice.com
Sin embargo, no se disponía de inhibidores de SGLT2 y los agonistas del receptor de GLP-1 se utilizaron con poca frecuencia en esos estudios.
La elección de los agentes debe individualizarse, teniendo en cuenta las preferencias, necesidades y circunstancias clínicas del paciente (p. ej., peso, comorbilidades, riesgos de complicaciones), la efectividad del agente en términos de respuesta metabólica y protección cardiovascular y renal, efectos adversos y otros factores.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
A la hora de elegir, revisar y cambiar medicamentos, siempre:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si está indicado el tratamiento combinado, introduzca los medicamentos de forma gradual, verificando la tolerabilidad y eficacia de cada medicamento.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si un adulto con diabetes de tipo 2 presenta hiperglucemia sintomática en cualquier fase del tratamiento, considere el tratamiento de rescate con insulina o una sulfonilurea, y revise el tratamiento cuando se haya logrado el control glucémico.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Farmacoterapia antihiperglucémica: tratamiento inicial
El NICE ha elaborado un diagrama de flujo que resume sus recomendaciones para elegir medicamentos de primera línea en adultos con diabetes de tipo 2.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
NICE: Type 2 diabetes in adults: choosing medicines
Opens in new window
[Figure caption and citation for the preceding image starts]: Diabetes de tipo 2 en adultos: elección de medicamentos - cómo elegir medicamentos de primera líneaEl NICE NG28 (2022) Diabetes de tipo 2 en adultos: elección de medicamentos; usado con permiso [Citation ends].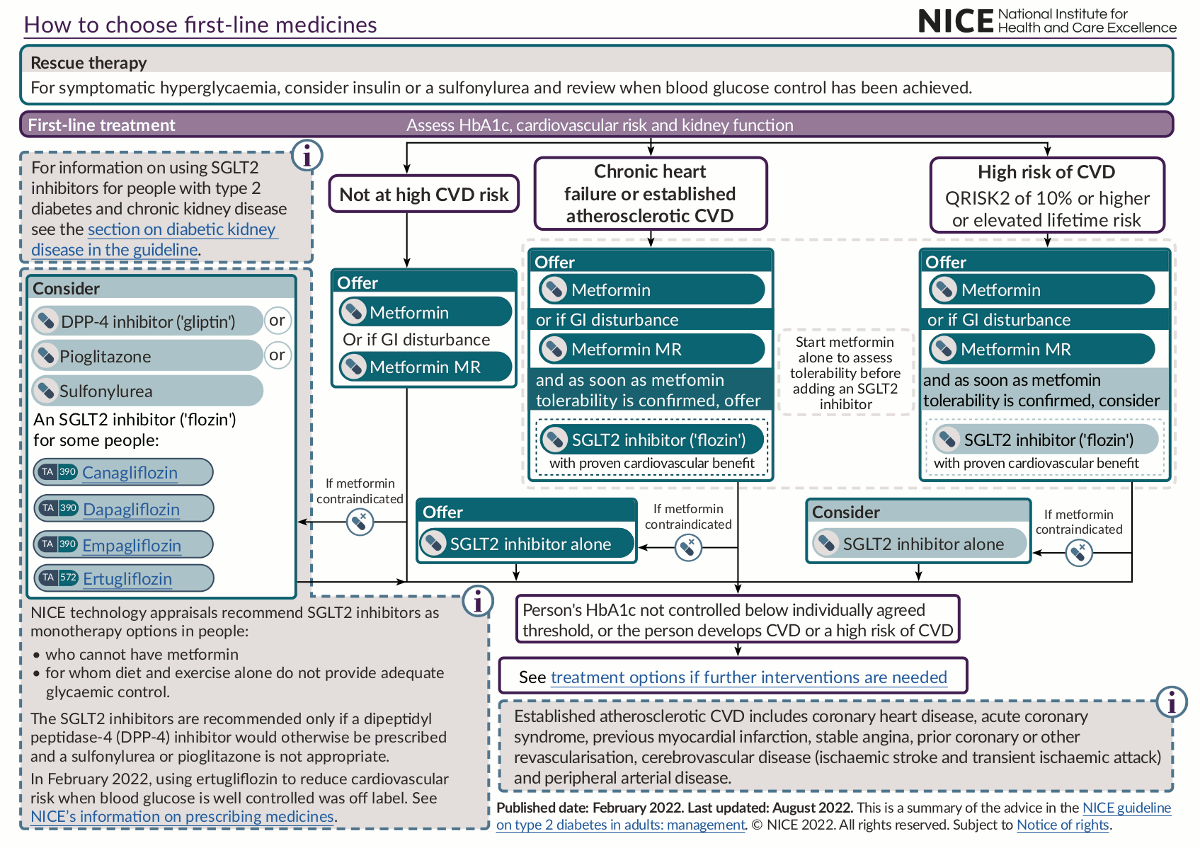
Evaluar la HbA1c, el riesgo cardiovascular y la función renal del paciente.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Determinar si el paciente tiene insuficiencia cardíaca crónica o enfermedad cardiovascular aterosclerótica establecida (ECV; incluye cardiopatía coronaria, síndrome coronario agudo, infarto de miocardio previo, angina estable, revascularización coronaria u otra revascularización previa, enfermedad cerebrovascular [accidente cerebrovascular isquémico y accidente isquémico transitorio] y enfermedad arterial periférica), o tiene un alto riesgo de desarrollar enfermedad cardiovascular. Utilice esta evaluación de riesgo cardiovascular para adaptar el tratamiento farmacológico.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
En su guía de práctica clínica sobre diabetes de tipo 2 (actualizada por última vez en 2022), el NICE recomienda utilizar QRISK2 para evaluar el riesgo de enfermedad cardiovascular en adultos con diabetes de tipo 2.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Sin embargo, la guía de práctica clínica del NICE de 2023 sobre ECV recomienda el uso de QRISK3. El NICE reconoce que puede ser necesario utilizar QRISK2 hasta que los sistemas clínicos electrónicos se actualicen con QRISK3.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
A continuación nos referimos a QRISK3 pero, en función de la disponibilidad local, tanto QRISK2 como QRISK3 son herramientas razonables para evaluar el riesgo de ECV en adultos con diabetes de tipo 2.
Tenga en cuenta que el NICE especifica determinadas poblaciones (por ejemplo, personas con enfermedades mentales graves) para las que se debe usar QRISK3, ya que QRISK2 puede subestimar el riesgo de ECV en estos pacientes.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Además, el NICE señala que cualquier herramienta de riesgo de ECV (incluido el QRISK3) puede subestimar el riesgo en algunos grupos (por ejemplo, los tratados por el VIH) y hacen hincapié en el uso del juicio clínico para interpretar las puntuaciones de riesgo.[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
El NICE no recomienda el uso de herramientas de riesgo de ECV para las personas con alto riesgo de ECV (p. ej., aquellas con TFGe <60 mL/min/1.73 m² y/o albuminuria).[125]National Institute for Health and Care Excellence. Cardiovascular disease: risk assessment and reduction, including lipid modification. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ng238/chapter/Recommendations
Metformina
Administrar metformina como tratamiento farmacológico de primera línea a todos los adultos con diabetes de tipo 2.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La dosis de metformina de liberación inmediata debe aumentarse gradualmente durante varias semanas para minimizar el riesgo de efectos adversos gastrointestinales.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si se producen alteraciones gastrointestinales con la metformina de liberación inmediata, se puede utilizar en su lugar una formulación de liberación modificada.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Sin embargo, la metformina de liberación modificada se asocia con una reducción de la HbA1c estadísticamente peor, pero probablemente clínicamente similar, y una mejora mínima de la intolerancia gastrointestinal en comparación con la metformina de liberación inmediata.[151]Abrilla AA, Pajes ANNI, Jimeno CA. Metformin extended-release versus metformin immediate-release for adults with type 2 diabetes mellitus: a systematic review and meta-analysis of randomized controlled trials. Diabetes Res Clin Pract. 2021 Aug;178:108824.
https://www.diabetesresearchclinicalpractice.com/article/S0168-8227(21)00183-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/33887354?tool=bestpractice.com
Si la metformina está contraindicada o no se tolera, el tratamiento farmacológico alternativo debe basarse en el perfil de riesgo cardiovascular del paciente.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si el paciente no tiene ECV o no tiene un alto riesgo de ECV, considere usar uno de los siguientes medicamentos en lugar de metformina:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Un inhibidor de la dipeptidil peptidasa-4 (DPP-4), o
Pioglitazona, o
Una sulfonilurea, o
Un inhibidor de SGLT2 (se recomienda un inhibidor de SGLT2 en algunas personas: aquellas en quienes la metformina está contraindicada o no se tolera, cuando la dieta y el ejercicio por sí solos no proporcionan un control glucémico adecuado, solo si de otro modo se prescribiría un inhibidor de DPP-4 y una sulfonilurea o pioglitazona no es adecuada).[152]National Institute for Health and Care Excellence. Canagliflozin, dapagliflozin and empagliflozin as monotherapies for treating type 2 diabetes. May 2016 [internet publication].
https://www.nice.org.uk/guidance/ta390
[153]National Institute for Health and Care Excellence. Ertugliflozin as monotherapy or with metformin for treating type 2 diabetes. March 2019 [internet publication].
https://www.nice.org.uk/guidance/ta572
Si el paciente tiene un alto riesgo de desarrollar enfermedad cardiovascular (edad ≥40 años con QRISK3 ≥10%, o edad <40 años con ≥1 factor de riesgo cardiovascular), considere un inhibidor de SGLT2 con beneficio cardiovascular comprobado (p. ej., canagliflozina, dapagliflozina, empagliflozina) en lugar de metformina.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si el paciente tiene insuficiencia cardíaca crónica o ECV aterosclerótica establecida, administre un inhibidor de SGLT2 con beneficio cardiovascular comprobado en lugar de metformina.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Antes de iniciar el tratamiento con un inhibidor del SGLT2 siempre:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Compruebe si el paciente tiene un mayor riesgo de cetoacidosis diabética (CAD), por ejemplo:
Han tenido un episodio previo de CAD
No se encuentran bien con enfermedades intercurrentes
El paciente sigue una dieta muy baja en carbohidratos o cetogénica.
Informar al paciente sobre el riesgo de CAD y abordar los factores de riesgo modificables de CAD; por ejemplo, para aquellos que siguen una dieta muy baja en carbohidratos o cetogénica puede ser necesario retrasar el tratamiento hasta que hayan cambiado su dieta.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Fármacos con beneficio cardiovascular y renal
A menos que la metformina esté contraindicada o no se tolere, tan pronto como se confirme la tolerabilidad de la metformina (después de aumentar gradualmente la dosis de metformina de liberación inmediata durante varias semanas):[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si el paciente tiene un alto riesgo de desarrollar ECV, considere un inhibidor de SGLT2 con beneficio cardiovascular comprobado además de metformina.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si el paciente tiene insuficiencia cardíaca crónica o ECV aterosclerótica establecida, agregue a su régimen de tratamiento un inhibidor de SGLT2 con beneficio cardiovascular comprobado, es decir, junto con metformina.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Estas recomendaciones se aplican en todas las etapas del tratamiento. Por lo tanto, si un paciente que originalmente no tenía ECV desarrolla ECV, agregue un inhibidor de SGLT2 con beneficio cardiovascular comprobado a su régimen de tratamiento existente o administre un inhibidor de SGLT2 en lugar de un fármaco existente.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Del mismo modo, si se descubre recientemente que un paciente tiene un alto riesgo de ECV, considere agregar un inhibidor de SGLT2 a sus tratamientos actuales o cambiar uno de sus medicamentos actuales por un inhibidor de SGLT2.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Aunque el NICE no recomienda los agonistas del receptor de GLP-1 como tratamiento de primera línea para la diabetes de tipo 2, una actualización de 2022 de un informe de consenso conjunto de la American Diabetes Association (ADA) y la Asociación Europea para el Estudio de la Diabetes (EASD) recomienda que la monoterapia con un agonista del receptor GLP-1 (p. ej., dulaglutida, exenatida, liraglutida, lixisenatida, semaglutida) o un inhibidor de SGLT2 puede considerarse como una alternativa a la metformina, según la evidencia sobre los beneficios cardiovasculares y renales de estas clases de fármacos, independientemente de sus efectos hipoglucemiantes.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[146]Li S, Vandvik PO, Lytvyn L, et al. SGLT-2 inhibitors or GLP-1 receptor agonists for adults with type 2 diabetes: a clinical practice guideline. BMJ. 2021 May 11;373:n1091.
https://www.bmj.com/content/373/bmj.n1091.long
http://www.ncbi.nlm.nih.gov/pubmed/33975892?tool=bestpractice.com
Específicamente, las ADA/EASD recomiendan:[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Se debe utilizar un agonista del receptor GLP-1 o un inhibidor de SGLT2 con beneficio comprobado en personas con ECV establecida, y se debe considerar en personas sin ECV establecida pero con múltiples factores de riesgo cardiovascular. En personas con insuficiencia cardíaca, se debe utilizar un inhibidor de SGLT2.
En personas con ERC y TFG estimada ≥20 ml/min/1.73 m² y una RAC en orina >3.0 mg/mmol (>30 mg/g), se debe iniciar un inhibidor de SGLT2 con beneficio comprobado. Las indicaciones y los umbrales de la TGF estimada pueden variar según la región. Si dicho tratamiento no se tolera o está contraindicado, se podría considerar un agonista del receptor de GLP-1 con beneficio comprobado en los resultados cardiovasculares y se debe continuar hasta que esté indicada la terapia de reemplazo renal.
En personas con insuficiencia cardíaca, ERC, ECV establecida o múltiples factores de riesgo de ECV, la decisión de utilizar agonistas del receptor de GLP-1 o inhibidores de SGLT2 con beneficio demostrado debe ser independiente del uso de base de metformina y de la HbA1c inicial.
El ESC hace recomendaciones muy similares a la ADA/EASD. La ESC recomienda el uso de un inhibidor de SGLT2 (con beneficio comprobado) en pacientes con diabetes de tipo 2 y ERC cuando la TFGe es de ≥20 mL/min/1.73 m² para reducir el riesgo de ECV e insuficiencia renal.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Además, recomiendan (independientemente de la HbA1c inicial/objetivo y de cualquier medicamento hipoglucemiante concomitante):[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Agonistas del receptor de GLP-1 e inhibidores de SGLT2, con beneficios cardiovasculares comprobados, para pacientes con diabetes de tipo 2 y ASCVD para reducir los eventos cardiovasculares. Además, aconsejan que se pueden considerar estos mismos fármacos, así como la metformina, para aquellas personas sin ASCVD o DOD graves, pero con un riesgo de ECV a 10 años ≥10%, para reducir el riesgo cardiovascular. Aconsejan que el tratamiento con metformina no debe ser un requisito previo para el uso de estos otros fármacos para el beneficio cardiovascular.
Inhibidores de SGLT2 (con beneficio demostrado) en pacientes con diabetes de tipo 2 e insuficiencia cardíaca (independientemente de la fracción de eyección), para reducir el riesgo de hospitalización por insuficiencia cardíaca o muerte cardiovascular.[137]McDonagh TA, Metra M, Adamo M, et al. 2023 focused update of the 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2023 Oct 1;44(37):3627-39.
https://academic.oup.com/eurheartj/article/44/37/3627/7246292?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622666?tool=bestpractice.com
Inhibidores de SGLT2 (con beneficio demostrado) en pacientes con diabetes de tipo 2 con múltiples factores de riesgo de ASCVD o ASCVD establecida, para reducir el riesgo de hospitalización por insuficiencia cardíaca.
Además, la ESC recomienda que si se necesita un manejo de la glucemia adicional para los pacientes con ASCVD tras el uso de medicamentos antidiabéticos con beneficios cardiovasculares comprobados (p. ej., inhibidores de SGLT2, agonistas del receptor GLP-1), se debe priorizar a los fármacos con seguridad cardiovascular comprobada sobre los fármacos sin evidencia de beneficio cardiovascular o seguridad.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
La ESC también recomienda que si se necesita un control glucémico adicional para pacientes con (o en riesgo de) insuficiencia cardíaca después del tratamiento con un inhibidor de SGLT2 (con beneficio comprobado), se deben considerar medicamentos antidiabéticos con efectos neutros sobre la insuficiencia cardíaca en ensayos de resultados cardiovasculares (CVOT, por sus siglas en inglés).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Las KDIGO señalan que si se requiere un control glucémico adicional en pacientes con diabetes de tipo 2 y ERC después del tratamiento de primera línea con metformina e inhibidores de SGLT2, generalmente se prefieren los agonistas del receptor de GLP-1.[135]Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2022 Clinical Practice Guideline for diabetes management in chronic kidney disease. Kidney Int. 2022 Nov;102(5s):S1-127.
https://www.kidney-international.org/article/S0085-2538(22)00507-5/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36272764?tool=bestpractice.com
Del mismo modo, la ESC recomienda el uso de un agonista del receptor de GLP-1 para el control glucémico adicional (si es necesario) en aquellas personas con ERC y TFGe >15 mL/min/1.73 m² (dado que estos fármacos conllevan un bajo riesgo de hipoglucemia y tienen efectos beneficiosos sobre el peso, el riesgo cardiovascular y la albuminuria).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
La actualización de UKKA 2023 sugiere iniciar un inhibidor de SGLT2 para pacientes con diabetes de tipo 2 y ERC (excluyendo a los receptores de trasplante renal) con una TFGe de >45-60 mL/min/1.73 m² (y el cociente albúmina/creatinina en orina <25 mg/mmol) para modificar el riesgo cardiovascular y ralentizar la tasa de deterioro de la función renal (basado en metanálisis de grandes ensayos clínicos aleatorizados, que muestran que los beneficios cardiovasculares y renales están presentes en un rango de TFGe).[136]Herrington WG, Frankel AH. UK Kidney Association clinical practice guideline: sodium-glucose co-transporter-2 (SGLT-2) inhibition in adults with kidney disease. Apr 2023 [internet publication].
https://guidelines.ukkidney.org
Señalan que los efectos sobre el control glucémico pueden ser limitados, ya que los efectos reductores de la glucosa de los inhibidores de SGLT2 se reducen con la disminución de la TFGe.[136]Herrington WG, Frankel AH. UK Kidney Association clinical practice guideline: sodium-glucose co-transporter-2 (SGLT-2) inhibition in adults with kidney disease. Apr 2023 [internet publication].
https://guidelines.ukkidney.org
Farmacoterapia antihiperglucémica: escalada de la terapia
El NICE ha elaborado un diagrama de flujo que resume sus recomendaciones para elegir medicamentos para el tratamiento posterior en adultos con diabetes de tipo 2.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
NICE: Type 2 diabetes in adults: choosing medicines
Opens in new window
[Figure caption and citation for the preceding image starts]: Diabetes de tipo 2 en adultos: elección de medicamentos - cómo elegir medicamentos para el tratamiento posteriorEl NICE NG28 (2022) Diabetes de tipo 2 en adultos: elección de medicamentos; usado con permiso [Citation ends].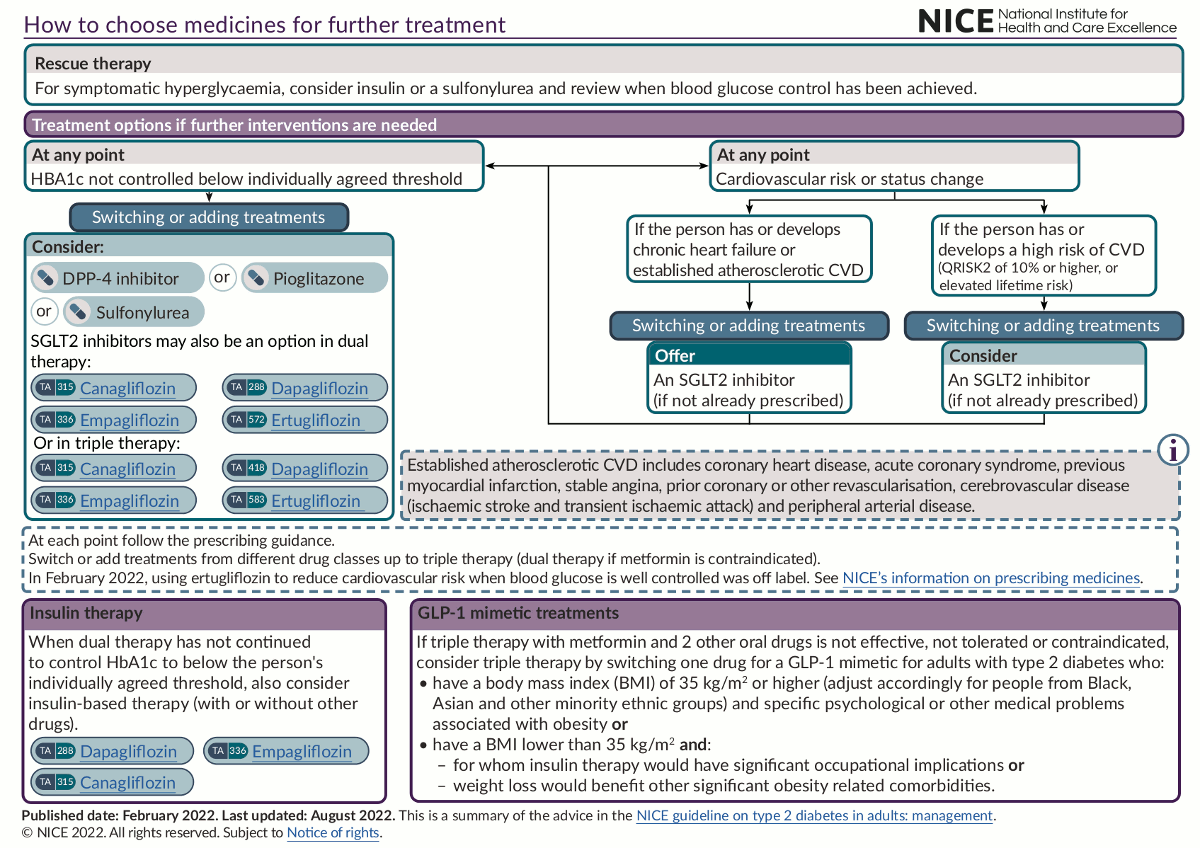
Si la HbA1c del paciente no se controla por debajo del umbral acordado individualmente, puede ser adecuado cambiar o agregar tratamientos. Los medicamentos deben introducirse de forma gradual, comprobando la tolerabilidad y eficacia de cada uno de ellos.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si el tratamiento inicial no ha seguido controlando la HbA1c por debajo del umbral acordado individualmente por la persona para una intervención adicional, considere cambiar o agregar:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Un inhibidor de DPP-4[153]National Institute for Health and Care Excellence. Ertugliflozin as monotherapy or with metformin for treating type 2 diabetes. March 2019 [internet publication].
https://www.nice.org.uk/guidance/ta572
[154]National Institute for Health and Care Excellence. Canagliflozin in combination therapy for treating type 2 diabetes. June 2014 [internet publication].
https://www.nice.org.uk/guidance/ta315
[155]National Institute for Health and Care Excellence. Empagliflozin in combination therapy for treating type 2 diabetes. March 2015 [internet publication].
https://www.nice.org.uk/guidance/ta336
[156]National Institute for Health and Care Excellence. Dapagliflozin in combination therapy for treating type 2 diabetes. Nov 2016 [internet publication].
https://www.nice.org.uk/guidance/ta288
Pioglitazona
Una sulfonilurea, o
Un inhibidor de SGLT2.[154]National Institute for Health and Care Excellence. Canagliflozin in combination therapy for treating type 2 diabetes. June 2014 [internet publication].
https://www.nice.org.uk/guidance/ta315
[155]National Institute for Health and Care Excellence. Empagliflozin in combination therapy for treating type 2 diabetes. March 2015 [internet publication].
https://www.nice.org.uk/guidance/ta336
[156]National Institute for Health and Care Excellence. Dapagliflozin in combination therapy for treating type 2 diabetes. Nov 2016 [internet publication].
https://www.nice.org.uk/guidance/ta288
[157]National Institute for Health and Care Excellence. Ertugliflozin with metformin and a dipeptidyl peptidase-4 inhibitor for treating type 2 diabetes. Jun 2019 [internet publication].
https://www.nice.org.uk/guidance/TA583
Si la terapia dual con metformina y otro fármaco oral no ha seguido controlando la HbA1c por debajo del umbral acordado individualmente por el paciente para una intervención adicional, considere:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si la metformina está contraindicada o no se tolera y la terapia dual con 2 fármacos orales no ha seguido controlando la HbA1c por debajo del umbral de intervención acordado individualmente por el paciente, considere el tratamiento basado en insulina (ver Farmacoterapia antihiperglucémica: tratamientos basados en insulina).[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si la terapia triple con metformina y otros 2 fármacos orales no es eficaz, no se tolera o está contraindicada, considere la terapia triple cambiando un fármaco por un agonista del receptor GLP-1 o tirzepatida (un polipéptido insulinotrópico (GIP)/agonista del receptor GLP-1 dependiente de glucosa dual) en:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[159]National Institute for Health and Care Excellence. Tirzepatide for treating type 2 diabetes. Oct 2023 [internet publication].
https://www.nice.org.uk/guidance/ta924/chapter/1-Recommendations
Pacientes que tienen un IMC ≥35 kg/m² (ajustar en consecuencia para personas de raza negra, asiática y otros grupos étnicos minoritarios) y problemas psicológicos u otros problemas médicos específicos asociados con la obesidad, o
Aquellos con un IMC <35 kg/m² y para quienes el tratamiento con insulina tendría implicaciones ocupacionales importantes, o la pérdida de peso beneficiaría otras comorbilidades importantes relacionadas con la obesidad.
Cabe destacar que la ADA recomienda que se prefiera un agonista del receptor GLP-1 o un agonista doble de GIP/GLP-1 en lugar de la insulina cuando se requiere un mayor control glucémico para los adultos con diabetes de tipo 2.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Advertencias
Considere cuidadosamente las combinaciones de medicamentos, asegurándose de que son seguras y adecuadas para su paciente. Si es posible, evite combinar la insulina con la pioglitazona. La Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido (MHRA) advierte que se debe observar la evolución de los pacientes para detectar signos y síntomas de insuficiencia cardíaca, aumento de peso y edema si la pioglitazona se utiliza en combinación con la insulina. Esto se debe al aumento de la incidencia de la insuficiencia cardíaca cuando la pioglitazona se utiliza en combinación con la insulina, especialmente en pacientes con factores predisponentes.[160]Medicines and Healthcare products Regulatory Agency. Insulin combined with pioglitazone: risk of cardiac failure. December 2014 [internet publication].
https://www.gov.uk/drug-safety-update/insulin-combined-with-pioglitazone-risk-of-cardiac-failure
Ofrezca solo un agonista del receptor de GLP-1 en combinación con insulina con el asesoramiento de un especialista y el soporte continuo de un equipo multidisciplinar dirigido por un especialista.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) advierte de casos de cetoacidosis diabética en pacientes con diabetes tipo 2 tratados con una combinación de un agonista del receptor GLP-1 e insulina, en los cuales las dosis de insulina concomitante fueron rápidamente reducidas o suspendidas.[161]Medicines and Healthcare products Regulatory Agency. GLP-1 receptor agonists: reports of diabetic ketoacidosis when concomitant insulin was rapidly reduced or discontinued. June 2019 [internet publication].
https://www.gov.uk/drug-safety-update/glp-1-receptor-agonists-reports-of-diabetic-ketoacidosis-when-concomitant-insulin-was-rapidly-reduced-or-discontinued
La MHRA advierte que no se puede descartar el mismo riesgo para el agonista dual del receptor GIP/GLP-1, la tirzepatida, y se debe tener la precaución adecuada si se utiliza en combinación con insulina.
Tenga en cuenta que las recomendaciones de fármacos con beneficio cardiovascular y renal se aplican en todas las etapas del tratamiento. Por lo tanto, si un paciente que originalmente no tenía ECV desarrolla ECV, agregue un inhibidor de SGLT2 con beneficio cardiovascular comprobado a su régimen de tratamiento existente o administre un inhibidor de SGLT2 en lugar de un fármaco existente.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Del mismo modo, si se descubre recientemente que un paciente tiene un alto riesgo de ECV, considere agregar un inhibidor de SGLT2 a sus tratamientos actuales o cambiar uno de sus medicamentos actuales por un inhibidor de SGLT2.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Propiedades clínicas de los fármacos antihiperglucémicos específicos
Seleccione los fármacos en función de cada caso, tras una cuidadosa conversación con el paciente sobre los pros y los contras de cada opción. Pueden preferirse los agentes que ofrecen protección cardiovascular y renal y reducen la mortalidad cardiovascular o por todas las causas.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Metformina
La metformina es un "sensibilizador" de la insulina que se administra por vía oral.[162]Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020 Jan 7;41(2):255-323.
https://www.doi.org/10.1093/eurheartj/ehz486
http://www.ncbi.nlm.nih.gov/pubmed/31497854?tool=bestpractice.com
Es muy eficaz para reducir los niveles de glucemia, conlleva un riesgo mínimo de hipoglucemia cuando se utiliza como monoterapia, es neutral en cuanto al peso (con el potencial de una pérdida de peso modesta), tiene un buen perfil de seguridad y existe experiencia a largo plazo sobre su uso.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[163]Tsapas A, Karagiannis T, Kakotrichi P, et al. Comparative efficacy of glucose-lowering medications on body weight and blood pressure in patients with type 2 diabetes: a systematic review and network meta-analysis. Diabetes Obes Metab. 2021 Sep;23(9):2116-24.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.14451
http://www.ncbi.nlm.nih.gov/pubmed/34047443?tool=bestpractice.com
[164]Tsapas A, Avgerinos I, Karagiannis T, et al. Comparative effectiveness of glucose-lowering drugs for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med. 2020 Aug 18;173(4):278-86.
https://www.acpjournals.org/doi/10.7326/M20-0864?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32598218?tool=bestpractice.com
Estas propiedades, junto con su coste favorable, hacen que sea generalmente el agente de primera elección recomendado en pacientes con diabetes de tipo 2 (sin embargo, hay que tener en cuenta que algunas guías de práctica clínica como las de la ESC en 2023 abogan por el uso de otros fármacos de primera línea cuando el paciente tiene factores de riesgo adicionales específicos o comorbilidades como ASCVD o ERC).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Es probable que la metformina tenga efectos beneficiosos sobre los eventos cardiovasculares adversos graves (p. ej., infarto de miocardio, accidente cerebrovascular, muerte cardiovascular) y la mortalidad por cualquier causa, y es probable que su uso a largo plazo mejore el pronóstico cardiovascular (aunque la ESC advierte que los beneficios cardiovasculares de la metformina no son concluyentes).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[142]UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. 1998 Sep 12;352(9131):854-65.
http://www.ncbi.nlm.nih.gov/pubmed/9742977?tool=bestpractice.com
[143]Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008 Oct 9;359(15):1577-89.
https://www.nejm.org/doi/full/10.1056/NEJMoa0806470
http://www.ncbi.nlm.nih.gov/pubmed/18784090?tool=bestpractice.com
[147]Griffin SJ, Leaver JK, Irving GJ. Impact of metformin on cardiovascular disease: a meta-analysis of randomised trials among people with type 2 diabetes. Diabetologia. 2017 Sep;60(9):1620-9.
https://link.springer.com/article/10.1007%2Fs00125-017-4337-9
http://www.ncbi.nlm.nih.gov/pubmed/28770324?tool=bestpractice.com
[165]Monami M, Candido R, Pintaudi B, et al. Effect of metformin on all-cause mortality and major adverse cardiovascular events: an updated meta-analysis of randomized controlled trials. Nutr Metab Cardiovasc Dis. 2021 Mar 10;31(3):699-704.
https://www.nmcd-journal.com/article/S0939-4753(20)30508-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/33549430?tool=bestpractice.com
La metformina parece tener un efecto neutral sobre la insuficiencia cardíaca y la enfermedad renal diabética.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
La metformina puede utilizarse con seguridad (con una posible reducción de la dosis) en pacientes con tasas de filtración glomerular estimada (TFGe) reducidas con una monitorización cuidadosa, pero está contraindicada si la TFG estimada es inferior a 30 mL/minuto/1.73 m².[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[135]Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2022 Clinical Practice Guideline for diabetes management in chronic kidney disease. Kidney Int. 2022 Nov;102(5s):S1-127.
https://www.kidney-international.org/article/S0085-2538(22)00507-5/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36272764?tool=bestpractice.com
[166]de Boer IH, Khunti K, Sadusky T, et al. Diabetes management in chronic kidney disease: a consensus report by the American Diabetes Association (ADA) and kidney disease: improving global outcomes (KDIGO). Diabetes Care. 2022 Dec 1;45(12):3075-90.
https://diabetesjournals.org/care/article/45/12/3075/147614/Diabetes-Management-in-Chronic-Kidney-Disease-A
http://www.ncbi.nlm.nih.gov/pubmed/36189689?tool=bestpractice.com
Los efectos adversos gastrointestinales son frecuentes con la metformina.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Los niveles disminuidos o deficientes de vitamina B12 también son un efecto secundario común reconocido del tratamiento, especialmente en aquellos que reciben una dosis más alta o una duración de tratamiento más prolongada y en aquellos con factores de riesgo existentes.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[167]Medicines and Healthcare products Regulatory Agency. Metformin and reduced vitamin B12 levels: new advice for monitoring patients at risk. June 2022 [internet publication].
https://www.gov.uk/drug-safety-update/metformin-and-reduced-vitamin-b12-levels-new-advice-for-monitoring-patients-at-risk
Inhibidores del SGLT2
Los inhibidores de SGLT2 son inhibidores de la recaptación renal de glucosa.[162]Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020 Jan 7;41(2):255-323.
https://www.doi.org/10.1093/eurheartj/ehz486
http://www.ncbi.nlm.nih.gov/pubmed/31497854?tool=bestpractice.com
Son fármacos orales y los ejemplos incluyen canagliflozina, dapagliflozina, empagliflozina y ertugliflozina.
Tienen un efecto reductor de la glucosa de intermedio a alto, con menor eficacia glucémica con TFG estimadas más bajas.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[164]Tsapas A, Avgerinos I, Karagiannis T, et al. Comparative effectiveness of glucose-lowering drugs for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med. 2020 Aug 18;173(4):278-86.
https://www.acpjournals.org/doi/10.7326/M20-0864?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32598218?tool=bestpractice.com
No aumentan el riesgo de hipoglucemia, y se asocian con una pérdida de peso moderada (2-3 kg) en la práctica clínica.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[163]Tsapas A, Karagiannis T, Kakotrichi P, et al. Comparative efficacy of glucose-lowering medications on body weight and blood pressure in patients with type 2 diabetes: a systematic review and network meta-analysis. Diabetes Obes Metab. 2021 Sep;23(9):2116-24.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.14451
http://www.ncbi.nlm.nih.gov/pubmed/34047443?tool=bestpractice.com
Provocan glucosuria renal y tienen efecto diurético, lo que reduce la presión arterial.[168]Scheen AJ. Pharmacodynamics, efficacy and safety of sodium-glucose co-transporter type 2 (SGLT2) inhibitors for the treatment of type 2 diabetes mellitus. Drugs. 2015 Jan;75(1):33-59.
http://www.ncbi.nlm.nih.gov/pubmed/25488697?tool=bestpractice.com
También existe evidencia considerable que respalda los beneficios de inhibidores específicos de SGLT2 en la reducción de eventos cardíacos adversos importantes, infarto de miocardio, hospitalización por insuficiencia cardíaca, muerte cardiovascular, mortalidad por cualquier causa y mejora de los resultados renales, en pacientes con diabetes de tipo 2 con enfermedad establecida/alto riesgo de ECV.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[169]Palmer SC, Tendal B, Mustafa RA, et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ. 2021 Jan 13;372:m4573.
https://www.bmj.com/content/372/bmj.m4573.long
http://www.ncbi.nlm.nih.gov/pubmed/33441402?tool=bestpractice.com
Los beneficios son en gran medida independientes de su efecto reductor de glucosa.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Específicamente, se ha demostrado que la canagliflozina y la empagliflozina tienen efectos beneficiosos sobre los eventos cardíacos adversos importantes y la mortalidad cardiovascular; la canagliflozina, la dapagliflozina, la empagliflozina y la ertugliflozina han mostrado efectos beneficiosos sobre la insuficiencia cardíaca; y la canagliflozina, la dapagliflozina y la empagliflozina han demostrado efectos renales beneficiosos, incluso en el avance de la enfermedad renal diabética y en la prevención de resultados renales importantes (diálisis, trasplante o muerte por enfermedad renal).[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[170]Zelniker TA, Wiviott SD, Raz I, et al. Comparison of the effects of glucagon-like peptide receptor agonists and sodium-glucose cotransporter 2 inhibitors for prevention of major adverse cardiovascular and renal outcomes in type 2 diabetes mellitus. Circulation. 2019 Apr 23;139(17):2022-31.
http://www.ncbi.nlm.nih.gov/pubmed/30786725?tool=bestpractice.com
[171]Neal B, Perkovic V, Mahaffey KW, et al; CANVAS Program Collaborative Group. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017 Aug 17;377(7):644-57.
http://www.nejm.org/doi/full/10.1056/NEJMoa1611925#t=article
http://www.ncbi.nlm.nih.gov/pubmed/28605608?tool=bestpractice.com
[172]Cherney DZ, Zinman B, Inzucchi SE, et al. Effects of empagliflozin on the urinary albumin-to-creatinine ratio in patients with type 2 diabetes and established cardiovascular disease: an exploratory analysis from the EMPA-REG OUTCOME randomised, placebo-controlled trial. Lancet Diabetes Endocrinol. 2017 Aug;5(8):610-21.
http://www.ncbi.nlm.nih.gov/pubmed/28666775?tool=bestpractice.com
[173]Mahaffey KW, Jardine MJ, Bompoint S, et al. Canagliflozin and cardiovascular and renal outcomes in type 2 diabetes mellitus and chronic kidney disease in primary and secondary cardiovascular prevention groups. Circulation. 2019 Aug 27;140(9):739-50.
https://www.ahajournals.org/doi/full/10.1161/CIRCULATIONAHA.119.042007
http://www.ncbi.nlm.nih.gov/pubmed/31291786?tool=bestpractice.com
[174]Zelniker TA, Wiviott SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet. 2019 Jan 5;393(10166):31-39.
http://www.ncbi.nlm.nih.gov/pubmed/30424892?tool=bestpractice.com
[175]Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med. 2019 Jun 13;380(24):2295-306.
https://www.nejm.org/doi/10.1056/NEJMoa1811744
http://www.ncbi.nlm.nih.gov/pubmed/30990260?tool=bestpractice.com
[176]Zinman B, Wanner C, Lachin JM, et al; EMPA-REG OUTCOME Investigators. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015 Nov 26;373(22):2117-28.
https://www.nejm.org/doi/10.1056/NEJMoa1504720?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dwww.ncbi.nlm.nih.gov
http://www.ncbi.nlm.nih.gov/pubmed/26378978?tool=bestpractice.com
[177]Mahaffey KW, Neal B, Perkovic V, et al; CANVAS Program Collaborative Group. Canagliflozin for primary and secondary prevention of cardiovascular events: results from the CANVAS program (Canagliflozin Cardiovascular Assessment Study). Circulation. 2018 Jan 23;137(4):323-34.
https://www.ahajournals.org/doi/full/10.1161/circulationaha.117.032038
http://www.ncbi.nlm.nih.gov/pubmed/29133604?tool=bestpractice.com
[178]Rådholm K, Figtree G, Perkovic V, et al. Canagliflozin and heart failure in type 2 diabetes mellitus. Circulation. 2018 Jul 31;138(5):458-68.
https://www.ahajournals.org/doi/full/10.1161/CIRCULATIONAHA.118.034222
http://www.ncbi.nlm.nih.gov/pubmed/29526832?tool=bestpractice.com
[179]Wiviott SD, Raz I, Bonaca MP, et al; DECLARE–TIMI 58 Investigators. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2019 Jan 24;380(4):347-57.
https://www.nejm.org/doi/full/10.1056/NEJMoa1812389
http://www.ncbi.nlm.nih.gov/pubmed/30415602?tool=bestpractice.com
[180]Neuen BL, Young T, Heerspink HJL, et al. SGLT2 inhibitors for the prevention of kidney failure in patients with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2019 Nov;7(11):845-54.
http://www.ncbi.nlm.nih.gov/pubmed/31495651?tool=bestpractice.com
El análisis de los datos sugiere que los inhibidores de SGLT2 tienen efectos beneficiosos sobre los resultados relacionados con la insuficiencia cardíaca en personas con insuficiencia cardíaca, independientemente de la fracción de eyección o el estado de la diabetes.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[181]Kato ET, Silverman MG, Mosenzon O, et al. Effect of dapagliflozin on heart failure and mortality in type 2 diabetes mellitus. Circulation. 2019 May 28;139(22):2528-36.
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.119.040130
http://www.ncbi.nlm.nih.gov/pubmed/30882238?tool=bestpractice.com
[182]Figtree GA, Rådholm K, Barrett TD, et al. Effects of canagliflozin on heart failure outcomes associated with preserved and reduced ejection fraction in type 2 diabetes mellitus. Circulation. 2019 May 28;139(22):2591-3.
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.119.040057
http://www.ncbi.nlm.nih.gov/pubmed/30882240?tool=bestpractice.com
[183]McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med. 2019 Nov 21;381(21):1995-2008.
https://www.nejm.org/doi/10.1056/NEJMoa1911303
http://www.ncbi.nlm.nih.gov/pubmed/31535829?tool=bestpractice.com
[184]National Institute for Health and Care Excellence. Dapagliflozin for treating chronic heart failure with reduced ejection fraction. February 2021 [internet publication].
https://www.nice.org.uk/guidance/TA679
[185]Vaduganathan M, Docherty KF, Claggett BL, et al. SGLT-2 inhibitors in patients with heart failure: a comprehensive meta-analysis of five randomised controlled trials. Lancet. 2022 Sep 3;400(10354):757-67.
https://pubmed.ncbi.nlm.nih.gov/36041474
http://www.ncbi.nlm.nih.gov/pubmed/36041474?tool=bestpractice.com
[186]Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med. 2020 Oct 8;383(15):1413-24.
https://www.nejm.org/doi/10.1056/NEJMoa2022190?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32865377?tool=bestpractice.com
[187]Chen C, Peng H, Li M, et al. Patients with type 2 diabetes mellitus and heart failure benefit more from sodium-glucose cotransporter 2 inhibitor: a systematic review and meta-analysis. Front Endocrinol (Lausanne). 2021 Oct 25:12:664533.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8572881
http://www.ncbi.nlm.nih.gov/pubmed/34759887?tool=bestpractice.com
Además, un metanálisis de datos de ensayos aleatorizados controlados mostró que los inhibidores de SGLT2 reducen el riesgo de hiperpotasemia grave en personas con diabetes de tipo 2 con alto riesgo cardiovascular o con enfermedad renal crónica, sin aumentar el riesgo de hipopotasemia.[188]Neuen BL, Oshima M, Agarwal R, et al. Sodium-glucose cotransporter 2 inhibitors and risk of hyperkalemia in people with type 2 diabetes: a meta-analysis of individual participant data from randomized, controlled trials. Circulation. 2022 May 10;145(19):1460-70.
https://www.ahajournals.org/doi/full/10.1161/CIRCULATIONAHA.121.057736?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/35394821?tool=bestpractice.com
Hasta la fecha, existe mayor incertidumbre sobre los beneficios cardiovasculares asociados con ertugliflozina que con otros inhibidores de SGLT2.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
[189]Cinti F, Moffa S, Impronta F, et al. Spotlight on ertugliflozin and its potential in the treatment of type 2 diabetes: evidence to date. Drug Des Devel Ther. 2017 Oct 3;11:2905-19.
https://www.dovepress.com/spotlight-on-ertugliflozin-and-its-potential-in-the-treatment-of-type--peer-reviewed-fulltext-article-DDDT
http://www.ncbi.nlm.nih.gov/pubmed/29042751?tool=bestpractice.com
En su guía de práctica clínica sobre la diabetes de tipo 2, el NICE aconsejó que la ertugliflozina no mostró una reducción consistente de la insuficiencia cardíaca frente al placebo en el metanálisis de la red, ni fue estadísticamente significativamente mejor que el placebo para el resultado de eventos cardiovasculares adversos mayores (MACE) de 3 puntos (que comprende muerte cardiovascular, infarto de miocardio no fatal y accidente cerebrovascular no fatal).[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Además, un ensayo aleatorizado de fase 3, doble ciego, evaluó los efectos de la ertugliflozina frente al placebo en los resultados cardiovasculares y renales en personas con diabetes de tipo 2 y enfermedad cardiovascular aterosclerótica establecida; los resultados mostraron no inferioridad con respecto al placebo en el resultado primario de eventos cardiovasculares adversos importantes, pero ninguna superioridad en los resultados cardiovasculares y renales secundarios clave.[190]ClinicalTrials.gov. Cardiovascular outcomes following ertugliflozin treatment in type 2 diabetes mellitus participants with vascular disease: the VERTIS CV study (MK-8835-004). April 2019 [internet publication].
https://clinicaltrials.gov/ct2/show/NCT01986881
[191]Cannon CP, Pratley R, Dagogo-Jack S, et al. Cardiovascular outcomes with ertugliflozin in type 2 diabetes. N Engl J Med. 2020 Oct 8;383(15):1425-35.
https://www.nejm.org/doi/10.1056/NEJMoa2004967?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32966714?tool=bestpractice.com
Los inhibidores de SGLT-2 se asocian con un mayor riesgo de infecciones genitales micóticas (generalmente leves y tratables) y un mayor riesgo de cetoacidosis diabética (aunque la incidencia es baja).[73]Medicines and Healthcare products Regulatory Agency. SGLT2 inhibitors: updated advice on the risk of diabetic ketoacidosis. April 2016 [internet publication].
https://www.gov.uk/drug-safety-update/sglt2-inhibitors-updated-advice-on-the-risk-of-diabetic-ketoacidosis
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[192]Ueda P, Svanström H, Melbye M, et al. Sodium glucose cotransporter 2 inhibitors and risk of serious adverse events: nationwide register based cohort study. BMJ. 2018 Nov 14;363:k4365.
https://www.bmj.com/content/363/bmj.k4365.long
http://www.ncbi.nlm.nih.gov/pubmed/30429124?tool=bestpractice.com
[193]Erondu N, Desai M, Ways K, et al. Diabetic ketoacidosis and related events in the canagliflozin type 2 diabetes clinical program. Diabetes Care. 2015 Sep;38(9):1680-6.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4542268
http://www.ncbi.nlm.nih.gov/pubmed/26203064?tool=bestpractice.com
[194]Peters AL, Buschur EO, Buse JB, et al. Euglycemic diabetic ketoacidosis: a potential complication of treatment with sodium-glucose cotransporter 2 inhibition. Diabetes Care. 2015 Sep;38(9):1687-93.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4542270
http://www.ncbi.nlm.nih.gov/pubmed/26078479?tool=bestpractice.com
[195]Fleming N, Hamblin PS, Story D, et al. Evolving evidence of diabetic ketoacidosis in patients taking sodium-glucose cotransporter 2 inhibitors. J Clin Endocrinol Metab. 2020 Aug 1;105(8):dgaa200.
https://academic.oup.com/jcem/article/105/8/2475/5821255?login=false
http://www.ncbi.nlm.nih.gov/pubmed/32302001?tool=bestpractice.com
La Administración de Medicamentos y Alimentos de EE. UU. (FDA) ha emitido una advertencia sobre el riesgo de daño renal agudo con canagliflozina y dapagliflozina.[196]US Food and Drug Administration (FDA). FDA drug safety communication: FDA strengthens kidney warnings for diabetes medicines canagliflozin (Invokana, Invokamet) and dapagliflozin (Farxiga, Xigduo XR). June 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-strengthens-kidney-warnings-diabetes-medicines-canagliflozin
La MHRA y la Agencia Europea de Medicamentos (EMA) advierten sobre un mayor riesgo de amputación de miembros inferiores (principalmente dedos de los pies) en pacientes con diabetes de tipo 2 que toman canagliflozina, y la MHRA enfatiza la importancia del cuidado preventivo de los pies para todos los pacientes con diabetes.[197]European Medicines Agency. SGLT2 inhibitors: information on potential risk of toe amputation to be included in prescribing information. February 2017 [internet publication].
https://www.ema.europa.eu/en/documents/referral/sglt2-inhibitors-previously-canagliflozin-article-20-procedure-sglt2-inhibitors-information_en-0.pdf
[198]Medicines and Healthcare products Regulatory Agency. SGLT2 inhibitors: updated advice on increased risk of lower-limb amputation (mainly toes). March 2017 [internet publication].
https://www.gov.uk/drug-safety-update/sglt2-inhibitors-updated-advice-on-increased-risk-of-lower-limb-amputation-mainly-toes
Por lo tanto, los pacientes con úlceras en los pies o con alto riesgo de amputación deben recibir educación integral sobre el cuidado de los pies mientras reciben tratamiento con inhibidores de SGLT2. Las guías de práctica clínica de la EASD/ADA sobre el tratamiento de la hiperglucemia en la diabetes de tipo 2 señalan que, si bien los primeros estudios resaltaron posibles inquietudes relativas a la seguridad relacionados con los inhibidores de SGLT2, incluido el daño renal agudo y la amputación, los estudios a más largo plazo que han evaluado y monitoreado prospectivamente estos eventos no han observado un desequilibrio importante en los riesgos.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[199]Dorsey-Treviño EG, González-González JG, Alvarez-Villalobos N, et al. Sodium-glucose cotransporter 2 (SGLT-2) inhibitors and microvascular outcomes in patients with type 2 diabetes: systematic review and meta-analysis. J Endocrinol Invest. 2020 Mar;43(3):289-304.
http://www.ncbi.nlm.nih.gov/pubmed/31489568?tool=bestpractice.com
La MHRA y la FDA también advierten de casos de fascitis necrosante del perineo (también conocida como gangrena de Fournier) observados en la vigilancia posterior a la comercialización de los inhibidores de SGLT2.[200]US Food and Drug Administration. FDA drug safety communication: FDA warns about rare occurrences of a serious infection of the genital area with SGLT2 inhibitors for diabetes. August 2018 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-occurrences-serious-infection-genital-area-sglt2-inhibitors-diabetes
[201]Medicines and Healthcare products Regulatory Agency. SGLT2 inhibitors: reports of Fournier’s gangrene (necrotising fasciitis of the genitalia or perineum). February 2019 [internet publication].
https://www.gov.uk/drug-safety-update/sglt2-inhibitors-reports-of-fournier-s-gangrene-necrotising-fasciitis-of-the-genitalia-or-perineum
Agonistas del receptor GLP-1
Los agonistas del receptor de GLP-1 son fármacos basados en incretinas.[162]Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020 Jan 7;41(2):255-323.
https://www.doi.org/10.1093/eurheartj/ehz486
http://www.ncbi.nlm.nih.gov/pubmed/31497854?tool=bestpractice.com
Las incretinas son un grupo de hormonas metabólicas que disminuyen los niveles de glucemia al estimular la liberación de insulina e inhibir la liberación de glucagón; las dos incretinas más importantes son los péptidos intestinales GLP-1 y GIP. Los agonistas del receptor de GLP-1 promueven la secreción de insulina dependiente de la glucosa y la supresión de glucagón, desaceleran el vaciamiento gástrico, limitan los incrementos glucémicos después de las comidas y reducen el apetito y la ingesta de energía.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Los ejemplos incluyen dulaglutida, exenatida, liraglutida, lixisenatida y semaglutida. Generalmente se administran por vía subcutánea, aunque existe una formulación por vía oral de semaglutida disponible.
Tienen un efecto hipoglucemiante alto/muy alto y no provocan hipoglucemia.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[164]Tsapas A, Avgerinos I, Karagiannis T, et al. Comparative effectiveness of glucose-lowering drugs for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med. 2020 Aug 18;173(4):278-86.
https://www.acpjournals.org/doi/10.7326/M20-0864?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32598218?tool=bestpractice.com
La evidencia respalda los beneficios de los agonistas específicos del receptor GLP-1 para reducir los eventos cardíacos adversos importantes y el avance de la enfermedad renal diabética en pacientes de alto riesgo con diabetes de tipo 2; estos beneficios se producen en gran medida independientemente de sus efectos reductores de la glucosa.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[169]Palmer SC, Tendal B, Mustafa RA, et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ. 2021 Jan 13;372:m4573.
https://www.bmj.com/content/372/bmj.m4573.long
http://www.ncbi.nlm.nih.gov/pubmed/33441402?tool=bestpractice.com
[202]Giugliano D, Scappaticcio L, Longo M, et al. GLP-1 receptor agonists and cardiorenal outcomes in type 2 diabetes: an updated meta-analysis of eight CVOTs. Cardiovasc Diabetol. 2021 Sep 15;20(1):189.
https://cardiab.biomedcentral.com/articles/10.1186/s12933-021-01366-8
http://www.ncbi.nlm.nih.gov/pubmed/34526024?tool=bestpractice.com
Por ejemplo, la dulaglutida y semaglutida han demostrado que reducen eventos cardiovasculares importantes, pero no la mortalidad por todas las causas o por causa cardiovascular.[203]Gerstein HC, Colhoun HM, Dagenais GR, et al; REWIND Investigators. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet. 2019 Jul 13;394(10193):121-30.
http://www.ncbi.nlm.nih.gov/pubmed/31189511?tool=bestpractice.com
[204]Marso SP, Bain SC, Consoli A, et al; SUSTAIN-6 Investigators. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2016 Nov 10;375(19):1834-44.
http://www.nejm.org/doi/full/10.1056/NEJMoa1607141#t=article
http://www.ncbi.nlm.nih.gov/pubmed/27633186?tool=bestpractice.com
[205]Kaul S. Mitigating cardiovascular risk in type 2 diabetes with antidiabetes drugs: a review of principal cardiovascular outcome results of EMPA-REG OUTCOME, LEADER, and SUSTAIN-6 trials. Diabetes Care. 2017 Jul;40(7):821-31.
https://care.diabetesjournals.org/content/40/7/821.long
http://www.ncbi.nlm.nih.gov/pubmed/28637887?tool=bestpractice.com
La liraglutida redujo significativamente la mortalidad cardiovascular y mortalidad por todas las causas en las personas con diabetes y enfermedad cardiovascular o un riesgo elevado de enfermedad cardiovascular (ECV) en un ensayo aleatorizado.[206]Marso SP, Daniels GH, Brown-Frandsen K, et al; LEADER Steering Committee on behalf of the LEADER Trial Investigators. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2016 Jul 28;375(4):311-22.
http://www.nejm.org/doi/full/10.1056/NEJMoa1603827#t=article
http://www.ncbi.nlm.nih.gov/pubmed/27295427?tool=bestpractice.com
Sin embargo, los ensayos han demostrado que la exenatida y la lixisenatida no reducen los eventos cardiovasculares importantes.[207]Hu Y. Advances in reducing cardiovascular risk in the management of patients with type 2 diabetes mellitus. Chronic Dis Transl Med. 2019 Mar 15;5(1):25-36.
https://www.sciencedirect.com/science/article/pii/S2095882X18300653
http://www.ncbi.nlm.nih.gov/pubmed/30993261?tool=bestpractice.com
Se ha demostrado que la dulaglutida, la liraglutida y la semaglutida (subcutánea) producen criterios de valoración renales beneficiosos, impulsados por los resultados de albuminuria.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[208]Yuan D, Sharma H, Krishnan A, et al. Effect of glucagon-like peptide 1 receptor agonists on albuminuria in adult patients with type 2 diabetes mellitus: a systematic review and meta-analysis. Diabetes Obes Metab. 2022 Sep;24(9):1869-81.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.14776
http://www.ncbi.nlm.nih.gov/pubmed/35589615?tool=bestpractice.com
Un metanálisis de ensayos aleatorizados controlados con placebo que estudiaron los agonistas del receptor GLP-1 en pacientes con diabetes de tipo 2 mostró que el tratamiento no redujo las hospitalizaciones por insuficiencia cardíaca ni la mortalidad en pacientes con insuficiencia cardíaca, pero que puede prevenir la aparición de insuficiencia cardíaca y la mortalidad en pacientes sin insuficiencia cardíaca.[209]Ferreira JP, Saraiva F, Sharma A, et al. Glucagon-like peptide 1 receptor agonists in patients with type 2 diabetes with and without chronic heart failure: a meta-analysis of randomized placebo-controlled outcome trials. Diabetes Obes Metab. 2023 Jun;25(6):1495-502.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.14997
http://www.ncbi.nlm.nih.gov/pubmed/36722252?tool=bestpractice.com
La reducción de los eventos ateroscleróticos observada con los agonistas del receptor de GLP-1 no estuvo influenciada por el estado de insuficiencia cardíaca.[209]Ferreira JP, Saraiva F, Sharma A, et al. Glucagon-like peptide 1 receptor agonists in patients with type 2 diabetes with and without chronic heart failure: a meta-analysis of randomized placebo-controlled outcome trials. Diabetes Obes Metab. 2023 Jun;25(6):1495-502.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.14997
http://www.ncbi.nlm.nih.gov/pubmed/36722252?tool=bestpractice.com
Los agonistas del receptor GLP-1 producen una pérdida de peso de intermedia a muy alta.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[163]Tsapas A, Karagiannis T, Kakotrichi P, et al. Comparative efficacy of glucose-lowering medications on body weight and blood pressure in patients with type 2 diabetes: a systematic review and network meta-analysis. Diabetes Obes Metab. 2021 Sep;23(9):2116-24.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.14451
http://www.ncbi.nlm.nih.gov/pubmed/34047443?tool=bestpractice.com
Son adecuados para los pacientes obesos sin gastroparesia que desean perder peso, están dispuestos a recibir inyecciones y pueden tolerar el efecto adverso común de las náuseas iniciales.[210]Htike ZZ, Zaccardi F, Papamargaritis D, et al. Efficacy and safety of glucagon-like peptide-1 receptor agonists in type 2 diabetes: a systematic review and mixed-treatment comparison analysis. Diabetes Obes Metab. 2017 Apr;19(4):524-36.
http://www.ncbi.nlm.nih.gov/pubmed/27981757?tool=bestpractice.com
En una revisión, el uso de agonistas del receptor de GLP-1 condujo a una pérdida de 1.4 kg frente al placebo, y a una pérdida de 4.8 kg frente a la insulina.[211]Amori RE, Lau J, Pittas AG. Efficacy and safety of incretin therapy in type 2 diabetes: systematic review and meta-analysis. JAMA. 2007 Jul 11;298(2):194-206.
http://www.ncbi.nlm.nih.gov/pubmed/17622601?tool=bestpractice.com
Una revisión sistemática y un metanálisis de liraglutida indican que produjo una reducción de peso significativa con un perfil de seguridad razonable para pacientes con sobrepeso u obesidad, independientemente del estado diabético, en comparación con el placebo.[212]Konwar M, Bose D, Jaiswal SK, et al. Efficacy and safety of liraglutide 3.0 mg in patients with overweight and obese with or without diabetes: a systematic review and meta-analysis. Int J Clin Pract. 2022 Jul 19:2022:1201977.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9325632
http://www.ncbi.nlm.nih.gov/pubmed/35936066?tool=bestpractice.com
La ADA recomienda que para los adultos con diabetes y sobrepeso u obesidad, un agonista del receptor de GLP-1 con mayor eficacia en la pérdida de peso (es decir, semaglutida) es una opción preferida donde la farmacoterapia está indicada como complemento de los cambios en el estilo de vida para el control del peso.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Advierten que este enfoque tiene beneficios adicionales independientes del peso (por ejemplo, glucémicos y cardiometabólicos).[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Los agonistas del receptor de GLP-1 son eficaces para mejorar la esteatosis y algunos ensayos aleatorizados controlados han demostrado beneficios potenciales con liraglutida y semaglutida en pacientes con esteatohepatitis asociada a la disfunción metabólica (MASH; anteriormente conocida como esteatohepatitis no alcohólica [NASH, por sus siglas en inglés]), incluida una ralentización notable del avance de la fibrosis hepática.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
La ADA recomienda considerar el uso de un agonista del receptor de GLP-1 (con beneficio demostrado en MASH, anteriormente conocido como NASH) para adultos con diabetes de tipo 2 (particularmente aquellos con sobrepeso u obesidad) y hepatopatía esteatótica asociada a la disfunción metabólica (MASLD, anteriormente conocida como esteatosis hepática no alcohólica [EHNA]), como complemento de las intervenciones en el estilo de vida para la pérdida de peso.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
La ADA también recomienda que los agonistas del receptor de GLP-1 sean una opción preferida para el tratamiento de la hiperglucemia en personas con diabetes de tipo 2 con MASH confirmado por biopsia (anteriormente NASH) o con alto riesgo de fibrosis hepática clínicamente significativa en pruebas no invasivas.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Los efectos adversos más frecuentes de los inhibidores de GLP-1 son gastrointestinales, como náuseas, vómitos y diarrea, pero tienden a reducirse con el tiempo. Además, la MHRA advierte de casos de cetoacidosis diabética en pacientes con diabetes tipo 2 tratados con una combinación de un agonista del receptor GLP-1 e insulina, en los cuales las dosis de insulina concomitante fueron rápidamente reducidas o suspendidas.[161]Medicines and Healthcare products Regulatory Agency. GLP-1 receptor agonists: reports of diabetic ketoacidosis when concomitant insulin was rapidly reduced or discontinued. June 2019 [internet publication].
https://www.gov.uk/drug-safety-update/glp-1-receptor-agonists-reports-of-diabetic-ketoacidosis-when-concomitant-insulin-was-rapidly-reduced-or-discontinued
Se ha informado pancreatitis en ensayos clínicos con agonistas del receptor de GLP-1, pero no se ha establecido la causalidad.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Existe evidencia contradictoria sobre si los agonistas del receptor de GLP-1 aumentan el riesgo de trastornos de la tiroides.
Un metanálisis de ensayos aleatorizados controlados realizado en 2022 concluyó que los agonistas del receptor de GLP-1 no aumentaban ni disminuían el riesgo de cáncer de tiroides, hipertiroidismo, hipotiroidismo, tiroiditis, masa tiroidea y bocio, aunque señaló que debido a la baja incidencia de estas enfermedades, estos hallazgos necesitaban ser examinados más a fondo.[213]Hu W, Song R, Cheng R, et al. Use of GLP-1 Receptor agonists and occurrence of thyroid disorders: a meta-analysis of randomized controlled trials. Front Endocrinol (Lausanne). 2022 Jul 11:13:927859.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9309474
http://www.ncbi.nlm.nih.gov/pubmed/35898463?tool=bestpractice.com
Sin embargo, un análisis de casos y controles anidado de 2562 sujetos con cáncer de tiroides informó que el uso de agonistas del receptor de GLP-1 se asoció con un mayor riesgo de cáncer de tiroides y carcinoma medular tiroideo, en particular después de 1 a 3 años de tratamiento.[214]Bezin J, Gouverneur A, Pénichon M, et al. GLP-1 receptor agonists and the risk of thyroid cancer. Diabetes Care. 2023 Feb 1;46(2):384-90.
https://diabetesjournals.org/care/article-abstract/46/2/384/147888/GLP-1-Receptor-Agonists-and-the-Risk-of-Thyroid?redirectedFrom=fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36356111?tool=bestpractice.com
Una revisión sistemática y un metanálisis en red que combina 84 ensayos que investigaron el efecto de los agonistas del receptor GLP-1 y los inhibidores de la DPP-4 (terapias basadas en incretinas) concluyeron que no estaban asociados con un mayor riesgo de cánceres del sistema digestivo en pacientes con diabetes de tipo 2.[215]Chai S, Yu S, Yang Z, et al. Effect of incretin-based therapies on cancers of digestive system among 101 595 patients with type 2 diabetes mellitus: a systematic review and network meta-analysis combining 84 trials with a median duration of 30 weeks. BMJ Open Diabetes Res Care. 2019 Sep 20;7(1):e000728.
https://drc.bmj.com/content/7/1/e000728.long
http://www.ncbi.nlm.nih.gov/pubmed/31641525?tool=bestpractice.com
La EMA está revisando datos sobre el riesgo de pensamientos suicidas y de autolesión con agonistas del receptor GLP-1, tras informes de tales sucesos en personas que usan liraglutida y semaglutida.
Doble agonista del receptor GIP/GLP-1
La tirzepatida es el primer y único agonista dual del receptor GIP/GLP-1 disponible. Aumenta la sensibilidad y la secreción de insulina, suprime la secreción de glucagón y retrasa el vaciado gástrico. En 2023, el NICE recomendó el uso de tirzepatida (como complemento de la dieta y el ejercicio) en adultos cuya diabetes de tipo 2 no está adecuadamente controlada, solo si la terapia antidiabética triple es ineficaz, está contraindicada o no se tolera, y cumplen uno de los siguientes criterios:[159]National Institute for Health and Care Excellence. Tirzepatide for treating type 2 diabetes. Oct 2023 [internet publication].
https://www.nice.org.uk/guidance/ta924/chapter/1-Recommendations
IMC ≥35 kg/m² (ajustado en consecuencia para personas de raza negra, asiática y otros grupos étnicos minoritarios) y problemas psicológicos específicos u otros problemas médicos asociados a la obesidad; o
IMC <35 kg/m² e implicaciones ocupacionales significativas del tratamiento con insulina o beneficios potenciales de la pérdida de peso en otras complicaciones significativas relacionadas con la obesidad.
El NICE posiciona a la tirzepatida como una alternativa al uso de un agonista del receptor GLP-1 (es decir, la tirzepatida es una opción a considerar al mismo nivel de la vía de tratamiento de la diabetes de tipo 2 del Reino Unido que los agonistas del receptor GLP-1).[159]National Institute for Health and Care Excellence. Tirzepatide for treating type 2 diabetes. Oct 2023 [internet publication].
https://www.nice.org.uk/guidance/ta924/chapter/1-Recommendations
El NICE señala que la tirzepatida se utiliza en una fase más temprana de la vía de tratamiento a nivel internacional, pero en su revisión solo se consideró como una opción alternativa al inicio con un agonista del receptor GLP-1.[159]National Institute for Health and Care Excellence. Tirzepatide for treating type 2 diabetes. Oct 2023 [internet publication].
https://www.nice.org.uk/guidance/ta924/chapter/1-Recommendations
La tirzepatida está aprobada en Europa para el tratamiento de adultos con diabetes mellitus de tipo 2 insuficientemente controlada como complemento de la dieta y el ejercicio (como monoterapia cuando la metformina se considera inapropiada debido a intolerancia o contraindicaciones; o además de otros medicamentos para el tratamiento de la diabetes). La orientación estadounidense sobre la diabetes de tipo 2 en adultos de la ADA incluye recomendaciones para un agonista dual del receptor GIP/GLP-1 (es decir, tirzepatida) como una opción preferida cuando la farmacoterapia está indicada para el control del peso en personas con sobrepeso u obesidad (la ADA enfatiza que este enfoque tiene beneficios glucémicos y cardiometabólicos adicionales independientes del peso).[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Se ha demostrado que la tirzepatida tiene un mayor efecto sobre los niveles de glucosa y el control del peso que los agonistas selectivos del receptor GLP-1 solos, sin mayor riesgo de hipoglucemia.[216]Rosenstock J, Wysham C, Frías JP, et al. Efficacy and safety of a novel dual GIP and GLP-1 receptor agonist tirzepatide in patients with type 2 diabetes (SURPASS-1): a double-blind, randomised, phase 3 trial. Lancet. 2021 Jul 10;398(10295):143-55.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)01324-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34186022?tool=bestpractice.com
[217]Frías JP, Davies MJ, Rosenstock J, et al. Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. N Engl J Med. 2021 Aug 5;385(6):503-15.
https://www.nejm.org/doi/10.1056/NEJMoa2107519?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/34170647?tool=bestpractice.com
[218]Frias JP, Nauck MA, Van J, et al. Efficacy and safety of LY3298176, a novel dual GIP and GLP-1 receptor agonist, in patients with type 2 diabetes: a randomised, placebo-controlled and active comparator-controlled phase 2 trial. Lancet. 2018 Nov 17;392(10160):2180-93.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(18)32260-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30293770?tool=bestpractice.com
[219]Inagaki N, Takeuchi M, Oura T, et al. Efficacy and safety of tirzepatide monotherapy compared with dulaglutide in Japanese patients with type 2 diabetes (SURPASS J-mono): a double-blind, multicentre, randomised, phase 3 trial. Lancet Diabetes Endocrinol. 2022 Sep;10(9):623-33.
https://www.thelancet.com/journals/landia/article/PIIS2213-8587(22)00188-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35914543?tool=bestpractice.com
Algunos ensayos han demostrado que en pacientes con diabetes de tipo 2, la tirzepatida fue superior a la insulina degludec ajustada (con mayores reducciones en la HbA1c y el peso corporal y un menor riesgo de hipoglucemia), y en pacientes con diabetes de tipo 2 y un riesgo cardiovascular elevado, la tirzepatida fue superior a la insulina glargina (con una reducción mayor y clínicamente significativa de la HbA1c con una menor incidencia de hipoglucemia).[220]Ludvik B, Giorgino F, Jódar E, et al. Once-weekly tirzepatide versus once-daily insulin degludec as add-on to metformin with or without SGLT2 inhibitors in patients with type 2 diabetes (SURPASS-3): a randomised, open-label, parallel-group, phase 3 trial. Lancet. 2021 Aug 14;398(10300):583-98.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)01443-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34370970?tool=bestpractice.com
[221]Del Prato S, Kahn SE, Pavo I, et al. Tirzepatide versus insulin glargine in type 2 diabetes and increased cardiovascular risk (SURPASS-4): a randomised, open-label, parallel-group, multicentre, phase 3 trial. Lancet. 2021 Nov 13;398(10313):1811-24.
http://www.ncbi.nlm.nih.gov/pubmed/34672967?tool=bestpractice.com
El NICE señala que las dosis más altas de tirzepatida se asocian con un mayor grado de pérdida de peso, mientras que los efectos sobre la HbA1c parecen ser menos dependientes de la dosis, presentes incluso en dosis bajas.[159]National Institute for Health and Care Excellence. Tirzepatide for treating type 2 diabetes. Oct 2023 [internet publication].
https://www.nice.org.uk/guidance/ta924/chapter/1-Recommendations
Los análisis (incluido un metanálisis preespecificado) de los resultados iniciales sobre la seguridad cardiovascular a corto plazo de la tirzepatida de los ensayos clínicos SURPASS realizados en pacientes con diabetes de tipo 2, sugieren que no hay un exceso de riesgo cardiovascular ni un aumento del riesgo de eventos cardiovasculares graves con tirzepatida en comparación con los controles (incluidos semaglutida y dulaglutida, agonistas del receptor GLP-1 con beneficios cardiovasculares conocidos).[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[221]Del Prato S, Kahn SE, Pavo I, et al. Tirzepatide versus insulin glargine in type 2 diabetes and increased cardiovascular risk (SURPASS-4): a randomised, open-label, parallel-group, multicentre, phase 3 trial. Lancet. 2021 Nov 13;398(10313):1811-24.
http://www.ncbi.nlm.nih.gov/pubmed/34672967?tool=bestpractice.com
[222]Sattar N, McGuire DK, Pavo I, et al. Tirzepatide cardiovascular event risk assessment: a pre-specified meta-analysis. Nat Med. 2022 Mar;28(3):591-8.
https://www.nature.com/articles/s41591-022-01707-4
http://www.ncbi.nlm.nih.gov/pubmed/35210595?tool=bestpractice.com
Además, el análisis post-hoc del ensayo clínico SURMOUNT-1 (realizado para evaluar la eficacia y seguridad de tirzepatida en pacientes con obesidad o sobrepeso), que excluyó notablemente a los pacientes con diabetes de tipo 2, concluyó que se observaron beneficios significativos en la reducción del riesgo cardiovascular con tirzepatida frente a placebo.[223]Hankosky ER, Wang H, Neff LM, et al. Tirzepatide reduces the predicted risk of atherosclerotic cardiovascular disease and improves cardiometabolic risk factors in adults with obesity or overweight: SURMOUNT-1 post hoc analysis. Diabetes Obes Metab. 2024 Jan;26(1):319-28.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.15318
http://www.ncbi.nlm.nih.gov/pubmed/37932236?tool=bestpractice.com
Sin embargo, se requiere más investigación sobre los efectos cardiovasculares a largo plazo de la tirzepatida. Los ensayos en curso SURPASS-CVOT (en pacientes con diabetes de tipo 2) y SURMOUNT-MMO (en pacientes con obesidad sin diabetes) buscarán proporcionar datos más sólidos sobre la seguridad cardiovascular de la tirzepatida y sus efectos sobre los resultados cardiovasculares y la morbilidad y mortalidad.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[224]Nicholls SJ, Bhatt DL, Buse JB, et al. Comparison of tirzepatide and dulaglutide on major adverse cardiovascular events in participants with type 2 diabetes and atherosclerotic cardiovascular disease: SURPASS-CVOT design and baseline characteristics. Am Heart J. 2024 Jan;267:1-11.
https://www.sciencedirect.com/science/article/pii/S0002870323002806?via%3Dihub
http://www.ncbi.nlm.nih.gov/pubmed/37758044?tool=bestpractice.com
[225]ClinicalTrials.gov. A study of tirzepatide (LY3298176) on the reduction on morbidity and mortality in adults with obesity (SURMOUNT-MMO). ClinicalTrials.gov Identifier: NCT05556512. Oct 2024 [internet publication].
https://clinicaltrials.gov/study/NCT05556512
El análisis post-hoc de SURPASS-4, que comparó tirzepatida con insulina glargina en pacientes con diabetes de tipo 2 y aumento del riesgo cardiovascular o ECV establecida, sugirió que la tirzepatida puede estar asociada con beneficios renales.[226]Heerspink HJL, Sattar N, Pavo I, et al. Effects of tirzepatide versus insulin glargine on kidney outcomes in type 2 diabetes in the SURPASS-4 trial: post-hoc analysis of an open-label, randomised, phase 3 trial. Lancet Diabetes Endocrinol. 2022 Nov;10(11):774-85.
http://www.ncbi.nlm.nih.gov/pubmed/36152639?tool=bestpractice.com
La tirzepatida fue razonablemente bien tolerada en los ensayos, y los efectos adversos más frecuentes fueron similares a los observados con los agonistas del receptor de GLP-1 (náuseas, vómitos y dispepsia). El aumento lento de la dosis de tirzepatida puede minimizar el riesgo de estos efectos adversos.[159]National Institute for Health and Care Excellence. Tirzepatide for treating type 2 diabetes. Oct 2023 [internet publication].
https://www.nice.org.uk/guidance/ta924/chapter/1-Recommendations
Las mismas advertencias y precauciones anotadas anteriormente para los agonistas del receptor de GLP-1 se aplican a la tirzepatida.
Inhibidores de la DPP-4
Los inhibidores de DPP-4 son fármacos orales a base de incretinas.[162]Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020 Jan 7;41(2):255-323.
https://www.doi.org/10.1093/eurheartj/ehz486
http://www.ncbi.nlm.nih.gov/pubmed/31497854?tool=bestpractice.com
Las incretinas GLP-1 y GIP son rápidamente inactivadas por la enzima DPP-4. Los inhibidores de DPP-4 (también conocidos como gliptinas) incluyen la alogliptina, la linagliptina, la saxagliptina, la sitagliptina y la vildagliptina. Tienen un modesto efecto hipoglucemiante, son neutros en cuanto al peso y, en general, se toleran bien con un riesgo mínimo de hipoglucemia.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[163]Tsapas A, Karagiannis T, Kakotrichi P, et al. Comparative efficacy of glucose-lowering medications on body weight and blood pressure in patients with type 2 diabetes: a systematic review and network meta-analysis. Diabetes Obes Metab. 2021 Sep;23(9):2116-24.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.14451
http://www.ncbi.nlm.nih.gov/pubmed/34047443?tool=bestpractice.com
[164]Tsapas A, Avgerinos I, Karagiannis T, et al. Comparative effectiveness of glucose-lowering drugs for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med. 2020 Aug 18;173(4):278-86.
https://www.acpjournals.org/doi/10.7326/M20-0864?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32598218?tool=bestpractice.com
En general, los inhibidores de la DPP-4 no se asocian con ningún aumento o reducción de los eventos cardíacos adversos graves, la mortalidad por cualquier causa o la insuficiencia cardíaca; sin embargo, la saxagliptina puede estar asociada con un mayor riesgo de hospitalización por insuficiencia cardíaca (y, por lo tanto, no está recomendado por la ESC para su uso en pacientes con riesgo o con antecedentes de insuficiencia cardíaca).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[227]Mannucci E, Nreu B, Montereggi C, et al. Cardiovascular events and all-cause mortality in patients with type 2 diabetes treated with dipeptidyl peptidase-4 inhibitors: an extensive meta-analysis of randomized controlled trials. Nutr Metab Cardiovasc Dis. 2021 Sep 22;31(10):2745-55.
https://www.nmcd-journal.com/article/S0939-4753(21)00279-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34364771?tool=bestpractice.com
En un ensayo pequeño, se encontró que la vildagliptina el único inhibidor de la DPP-4 mencionado anteriormente que no se había estudiado en un CVOT específico, se asoció con un aumento del volumen del ventrículo izquierdo (de significado clínico desconocido), pero no se demostró ningún efecto significativo sobre la fracción de eyección ventricular izquierda (FEVI).[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
[228]McMurray JJV, Ponikowski P, Bolli GB, et al. Effects of vildagliptin on ventricular function in patients with type 2 diabetes mellitus and heart failure: a randomized placebo-controlled trial. JACC Heart Fail. 2018 Jan;6(1):8-17.
https://www.sciencedirect.com/science/article/pii/S2213177917305358?via%3Dihub
http://www.ncbi.nlm.nih.gov/pubmed/29032139?tool=bestpractice.com
Para los pacientes con diabetes de tipo 2 con insuficiencia cardíaca o con riesgo de enfermedad cardíaca, las guías de práctica clínica de la ESC recomiendan que la linagliptina y la sitagliptina tengan un efecto neutro sobre el riesgo de hospitalización por insuficiencia cardíaca y deben considerarse como opciones para reducir la glucosa en estos pacientes.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Los inhibidores de la DPP-4 no retrasan el avance de la enfermedad renal diabética; sin embargo, se observó una reducción en el riesgo de avance de la albuminuria con linagliptina en un ensayo controlado con placebo.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Los inhibidores de DPP-4 se pueden utilizar en casos de insuficiencia renal, aunque puede ser necesario ajustar la dosis.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
El dolor en las articulaciones es un evento adverso potencialmente raro.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Se ha informado pancreatitis en ensayos clínicos, pero no se ha establecido la causalidad; los medicamentos deben suspenderse si se sospecha pancreatitis. Algunos análisis recientes han sugerido que los inhibidores de DPP-4 se asocian con un mayor riesgo de lesión hepática aguda (en comparación con los inhibidores de SGLT-2) en pacientes con diabetes de tipo 2.[229]Pradhan R, Yin H, Yu OHY, et al. Incretin-based drugs and the risk of acute liver injury among patients with type 2 diabetes. Diabetes Care. 2022 Oct 1;45(10):2289-98.
https://diabetesjournals.org/care/article/45/10/2289/147257/Incretin-Based-Drugs-and-the-Risk-of-Acute-Liver
http://www.ncbi.nlm.nih.gov/pubmed/35866685?tool=bestpractice.com
Además, el sistema de notificación de eventos adversos de la FDA señaló que había señales consistentes de eventos relacionados con la vesícula biliar o biliares asociados con los inhibidores de DPP-4 con datos del mundo real, y que los médicos deben estar conscientes de esto en la práctica clínica.[230]He L, Wang J, Li Z, et al. Dipeptidyl peptidase 4 inhibitors and gallbladder or biliary diseases: data from the U.S. Food and Drug Administration adverse event reporting system. Diabetes Care. 2023 Feb 1;46(2):e72-3.
https://diabetesjournals.org/care/article/46/2/e72/148158/Dipeptidyl-Peptidase-4-Inhibitors-and-Gallbladder
http://www.ncbi.nlm.nih.gov/pubmed/36534433?tool=bestpractice.com
Sulfonilurea
Las sulfonilureas son fármacos orales que estimulan la liberación de insulina de las células beta pancreáticas. Los ejemplos incluyen gliclazida y glimepirida.
Las sulfonilureas tienen un alto efecto hipoglucemiante y son objeto de una larga experiencia clínica.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[164]Tsapas A, Avgerinos I, Karagiannis T, et al. Comparative effectiveness of glucose-lowering drugs for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med. 2020 Aug 18;173(4):278-86.
https://www.acpjournals.org/doi/10.7326/M20-0864?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32598218?tool=bestpractice.com
Pueden reducir las complicaciones microvasculares, pero no reducen el riesgo cardiovascular ni retrasan el avance de la enfermedad renal diabética, y pueden provocar aumento de peso e hipoglucemia.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[163]Tsapas A, Karagiannis T, Kakotrichi P, et al. Comparative efficacy of glucose-lowering medications on body weight and blood pressure in patients with type 2 diabetes: a systematic review and network meta-analysis. Diabetes Obes Metab. 2021 Sep;23(9):2116-24.
https://dom-pubs.pericles-prod.literatumonline.com/doi/10.1111/dom.14451
http://www.ncbi.nlm.nih.gov/pubmed/34047443?tool=bestpractice.com
En algunos estudios se han informado resultados cardiovasculares adversos, aunque las revisiones sistemáticas no han encontrado un aumento en la mortalidad por cualquier causa en comparación con otros tratamientos activos.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[231]Khunti K, Chatterjee S, Gerstein HC, et al. Do sulphonylureas still have a place in clinical practice? Lancet Diabetes Endocrinol. 2018 Oct;6(10):821-32.
https://www.thelancet.com/journals/landia/article/PIIS2213-8587(18)30025-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29501322?tool=bestpractice.com
Además, un ensayo aleatorizado controlado en adultos con diabetes de tipo 2 mostró una seguridad cardiovascular comparable de la sulfonilurea, glimepirida, en comparación con el inhibidor de DPP-4, linagliptina, durante 6.3 años, y un estudio escocés comparativo de seguridad en el mundo real concluyó que es poco probable que las sulfonilureas de segunda línea aumenten el riesgo cardiovascular o la mortalidad por cualquier causa.[232]Rosenstock J, Kahn SE, Johansen OE, et al. Effect of linagliptin vs glimepiride on major adverse cardiovascular outcomes in patients with type 2 diabetes: the CAROLINA randomized clinical trial. JAMA. 2019 Sep 24;322(12):1155-66.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6763993
http://www.ncbi.nlm.nih.gov/pubmed/31536101?tool=bestpractice.com
[233]Wang H, Cordiner RLM, Huang Y, et al. Cardiovascular safety in type 2 diabetes with sulfonylureas as second-line drugs: a nationwide population-based comparative safety study. Diabetes Care. 2023 May 1;46(5):967-77.
https://diabetesjournals.org/care/article/46/5/967/148656/Cardiovascular-Safety-in-Type-2-Diabetes-With
http://www.ncbi.nlm.nih.gov/pubmed/36944118?tool=bestpractice.com
Deben usarse con precaución en personas con riesgo de hipoglucemia.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Pioglitazona
La pioglitazona es un fármaco oral que es un "sensibilizador" de la insulina.[162]Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020 Jan 7;41(2):255-323.
https://www.doi.org/10.1093/eurheartj/ehz486
http://www.ncbi.nlm.nih.gov/pubmed/31497854?tool=bestpractice.com
Es parte de un grupo de medicamentos llamados tiazolidinedionas. Tiene un alto efecto hipoglucemiante y no provoca hipoglucemia.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[164]Tsapas A, Avgerinos I, Karagiannis T, et al. Comparative effectiveness of glucose-lowering drugs for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med. 2020 Aug 18;173(4):278-86.
https://www.acpjournals.org/doi/10.7326/M20-0864?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32598218?tool=bestpractice.com
Ha demostrado beneficios cardiovasculares potenciales, así como beneficios potenciales en MASLD (también conocido como NAFLD) y MASH (también conocido como NASH).[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
La ADA recomienda la pioglitazona como agente preferido para el tratamiento de la hiperglucemia en personas con diabetes de tipo 2 con MASH confirmado por biopsia o con alto riesgo de fibrosis hepática clínicamente significativa en pruebas no invasivas.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Sin embargo, se ha asociado con retención de líquidos, insuficiencia cardíaca congestiva, aumento de peso y fracturas óseas.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
[164]Tsapas A, Avgerinos I, Karagiannis T, et al. Comparative effectiveness of glucose-lowering drugs for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med. 2020 Aug 18;173(4):278-86.
https://www.acpjournals.org/doi/10.7326/M20-0864?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/32598218?tool=bestpractice.com
La ESC no recomienda el uso de pioglitazona en pacientes con riesgo o con antecedentes de insuficiencia cardíaca debido a su asociación con un mayor riesgo de insuficiencia cardíaca incidente en pacientes con diabetes.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
El uso de pioglitazona se asocia a un pequeño aumento del riesgo de cáncer de vejiga.[234]US Food and Drug Administration. FDA drug safety communication: updated FDA review concludes that use of type 2 diabetes medicine pioglitazone may be linked to an increased risk of bladder cancer. December 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-updated-fda-review-concludes-use-type-2-diabetes-medicine-pioglitazone
Otra tiazolidinediona, la rosiglitazona, se ha retirado del mercado debido a las persistentes preocupaciones relativas a la seguridad.[235]European Medicines Agency. Questions and answers on the suspension of rosiglitazone-containing medicines (Avandia, Avandamet and Avaglim). September 2010 [internet publication].
https://www.ema.europa.eu/en/documents/medicine-qa/questions-answers-suspension-rosiglitazone-containing-medicines-avandia-avandamet-avaglim_en.pdf
Farmacoterapia antihiperglucémica: tratamientos basados en la insulina
Al iniciar el tratamiento con insulina, el paciente debe continuar con la metformina mientras no haya contraindicaciones o intolerancias.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Revisar la necesidad continua de otros tratamientos hipoglucemiantes (p. ej., considerar el riesgo de hipoglucemia aditiva y si hay beneficios adicionales de continuar con otros fármacos, como los cardiometabólicos o los relacionados con el riñón).[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Elija el tipo de insulina más adecuado para el paciente y desarrolle una pauta individualizada, basada en las siguientes opciones:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Administre insulina isófana basal (protamina neutra de Hagedorn, NPH) inyectada una o dos veces al día según la necesidad
Considere la posibilidad de iniciar tanto la insulina NPH como la de acción corta (sobre todo si la HbA1c de la persona es de 75 mmol/mol [9.0%] o superior), administrada cualquiera de ellas:
Considere el uso de insulina detemir o insulina glargina como alternativa a la insulina NPH si:
El paciente necesita la ayuda de un cuidador o de un profesional sanitario para inyectarse la insulina, y el uso de insulina detemir o insulina glargina reduciría la frecuencia de las inyecciones de dos a una vez al día, o
El estilo de vida del paciente está restringido por episodios sintomáticos recurrentes de hipoglucemia, o
De lo contrario, el paciente necesitaría inyecciones de insulina NPH dos veces al día en combinación con fármacos orales para reducir la glucosa
Considere el uso de los preparados premezclados (bifásicos) que incluyen análogos de insulina de acción corta, en lugar de los preparados premezclados (bifásicos) que incluyen preparados de insulina humana de acción corta, si:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
El paciente prefiere inyectarse la insulina inmediatamente antes de la comida, o
La hipoglucemia es un problema, o
Los niveles de glucemia aumentan notablemente después de las comidas.
Considere el cambio de insulina NPH a insulina detemir o insulina glargina si el paciente:[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
No alcanza su objetivo de HbA1c debido a una hipoglucemia significativa, o
Presenta una hipoglucemia significativa con la insulina NPH, independientemente del nivel de HbA1c alcanzado, o
No puede utilizar el dispositivo necesario para inyectar la insulina NPH, pero podría administrar su propia insulina de forma segura y precisa si se cambia a uno de los análogos de insulina de acción prolongada, o
Necesita la ayuda de un cuidador o de un profesional de salud para administrar las inyecciones de insulina y para quien el cambio a uno de los análogos de insulina de acción prolongada reduciría el número de inyecciones diarias.
Si el paciente está recibiendo un régimen de insulina basal (insulina NPH, insulina detemir o insulina glargina), monitorice la necesidad de insulina de acción corta antes de las comidas (o una preparación de insulina premezclada [bifásica]).[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
Si el paciente está en tratamiento con insulina premezclada (bifásica), monitorice la necesidad de una nueva inyección de insulina de acción corta antes de las comidas o de cambiar a un régimen de bolo basal con insulina NPH o insulina detemir o insulina glargina, si el control glucémico sigue siendo inadecuado.[36]National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Jun 2022 [internet publication].
https://www.nice.org.uk/guidance/ng28
La mayoría de las personas con diabetes de tipo 2 utilizan dispositivos de administración de insulina (plumas de insulina).
Pueden ajustarse para administrar dosis fijas de insulina, están ampliamente disponibles y ofrecen comodidad y precisión en la dosificación de la insulina.
Con menor frecuencia, las bombas de insulina y los sistemas de bombeo con parches se utilizan de forma individualizada en personas que necesitan múltiples dosis diarias de insulina.
Las bombas de insulina suelen reservarse para las personas con diabetes de tipo 1. Si una bomba de insulina es adecuada para el paciente, su uso requerirá un compromiso significativo por parte del paciente para conseguir beneficios clínicos más allá de la terapia basada en múltiples dosis diarias de inyección.
La insulina exógena es una forma muy eficaz de reducir la glucosa sérica y la HbA1c, pero su uso debe guiarse en la mayoría de los pacientes por pruebas regulares de automonitorizacion de la glucemia (pruebas de glucemia por punción digital) o por una monitorización continua de la glucosa.
La hipoglucemia (glucosa ≤3.9 mmol/L [≤70 mg/dL]) es la complicación potencial más grave del tratamiento con insulina. Las personas que conducen deben tener especial cuidado para evitar la hipoglucemia y se les debe advertir sobre los peligros. Consulte la sección Complicaciones de este tema.
Otro efecto secundario importante es el aumento de peso.
Los efectos secundarios menos comunes pueden incluir hambre, náuseas, diaforesis, irritación en el sitio de la inyección o anafilaxia.
Dosis de corrección de insulina
Cuando los pacientes motivados y bien informados usan insulina basal/en bolo, la dosis de insulina de acción rápida que se administra antes de cada comida se puede basar en el contenido anticipado de carbohidratos de las comidas que se van a consumir y a veces se puede ajustar si se anticipa alguna actividad física.
Se puede añadir una dosis de corrección (o ajuste) a la insulina del bolo en función del nivel de glucemia antes de las comidas. En la práctica, un abordaje conservador para calcular una dosis de corrección es asumir que 1 unidad de insulina reducirá la glucemia del paciente entre 2 y 4 mmol/L (36-72 mg/dL). La dosis de corrección también puede calcularse utilizando la dosis diaria total de insulina del paciente si la ingesta de alimentos es estable. La dosis de corrección puede añadirse a la necesidad de insulina del paciente a la hora de la comida (ya sea basada en el tamaño general de la comida o en el recuento de carbohidratos) y administrarse como la dosis total del bolo.
Alternativas al régimen de insulina basal-bolo
Mientras que el NICE recomienda considerar un régimen de insulina basal-bolo para los pacientes que no pueden mantener los objetivos glucémicos solo con insulina basal, la ADA/EASD también señala una opción alternativa de añadir un agonista del receptor de GLP-1 o a la insulina basal para intensificar el tratamiento.[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Además, las guías de práctica clínica de diabetes de la ADA 2024 incluyen que, si se utiliza insulina en un adulto con diabetes de tipo 2, se recomienda utilizarla en combinación con un agonista del receptor GLP-1 o un agonista dual del receptor GIP/GLP-1 para obtener una mayor eficacia glucémica (y beneficios adicionales en el peso y el riesgo de hipoglucemia), con la dosis de insulina ajustada según sea necesario cuando se añade o se actualiza uno de estos agentes.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
Los datos de los ensayos respaldan la combinación de insulina basal y un agonista del receptor de GLP-1 para reducir la HbA1c y limitar el aumento de peso y la hipoglucemia en comparación con un régimen de insulina intensificado.[236]Wysham CH, Lin J, Kuritzky L. Safety and efficacy of a glucagon-like peptide-1 receptor agonist added to basal insulin therapy versus basal insulin with or without a rapid-acting insulin in patients with type 2 diabetes: results of a meta-analysis. Postgrad Med. 2017 May;129(4):436-45.
http://www.ncbi.nlm.nih.gov/pubmed/28294702?tool=bestpractice.com
[237]Maiorino MI, Chiodini P, Bellastella G, et al. Insulin and glucagon-like peptide 1 receptor agonist combination therapy in type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Diabetes Care. 2017 Apr;40(4):614-24.
https://care.diabetesjournals.org/content/40/4/614.long
http://www.ncbi.nlm.nih.gov/pubmed/28325801?tool=bestpractice.com
[238]Aroda VR, Arulandu JR, Cannon AJ. Insulin/glucagon-like peptide-1 receptor agonist combination therapy for the treatment of type 2 diabetes: are two agents better than one? Clin Diabetes. 2018 Apr;36(2):138-47.
https://diabetesjournals.org/clinical/article/36/2/138/32834/Insulin-Glucagon-Like-Peptide-1-Receptor-Agonist
http://www.ncbi.nlm.nih.gov/pubmed/29686453?tool=bestpractice.com
Esto podría ser particularmente útil para pacientes con obesidad que requieren altas dosis de insulina debido a la resistencia a la insulina, lo que hace que el efecto secundario del aumento de peso por el uso de insulina sea especialmente problemático.
Se ha demostrado que un inhibidor de SGLT2 puede añadirse a la insulina basal para reducir la glucemia sin que se produzca un aumento de peso o una hipoglucemia.[239]Tang H, Cui W, Li D, et al. Sodium-glucose co-transporter 2 inhibitors in addition to insulin therapy for management of type 2 diabetes mellitus: a meta-analysis of randomized controlled trials. Diabetes Obes Metab. 2017 Jan;19(1):142-7.
http://www.ncbi.nlm.nih.gov/pubmed/27598833?tool=bestpractice.com
[240]Rosenstock J, Jelaska A, Zeller C, et al. Impact of empagliflozin added on to basal insulin in type 2 diabetes inadequately controlled on basal insulin: a 78-week randomized, double-blind, placebo-controlled trial. Diabetes Obes Metab. 2015 Oct;17(10):936-48.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5034797
http://www.ncbi.nlm.nih.gov/pubmed/26040302?tool=bestpractice.com
[241]Rosenstock J, Jelaska A, Frappin G, et al. Improved glucose control with weight loss, lower insulin doses, and no increased hypoglycemia with empagliflozin added to titrated multiple daily injections of insulin in obese inadequately controlled type 2 diabetes. Diabetes Care. 2014 Jul;37(7):1815-23.
https://care.diabetesjournals.org/content/37/7/1815.long
http://www.ncbi.nlm.nih.gov/pubmed/24929430?tool=bestpractice.com
Estos regímenes solo los debe iniciar un especialista en diabetes.
Reglas de los días de enfermedad
Asegúrese de que el paciente es consciente de que cualquier enfermedad intercurrente puede provocar un aumento de los niveles de glucosa.[242]Down S. How to advise on sick day rules. Diabetes Primary Care. 2020 Apr;22(3):47-8.
https://diabetesonthenet.com/wp-content/uploads/pdf/dotn024ae8fb1b78500b7bc752b98e9b6d92.pdf
Administre al paciente consejos orales y escritos claros e individualizados ("reglas de los días de enfermedad") sobre cómo adaptar la gestión durante la enfermedad intercurrente. Algunos fármacos deben suspenderse durante la enfermedad intercurrente; es importante asegurarse de que el paciente es consciente de que tendrá que volver a tomar la medicación suspendida cuando se sienta mejor y pueda comer y beber.
DiabetesontheNet: sick day rules
Opens in new window
La nemotecnia SADMANS puede ser útil como recordatorio de los fármacos para hacer una pausa temporal durante los días de enfermedad, en los que la enfermedad conduce a la deshidratación:[243]Diabetes Canada. Clinical practice guidelines for the prevention and management of diabetes in Canada: appendix 8 - sick-day medication list. 2018 [internet publication].
https://guidelines.diabetes.ca/cpg
S - sulfonilureas
A - inhibidores IECA
D - diuréticos, inhibidores directos de la renina
M - metformina
A - antagonistas de los receptores de la angiotensina II
N - fármacos antiinflamatorios no esteroideos
S - inhibidores de SGLT2
Si un adulto con diabetes de tipo 2 no está bien, considere la necesidad de coordinar el ingreso hospitalario o buscar asesoramiento especializado. Utilice su juicio clínico y tenga en cuenta la edad, la fragilidad, las comorbilidades y el riesgo de complicaciones del paciente, así como la presencia de hiperglucemia, hipoglucemia y/o cetosis.
Tenga en cuenta que existe un riesgo considerable de hipoglucemia en algunos pacientes. Esto es especialmente preocupante en los pacientes de edad avanzada y/o frágiles, en los que tienen poco apetito (y la consiguiente reducción de la ingesta oral) debido a una enfermedad aguda, y en los que toman medicamentos que los exponen a un riesgo específico de hipoglucemia (p. ej., las sulfonilureas y la insulina). Estos pacientes necesitarán una estrecha monitorización de la glucemia y pueden requerir ajustes de la medicación.
Cirugía bariátrica para el tratamiento de la diabetes en pacientes con obesidad
Las guías de práctica clínica sobre obesidad de la Organización Mundial de Gastroenterología y de la Federación Internacional para la Cirugía de la Obesidad y Enfermedades Metabólicas señalan que la cirugía bariátrica es el tratamiento a largo plazo más eficaz para la obesidad y muchas de sus afecciones de salud asociadas.[28]World Gastroenterology Organisation and International Federation for the Surgery of Obesity and Metabolic Diseases. IFSO-WGO guidelines on obesity. 2023 [internet publication].
https://www.worldgastroenterology.org/guidelines/obesity/obesity-english
La gastrectomía en manga y la derivación gástrica en Y de Roux son actualmente los procedimientos bariátricos realizados con mayor frecuencia en todo el mundo.[28]World Gastroenterology Organisation and International Federation for the Surgery of Obesity and Metabolic Diseases. IFSO-WGO guidelines on obesity. 2023 [internet publication].
https://www.worldgastroenterology.org/guidelines/obesity/obesity-english
Antes de considerar la cirugía bariátrica, se debe completar una evaluación médica, psicológica y nutricional integral que implique a un equipo multidisciplinario, para determinar la idoneidad del paciente e identificar cualquier problema que deba abordarse; también se requiere un seguimiento de por vida, así como el abandono del tabaco, el alcohol y las drogas.[28]World Gastroenterology Organisation and International Federation for the Surgery of Obesity and Metabolic Diseases. IFSO-WGO guidelines on obesity. 2023 [internet publication].
https://www.worldgastroenterology.org/guidelines/obesity/obesity-english
Las guías de práctica clínica del NICE recomiendan:[117]National Institute for Health and Care Excellence. Obesity: identification, assessment and management. July 2023 [internet publication].
https://www.nice.org.uk/guidance/cg189
Ofrezca una evaluación acelerada para la cirugía bariátrica a cualquier persona con un IMC igual o superior a 35 kg/m² que tenga una diabetes de tipo 2 de reciente aparición (diagnosticada en los últimos 10 años), siempre que también esté recibiendo o vaya a recibir una evaluación por parte de un equipo especializado en control de peso.
Considere una evaluación acelerada para cirugía bariátrica para cualquier persona con un IMC de 30 a 34.9 kg/m² que tenga diabetes de tipo 2 de aparición reciente, siempre y cuando también esté recibiendo, o vaya a recibir, una evaluación por parte de un equipo especializado en control de peso.
Considere una evaluación acelerada para cirugía bariátrica para cualquier persona con antecedentes familiares del sur de Asia, China, otros países asiáticos, Medio Oriente, África negra o África-Caribe, que tenga diabetes de tipo 2 de reciente aparición utilizando un umbral de IMC más bajo (reducido en 2.5 kg/m²) que otras poblaciones.
La guía de consenso de la ADA/EASD de 2022 recomienda que la cirugía bariátrica se considere una opción para adultos con diabetes de tipo 2 que sean candidatos para la cirugía adecuados y que tengan:[102]Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1;45(11):2753-86.
https://diabetesjournals.org/care/article/45/11/2753/147671/Management-of-Hyperglycemia-in-Type-2-Diabetes
http://www.ncbi.nlm.nih.gov/pubmed/36148880?tool=bestpractice.com
Un IMC ≥40.0 kg/m² si es de ascendencia no asiática
Un IMC ≥37.5 kg/m² si es de ascendencia asiática
Un IMC de 35.0 a 39.9 kg/m² (32.5 a 37.4 kg/m² si es de ascendencia asiática) y que no pueden lograr una pérdida de peso duradera y una mejora de las comorbilidades (incluida la hiperglucemia) con métodos no quirúrgicos.
Además, la ESC recomienda que se considere la cirugía bariátrica para los pacientes con alto o muy alto riesgo de ECV con IMC ≥35 kg/m² cuando los esfuerzos repetitivos y estructurados de cambios en el estilo de vida combinados con medicamentos para reducir peso no dan como resultado una pérdida de peso mantenida.[80]Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023 Oct 14;44(39):4043-140.
https://academic.oup.com/eurheartj/article/44/39/4043/7238227?login=false
http://www.ncbi.nlm.nih.gov/pubmed/37622663?tool=bestpractice.com
Los ensayos clínicos aleatorizados han demostrado un beneficio de la cirugía bariátrica (también denominada cirugía metabólica) en comparación con el tratamiento médico en solitario en lo que respecta a la remisión de la diabetes, el control glucémico, la necesidad de medicamentos para reducir la glucosa, la calidad de vida y la reducción de los marcadores de los factores de riesgo cardiovascular a corto plazo (p. ej., de 1 a 3 años) en personas con diabetes tipo 2, así como para la posible prevención de la diabetes tipo 2.[28]World Gastroenterology Organisation and International Federation for the Surgery of Obesity and Metabolic Diseases. IFSO-WGO guidelines on obesity. 2023 [internet publication].
https://www.worldgastroenterology.org/guidelines/obesity/obesity-english
[244]Carlsson LM, Peltonen M, Ahlin S, et al. Bariatric surgery and prevention of type 2 diabetes in Swedish obese subjects. N Engl J Med. 2012 Aug 23;367(8):695-704.
https://www.nejm.org/doi/10.1056/NEJMoa1112082?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dwww.ncbi.nlm.nih.gov
http://www.ncbi.nlm.nih.gov/pubmed/22913680?tool=bestpractice.com
[245]Schauer PR, Kashyap SR, Wolski K, et al. Bariatric surgery versus intensive medical therapy in obese patients with diabetes. N Engl J Med. 2012 Apr 26;366(17):1567-76.
https://www.nejm.org/doi/10.1056/NEJMoa1200225?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dwww.ncbi.nlm.nih.gov
http://www.ncbi.nlm.nih.gov/pubmed/22449319?tool=bestpractice.com
[246]Schauer PR, Bhatt DL, Kirwan JP, et al; STAMPEDE Investigators. Bariatric surgery versus intensive medical therapy for diabetes - 5-year outcomes. N Engl J Med. 2017 Feb 16;376(7):641-51.
https://www.nejm.org/doi/10.1056/NEJMoa1600869
http://www.ncbi.nlm.nih.gov/pubmed/28199805?tool=bestpractice.com
[247]Kashyap SR, Bhatt DL, Wolski K, et al. Metabolic effects of bariatric surgery in patients with moderate obesity and type 2 diabetes: analysis of a randomized control trial comparing surgery with intensive medical treatment. Diabetes Care. 2013 Aug;36(8):2175-82.
http://care.diabetesjournals.org/content/36/8/2175.long
http://www.ncbi.nlm.nih.gov/pubmed/23439632?tool=bestpractice.com
[248]Ikramuddin S, Korner J, Lee WJ, et al. Roux-en-Y gastric bypass vs intensive medical management for the control of type 2 diabetes, hypertension, and hyperlipidemia: the Diabetes Surgery Study randomized clinical trial. JAMA. 2013 Jun 5;309(21):2240-9.
http://jamanetwork.com/journals/jama/fullarticle/1693889
http://www.ncbi.nlm.nih.gov/pubmed/23736733?tool=bestpractice.com
[249]Halperin F, Ding SA, Simonson DC, et al. Roux-en-Y gastric bypass surgery or lifestyle with intensive medical management in patients with type 2 diabetes: feasibility and 1-year results of a randomized clinical trial. JAMA Surg. 2014 Jul;149(7):716-26.
http://jamanetwork.com/journals/jamasurgery/fullarticle/1876617
http://www.ncbi.nlm.nih.gov/pubmed/24899464?tool=bestpractice.com
Los estudios de cohorte sugieren que tanto el bypass en Y de Roux, como la gastrectomía en manga conducen a una remisión de la diabetes que dura una media de aproximadamente 5 años en más de la mitad de los pacientes, y reducen significativamente la mortalidad, el accidente cerebrovascular, el infarto de miocardio y las complicaciones microvasculares en pacientes con diabetes tipo 2.[250]Yska JP, van Roon EN, de Boer A, et al. Remission of type 2 diabetes mellitus in patients after different types of bariatric surgery: a population-based cohort study in the United Kingdom. JAMA Surg. 2015 Dec;150(12):1126-33.
https://jamanetwork.com/journals/jamasurgery/fullarticle/2446843
http://www.ncbi.nlm.nih.gov/pubmed/26422580?tool=bestpractice.com
[251]Fisher DP, Johnson E, Haneuse S, et al. Association between bariatric surgery and macrovascular disease outcomes in patients with type 2 diabetes and severe obesity. JAMA. 2018 Oct 16;320(15):1570-82.
https://jamanetwork.com/journals/jama/fullarticle/2707461
http://www.ncbi.nlm.nih.gov/pubmed/30326126?tool=bestpractice.com
[252]O'Brien R, Johnson E, Haneuse S, et al. Microvascular outcomes in patients with diabetes after bariatric surgery versus usual care: a matched cohort study. Ann Intern Med. 2018 Sep 4;169(5):300-10.
http://www.ncbi.nlm.nih.gov/pubmed/30083761?tool=bestpractice.com
Una revisión sistemática y un metanálisis de ensayos aleatorizados controlados concluyeron que la derivación en Y de Roux dio como resultado una tasa más alta de remisión de la diabetes de tipo 2 en comparación con la gastrectomía en manga después de 1 año, pero que las tasas de remisión no difirieron en los estudios con un seguimiento a 2 y 5 años.[253]Borgeraas H, Hofsø D, Hertel JK, et al. Comparison of the effect of Roux-en-Y gastric bypass and sleeve gastrectomy on remission of type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Obes Rev. 2020 Jun;21(6):e13011.
https://onlinelibrary.wiley.com/doi/10.1111/obr.13011
http://www.ncbi.nlm.nih.gov/pubmed/32162437?tool=bestpractice.com
En comparación con la gastrectomía en manga, la técnica de Roux en Y produce una pérdida de peso algo mayor y otros beneficios, pero es una operación que presenta mayores desafíos técnicos con tasas de reintervención y readmisión más elevados.
Los beneficios y riesgos de la cirugía bariátrica también varían sustancialmente entre los subgrupos de pacientes con diabetes tipo 2. En los estudios observacionales, los beneficios medios parecen ser mayores en las personas con un inicio más reciente de la diabetes de tipo 2 y en las personas que no reciben tratamiento con insulina.[254]O'Keefe KL, Kemmeter PR, Kemmeter KD. Bariatric surgery outcomes in patients aged 65 years and older at an American Society for Metabolic and Bariatric Surgery Center of Excellence. Obes Surg. 2010 Sep;20(9):1199-205.
http://www.ncbi.nlm.nih.gov/pubmed/20532834?tool=bestpractice.com
[255]Park JY. Prediction of type 2 diabetes remission after bariatric or metabolic surgery. J Obes Metab Syndr. 2018 Dec 30;27(4):213-22.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6513303
http://www.ncbi.nlm.nih.gov/pubmed/31089566?tool=bestpractice.com
Se han documentado beneficios en personas más jóvenes (de 40 a 50 años), así como en mayores de 65 años.[254]O'Keefe KL, Kemmeter PR, Kemmeter KD. Bariatric surgery outcomes in patients aged 65 years and older at an American Society for Metabolic and Bariatric Surgery Center of Excellence. Obes Surg. 2010 Sep;20(9):1199-205.
http://www.ncbi.nlm.nih.gov/pubmed/20532834?tool=bestpractice.com
[255]Park JY. Prediction of type 2 diabetes remission after bariatric or metabolic surgery. J Obes Metab Syndr. 2018 Dec 30;27(4):213-22.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6513303
http://www.ncbi.nlm.nih.gov/pubmed/31089566?tool=bestpractice.com
Los procedimientos de cirugía bariátrica, en particular la derivación gástrica en Y de Roux, se han asociado con complicaciones posteriores relacionadas con el alcohol.[28]World Gastroenterology Organisation and International Federation for the Surgery of Obesity and Metabolic Diseases. IFSO-WGO guidelines on obesity. 2023 [internet publication].
https://www.worldgastroenterology.org/guidelines/obesity/obesity-english
[256]Mahmud N, Panchal S, Abu-Gazala S, et al. Association between bariatric surgery and alcohol use-related hospitalization and all-cause mortality in a veterans affairs cohort. JAMA Surg. 2023 Feb 1;158(2):162-71.
https://pubmed.ncbi.nlm.nih.gov/36515960
http://www.ncbi.nlm.nih.gov/pubmed/36515960?tool=bestpractice.com
Es importante tener esto en cuenta al seleccionar pacientes para estos procedimientos y considerar el asesoramiento relacionado con el alcohol.[256]Mahmud N, Panchal S, Abu-Gazala S, et al. Association between bariatric surgery and alcohol use-related hospitalization and all-cause mortality in a veterans affairs cohort. JAMA Surg. 2023 Feb 1;158(2):162-71.
https://pubmed.ncbi.nlm.nih.gov/36515960
http://www.ncbi.nlm.nih.gov/pubmed/36515960?tool=bestpractice.com
Planificación del embarazo
Las mujeres con diabetes de tipo 2 deben utilizar un método anticonceptivo eficaz hasta que planifiquen un embarazo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Se debe evaluar a las mujeres antes del embarazo para detectar retinopatía, nefropatía, neuropatía y posibles enfermedades cardiovasculares, que pueden empeorar durante el embarazo o complicarlo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Explique a las mujeres con diabetes que estén planeando un embarazo que:[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Si presentan un buen control glucémico antes de la concepción y durante todo el embarazo, se reducirá el riesgo de aborto espontáneo, malformaciones congénitas, mortinatos y muerte neonatal
Los riesgos pueden reducirse pero no eliminarse.
Acordar objetivos individualizados de automonitorización de la glucemia con las mujeres que tienen diabetes y están planeando un embarazo, teniendo en cuenta el riesgo de hipoglucemia.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
El NICE recomienda que la HbA1c sea <48 mmol/mol (6,5%) antes de la concepción si se puede conseguir sin hipoglucemia problemática.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Cualquier reducción hacia este objetivo es probable que reduzca el riesgo de malformaciones congénitas. El NICE recomienda la medición mensual de los niveles de HbA1c para las mujeres con diabetes que estén planeando un embarazo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Se debe aconsejar encarecidamente a las mujeres con diabetes cuyo nivel de HbA1c sea superior a 86 mmol/mol (10%) que no se queden embarazadas hasta que su nivel de HbA1c sea inferior, debido a los riesgos asociados.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Revise la medicación del paciente. Suspenda cualquier fármaco contraindicado en el embarazo si su paciente está planeando un embarazo o tan pronto como se confirme el embarazo; utilice fármacos alternativos que sean adecuados para las mujeres embarazadas.
A las mujeres con diabetes se les puede aconsejar el uso de metformina (con o sin insulina) en el periodo preconcepcional (y durante el embarazo), cuando los beneficios probables de un mejor control glucémico superen el potencial de daño. Suspenda todos los demás agentes orales para reducir la glucemia antes (y durante) el embarazo, incluidos los inhibidores de SGLT2.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
[136]Herrington WG, Frankel AH. UK Kidney Association clinical practice guideline: sodium-glucose co-transporter-2 (SGLT-2) inhibition in adults with kidney disease. Apr 2023 [internet publication].
https://guidelines.ukkidney.org
Suspenda los inhibidores IECA y los antagonistas de los receptores de la angiotensina II antes de la concepción, o tan pronto como se confirme el embarazo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Suspenda las estatinas antes del embarazo o tan pronto como se confirme el mismo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Aconseje a las mujeres que estén planeando un embarazo que tomen ácido fólico (5 mg/día), que debe continuarse hasta las 12 semanas de gestación.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Las mujeres con diabetes tienen un mayor riesgo de dar a luz bebés con defectos del tubo neural, en comparación con la población general.[257]Tinker SC, Gilboa SM, Moore CA, et al. Specific birth defects in pregnancies of women with diabetes: National Birth Defects Prevention Study, 1997-2011. Am J Obstet Gynecol. 2020 Feb;222(2):176.e1-11.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7186569
http://www.ncbi.nlm.nih.gov/pubmed/31454511?tool=bestpractice.com
Durante el embarazo
Durante el embarazo, las mujeres deben ser atendidas por un equipo multidisciplinar, que incluya un dietista, una enfermera educadora, un endocrinólogo y un obstetra.
Ofrezca a las mujeres embarazadas con diabetes preexistente una evaluación de la retina mediante estudios por imágenes digitales con midriasis utilizando tropicamida tras su primera cita clínica prenatal (a menos que se hayan sometido a una evaluación de la retina en los últimos 3 meses), y de nuevo a las 28 semanas. Si hay alguna retinopatía diabética en el momento de la reserva, realice una evaluación adicional de la retina a las 16-20 semanas.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Las guías de práctica clínica del NICE recomiendan los siguientes objetivos de glucemia en mujeres embarazadas con diabetes de tipo 2 preexistente (siempre que puedan alcanzarse sin provocar una hipoglucemia problemática):[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
[Evidencia C]4efe3e6f-336e-471b-b4bd-bb6de160be6aguidelineC¿Cuáles son los efectos de un control glucémico más estricto comparado con un control glucémico menos estricto en las mujeres embarazadas con diabetes gestacional?[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Ayuno: <5.3 mmol/L (<95.4 mg/dL), y
1 hora después de las comidas: <7.8 mmol/L (<140.4 mg/dL), o
2 horas después de las comidas: <6.4 mmol/L (<115.2 mg/dL).
Aconseje a las mujeres embarazadas con diabetes que reciben insulina que mantengan su nivel de glucosa plasmática capilar por encima de 4 mmol/L (72 mg/dL).[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Mida los niveles de HbA1c en todas las mujeres embarazadas con diabetes preexistente en la cita de reserva para determinar el nivel de riesgo para el embarazo. Considere la posibilidad de medir los niveles de HbA1c en el segundo y tercer trimestre del embarazo para las mujeres con diabetes preexistente, a fin de evaluar el nivel de riesgo para el embarazo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Revise la medicación de la paciente. Suspenda cualquier agente contraindicado durante el embarazo tan pronto como se confirme el embarazo y utilice alternativas que sean adecuadas para mujeres embarazadas, como se describe en la sección "Planificación del embarazo" anterior.
Las mujeres que están en periodo de lactancia materna pueden reanudar o continuar con la metformina inmediatamente después del parto, pero deben evitar otros tratamientos orales para reducir la glucemia durante la lactancia.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Las mujeres con diabetes que están en periodo de lactancia materna deben seguir evitando cualquier medicamento para sus complicaciones diabéticas que hayan dejado de tomar por razones de seguridad cuando empezaron a planificar el embarazo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
El NICE recomienda la insulina NPH como primera opción de insulina de acción prolongada durante el embarazo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Considere la posibilidad de continuar el tratamiento con análogos de la insulina de acción prolongada (insulina detemir o insulina glargina) en el caso de las mujeres con diabetes que hayan presentado un buen control de la glucemia mientras los utilizaban antes del embarazo.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
La evidencia disponible sobre los análogos de insulina de acción rápida (insulina asparta e insulina lispro) no muestra un efecto adverso sobre el embarazo o la salud del bebé.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
En la práctica, la mayoría de las mujeres embarazadas con diabetes de tipo 2 necesitarán insulina.
Las mujeres embarazadas deben medir sus niveles de glucemia en ayunas, antes de las comidas, una hora después de las comidas y a la hora de acostarse todos los días.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
La pauta debe examinarse cada pocas semanas al principio del embarazo para poder modificar el contenido y el horario de la nutrición, las pautas de ejercicio y las dosis de insulina para lograr un control óptimo. La monitorización de la MCG durante el embarazo puede considerarse de forma individual (además de la automonitorización) para aquellas que reciben insulina, que experimentan hipoglucemia grave problemática o que tienen niveles de glucosa en sangre inestables que causan preocupación a pesar de los esfuerzos por optimizar el control.[34]American Diabetes Association. Standards of care in diabetes - 2024. Diabetes Care. 2024 Jan;47(suppl 1):S1-321.
https://diabetesjournals.org/care/issue/47/Supplement_1
[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
Los requerimientos de insulina generalmente aumentan en las primeras etapas del embarazo y disminuyen a partir de 8-16 semanas antes de subir durante el resto del embarazo.
Aconseje a las mujeres embarazadas con diabetes de tipo 2 que tomen una dosis baja de ácido acetilsalicílico a partir de las 12 semanas hasta el nacimiento del bebé.[99]National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. Dec 2020 [internet publication].
https://www.nice.org.uk/guidance/ng3
[258]National Institute for Health and Care Excellence. Hypertension in pregnancy: diagnosis and management. April 2023 [internet publication].
https://www.nice.org.uk/guidance/ng133

