Etiología
Trypanosoma cruzi presenta ciclos silvestres (que ocurren en animales salvajes), peridomésticos y domésticos. El ciclo doméstico lo mantienen los triatominos adaptados a las viviendas humanas, que transmiten el parásito de animales domésticos a humanos y entre humanos.[12][42][43] El ciclo silvestre lo mantienen los triatominos y los animales salvajes. En el ciclo peridoméstico, la infección entre los animales domésticos la mantienen los triatominos peridomésticos en las zonas circundantes a viviendas humanas (y, ocasionalmente, mediante el intercambio con el ciclo silvestre, como cuando los perros y gatos cazan animales salvajes o los animales salvajes invaden los alrededores de las viviendas humanas).[44][45][46][47] Los pájaros y los animales de sangre fría son resistentes a la infección.
El modo clásico de transmisión del T cruzi es mediante contacto con las heces o la orina de los insectos triatominos chupadores de sangre (generalmente conocidos como insectos 'besadores' en los Estados Unidos), que generalmente atacan durante la noche.[29][48] Más de 150 especies de triatominos han sido descritas en zonas endémicas, e incluyen especies de Alberprosenia; especies de Belminus; especies de Eratyrus; especies de Microtriatoma; especies de Panstrongylus; especies de Psammolestes; especies de Rhodnius; y especies de Triatoma.[42][49][50][51] El principal vector en los Estados Unidos es T. sanguisuga.[52][53] Existen muy pocos informes sobre casos de transmisión en humanos mediante vectores en Estados Unidos; sin embargo, el aumento de la presencia doméstica de los vectores, la globalización y los futuros aumentos en la temperatura han aumentado la información sobre el hecho de que la transmisión por vectores se puede establecer en Estados Unidos.[39][54]
Otros modos principales de transmisión incluyen transfusiones de sangre, consumo de alimentos o bebidas contaminados y transmisión vertical (que causa enfermedades congénitas). Los modos secundarios de transmisión incluyen el trasplante de órganos, los accidentes de laboratorio, la manipulación de animales infectados, la actividad sexual (a través de heridas, esperma o fluidos menstruales); y la infección inducida en forma delictiva (mediante inoculación o por vía oral).[9][42][55][56] Es importante señalar que la transmisión sexual es posible en el caso de la enfermedad de Chagas aguda debido al alto nivel de parasitemia pero, a diferencia de otros mecanismos, esta vía no ocurre en el contexto de una enfermedad crónica.
Se ha observado un mayor número de casos y microepidemias de transmisión oral en países latinoamericanos (principalmente en la región amazónica de Brasil). Se ha informado de varios brotes de enfermedad de Chagas aguda que afectan a grupos de personas, a menudo familias, de zonas endémicas. Con mayor frecuencia, la ingesta ocurre mediante açaí hecho en casa, otros productos de palma y jugo de caña de azúcar. No obstante, también puede suceder tras la ingesta de agua contaminada con jugo de frutas y después de comer la carne cruda de animales silvestres.[9]
[Figure caption and citation for the preceding image starts]: Triatoma sanguisuga: especies de vectores con amplia distribución en los EE.UU.Cleber Galvao, PhD, Laboratório Nacional e Internacional de Referência em Taxonomia de Triatomíneos, Instituto Oswaldo Cruz, Rio de Janeiro, Brazil; utilizado con autorización [Citation ends].
Fisiopatología
El parásito generalmente se transmite por un insecto triatomino infectado. Los triatominos se esconden en los nidos o lugares de descanso de los animales salvajes y se alimentan de sangre mientras el animal duerme (ciclo selvático). Algunas de estas especies de insectos se han adaptado a las viviendas humanas, donde se ocultan en grietas y emergen por la noche para alimentarse de sangre (ciclo doméstico). Dentro del intestino del vector, Trypanosoma cruzi experimenta varias etapas sucesivas de desarrollo, la última de las cuales consiste en una forma flagelada que vive en el recto del vector. La ingesta de sangre provoca que el vector defeque y deposite heces que contienen tripomastigotes metacíclicos infecciosos en la piel de la víctima, cerca de la herida causada por la picadura. Al despertar, la víctima suele frotar la comezón de la zona de la picadura, de manera que empuja las heces cargadas de tripanosomas hacia el interior de la herida o hacia la conjuntiva. Los tripomastigotes metacíclicos entran en el torrente sanguíneo de la víctima a través de la herida o penetran en las membranas mucosas, como la conjuntiva (lo que conduce al signo de Romaña). Esto inicia la fase aguda de la enfermedad.[4][26][42] Esta forma infecciosa del parásito invade las células macrófagas y se transforma en amastigotes intracelulares. Los amastigotes se multiplican mediante fisión binaria y se liberan como tripomastigotes en el torrente sanguíneo y en los tejidos.[4][12][26]
El periodo de incubación varía según el modo de transmisión. El periodo de incubación después de la transmisión vectorial es de entre 4 y 15 días; después de la transmisión transfusional es de 30 días o más (hasta 4 meses); después de ingerir alimentos o bebida contaminados es de entre 3 y 22 días; y después de la transmisión accidental es de hasta 20 días. La transmisión materno-fetal puede ocurrir en cualquier momento del periodo de gestación o durante el parto.[57][58][59][60][61]
Los tripomastigotes infectan nuevas células de varios tejidos (p. ej., sistema reticuloendotelial, miocardio, músculos, sistema nervioso) y se transforman en amastigotes intracelulares. Tras la infección, las respuestas inflamatorias, las lesiones celulares y la fibrosis ocurren secuencialmente (en su mayor parte en el corazón, el esófago y el colon). En la fase aguda, ocurren varios ciclos de multiplicación intracelular del parásito. Esto conduce a una alta parasitemia que amplifica aún más la inflamación y las lesiones celulares, aunque este proceso es menos intenso durante la enfermedad de Chagas crónica.
Los miocitos y las células nerviosas (que causan desnervación autónoma) se ven generalmente afectados. La destrucción directa ocurre mediante parasitismo intracelular, necrosis relacionada con la inflamación y otros mecanismos citotóxicos. La fibrosis en la cardiomiopatía de Chagas es más intensa que la fibrosis asociada a cualquier otra enfermedad cardíaca. La afectación cardíaca en la fase crónica se debe a la destrucción del sistema de conducción, los miocitos y los nervios cardíacos parasimpáticos. En asociación con la aparición de focos eléctricos arritmogénicos en las zonas inflamatorias, da lugar a un síndrome arrítmico.[4][62][63][64][65] La hipertrofia de los miocitos y la fibrosis intensa que sustituye las células destruidas predisponen a la dilatación y a la insuficiencia cardíacas. La pared ventricular izquierda se vuelve más delgada, de forma que generalmente permite la formación de un aneurisma apical. En este tipo de aneurismas a menudo se presentan trombos, lo que explica con facilidad los casos comunes de tromboembolia sistémica y pulmonar.[4][14][64]
La desnervación intramural parasimpática se encuentra de manera irregular en el sistema gastrointestinal y afecta principalmente al esófago y al colon (con mayor frecuencia, al colon sigmoide). El intestino afectado puede presentar una apariencia macroscópica normal con alteraciones peristálticas funcionales, pero también se puede dilatar, lo que conduce a un megaesófago o megacolon. El vólvulo del colon sigmoide es una complicación que se presenta en casos raros, aparece en casos avanzados y está asociado a un riesgo alto de necrosis intestinal.[66][67][68][69][70]
Los factores que predisponen a un paciente en la fase indeterminada de la infección por T. cruzi a desarrollar una enfermedad sintomática no están definidos. Son muchos los factores que pueden contribuir.[71][72] Estos incluyen: exposición a la reinfección por T. cruzi en zonas con transmisión vectorial sostenida; sexo masculino; carga parasitaria; factores genéticos del huésped; estados nutricionales; contexto social y calidad de vida de los pacientes; y presencia de comorbilidades (importantes en la patogénesis de la enfermedad de Chagas crónica sintomática/determinada).[72]
[Figure caption and citation for the preceding image starts]: Ciclo de vida de Trypanosoma cruzi, el parásito causante de la enfermedad de ChagasCenters for Disease Control and Prevention, Atlanta, GA, USA: Public Health Image Library ID # 3384 (Alexander J. da Silva, PhD/Melanie Moser, 2002) [Citation ends].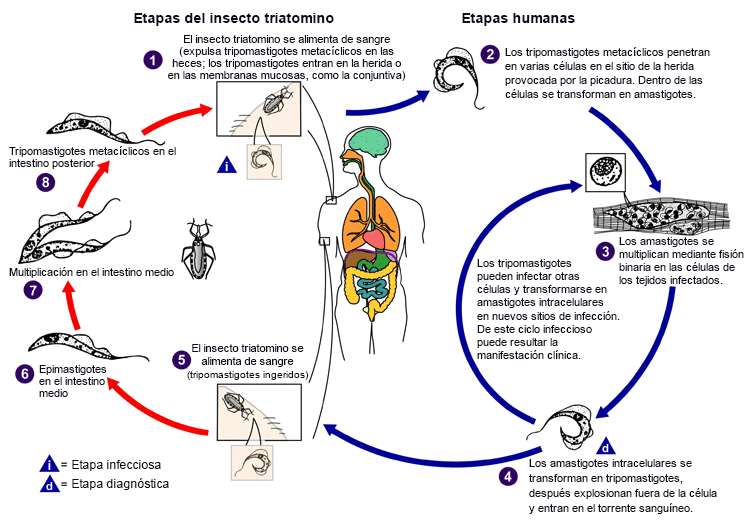
Clasificación
Etapas clínicas de la infección
Fase aguda
Generalmente dura de 3 a 8 semanas (hasta 12 semanas en algunos casos) y se define por la evidencia de Trypanosoma cruzi en la sangre periférica. Los pacientes permanecen infectados de por vida si no reciben tratamiento durante esta fase. La mayoría de los pacientes no presentan síntomas, o presentan síntomas leves o un síndrome febril inespecífico. En raras ocasiones, pueden presentar síntomas más graves como miocarditis o meningoencefalitis.[9][10]
Fase crónica
Se desarrolla después de muchas décadas si no se administra un tratamiento adecuado durante la fase aguda. Aproximadamente del 60% al 70% de las personas infectadas permanecen asintomáticas a lo largo de su vida, mientras que del 20% al 30% de los pacientes desarrollan una enfermedad sintomática.[2][11] La enfermedad asintomática avanza a enfermedad sintomática crónica a una tasa de 1.85% a 7.00% anual.[2]
Las diversas formas clínicas de la enfermedad pueden presentarse por separado o simultáneamente:
Forma indeterminada: la forma más frecuente. Los pacientes pueden ser asintomáticos durante décadas después de la fase aguda. Aunque la serología es positiva para T. cruzi, estos pacientes presentan resultados normales anatómicamente y fisiológicamente en rayos X del corazón, esófago y colon, y ningún cambio anormal en la ecocardiografía.[12]
Forma cardíaca: se presenta entre la 2ª y 4ª década de vida, generalmente de 5 a 15 años tras la infección inicial, y afecta hasta el 30% de los pacientes.[4][13][14]
Forma gastrointestinal: poco frecuente en países al norte del Ecuador. La esofagopatía afecta al 5% al 10% de los pacientes, y la colonopatía afecta al 3% al 5% de los pacientes.[13]
Forma mixta (cardíaca y gastrointestinal).
Fase de reactivación
La enfermedad crónica puede agudizarse en pacientes inmunocomprometidos (p. ej., SIDA, cánceres hematológicos, post-trasplante de órganos, tratamiento inmunosupresor en dosis altas) debido a la reactivación de T. cruzi.[15] Los pacientes suelen presentar meningoencefalitis o miocarditis; sin embargo, también pueden presentarse manifestaciones dermatológicas.[8][16]
La reactivación de la enfermedad de Chagas es parte de los criterios de diagnóstico del SIDA en Brasil.[17][18]
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad