O tratamento da leishmaniose é complexo e, após discutir as opções de medicamento de uso primário de maneira mais geral, a discussão é agrupada por grande síndrome clínica. É importante reconhecer que a literatura disponível sobre o tratamento varia em metodologia, com relativamente poucos ensaios clínicos bem controlados e uma diversidade de endpoints do tratamento.
Para todos os tipos de leishmaniose, fatores dos parasitas e do hospedeiro podem influenciar os desfechos do tratamento. Não apenas os desfechos do tratamento podem variar de acordo com as espécies, mas também há diferenças observadas em uma única espécie e em diferentes regiões geográficas. Por exemplo, a resposta ao tratamento da leishmaniose visceral (LV) causada por Leishmania donovani varia significativamente entre o sul da Ásia e a África Oriental, sendo a anfotericina B lipossomal de preferência na primeira e os compostos antimoniais pentavalentes mantendo maior eficácia na segunda.[107]Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet. 2018 Sep 15;392(10151):951-70.
http://www.ncbi.nlm.nih.gov/pubmed/30126638?tool=bestpractice.com
Fatores do hospedeiro que influenciam na resposta ao tratamento incluem o estado nutricional e a presença de imunocomprometimento, como HIV/AIDS.
Além de tratar o parasita, deve-se considerar o tratamento de coinfecções e/ou cuidados de suporte, particularmente na LV. O objetivo da terapia em todas as formas de leishmaniose é a cura clínica, reconhecendo que os parasitas de Leishmania provavelmente persistem após o tratamento.[108]Martínez-Valencia AJ, Daza-Rivera CF, Rosales-Chilama M, et al. Clinical and parasitological factors in parasite persistence after treatment and clinical cure of cutaneous leishmaniasis. PLoS Negl Trop Dis. 2017 Jul 13;11(7):e0005713.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5526576
http://www.ncbi.nlm.nih.gov/pubmed/28704369?tool=bestpractice.com
[109]Dereure J, Duong Thanh H, Lavabre-Bertrand T, et al. Visceral leishmaniasis: persistence of parasites in lymph nodes after clinical cure. J Infect. 2003 Jul;47(1):77-81.
http://www.ncbi.nlm.nih.gov/pubmed/12850167?tool=bestpractice.com
As considerações gerais para a escolha do tratamento incluem eficácia regional, segurança, disponibilidade e custo; este últimos dois fatores costumam orientar as decisões de tratamento em ambientes com poucos recursos.
Medicamentos antileishmaniose
Anfotericina B
A anfotericina B lipossomal é a formulação de primeira escolha para o tratamento da leishmaniose, quando disponível. Seu uso é limitado por questões de custo, disponibilidade e necessidade de uma cadeia de refrigeração. Está aprovada na Europa e nos EUA para a LV; o uso em outros tipos de leishmaniose é off-label. Geralmente, a anfotericina B lipossomal é bem tolerada e apresenta efeitos adversos como reações relacionadas à infusão (por exemplo, calafrios, febre), náuseas, vômitos, hipocalemia e insuficiência renal.[110]Berman JD. U.S Food and Drug Administration approval of AmBisome (liposomal amphotericin B) for treatment of visceral leishmaniasis. Clin Infect Dis. 1999 Jan;28(1):49-51.
https://academic.oup.com/cid/article/28/1/49/302484?login=false
http://www.ncbi.nlm.nih.gov/pubmed/10391695?tool=bestpractice.com
[111]Berman JD, Badaro R, Thakur CP, et al. Efficacy and safety of liposomal amphotericin B (AmBisome) for visceral leishmaniasis in endemic developing countries. Bull World Health Organ. 998;76(1):25-32.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2305623
http://www.ncbi.nlm.nih.gov/pubmed/9615494?tool=bestpractice.com
[112]Bern C, Adler-Moore J, Berenguer J, et al. Liposomal amphotericin B for the treatment of visceral leishmaniasis. Clin Infect Dis. 2006 Oct 1;43(7):917-24.
http://cid.oxfordjournals.org/content/43/7/917.full
http://www.ncbi.nlm.nih.gov/pubmed/16941377?tool=bestpractice.com
A anfotericina desoxicolato é uma opção caso a formulação lipossomal não esteja disponível; os efeitos adversos são similares, mas mais frequentes e graves, e a administração é mais complicada.[113]Olliaro PL, Guerin PJ, Gerstl S, et al. Treatment options for visceral leishmaniasis: a systematic review of clinical studies done in India, 1980-2004. Lancet Infect Dis. 2005 Dec;5(12):763-74.
http://www.ncbi.nlm.nih.gov/pubmed/16310148?tool=bestpractice.com
[114]Sundar S, Mehta H, Suresh AV, et al. Amphotericin B treatment for Indian visceral leishmaniasis: conventional versus lipid formulations. Clin Infect Dis. 2004 Feb 1;38(3):377-83.
http://cid.oxfordjournals.org/content/38/3/377.full
http://www.ncbi.nlm.nih.gov/pubmed/14727208?tool=bestpractice.com
Outras formulações lipídicas de anfotericina B, quando disponíveis, foram analisadas de maneira menos rigorosa e parecem ser inferiores à anfotericina B lipossomal.[115]Yardley V, Croft SL. A comparison of the activities of three amphotericin B lipid formulations against experimental visceral and cutaneous leishmaniasis. Int J Antimicrob Agents. 2000 Feb;13(4):243-8.
http://www.ncbi.nlm.nih.gov/pubmed/10755238?tool=bestpractice.com
A anfotericina B é o único medicamento antileishmaniose com dados de segurança para uso na gestação.
Miltefosina
A miltefosina é único medicamento antileishmaniose oral disponível.
O uso da miltefosina é limitado por:
Al] de teratogenicidade na gestação. As mulheres não podem estar grávidas e devem fazer uso de contracepção eficaz durante o tratamento e pelo menos 5 meses depois de concluí-lo
Efeitos adversos gastrointestinais significativos, incluindo náuseas, vômitos e dor abdominal.
Resistência natural ou nova em algumas regiões.[116]Carnielli JBT, Crouch K, Forrester S, et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 2018 Oct;36:83-91.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6197651
http://www.ncbi.nlm.nih.gov/pubmed/30268832?tool=bestpractice.com
[117]Tiwary P, Kumar D, Sundar S. Identification and functional validation of a biomarker for the diagnosis of miltefosine relapse during visceral leishmaniasis. Am J Trop Med Hyg. 2018 Feb;98(2):492-6.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6197651
http://www.ncbi.nlm.nih.gov/pubmed/29280431?tool=bestpractice.com
A miltefosina está aprovada nos EUA (mas não na Europa) para uso em:
LV causada por Leishmania donovani
Leishmaniose cutânea (CL) devido a Leishmania braziliensis, Leishmania guyanensis e Leishmania panamensis
Leishmaniose mucosa (LM) devido à Leishmania braziliensis.
Compostos de antimônio pentavalente
Medicamentos específicos incluem estibogluconato de sódio e antimoniato de meglumina. Geralmente, são preferíveis produtos de marca devido ao seu conteúdo mais confiável e à menor toxicidade.[121]Sundar S, Chakravarty J. Antimony toxicity. Int J Environ Res Public Health. 2010 Dec;7(12):4267-77.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3037053
http://www.ncbi.nlm.nih.gov/pubmed/21318007?tool=bestpractice.com
Nos EUA, não há compostos antimoniais pentavalentes aprovados pela Food and Drug Administration (FDA) atualmente disponíveis. Na Europa, o estibogluconato de sódio está licenciado para uso nas principais formas de leishmaniose.
Foram observadas diferenças regionais significativas na eficácia, com alto nível de resistência no sul da Ásia.[122]Sundar S. Drug resistance in Indian visceral leishmaniasis. Trop Med Int Health. 2001 Nov;6(11):849-54.
https://onlinelibrary.wiley.com/doi/full/10.1046/j.1365-3156.2001.00778.x
http://www.ncbi.nlm.nih.gov/pubmed/11703838?tool=bestpractice.com
Paromomicina
A paromomicina é um aminoglicosídeo que pode ser administrado de maneira tópica na LC ou por via intramuscular na LV, e, geralmente, é usada em associação com outro agente.
As preparações intramuscular e tópica de paromomicina não estão aprovadas para uso nos EUA ou Europa. As preparações orais estão aprovadas nos EUA para outras indicações e podem ser usadas para compor pomadas tópicas, mas seu uso é off-label.
Quando usada de maneira tópica, a paromomicina pode causar reações leves a moderadas no local da aplicação, inclusive vermelhidão, dor, inchaço, queimação e prurido. Os efeitos adversos da paromomicina sistêmica incluem dor significativa no local da injeção, aminotransferases elevadas, insuficiência renal e ototoxicidade reversível.
Faltam dados de segurança para o uso de paromomicina durante a gestação.
Pentamidina
Geralmente, seu uso limita-se a situações específicas na LC e à profilaxia secundária em pacientes imunocomprometidos.
A pentamidina está disponível nos EUA, mas seu uso na leishmaniose é off-label. Está aprovada na Europa para o tratamento da LC.
Os efeitos adversos são significativos e incluem diabetes mellitus, pancreatite, sintomas gastrointestinais, hipotensão, prolongamento do QT, distúrbios eletrolíticos, nefrotoxicidade, hepatotoxicidade, citopenias e rabdomiólise. Esses efeitos são mitigados quando o medicamento é administrado por via intralesional para leishmaniose cutânea.
Não há dados disponíveis sobre a segurança da pentamidina na gestação.
Outros medicamentos, como os antifúngicos azólicos, podem desempenhar um papel em algumas situações específicas.
Leishmaniose cutânea: princípios gerais
O tratamento adequado é individualizado para cada paciente com LC. As diretrizes da Infectious Diseases Society of America (IDSA)/American Society of Tropical Medicine and Hygiene (ASTMH) classificam a leishmaniose cutânea em simples ou complexa.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
LC simples:
Sem comprometimento da mucosa e espécies de parasitas não associadas à LM
≤4 lesões <1 cm
Localização viável para terapia local e/ou pele não exposta (não importante do ponto de vista cosmético)
Hospedeiro imunocompetente
Lesões que remitem sem terapia.
LC complexa:
Espécies de parasitas causadas por espécies associadas à LM
Nódulos subcutâneos locais
Grande adenopatia regional
>4 lesões, geralmente >1 cm
Lesão individual ≥5 cm
O tamanho ou o local inviabilizam a terapia e/ou lesão no rosto, dedos das mãos, dedos dos pés, articulações ou genitália.
Hospedeiro imunocomprometido
Fracasso da terapia local
Síndromes incomuns (leishmaniose recidiva, leishmaniose cutânea difusa ou leishmaniose disseminada).
Em ambientes com abundância de recursos, o diagnóstico parasitológico com identificação de espécies é ideal para orientar o tratamento, e deve ser obtido. Em ambientes com poucos recursos, deve-se tentar confirmar o diagnóstico o máximo possível, devido aos efeitos adversos significativos associados ao tratamento.[123]Croft SL, Yardley V. Chemotherapy of leishmaniasis. Curr Pharm Des. 2002;8(4):319-42.
http://www.ncbi.nlm.nih.gov/pubmed/11860369?tool=bestpractice.com
[124]Amato VS, Tuon FF, Siqueira AM, et al. Treatment of mucosal leishmaniasis in Latin America: systematic review. Am J Trop Med Hyg. 2007 Aug;77(2):266-74.
http://www.ncbi.nlm.nih.gov/pubmed/17690398?tool=bestpractice.com
[125]Oliveira LF, Schubach AO, Martins MM, et al. Systematic review of the adverse effects of cutaneous leishmaniasis treatment in the New World. Acta Tropica. 2011 May;118(2):87-96.
http://www.ncbi.nlm.nih.gov/pubmed/21420925?tool=bestpractice.com
Nos casos em que as espécies não podem ser determinadas, o conhecimento dos padrões de prevalência regional (velho mundo versus novo mundo) e local pode ajudar na orientação da terapia. Por exemplo, um paciente com LC do "cinturão da mucosa" da Bolívia, Brasil e Peru pode estar em maior risco de disseminação da forma mucosa e, portanto, deve-se considerar o monitoramento de pacientes sem um diagnóstico claro específico da espécie para o desenvolvimento de doença da mucosa após tratamento da(s) lesão(s) primária(s) da pele.
A LC simples pode requerer apenas a vigilância ativa ou, para acelerar a cura, pode ser tratada com terapias locais ou, potencialmente, com antifúngicos azólicos. Geralmente, a LC complexa requer terapia sistêmica para evitar incapacidade e estigma social e/ou para prevenir a disseminação do parasita (por exemplo, leishmaniose mucosa [LM]) ou recidiva.
Para todos os casos de LC ulcerativa, deve-se adotar cuidados para garantir o tratamento adequado da ferida, inclusive a lavagem da(s) úlcera(s) e a aplicação de pomada para formar uma barreira. A presença de quentura, vermelhidão, dor e/ou secreção purulenta deve requerer a avaliação e o tratamento de uma infecção bacteriana secundária. Geralmente, as evidências de cura começam com achatamento, e as úlceras grandes podem não cicatrizar completamente até o fim do tratamento.
CDC: parasites – leishmaniasis
Opens in new window
As recomendações de tratamento para situações específicas são dadas abaixo; no entanto, a maioria dos estudos sobre o tratamento da LC tem sido mal planejada e relatada, resultando em falta de evidências claras de tratamentos potencialmente benéficos. Há necessidade de estudos grandes e bem conduzidos que avaliem os efeitos em longo prazo das terapias atuais e avaliem as taxas de recorrência da leishmaniose cutânea e sua progressão para doença da mucosa.[126]Heras-Mosteiro J, Monge-Maillo B, Pinart M, et al. Interventions for Old World cutaneous leishmaniasis. Cochrane Database Syst Rev. 2017 Nov 17;11(11):CD005067.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005067.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/29149474?tool=bestpractice.com
[127]Pinart M, Rueda JR, Romero GA, et al. Interventions for American cutaneous and mucocutaneous leishmaniasis. Cochrane Database Syst Rev. 2020 Aug 27;8(8):CD004834.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004834.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/32853410?tool=bestpractice.com
Leishmaniose cutânea: tratamento específico
Leishmaniose cutânea simples
Para a LC simples, as opções incluem vigilância ativa, tratamentos locais ou medicamentos sistêmicos menos tóxicos.
A maior parte dos casos de LC, principalmente entre espécies do Velho Mundo, apresenta resolução espontânea em 18 meses; portanto, é importante decidir se o tratamento é realmente indicado.[107]Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet. 2018 Sep 15;392(10151):951-70.
http://www.ncbi.nlm.nih.gov/pubmed/30126638?tool=bestpractice.com
[128]Morizot G, Kendjo E, Mouri O, et al. Travelers with cutaneous leishmaniasis cured without systemic therapy. Clin Infect Dis. 2013 Aug;57(3):370-80.
https://academic.oup.com/cid/article/57/3/370/461927
http://www.ncbi.nlm.nih.gov/pubmed/23633111?tool=bestpractice.com
Essa decisão deve ser individualizada, levando em consideração fatores como o início ou não da cicatrização, o comprometimento da cicatrização da ferida, o risco de infecções secundárias, a preferência do paciente, a presença ou ausência de evidências de comprometimento da imunidade celular e a disponibilidade/experiência no tratamento.
Entre os indivíduos submetidos ao tratamento, as opções de terapia local incluem crioterapia, termoterapia e medicamentos tópicos ou intralesionais. Antes de iniciar qualquer terapia local, deve-se remover todas as crostas, se presentes.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
Crioterapia: consiste em congelar a lesão e circundar 1 a 2 cm de pele saudável com nitrogênio líquido até ficar branco, permitindo que a área descongele e, em seguida, congelar novamente. As diretrizes da IDSA/ASTMH recomendam uma sessão de crioterapia a cada 3 semanas, por até três vezes no total.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
A eficácia da crioterapia por lesão é de 67% em todas as regiões e é estatisticamente igual à dos compostos antimoniais intralesionais.[129]López-Carvajal L, Cardona-Arias JA, Zapata-Cardona MI, et al. Efficacy of cryotherapy for the treatment of cutaneous leishmaniasis: meta-analyses of clinical trials. BMC Infect Dis. 2016 Jul 26;16:360.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4960741
http://www.ncbi.nlm.nih.gov/pubmed/27456008?tool=bestpractice.com
Os efeitos adversos incluem dor e vermelhidão transitórias e hipopigmentação.
Termoterapia: utiliza calor administrado na lesão, geralmente em um único tratamento, resultando em queimadura de segundo grau, o que gera a necessidade de anestesia. Uma metanálise apresentou 73% de eficácia em todas as regiões, o que equivale à terapia sistêmica antimonial, mas com menos efeitos adversos.[130]Cardona-Arias JA, Vélez ID, López-Carvajal L. Efficacy of thermotherapy to treat cutaneous leishmaniasis: a meta-analysis of controlled clinical trials. 2015 May 26;10(5):e0122569.
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0122569
http://www.ncbi.nlm.nih.gov/pubmed/26009885?tool=bestpractice.com
A eficácia pode ser ainda maior no Velho Mundo, com taxas de cura de até 94% em Leishmania tropica.[107]Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet. 2018 Sep 15;392(10151):951-70.
http://www.ncbi.nlm.nih.gov/pubmed/30126638?tool=bestpractice.com
Os efeitos adversos incluem celulite, vermelhidão e dor no local do tratamento, e as diretrizes dos EUA recomendam o uso de antibióticos tópicos por vários dias após o procedimento.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
Essa modalidade de tratamento exige o uso de equipamentos especiais e um operador treinado nesse equipamento, o que limita sua aplicabilidade em maior escala.
Paromomicina tópica: o medicamento tópico mais bem estudado para o tratamento da LC. Na literatura, a eficácia varia de acordo com a formulação precisa; portanto, as versões comercial e composta podem não ser equivalentes ao relatado. A paromomicina pode ser usada isoladamente ou em conjunto com o cloreto de metilbenzetônio, ureia ou gentamicina.[126]Heras-Mosteiro J, Monge-Maillo B, Pinart M, et al. Interventions for Old World cutaneous leishmaniasis. Cochrane Database Syst Rev. 2017 Nov 17;11(11):CD005067.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005067.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/29149474?tool=bestpractice.com
Na doença do Velho Mundo com Leishmania major ulcerativa, observou-se uma taxa de cura global de aproximadamente 80% (com ou sem a adição de gentamicina) em comparação com 57% no braço com apenas o veículo.[131]Ben Salah A, Ben Messaoud N, Guedri E, et al. Topical paromomycin with or without gentamicin for cutaneous leishmaniasis. N Engl J Med. 2013 Feb 7;368(6):524-32.
http://www.ncbi.nlm.nih.gov/pubmed/23388004?tool=bestpractice.com
Em dois estudos no Novo Mundo entre lesões causadas por L panamensis, L guyanensis ou L braziliensis, produtos semelhantes à paromomicina apresentaram taxas de cura de 77% a 79%.[132]Sosa N, Pascale JM, Jiménez AI, et al. Topical paromomycin for New World cutaneous leishmaniasis. PLoS Negl Trop Dis. 2019 May 2;13(5):e0007253.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6497224
http://www.ncbi.nlm.nih.gov/pubmed/31048871?tool=bestpractice.com
[133]Soto J, Soto P, Ajata A, et al. Topical 15% paromomycin-aquaphilic for Bolivian Leishmania braziliensis cutaneous leishmaniasis: a randomized, placebo-controlled trial. Clin Infect Dis. 2019 Feb 15;68(5):844-9.
https://academic.oup.com/cid/article/68/5/844/5107841
http://www.ncbi.nlm.nih.gov/pubmed/30260376?tool=bestpractice.com
Estudos mais antigos no Novo Mundo mostraram taxas mais baixas de eficácia (aproximadamente 50%) com várias formulações diferentes de paromomicina; no entanto, as taxas de cura com compostos de antimônio pentavalente sistêmico nesses estudos foram similares (74%) à paromomicina tópica em estudos mais recentes.[134]Kim DH, Chung HJ, Bleys J, et al. Is paromomycin an effective and safe treatment against cutaneous leishmaniasis? A meta-analysis of 14 randomized controlled trials. PLoS Negl Trop Dis. 2009;3(2):e381.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2637543
http://www.ncbi.nlm.nih.gov/pubmed/19221595?tool=bestpractice.com
No Panamá, 3% dos pacientes tratados com paromomicina tópica desenvolveram doença na mucosa que precisou de tratamento sistêmico.[132]Sosa N, Pascale JM, Jiménez AI, et al. Topical paromomycin for New World cutaneous leishmaniasis. PLoS Negl Trop Dis. 2019 May 2;13(5):e0007253.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6497224
http://www.ncbi.nlm.nih.gov/pubmed/31048871?tool=bestpractice.com
O risco de doença da mucosa entre pacientes com parasitas do subgênero Viannia continua sendo uma preocupação significativa que justifica um monitoramento atento se o tratamento tópico for escolhido versus a opção inicial pela terapia sistêmica.
Terapia intralesional: consiste em injetar as lesões com um medicamento antileishmaniose, mais comumente um composto de antimônio pentavalente. A dor da injeção pode ser significativa. No Velho Mundo, os melhores resultados foram observados ao combinar estibogluconato de sódio intralesional e crioterapia, com taxas de cura registradas de 89% a 91%.[107]Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet. 2018 Sep 15;392(10151):951-70.
http://www.ncbi.nlm.nih.gov/pubmed/30126638?tool=bestpractice.com
Embora as evidências do Novo Mundo sejam menos sólidas e ainda haja preocupações referentes à LM, uma metanálise mostrou uma eficácia conjunta de 75%, mas com preferência pelo antimoniato de meglumina (eficácia de 82%) sobre o estibogluconato de sódio, que é preferido no Velho Mundo.[135]Brito NC, Rabello A, Cota GF. Efficacy of pentavalent antimoniate intralesional infiltration therapy for cutaneous leishmaniasis: a systematic review. PLoS One. 2017 Sep 19;12(9):e0184777.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5604971
http://www.ncbi.nlm.nih.gov/pubmed/28926630?tool=bestpractice.com
O estibogluconato de sódio está disponível para uso intralesional na Europa, mas não nos EUA. A pentamidina também pode ser usada por via intralesional.[136]Soto J, Paz D, Rivero D, et al. Intralesional pentamidine: a novel therapy for single lesions of Bolivian cutaneous leishmaniasis. Am J Trop Med Hyg. 2016 Apr;94(4):852-6.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4824229
http://www.ncbi.nlm.nih.gov/pubmed/26903605?tool=bestpractice.com
Outras metodologias, como a terapia fotodinâmica ou a laserterapia de CO₂, são possíveis terapias alternativas locais, mas evidências limitadas impedem fazer recomendações quanto ao seu uso.[Figure caption and citation for the preceding image starts]: Injeção intralesional para o tratamento da leishmaniose cutâneaImagem cortesia da Organização Mundial da Saúde [Citation ends].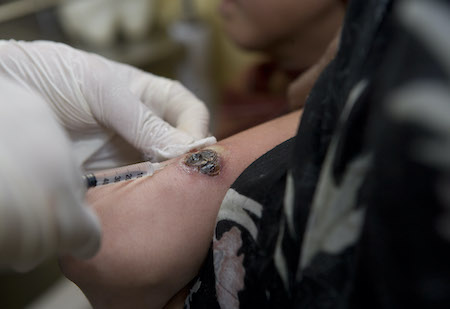
Geralmente, a terapia sistêmica é reservada para a doença complexa, mas a terapia com antifúngico azólico pode ser uma opção na LC simples.
Fluconazol, itraconazol e cetoconazol foram avaliados e estão disponíveis no mundo todo, embora o uso na LC seja off-label nos EUA e na Europa.
Todos têm efeitos adversos gastrointestinais e risco de hepatotoxicidade, mas o cetoconazol está relacionado ao risco de hepatotoxicidade que representa risco de vida e prolongamento QT que pode causar arritmias fatais.
Uma revisão sistemática não encontrou evidências suficientes para recomendar rotineiramente qualquer antifúngico azólico, mas no Novo Mundo a eficácia combinada do cetoconazol no tratamento de Leishmania mexicana foi de até 89%, sugerindo isso como uma opção potencial no México e em partes da América Central com o monitoramento apropriado dos efeitos adversos.[137]Galvão EL, Rabello A, Cota GF. Efficacy of azole therapy for tegumentary leishmaniasis: a systematic review and meta-analysis. PLoS One. 2017 Oct 9;12(10):e0186117.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5633178
http://www.ncbi.nlm.nih.gov/pubmed/29016694?tool=bestpractice.com
Leishmaniose cutânea complexa
Na LC complexa, a terapia sistêmica é preferível devido à extensão ou à localização da lesão, antes do fracasso da terapia local e/ou risco de disseminação.
Miltefosina: uma opção mais recente para LC. É aprovado para parasitas do subgênero Viannia no Novo Mundo, mas mesmo nesse contexto há variabilidade regional. As taxas de cura no Brasil, Bolívia e Colômbia variam de 71% a 91% para as espécies de Viannia, mas na Guatemala a taxa de cura foi de apenas 33% para L braziliensis.[138]Chakravarty J, Sundar S. Current and emerging medications for the treatment of leishmaniasis. Expert Opin Pharmacother. 2019 Jul;20(10):1251-65.
http://www.ncbi.nlm.nih.gov/pubmed/31063412?tool=bestpractice.com
Compostos antimoniais pentavalentes (estibogluconato de sódio, antimoniato de meglumina): geralmente eficazes, mas menos favoráveis devido à toxicidade e duração do tratamento associadas. Na doença do Velho Mundo, as taxas de cura variam de 98% para L major e tão baixas quanto 41% para L tropica. No Novo Mundo, a eficácia varia de 77% a 90%, mas níveis significativos de falha no tratamento são observados entre os parasitas do subgênero Viannia, especialmente L braziliensis, e também em certas regiões geográficas, como L mexicana na Guatemala ou entre espécies de Leishmania nas regiões da selva meridional do Peru, na fronteira com a Bolívia.[138]Chakravarty J, Sundar S. Current and emerging medications for the treatment of leishmaniasis. Expert Opin Pharmacother. 2019 Jul;20(10):1251-65.
http://www.ncbi.nlm.nih.gov/pubmed/31063412?tool=bestpractice.com
Anfotericina B lipossomal: provavelmente eficaz para a LC complexa, mas os dados limitam-se a estudos observacionais e vários ensaios clínicos pequenos. Dados retrospectivos de várias regiões variam de 46% a 84% de cura, mas ensaios clínicos pequenos realizados na Bolívia apresentaram taxas de 85% a 100%.[138]Chakravarty J, Sundar S. Current and emerging medications for the treatment of leishmaniasis. Expert Opin Pharmacother. 2019 Jul;20(10):1251-65.
http://www.ncbi.nlm.nih.gov/pubmed/31063412?tool=bestpractice.com
Pentamidina: tem um papel limitado no tratamento de LC no Novo Mundo causado por L guyanensis na Guiana Francesa e Suriname, com taxas de cura geralmente relatadas de 84% a 90%.[139]Roussel M, Nacher M, Frémont G, et al. Comparison between one and two injections of pentamidine isethionate, at 7 mg/kg in each injection, in the treatment of cutaneous leishmaniasis in French Guiana. Ann Trop Med Parasitol. 2006 Jun;100(4):307-14.
http://www.ncbi.nlm.nih.gov/pubmed/16762111?tool=bestpractice.com
[140]Lai A Fat EJ, Vrede MA, Soetosenojo RM, et al. Pentamidine, the drug of choice for the treatment of cutaneous leishmaniasis in Surinam. Int J Dermatol. 2002 Nov;41(11):796-800.
http://www.ncbi.nlm.nih.gov/pubmed/12453009?tool=bestpractice.com
A injeção intravenosa é preferível à injeção intramuscular, pois foi observada maior eficácia com a administração intravenosa (85% de cura com injeção intravenosa versus 51% com injeção intramuscular).[141]Christen JR, Bourreau E, Demar M, et al. Use of the intramuscular route to administer pentamidine isethionate in Leishmania guyanensis cutaneous leishmaniasis increases the risk of treatment failure. Travel Med Infect Dis. 2018 Jul - Aug;24:31-6.
http://www.ncbi.nlm.nih.gov/pubmed/29482012?tool=bestpractice.com
Outro uso potencial na Bolívia é a pentamidina intralesional, com uma eficácia relatada de 73%, mas isso pode não ter impacto sobre o risco de disseminação na mucosa.[136]Soto J, Paz D, Rivero D, et al. Intralesional pentamidine: a novel therapy for single lesions of Bolivian cutaneous leishmaniasis. Am J Trop Med Hyg. 2016 Apr;94(4):852-6.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4824229
http://www.ncbi.nlm.nih.gov/pubmed/26903605?tool=bestpractice.com
No entanto, a combinação desse mesmo esquema com 28 dias de miltefosina resultou em taxas de cura de 92%, com a vantagem de um tratamento sistêmico, mas com duração e custos mais elevados.[142]Soto J, Soto P, Ajata A, et al. Miltefosine combined with intralesional pentamidine for Leishmania braziliensis cutaneous leishmaniasis in Bolivia. Am J Trop Med Hyg. 2018 Nov;99(5):1153-5.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6221230
http://www.ncbi.nlm.nih.gov/pubmed/30255833?tool=bestpractice.com
Em outros cenários, os efeitos adversos e a eficácia relativamente menor da pentamidina costumam impedir seu uso. Isso pode ser devido em parte à subdosagem com base no sal (isetionato) versus a base.[143]Dorlo TP, Kager PA. Pentamidine dosage: a base/salt confusion. PLoS Negl Trop Dis. 2008 May 28;2(5):e225.
https://www.doi.org/10.1371/journal.pntd.0000225
http://www.ncbi.nlm.nih.gov/pubmed/18509543?tool=bestpractice.com
O tratamento de outras formas complexas de LC, incluindo leishmaniose disseminada, leishmaniose cutânea difusa e leishmaniose recidiva, deve ser orientado por especialistas, pois o tratamento pode ser desafiador e os dados são limitados.
A anfotericina B lipossomal tem sido usada com sucesso razoável na leishmaniose disseminada (taxa de cura de 75%).[144]Machado PR, Rosa ME, Guimarães LH, et al. Treatment of disseminated leishmaniasis with liposomal amphotericin B. Clin Infect Dis. 2015 Sep 15;61(6):945-9.
https://academic.oup.com/cid/article/61/6/945/450907
http://www.ncbi.nlm.nih.gov/pubmed/26048961?tool=bestpractice.com
Para a leishmaniose cutânea difusa, a Organização Pan-Americana da Saúde recomenda o tratamento em um centro de referência e lista compostos antimoniais pentavalentes, pentamidina ou miltefosina como opções potenciais.[145]Pan American Health Organization. Guideline for the treatment of Leishmaniasis in the Americas. Second edition. Sep 2022 [internet publication].
https://iris.paho.org/handle/10665.2/56120
No entanto, pode ser desafiador alcançar a cura nesses pacientes.
Pode ser frustrante tratar a leishmaniose recidivada.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
Um esquema potencial combina um composto de antimônio pentavalente e alopurinol por 30 dias.[146]Esfandiarpour I, Dabiri SH. Treatment of cutaneous leishmaniasis recidivans with a combination of allopurinol and meglumine antimoniate: a clinical and histologic study. Int J Dermatol. 2007 Aug;46(8):848-52.
http://www.ncbi.nlm.nih.gov/pubmed/17651170?tool=bestpractice.com
A anfotericina lipossomal e a miltefosina são frequentemente usadas.
Pacientes gestantes
O tratamento da doença cutânea simples e complexa em gestantes é altamente individualizado. Se possível, o tratamento deve ser adiado até terminar o período gestacional, mesmo em caso de lesões exofíticas; no entanto, pode haver aumento do risco de nascimento pré-termo e natimorto em pacientes com LC não tratada.[147]Morgan DJ, Guimaraes LH, Machado PR, et al. Cutaneous leishmaniasis during pregnancy: exuberant lesions and potential fetal complications. Clin Infect Dis. 2007 Aug 15;45(4):478-82.
https://academic.oup.com/cid/article/45/4/478/426772
http://www.ncbi.nlm.nih.gov/pubmed/17638198?tool=bestpractice.com
As preocupações teóricas sobre a transmissão transplacentária da LC existem com base em estudos realizados em camundongos, mas isso não foi relatado em humanos.[148]Avila-García M, Mancilla-Ramírez J, Segura-Cervantes E, et al. Transplacental transmission of cutaneous Leishmania mexicana strain in BALB/c mice. Am J Trop Med Hyg. 2013 Aug;89(2):354-8.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3741259
http://www.ncbi.nlm.nih.gov/pubmed/23798582?tool=bestpractice.com
Geralmente, as terapias locais são preferíveis às terapias sistêmicas, se possível, observando que as terapias intralesionais podem causar absorção sistêmica.
A anfotericina B é o agente de primeira escolha caso a terapia sistêmica seja necessária, devido à sua segurança relativa, comparada com outras opções.
Os compostos de antimônio pentavalente apresentam maior risco de aborto espontâneo e parto prematuro, e seu uso geralmente é evitado durante a gestação.
Leishmaniose mucosa
Pacientes com LM devem sempre receber tratamento com terapia sistêmica. Os dados sólidos são limitados, e a eficácia do tratamento varia; assim, é necessária uma abordagem individualizada à terapia. As opções de terapia incluem compostos de antimônio pentavalente, formulações de anfotericina B, miltefosina e pentamidina. A Organização Pan-Americana da Saúde classifica as evidências de todas as opções como baixas ou muito baixas, mas recomenda veementemente os compostos de antimônio pentavalente.[145]Pan American Health Organization. Guideline for the treatment of Leishmaniasis in the Americas. Second edition. Sep 2022 [internet publication].
https://iris.paho.org/handle/10665.2/56120
[149]Pan American Health Organization. Manual of procedures for leishmaniases surveillance and control in the Americas. Dec 2019 [internet publication].
https://iris.paho.org/handle/10665.2/51838
As diretrizes dos EUA não estratificam as alternativas, apenas classificam a pentamidina como uma alternativa pior.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
Os compostos de antimônio pentavalente são uma primeira escolha razoável em pacientes capazes de tolerar o ciclo. A eficácia varia de 58% com estibogluconato de sódio a 88% com antimoniato de meglumina. Alguns estudos acrescentaram adjuvantes como pentoxifilina ou gamainterferona, mas as evidências são fracas.[124]Amato VS, Tuon FF, Siqueira AM, et al. Treatment of mucosal leishmaniasis in Latin America: systematic review. Am J Trop Med Hyg. 2007 Aug;77(2):266-74.
http://www.ncbi.nlm.nih.gov/pubmed/17690398?tool=bestpractice.com
As formulações de anfotericina B são uma alternativa, principalmente em casos de fracasso do tratamento, recidiva ou intolerância a compostos de antimônio pentavalente. A anfotericina B lipossomal tem menos dados, mas é preferível quando disponível, pois oferece melhor segurança e tolerabilidade.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
Em uma série retrospectiva do Brasil, a taxa de cura foi de 93% para pacientes tratados com anfotericina B lipossomal.[150]Cunha MA, Leão AC, de Cassia Soler R, et al. Efficacy and safety of liposomal amphotericin B for the treatment of mucosal leishmaniasis from the New World: a retrospective study. Am J Trop Med Hyg. 2015 Dec;93(6):1214-8.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4674237
http://www.ncbi.nlm.nih.gov/pubmed/26483120?tool=bestpractice.com
Caso esse tratamento fracasse, a miltefosina pode ser usada, mas as taxas de cura são baixas, exceto na doença clinicamente leve.[151]Soto J, Toledo J, Valda L, et al. Treatment of Bolivian mucosal leishmaniasis with miltefosine. Clin Infect Dis. 2007 Feb 1;44(3):350-6.
https://academic.oup.com/cid/article/44/3/350/312370
http://www.ncbi.nlm.nih.gov/pubmed/17205440?tool=bestpractice.com
Pacientes gestantes
Leishmaniose visceral: princípios gerais
O principal objetivo do tratamento é evitar a morte e alcançar a cura clínica em longo prazo. A erradicação dos parasitas é improvável na maioria dos pacientes, como mostra a reativação da doença após anos da cura clínica inicial e a persistência de parasitas após o tratamento, em uma proporção significativa de pacientes, quando são utilizados métodos de detecção altamente sensíveis (como, por exemplo, reação em cadeia da polimerase).[82]Cruz I, Chicharro C, Nieto J, et al. Comparison of new diagnostic tools for management of pediatric Mediterranean visceral leishmaniasis. J Clin Microbiol. 2006 Jul;44(7):2343-7.
https://journals.asm.org/doi/10.1128/JCM.02297-05?url_ver=Z39.88-2003
http://www.ncbi.nlm.nih.gov/pubmed/16825347?tool=bestpractice.com
[152]Osman OF, Oskam L, Zijlstra EE, et al. Use of the polymerase chain reaction to assess the success of visceral leishmaniasis treatment. Trans R Soc Trop Med Hyg. 1998 Jul-Aug;92(4):397-400.
http://www.ncbi.nlm.nih.gov/pubmed/9850390?tool=bestpractice.com
Como na LC, existem fatores do parasita (geralmente correspondentes a espécies e/ou região geográfica) e fatores do hospedeiro que devem ser considerados ao determinar um curso de tratamento para um indivíduo. Todos os pacientes com doença sintomática devem ser tratados. Não se sabe se o tratamento da infecção latente por LV impediria o desenvolvimento de doença sintomática e não é recomendado, especialmente à luz das toxicidades dos tratamentos disponíveis.
Além do tratamento da Leishmania, o manejo deve abordar complicações frequentes, como depleção de volume, desnutrição, anemia e infecções bacterianas concomitantes (por exemplo, pneumonia) ou infecções parasitárias (por exemplo, malária).
Leishmaniose visceral: tratamento em pacientes imunocompetentes
Formulações de anfotericina B
Fora da África Oriental, a anfotericina B lipossomal é o tratamento de primeira escolha, com cura clínica >90% com esquemas variáveis.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[107]Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet. 2018 Sep 15;392(10151):951-70.
http://www.ncbi.nlm.nih.gov/pubmed/30126638?tool=bestpractice.com
[138]Chakravarty J, Sundar S. Current and emerging medications for the treatment of leishmaniasis. Expert Opin Pharmacother. 2019 Jul;20(10):1251-65.
http://www.ncbi.nlm.nih.gov/pubmed/31063412?tool=bestpractice.com
Para L donovani na Índia, a anfotericina B lipossomal foi demonstrada como razoavelmente segura e teve uma taxa de cura de 96% em ensaios clínicos.[153]Sundar S, Chakravarty J, Agarwal D, et al. Single-dose liposomal amphotericin B for visceral leishmaniasis in India. N Engl J Med. 2010 Feb 11;362(6):504-12.
https://www.doi.org/10.1056/NEJMoa0903627
http://www.ncbi.nlm.nih.gov/pubmed/20147716?tool=bestpractice.com
Vários estudos subsequentes, que incluíram mais de 2500 pacientes tratados com anfotericina B lipossomal no sul da Ásia, mostraram eficácia similar ou maior.[154]Lucero E, Collin SM, Gomes S, et al. Effectiveness and safety of short course liposomal amphotericin B (AmBisome) as first line treatment for visceral leishmaniasis in Bangladesh. PLoS Negl Trop Dis. 2015 Apr 2;9(4):e0003699.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4383421
http://www.ncbi.nlm.nih.gov/pubmed/25837313?tool=bestpractice.com
[155]Goswami RP, Goswami RP, Das S, et al. Short-course treatment regimen of Indian visceral leishmaniasis with an Indian liposomal amphotericin B preparation (Fungisome™). Am J Trop Med Hyg. 2016 Jan;94(1):93-8.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4710453
http://www.ncbi.nlm.nih.gov/pubmed/26526926?tool=bestpractice.com
[156]Pandey K, Pal B, Siddiqui NA, et al. Efficacy and safety of liposomal amphotericin B for visceral leishmaniasis in children and adolescents at a tertiary care center in Bihar, India. Am J Trop Med Hyg. 2017 Nov;97(5):1498-502.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5817748
http://www.ncbi.nlm.nih.gov/pubmed/29016288?tool=bestpractice.com
[157]Rahman R, Goyal V, Haque R, et al. Safety and efficacy of short course combination regimens with AmBisome, miltefosine and paromomycin for the treatment of visceral leishmaniasis (VL) in Bangladesh. PLoS Negl Trop Dis. 2017 May 30;11(5):e0005635.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5466346
http://www.ncbi.nlm.nih.gov/pubmed/28558062?tool=bestpractice.com
[158]Goyal V, Mahajan R, Pandey K, et al. Field safety and effectiveness of new visceral leishmaniasis treatment regimens within public health facilities in Bihar, India. PLoS Negl Trop Dis. 2018 Oct 22;12(10):e0006830.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6197645
http://www.ncbi.nlm.nih.gov/pubmed/30346949?tool=bestpractice.com
Na África Oriental, são necessárias doses mais altas de anfotericina B lipossomal para tratar L donovani e alcançaram uma cura clínica em >90%, apesar de a maioria desses pacientes ser complexa (por exemplo, gravidez, recidiva, doença avançada ou extremidades etárias).[159]Copeland NK, Aronson NE. Leishmaniasis: treatment updates and clinical practice guidelines review. Curr Opin Infect Dis. 2015 Oct;28(5):426-37.
http://www.ncbi.nlm.nih.gov/pubmed/26312442?tool=bestpractice.com
[160]Gebreyohannes EA, Bhagvathula AS, Abegaz TM, et al. Treatment outcomes of visceral leishmaniasis in Ethiopia from 2001 to 2017: a systematic review and meta-analysis. Infect Dis Poverty. 2018 Oct 19;7(1):108.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6194743
http://www.ncbi.nlm.nih.gov/pubmed/30340519?tool=bestpractice.com
Leishmania infantum (também conhecida como Leishmania chagasi) também é tratada preferencialmente com anfotericina B lipossomal.[138]Chakravarty J, Sundar S. Current and emerging medications for the treatment of leishmaniasis. Expert Opin Pharmacother. 2019 Jul;20(10):1251-65.
http://www.ncbi.nlm.nih.gov/pubmed/31063412?tool=bestpractice.com
A maioria dos dados de eficácia é proveniente da região mediterrânea, mas um estudo realizado no Brasil dá suporte ao uso da anfotericina B lipossomal em vez de compostos de antimônio pentavalente e também demonstrou a relação custo-efetividade dessa abordagem.[161]Romero GAS, Costa DL, Costa CHN, et al. Efficacy and safety of available treatments for visceral leishmaniasis in Brazil: a multicenter, randomized, open label trial. PLoS Negl Trop Dis. 2017 Jun 29;11(6):e0005706.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5507560
http://www.ncbi.nlm.nih.gov/pubmed/28662034?tool=bestpractice.com
[162]Assis TSM, Rabello A, Cota G, et al. Cost-effectiveness analysis of diagnostic-therapeutic strategies for visceral leishmaniasis in Brazil. Rev Soc Bras Med Trop. 2019 Apr 11;52:e20180272.
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0037-86822019000100638&lng=en&nrm=iso&tlng=en
http://www.ncbi.nlm.nih.gov/pubmed/30994802?tool=bestpractice.com
Terapia combinada
A combinação de compostos antimoniais pentavalentes com paromomicina é altamente eficaz para o tratamento da LV devido a L donovani na África Oriental, com taxas de cura de 90% a 95%.[160]Gebreyohannes EA, Bhagvathula AS, Abegaz TM, et al. Treatment outcomes of visceral leishmaniasis in Ethiopia from 2001 to 2017: a systematic review and meta-analysis. Infect Dis Poverty. 2018 Oct 19;7(1):108.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6194743
http://www.ncbi.nlm.nih.gov/pubmed/30340519?tool=bestpractice.com
[163]Kimutai R, Musa AM, Njoroge S, et al. Safety and effectiveness of sodium stibogluconate and paromomycin combination for the treatment of visceral leishmaniasis in eastern Africa: results from a pharmacovigilance programme. Clin Drug Investig. 2017 Mar;37(3):259-72.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5315726
http://www.ncbi.nlm.nih.gov/pubmed/28066878?tool=bestpractice.com
Essa combinação de medicamentos não deve ser usada em pacientes >50 anos de idade ou em pacientes com HIV devido às taxas de cura reduzidas de 81% e 56%, respectivamente.[163]Kimutai R, Musa AM, Njoroge S, et al. Safety and effectiveness of sodium stibogluconate and paromomycin combination for the treatment of visceral leishmaniasis in eastern Africa: results from a pharmacovigilance programme. Clin Drug Investig. 2017 Mar;37(3):259-72.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5315726
http://www.ncbi.nlm.nih.gov/pubmed/28066878?tool=bestpractice.com
Como a paromomicina parenteral não está disponível na Europa e nos EUA, é raro ver esse esquema sendo usado fora da África Oriental.
No sul da Ásia, as combinações de anfotericina B lipossomal com ciclos curtos de miltefosina ou paromomicina, ou de miltefosina com paromomicina, são alternativas altamente eficazes à anfotericina B.[157]Rahman R, Goyal V, Haque R, et al. Safety and efficacy of short course combination regimens with AmBisome, miltefosine and paromomycin for the treatment of visceral leishmaniasis (VL) in Bangladesh. PLoS Negl Trop Dis. 2017 May 30;11(5):e0005635.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5466346
http://www.ncbi.nlm.nih.gov/pubmed/28558062?tool=bestpractice.com
[158]Goyal V, Mahajan R, Pandey K, et al. Field safety and effectiveness of new visceral leishmaniasis treatment regimens within public health facilities in Bihar, India. PLoS Negl Trop Dis. 2018 Oct 22;12(10):e0006830.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6197645
http://www.ncbi.nlm.nih.gov/pubmed/30346949?tool=bestpractice.com
[164]Sundar S, Sinha PK, Rai M, et al. Comparison of short-course multidrug treatment with standard therapy for visceral leishmaniasis in India: an open-label, non-inferiority, randomised controlled trial. Lancet. 2011 Feb 5;377(9764):477-86.
http://www.ncbi.nlm.nih.gov/pubmed/21255828?tool=bestpractice.com
Outras opções de monoterapia
A monoterapia com miltefosina é uma opção alternativa. No sul da Ásia, os resultados iniciais foram excelentes, mas, após 10 anos de uso, observou-se uma redução na eficácia, e agora seu uso ocorre geralmente como uma alternativa ou em conjunto com outros medicamentos. A efetividade da monoterapia na África Oriental e na América do Sul também está abaixo do ideal.[138]Chakravarty J, Sundar S. Current and emerging medications for the treatment of leishmaniasis. Expert Opin Pharmacother. 2019 Jul;20(10):1251-65.
http://www.ncbi.nlm.nih.gov/pubmed/31063412?tool=bestpractice.com
Compostos antimoniais pentavalentes podem ser usados para L donovani na África Oriental ou em L infantum com eficácia decente, mas são considerados de segunda linha quando outras opções não estão disponíveis. A resistência aos medicamentos no sul da Ásia impede seu uso no subcontinente.[107]Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet. 2018 Sep 15;392(10151):951-70.
http://www.ncbi.nlm.nih.gov/pubmed/30126638?tool=bestpractice.com
Embora a monoterapia com paromomicina tenha demonstrado eficácia de 95% a 98% quando comparada à anfotericina B ou como braço único no sul da Ásia, em estudos limitados, outras opções mais seguras e com a mesma eficácia a tornam uma opção de nível inferior até mesmo em áreas onde está disponível.[165]Sundar S, Jha TK, Thakur CP, et al. Injectable paromomycin for visceral leishmaniasis in India. N Engl J Med. 2007 Jun 21;356(25):2571-81.
https://www.nejm.org/doi/10.1056/NEJMoa066536?url_ver=Z39.88-2003
http://www.ncbi.nlm.nih.gov/pubmed/17582067?tool=bestpractice.com
[166]Jamil KM, Haque R, Rahman R, et al. Effectiveness study of paromomycin IM injection (PMIM) for the treatment of visceral leishmaniasis (VL) in Bangladesh. PLoS Negl Trop Dis. 2015 Oct 23;9(10):e0004118.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4619770
http://www.ncbi.nlm.nih.gov/pubmed/26496648?tool=bestpractice.com
Pacientes que não respondem ou que apresentam recidiva depois da terapia inicial devem receber tratamento completo com um medicamento antileishmaniose (ou com uma combinação de medicamentos antileishmaniose) de uma classe diferente. No entanto, caso o tratamento inicial tenha sido com anfotericina B lipossomal, a repetição do tratamento com anfotericina B, potencialmente com doses totais mais altas, é adequada.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[107]Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet. 2018 Sep 15;392(10151):951-70.
http://www.ncbi.nlm.nih.gov/pubmed/30126638?tool=bestpractice.com
Pacientes gestantes
O tratamento é essencial, pois a leishmaniose visceral (LV) não tratada pode ser fatal tanto para a mãe quanto para o feto.
Dados limitados sugerem que anfotericina B lipossomal é uma opção de tratamento segura e eficaz.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[119]Pagliano P, Carannante N, Rossi M, et al. Visceral leishmaniasis in pregnancy: a case series and a systematic review of the literature. J Antimicrob Chemother. 2005 Feb;55(2):229-33.
https://academic.oup.com/jac/article/55/2/229/856828?login=false
http://www.ncbi.nlm.nih.gov/pubmed/15649998?tool=bestpractice.com
De maneira geral, o uso de compostos de antimônio pentavalente na gestação deve ser evitado devido ao aumento do risco de aborto espontâneo ou parto pré-termo, e não há dados de segurança sobre o uso de paromomicina na gestação.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
No entanto, caso não haja outras opções disponíveis, o tratamento com esses medicamentos (isolados ou em conjunto com outros) pode ser uma opção de acordo com as orientações do especialista.
A miltefosina deve ser evitada por causar riscos ao feto.
Leishmaniose visceral: tratamento em pacientes imunocomprometidos
O imunocomprometimento entre pacientes com LV ocorre mais comumente devido à coinfecção por HIV, seguida de imunossupressão iatrogênica (por exemplo, receptores de transplante de órgão sólido). Além de aumentarem o risco de desenvolver doença sintomática, as condições de imunocomprometimento reduzem a chance de cura inicial, ao mesmo tempo que elevam o risco de recidiva.[167]Akuffo H, Costa C, van Griensven J, et al. New insights into leishmaniasis in the immunosuppressed. PLoS Negl Trop Dis. 2018 May 10;12(5):e0006375.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5944929
http://www.ncbi.nlm.nih.gov/pubmed/29746470?tool=bestpractice.com
[168]Gajurel K, Dhakal R, Deresinski S. Leishmaniasis in solid organ and hematopoietic stem cell transplant recipients. Clin Transplant. 2017 Jan;31(1).
http://www.ncbi.nlm.nih.gov/pubmed/27801541?tool=bestpractice.com
É essencial adotar uma abordagem abrangente, para tratar o parasita, controlar a imunossupressão, monitorar a recidiva e, potencialmente, administrar uma profilaxia secundária.
Vírus da imunodeficiência humana (HIV)/síndrome de imunodeficiência adquirida (AIDS)
A terapia antirretroviral por toda a vida deve ser iniciada ou continuada em todos os pacientes com infecção por HIV, de acordo com as diretrizes locais atuais.
Geralmente, a anfotericina B lipossomal é considerada a melhor opção para pacientes com LV e infecção por HIV.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[169]National Institutes of Health, Centers for Disease Control and Prevention, HIV Medicine Association, and Infectious Diseases Society of America. Panel on Guidelines for the Prevention and Treatment of Opportunistic Infections in Adults and Adolescents with HIV. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: Leishmaniasis. 2017 [internet publication].
https://clinicalinfo.hiv.gov/en/guidelines/hiv-clinical-guidelines-adult-and-adolescent-opportunistic-infections/leishmaniasis
[170]World Health Organization. WHO technical report series 949: control of the leishmaniases - report of a meeting of the WHO Expert Committee on the control of leishmaniases. 2010 [internet publication].
https://www.who.int/publications/i/item/WHO-TRS-949
Uma dose total mais alta é usada em pacientes imunocomprometidos. No entanto, mesmo em doses mais altas, o tratamento pode ser insatisfatório e a recidiva é comum. Um ensaio clínico publicado na África Oriental mostrou uma eficácia de apenas 55% para a monoterapia com anfotericina B lipossomal entre pacientes com contagem mediana de CD4 de 69 células/microlitro.[171]Diro E, Blesson S, Edwards T, et al. A randomized trial of AmBisome monotherapy and AmBisome and miltefosine combination to treat visceral leishmaniasis in HIV co-infected patients in Ethiopia. PLoS Negl Trop Dis. 2019 Jan 17;13(1):e0006988.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6336227
http://www.ncbi.nlm.nih.gov/pubmed/30653490?tool=bestpractice.com
A terapia combinada deve ser considerada neste contexto. No ensaio clínico com anfotericina B lipossomal realizado na África Oriental discutido acima, o segundo braço mostrou 88% de eficácia com a combinação de anfotericina B lipossomal e miltefosina entre pacientes com uma contagem mediana de CD4 de 54 células/microlitro.[171]Diro E, Blesson S, Edwards T, et al. A randomized trial of AmBisome monotherapy and AmBisome and miltefosine combination to treat visceral leishmaniasis in HIV co-infected patients in Ethiopia. PLoS Negl Trop Dis. 2019 Jan 17;13(1):e0006988.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6336227
http://www.ncbi.nlm.nih.gov/pubmed/30653490?tool=bestpractice.com
Na Índia, a combinação de miltefosina e anfotericina B lipossomal foi associada a 96% de eficácia em comparação com a monoterapia com miltefosina em 85%.[172]Burza S, Mahajan R, Kazmi S, et al. AmBisome monotherapy and combination AmBisome-Miltefosine therapy for the treatment of visceral leishmaniasis in patients coinfected with human immunodeficiency virus in India: a randomized open-label, parallel-Arm, phase 3 trial. Clin Infect Dis. 2022 Oct 12;75(8):1423-32.
https://www.doi.org/10.1093/cid/ciac127
http://www.ncbi.nlm.nih.gov/pubmed/35147680?tool=bestpractice.com
A combinação de estibogluconato de sódio e paromomicina, altamente eficaz em habitantes da África Oriental não coinfectados com HIV, teve uma taxa de cura de apenas 56% e, provavelmente, deve ser evitada, a menos que seja a única opção.[163]Kimutai R, Musa AM, Njoroge S, et al. Safety and effectiveness of sodium stibogluconate and paromomycin combination for the treatment of visceral leishmaniasis in eastern Africa: results from a pharmacovigilance programme. Clin Drug Investig. 2017 Mar;37(3):259-72.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5315726
http://www.ncbi.nlm.nih.gov/pubmed/28066878?tool=bestpractice.com
A Organização Mundial da Saúde (OMS) sugere anfotericina B lipossomal associada a miltefosina sobre a monoterapia com anfotericina B lipossomal em pessoas com coinfecção por HIV na África Oriental e no Sudeste Asiático.[62]World Health Organization. WHO guideline for the treatment of visceral leishmaniasis in HIV co-infected patients in East Africa and South-East Asia. June 2022 [internet publication].
https://www.who.int/publications/i/item/9789240048294
Os compostos de antimônio pentavalente são uma alternativa em pacientes com infecção por HIV; no entanto, observou-se aumento da mortalidade quando comparados à anfotericina B, além de taxas mais altas de reações adversas graves.[173]Cota GF, de Sousa MR, Fereguetti TO, et al. Efficacy of anti-leishmania therapy in visceral leishmaniasis among HIV infected patients: a systematic review with indirect comparison. PLoS Negl Trop Dis. 2013 May 2;7(5):e2195.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3642227
http://www.ncbi.nlm.nih.gov/pubmed/23658850?tool=bestpractice.com
[174]Laguna F, Lopez-Velez R, Pulido F, et al. Treatment of visceral leishmaniasis in HIV-infected patients: a randomized trial comparing meglumine antimoniate with amphotericin B. Spanish HIV-Leishmania Study Group. AIDS. 1999 Jun 18;13(9):1063-9.
http://www.ncbi.nlm.nih.gov/pubmed/10397536?tool=bestpractice.com
[175]Delgado J, Macías J, Pineda JA, et al. High frequency of serious side effects from meglumine antimoniate given without an upper limit dose for the treatment of visceral leishmaniasis in human immunodeficiency virus type-1-infected patients. Am J Trop Med Hyg. 1999 Nov;61(5):766-9.
http://www.ncbi.nlm.nih.gov/pubmed/10586909?tool=bestpractice.com
Profilaxia secundária em HIV/AIDS
A profilaxia secundária com medicamentos antileishmaniose deve ser administrada a todos os pacientes com contagem de CD4 <200 a 350 células/microlitro (o ponto de corte mais alto de CD4 é recomendado pela Organização Pan-Americana da Saúde) devido ao alto risco de recidiva.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[145]Pan American Health Organization. Guideline for the treatment of Leishmaniasis in the Americas. Second edition. Sep 2022 [internet publication].
https://iris.paho.org/handle/10665.2/56120
[169]National Institutes of Health, Centers for Disease Control and Prevention, HIV Medicine Association, and Infectious Diseases Society of America. Panel on Guidelines for the Prevention and Treatment of Opportunistic Infections in Adults and Adolescents with HIV. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: Leishmaniasis. 2017 [internet publication].
https://clinicalinfo.hiv.gov/en/guidelines/hiv-clinical-guidelines-adult-and-adolescent-opportunistic-infections/leishmaniasis
[170]World Health Organization. WHO technical report series 949: control of the leishmaniases - report of a meeting of the WHO Expert Committee on the control of leishmaniases. 2010 [internet publication].
https://www.who.int/publications/i/item/WHO-TRS-949
Não há consenso sobre o melhor esquema, mas as diretrizes recomendam várias opções.
Um estudo prospectivo sobre a profilaxia com pentamidina na África Oriental apresentou uma taxa de recidiva de 46% em 1 ano entre pacientes com contagem de CD4 <200 células por microlitro, comparada a uma taxa de recidiva historicamente observada de 60% a 70% sem o uso de profilaxia.[176]Diro E, Edwards T, Ritmeijer K, et al. Long term outcomes and prognostics of visceral leishmaniasis in HIV infected patients with use of pentamidine as secondary prophylaxis based on CD4 level: a prospective cohort study in Ethiopia. PLoS Negl Trop Dis. 2019 Feb 21;13(2):e0007132.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6400407
http://www.ncbi.nlm.nih.gov/pubmed/30789910?tool=bestpractice.com
Não está claro quando a profilaxia secundária deve terminar. Algumas diretrizes sugerem suspendê-la depois que a contagem de CD4 chegar a >200 a 350 células/microlitro, enquanto outras recomendam a terapia por tempo indefinido, pois o risco de recidiva continua. De qualquer forma, é essencial realizar o monitoramento rigoroso da recidiva em todos os pacientes com infecção por HIV.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[169]National Institutes of Health, Centers for Disease Control and Prevention, HIV Medicine Association, and Infectious Diseases Society of America. Panel on Guidelines for the Prevention and Treatment of Opportunistic Infections in Adults and Adolescents with HIV. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: Leishmaniasis. 2017 [internet publication].
https://clinicalinfo.hiv.gov/en/guidelines/hiv-clinical-guidelines-adult-and-adolescent-opportunistic-infections/leishmaniasis
Na África Oriental, as taxas de recidiva foram altas mesmo entre os indivíduos com contagem de CD4 >200 células/microlitro, e a história de recidiva prévia é um preditor significativo para recidiva futura ou morte.[176]Diro E, Edwards T, Ritmeijer K, et al. Long term outcomes and prognostics of visceral leishmaniasis in HIV infected patients with use of pentamidine as secondary prophylaxis based on CD4 level: a prospective cohort study in Ethiopia. PLoS Negl Trop Dis. 2019 Feb 21;13(2):e0007132.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6400407
http://www.ncbi.nlm.nih.gov/pubmed/30789910?tool=bestpractice.com
Na África Oriental, uma taxa de recidiva de 37% foi observada em um acompanhamento de 2 anos após 12-18 meses de profilaxia com pentamidina, principalmente naqueles com baixa contagem de CD4 basilar.[177]Diro E, Ritmeijer K, Boelaert M, et al. Long-term clinical outcomes in visceral leishmaniasis/human immunodeficiency virus-coinfected patients during and after pentamidine secondary prophylaxis in Ethiopia: a single-arm clinical trial. Clin Infect Dis. 2018 Jan 18;66(3):444-51.
https://www.doi.org/10.1093/cid/cix807
http://www.ncbi.nlm.nih.gov/pubmed/29020217?tool=bestpractice.com
Outras formas de imunossupressão
Inclui pacientes de transplante de órgão sólido, neoplasia hematológica ou linfática ou tratamento com imunossupressores por outras indicações.
Caso os pacientes estejam tomando imunossupressores por outras indicações, considere reduzir a dose ou suspender esses medicamentos, se possível, embora isso se baseie em opiniões de especialistas e não em dados sólidos.[168]Gajurel K, Dhakal R, Deresinski S. Leishmaniasis in solid organ and hematopoietic stem cell transplant recipients. Clin Transplant. 2017 Jan;31(1).
http://www.ncbi.nlm.nih.gov/pubmed/27801541?tool=bestpractice.com
O tratamento foi realizado com múltiplos esquemas, mas a anfotericina B lipossomal é recomendada, principalmente em pacientes de transplante de órgão sólido.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[145]Pan American Health Organization. Guideline for the treatment of Leishmaniasis in the Americas. Second edition. Sep 2022 [internet publication].
https://iris.paho.org/handle/10665.2/56120
Embora a recidiva seja comum, principalmente entre pacientes de transplante de órgão sólido (aproximadamente 25%), os dados não são claros sobre o papel da profilaxia secundária. As diretrizes da IDSA/ASTMH não recomendam a profilaxia secundária entre pacientes sem recidiva prévia, mas em um pequeno estudo de caso-controle retrospectivo o risco de recidiva caiu 27% entre pacientes com profilaxia secundária.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[178]Clemente W, Vidal E, Girão E, et al. Risk factors, clinical features and outcomes of visceral leishmaniasis in solid-organ transplant recipients: a retrospective multicenter case-control study. Clin Microbiol Infect. 2015 Jan;21(1):89-95.
https://www.clinicalmicrobiologyandinfection.com/article/S1198-743X(14)00008-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/25636932?tool=bestpractice.com
Considere a profilaxia secundária de modo individual, principalmente entre pacientes com história de recidiva prévia e condição imunossupressora contínua.
Para todos os pacientes imunossuprimidos com recidiva, o tratamento com anfotericina B lipossomal é razoável, mesmo entre os pacientes que a receberam como terapia primária, pois acredita-se que o fracasso nesse quadro seja imunológico e não resultado de resistência ao medicamento. De maneira alternativa, pode-se tentar outras opções ou terapias combinadas.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
Pacientes gestantes
O tratamento é essencial, pois a leishmaniose visceral não tratada pode ser fatal tanto para a mãe quanto para o feto.
Dados limitados sugerem que anfotericina B lipossomal é uma opção de tratamento segura e eficaz.[8]Aronson N, Herwaldt BL, Libman M, et al. Diagnosis and treatment of leishmaniasis: clinical practice guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin Infect Dis. 2016 Dec 15;63(12):1539-57.
https://academic.oup.com/cid/article/63/12/1539/2645617
http://www.ncbi.nlm.nih.gov/pubmed/27941143?tool=bestpractice.com
[119]Pagliano P, Carannante N, Rossi M, et al. Visceral leishmaniasis in pregnancy: a case series and a systematic review of the literature. J Antimicrob Chemother. 2005 Feb;55(2):229-33.
https://academic.oup.com/jac/article/55/2/229/856828?login=false
http://www.ncbi.nlm.nih.gov/pubmed/15649998?tool=bestpractice.com
As outras formas de anfotericina podem ser usadas, se a anfotericina lipossomal não estiver disponível.
Leishmaniose dérmica pós-calazar
Há poucos estudos controlados sobre o manejo de Leishmaniose dérmica pós-calazar. A leishmaniose dérmica pós-calazar (LDPC) leve a moderada cura-se por si mesma de 3 a 12 meses na maioria dos pacientes descendentes de africanos orientais. O tratamento é indicado para pacientes africanos orientais com LDPC grave ou que não se cura por si mesma, para a LDPC em indianos e em pacientes que são imunocomprometidos.[6]Zijlstra EE, Musa AM, Khalil EA, et al. Post-kala-azar dermal leishmaniasis. Lancet Infect Dis. 2003 Feb;3(2):87-98.
http://www.ncbi.nlm.nih.gov/pubmed/12560194?tool=bestpractice.com
No sul da Ásia, a miltefosina é recomendada como tratamento de primeira linha para LDPC.[170]World Health Organization. WHO technical report series 949: control of the leishmaniases - report of a meeting of the WHO Expert Committee on the control of leishmaniases. 2010 [internet publication].
https://www.who.int/publications/i/item/WHO-TRS-949
Uma metanálise demonstrou preocupação com o declínio da eficácia, que está sendo observado mesmo em 12 semanas de terapia, e preocupações com a segurança (por exemplo, distúrbios oculares, incluindo cegueira, ceratite ulcerativa, visão turva, fotofobia) com ciclos mais longos de tratamento.[179]Pijpers J, den Boer ML, Essink DR, et al. The safety and efficacy of miltefosine in the long-term treatment of post-kala-azar dermal leishmaniasis in South Asia - a review and meta-analysis. PLoS Negl Trop Dis. 2019 Feb 11;13(2):e0007173.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6386412
http://www.ncbi.nlm.nih.gov/pubmed/30742620?tool=bestpractice.com
[180]World Health Organization. Statement on miltefosine - potential ocular disorders in patients treated with miltefosine for post-kala-azar dermal leishmaniasis (PKDL). Feb 2022 [internet publication].
https://www.who.int/news/item/10-02-2022-statement-on-miltefosine---potential-ocular-disorders-in-patients-treated-with-miltefosine-for-post-kala-azar-dermal-leishmaniasis-(pkdl)
A anfotericina B é considerada segunda linha no sul da Ásia.[170]World Health Organization. WHO technical report series 949: control of the leishmaniases - report of a meeting of the WHO Expert Committee on the control of leishmaniases. 2010 [internet publication].
https://www.who.int/publications/i/item/WHO-TRS-949
A anfotericina B lipossomal demonstrou eficácia em estudos limitados na região.[181]Basher A, Maruf S, Nath P, et al. Case report: treatment of widespread nodular post kala-azar dermal leishmaniasis with extended-dose liposomal amphotericin B in Bangladesh – a series of four cases. Am J Trop Med Hyg. 2017 Oct;97(4):1111-5.
https://www.ajtmh.org/configurable/content/journals$002ftpmd$002f97$002f4$002farticle-p1111.xml?t:ac=journals%24002ftpmd%24002f97%24002f4%24002farticle-p1111.xml
http://www.ncbi.nlm.nih.gov/pubmed/28820697?tool=bestpractice.com
[182]Musa AM, Khalil EA, Mahgoub FA, et al. Efficacy of liposomal amphotericin B (AmBisome) in the treatment of persistent post-kala-azar dermal leishmaniasis (PKDL). Ann Trop Med Parasitol. 2005 Sep;99(6):563-9.
http://www.ncbi.nlm.nih.gov/pubmed/16156969?tool=bestpractice.com
No entanto, a análise molecular demonstrou o ressurgimento de parasitas 6 meses após o tratamento com anfotericina B lipossomal, mas não com miltefosina.[183]Moulik S, Chaudhuri SJ, Sardar B, et al. Monitoring of parasite kinetics in Indian post-kala-azar dermal leishmaniasis. Clin Infect Dis. 2018 Jan 18;66(3):404-10.
https://academic.oup.com/cid/article/66/3/404/4157560
http://www.ncbi.nlm.nih.gov/pubmed/29020350?tool=bestpractice.com
Na Índia, a combinação de anfotericina B lipossomal e 45 dias de terapia com miltefosina mostraram 100% de eficácia versus 90 dias de monoterapia com miltefosina (75% de eficácia).[184]Ramesh V, Dixit KK, Sharma N, et al. Assessing the efficacy and safety of liposomal amphotericin B and miltefosine in combination for treatment of post kala-azar dermal leishmaniasis. J Infect Dis. 2020 Feb 3;221(4):608-17.
https://www.doi.org/10.1093/infdis/jiz486
http://www.ncbi.nlm.nih.gov/pubmed/31854451?tool=bestpractice.com
Pacientes gestantes
