Etiologia
A leishmaniose é uma doença infecciosa localizada ou sistêmica, causada pelo protozoário intracelular (macrófago) obrigatório do gênero Leishmania e transmitida a seres humanos pela picada do flebotomíneo fêmea infectado conhecido como mosquito-palha.[1][2] Existem mais de 20 espécies de Leishmania, incluindo Leishmania tropica, Leishmania major, Leishmania aethiopica, Leishmania infantum (sinônimo: Leishmania chagasi), Leishmania donovani, Leishmania mexicana, Leishmania amazonensis e Leishmania venezuelensis, bem como o subgênero Viannia que inclui Leishmania braziliensis, Leishmania guyanensis, Leishmania panamensis e Leishmania peruviana.[1] Um novo subgênero, Mundinia, está associado com Leishmania martiniquensis, Leishmania orientalis, Leishmania enrietti.[34]
A transmissão é antroponótica ou zoonótica, dependendo se o hospedeiro da doença é um ser humano ou um outro mamífero. Várias espécies de flebotomíneos e de mamíferos foram apontadas como vetores e hospedeiros da leishmaniose, respectivamente.[1][2] Ocorrem outros modos de transmissão (por exemplo, congênita, por transfusão sanguínea, por transplante de órgãos/tecidos, pelo compartilhamento de agulhas, por infecção laboratorial), mas eles são relativamente raros.[4][5]
Múltiplas espécies de Leishmania podem causar leishmaniose cutânea (LC).[1] A leishmaniose visceral (LV) é causada por L donovani na África Oriental e Sul da Ásia, ou por L infantum (sinônimo: L chagasi) na América Latina, Europa, norte da África e partes da Ásia, com novos focos de LV devido a Leishmania martiniquensis na Tailândia, Antilhas Francesas e Guiana.[2][35][36][37] A maioria dos casos de leishmaniose mucosa (LM) metastática é devida a L braziliensis, mas também pode ser causada por L guyanensis, L panamensis, L amazonensis, L aethiopica e, em pacientes imunossuprimidos, L infantum (sinônimo: L chagasi).[1] A leishmaniose dérmica pós-calazar é devida principalmente a L donovani e não a L infantum (sinônimo: L chagasi).[6] Algumas espécies de LC (por exemplo, L major) são conhecidas por causar lesões mais benignas e que se autocuram que outras espécies (por exemplo, L braziliensis e L tropica).
Estudos comparativos com foco em diferentes grupos étnicos, nativos, migrantes ou agrupamentos familiares demonstraram que componentes genéticos humanos controlam a suscetibilidade e a resistência à leishmaniose cutânea (LC).[38] Deste modo, esses estudos apontam para o papel das moléculas de antígeno leucocitário humano (HLA) na leishmaniose cutânea (LC) localizada e na leishmaniose mucosa (LM), bem como o papel do fator de necrose tumoral (TNF)-alfa no desenvolvimento da LM. De modo semelhante, estudos demonstraram uma base genética para a suscetibilidade à leishmaniose visceral (LV).[39][40][Figure caption and citation for the preceding image starts]: Inseto Phlebotomus papatasi fêmeaUsado com a permissão de EdRowtonPhotography.com [Citation ends].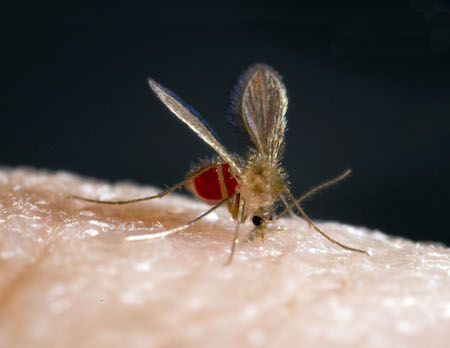
Fisiopatologia
Ao picar seus hospedeiros para obter repasto sanguíneo, as fêmeas de flebotomíneo infectadas regurgitam as formas promastigotas flageladas da Leishmania na pele, as quais invadem ou são fagocitadas por células hospedeiras locais ou recrutadas, principalmente macrófagos.[3][41][42]
Estudos experimentais mostraram que a saliva do flebotomíneo é vasodilatadora, anticoagulante e imunogênica: isso estimula o eritema, aumentando o carga parasitária, o tamanho da lesão e a persistência do parasita, provavelmente por alterar a resposta imune de uma resposta mediada por célula T auxiliar do tipo 1 para uma mediada por células T auxiliares do tipo 2.[43][44] Alguns dados limitados disponíveis em ambientes naturais demonstram que a variação na saliva do mosquito-palha pode determinar o desfecho clínico das infecções por Leishmania infantum (sinônimo: Leishmania chagasi).[45]
Nos fagolisossomos dos macrófagos residentes, as formas promastigotas transformam-se em amastigotas não flageladas.[46] Esta forma tecidual amastigota é encontrada durante a infecção humana. As amastigotas se replicam e podem, então, infectar outros macrófagos, seja localmente (por exemplo, na leishmaniose cutânea [LC] localizada) ou em tecidos distantes, após disseminação (por exemplo, nas leishmanioses mucosa ou visceral [LV]). Não está claro o motivo pelo qual algumas espécies de Leishmania permanecem localizadas enquanto outras se disseminam.[1][2][47][48] A disseminação a partir da derme através dos sistemas linfático e vascular causa a infecção de outros monócitos e macrófagos. Isso resulta em infiltração da medula óssea, hepatoesplenomegalia e, às vezes, linfadenopatia.
Na leishmaniose visceral (LV) avançada, infiltrações na medula óssea e no baço resultam na redução da produção e no aumento do consumo de células sanguíneas (hiperesplenismo). E, por conseguinte, em anemia, leucopenia e/ou trombocitopenia. Quando o sistema reticuloendotelial é invadido, a linhagem de células monocíticas torna-se cada vez mais suscetível a outros agentes infecciosos, como demonstra a alta frequência de infecções bacterianas sobrepostas (por exemplo, pneumonia, diarreia ou tuberculose).
A maioria das infecções por Leishmania em seres humanos permanece assintomática.[1][2] A proporção entre infecções assintomáticas e sintomáticas depende do tipo de espécie e cepa da Leishmania infectante, do hospedeiro, de fatores do flebotomíneo e de outros fatores não caracterizados. Por exemplo, essa proporção geralmente é maior em áreas de L infantum (sinônimo: L chagasi) que em áreas de Leishmania donovani, refletindo a elevada virulência desta última. Outros fatores (por exemplo, desnutrição) influenciam a infecção e a doença ressaltados pelas observações que a proporção entre infecções assintomáticas e sintomáticas por L infantum (sinônimo: L chagasi) é diferente na América Latina e na Europa.[2] Indivíduos que apresentam uma imunidade mediada por células insatisfatória, como pacientes infectados pelo vírus da imunodeficiência humana (HIV) ou com desnutrição intensa, apresentam risco maior de desenvolver a doença, às vezes anos ou décadas após a infecção.[19][49][50] Outros determinantes do hospedeiro, como fatores genéticos, podem desempenhar um papel importante na resposta imune adaptativa.[38] O período de incubação pode ser variável e depende da espécie parasitária.[1][2] Normalmente dura de 1 a 3 meses na LC, mas são observados períodos mais longos.[Figure caption and citation for the preceding image starts]: Inseto Phlebotomus papatasi fêmeaUsado com a permissão de EdRowtonPhotography.com [Citation ends]. [Figure caption and citation for the preceding image starts]: Ciclo de vida das espécies de Leishmania, os agentes causadores da leishmanioseImagem cedida pelo CDC; A.J. da Silva, PhD; M. Moser [Citation ends].
[Figure caption and citation for the preceding image starts]: Ciclo de vida das espécies de Leishmania, os agentes causadores da leishmanioseImagem cedida pelo CDC; A.J. da Silva, PhD; M. Moser [Citation ends]. [Figure caption and citation for the preceding image starts]: Preparação de toque de pele mostrando Leishmania tropica amastigotas. Macrófago intacto praticamente preenchido com amastigotas, várias das quais têm um núcleo perfeitamente visível e cinetoplasto (seta)Imagem cedida pelo CDC; NCID; DPDx [Citation ends].
[Figure caption and citation for the preceding image starts]: Preparação de toque de pele mostrando Leishmania tropica amastigotas. Macrófago intacto praticamente preenchido com amastigotas, várias das quais têm um núcleo perfeitamente visível e cinetoplasto (seta)Imagem cedida pelo CDC; NCID; DPDx [Citation ends].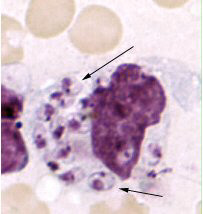
Classificação
Subtipos de leishmaniose
Cutâneo
Leishmaniose cutânea localizada
Leishmaniose cutânea difusa
Leishmaniose disseminada
Leishmaniose recidivante
Leishmaniose mucosa (às vezes classificada como um subtipo separado)
Visceral
Leishmaniose visceral (também conhecida como calazar, principalmente quando associada a Leishmania donovani)
Leishmaniose dérmica pós-calazar
Às vezes, a leishmaniose cutânea é categorizada pela ocorrência geográfica:[1]
Velho Mundo: causada por espécies de Leishmania encontradas no hemisfério Oriental, incluindo África, sudoeste da Ásia, Oriente Médio e Mediterrâneo (por exemplo, Leishmania tropica, Leishmania major, Leishmania aethiopica, Leishmania infantum [sinônimo: Leishmania chagasi] e Leishmania donovani)
Novo mundo: causada por espécies de Lehsimania encontradas no hemisfério Ocidental, incluindo as Américas do Sul e Central (por exemplo, subgênero Viannia, incluindo Leishmania braziliensis, Leishmania guyanensis, Leishmania panamensis e Leishmania peruviana; além de Leishmania mexicana, Leishmania amazonensis, Leishmania mexicana, Leishmania venezuelens e L infantum [sinônimo: L chagasi]; esta lista é não exaustiva).
Classificação clínica
O tratamento adequado é individualizado para cada paciente com LC. As diretrizes da Infectious Diseases Society of America (IDSA)/American Society of Tropical Medicine and Hygiene (ASTMH) classificam a leishmaniose cutânea em simples ou complexa.[8]
LC simples:
Sem comprometimento da mucosa e espécies de parasitas não associadas à LM
≤4 lesões <1 cm
Localização viável para terapia local e/ou pele não exposta (não importante do ponto de vista cosmético)
Hospedeiro imunocompetente
Lesões que remitem sem terapia.
LC complexa:
Espécies de parasitas causadas por espécies associadas à LM
Nódulos subcutâneos locais
Grande adenopatia regional
>4 lesões, geralmente >1 cm
Lesão individual ≥5 cm
O tamanho ou o local inviabilizam a terapia e/ou lesão no rosto, dedos das mãos, dedos dos pés, articulações ou genitália.
Hospedeiro imunocomprometido
Fracasso da terapia local
Síndromes incomuns (leishmaniose recidiva, leishmaniose cutânea difusa ou leishmaniose disseminada).
O uso deste conteúdo está sujeito ao nosso aviso legal