Abordagem
Os achados a seguir levantariam a suspeita clínica de colangite biliar primária (CBP):[14][15]
Bioquímica hepática anormal: achado de enzimas hepáticas anormais, em particular as elevadas concentrações de fosfatase alcalina (ALP) e/ou de gama-glutamiltransferase (GGT), no contexto de transaminases normais ou significativamente menos elevadas em pacientes sem nenhum outro processo etiológico hepático aparente.
Características clínicas típicas da colangite biliar primária (CBP): estas incluem fadiga, formação de xantelasma em torno dos olhos, olhos e boca secos (complexo sicca), desconforto abdominal e prurido sem uma causa cutânea óbvia, em particular quando a sensação de coceira é profunda e embaixo da pele. Escoriações que ocorrem como consequência do ato de coçar podem causar uma falsa suspeita clínica de doença cutânea primária. Todas essas características clínicas podem ocorrer na ausência de quaisquer características que pudessem deixar o médico especificamente preocupado com a possibilidade de doença hepática. A maioria dos pacientes que apresentam CBP sintomática em estágio inicial não terá icterícia. Na maioria dos casos em que as pessoas não foram diagnosticadas com CBP, isso ocorre, em grande parte, pois não houve suspeita de doença hepática de modo geral.
Características clínicas de doença hepática avançada: estas podem ocorrer em um paciente sem nenhuma etiologia aparente. As características clínicas neste cenário seriam tipicamente as de cirrose, incluindo alterações metabólicas (perda de peso, perda de massa muscular e afinamento da pele) e características hipertensivas portais (esplenomegalia, ascite e hemorragia por varizes). A icterícia é quase sempre proeminente em pacientes com CBP histologicamente avançada.
História
É importante observar que muitos pacientes não exibem nenhuma das características clínicas sugestivas de CBP em específico ou de doença hepática no geral.
Na história, além de características clínicas de suporte acima, os pacientes com CBP frequentemente irão descrever uma história familiar positiva da própria CBP ou de outra doença autoimune.[23] Há um aumento do risco de CBP em parentes de pacientes com a doença, sendo que esse risco é o maior em parentes de primeiro grau do sexo feminino com idade entre 45-60 anos.[24] Também pode haver uma história pessoal de doença autoimune associada. As associações específicas mais fortes são com a síndrome de Sjögren, esclerodermia e doença celíaca, embora a doença tireoidiana em particular deva ser considerada como uma doença associada em pacientes, devido à sua contribuição para a fadiga.
Ocasionalmente são observados sintomas de disfunção autonômica, como tontura postural e perda de concentração.
Exame físico
O exame físico dos pacientes sem cirrose geralmente não apresenta nada digno de nota. Xantelasmas ou hepatomegalia estão ocasionalmente presentes, embora não sejam específicos para CBP.
Os pacientes com doença cirrótica avançada apresentarão as características genéricas de cirrose no exame físico.
Investigação
O diagnóstico da CBP é baseado em três fatores:[14][15]
Presença de bioquímica hepática colestática com elevação pronunciada de fosfatase alcalina (ALP) e/ou de gama-gama-glutamiltransferase (GGT). Os pacientes com a doença em estágio inicial tipicamente não apresentarão icterícia, embora nos estágios tardios da doença as concentrações de bilirrubina possam estar substancialmente elevadas.
Perfil de autoanticorpos compatível com a CBP: anticorpos antimitocondriais (AAM) ou fator antinuclear (FAN) característico da CBP, como anti-sp100 e anti-gp210.[16][25][Figure caption and citation for the preceding image starts]: Padrões de autoanticorpo característicos na colangite biliar primária. Seta branca: coloração antimitocondrial; seta vermelha: coloração de fator antinuclear (FAN) em múltiplos pontos nuclearesDo acervo de DEJ Jones; usado com permissão. [Citation ends].
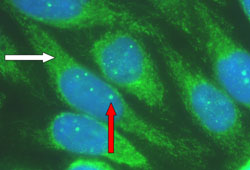 O perfil de autoanticorpos pode ser obtido por meio de imunofluorescência ou ensaio de imunoadsorção enzimática (ELISA). O AAM está presente em 90% a 85% dos pacientes diagnosticados e é considerado uma característica da CBP.[14]
O perfil de autoanticorpos pode ser obtido por meio de imunofluorescência ou ensaio de imunoadsorção enzimática (ELISA). O AAM está presente em 90% a 85% dos pacientes diagnosticados e é considerado uma característica da CBP.[14]Histologia hepática compatível ou diagnóstica na biópsia hepática, com a presença específica das clássicas lesões no ducto biliar, acompanhadas por inflamação do trato portal e formação de granuloma.[Figure caption and citation for the preceding image starts]: Aparências histológicas características na cirrose biliar primária: (a) estágio inicial da doença; (b) estágio avançado da doença; (c) doença com componente inflamatório significativoDo acervo do Professor Alastair Burt, Newcastle University; usado com permissão. [Citation ends].
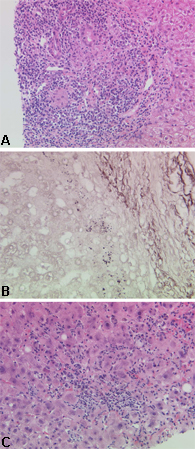
As diretrizes de prática clínica dos EUA e da Europa recomendam que o diagnóstico possa ser feito quando duas das três características estiverem presentes.[14][15]
A biópsia em geral não é necessária para confirmar o diagnóstico de CBP.[14][15]Isso é um reflexo do alto valor dos marcadores sorológicos para a doença, das complicações da biópsia e dos potenciais problemas de erro de amostragem no que frequentemente é uma doença com acometimento irregular.[26]
Um teste para fibrose deve ser realizado em todos os pacientes no diagnóstico para estadiar a doença.
Os exames de imagem com ultrassonografia abdominal ou colangiopancreatografia por ressonância magnética (CPRM) podem ser considerados para descartar outras causas de colestase e obstrução do ducto biliar.
Um subgrupo de pacientes (<10% de toda a população com CBP) apresenta um processo mais inflamatório, interpretado por alguns da área como uma variante da CBP e por outros como uma sobreposição com hepatite autoimune.[14][15]
A presença dessa variante inflamatória é confirmada por biópsia hepática. A identificação desse importante subgrupo de pacientes é uma das indicações restantes para a biópsia hepática na CBP. A suspeita dessa variante e a indicação para a necessidade de realização de uma biópsia neste contexto são baseadas nos seguintes fatores:
Presença de elevação desproporcional de alanina aminotransferase (ALT)
Presença de uma concentração elevada de imunoglobulina G (IgG) sérica (>20 g/L)
Presença de fadiga com rápida progressão
Menos frequentemente, marcadores sorológicos relevantes à hepatite, padrão difuso de fator antinuclear (FAN) ou anticorpos contra músculo liso, cuja ausência não exclui a possibilidade da presença de um processo sobrejacente potencialmente responsivo à terapia imunomoduladora.
Concentrações elevadas de IgM séricas policlonais também são observadas em pacientes com colangite biliar primária (CBP) e, embora não sejam parte dos critérios de diagnóstico clássicos, elas podem ser úteis em casos nos quais há dúvidas.[27]A significância clínica do FAN específico do anticorpo antimitocondrial (AAM) ou da CBP no contexto de bioquímica hepática normal não está clara. A ausência de tratamento é justificada nesse grupo, a menos que um grau significativo de fibrose esteja presente, mas é apropriado observar se haverá desenvolvimento futuro da CBP.
Avaliação da gravidade e prognóstico
A avaliação da gravidade e o prognóstico podem ser difíceis na prática, particularmente em pacientes com a doença em estágio inicial. Exames de sangue e de imagem não invasivos são os preferenciais para avaliar a fibrose; a biópsia hepática não é mais indicada para esse fim, exceto em situações específicas (por exemplo, ausência de anticorpos específicos para CBP, suspeita de coexistência de hepatite autoimune ou esteatose hepática associada a disfunção metabólica [antes conhecida como esteatose hepática não alcoólica] ou outras comorbidades) ou quando há resposta inadequada à terapia com ácido ursodesoxicólico a fim de caracterizar lesões histológicas que fundamentam a resistência ao tratamento.[15] Além disso, o curso da doença pode ser progressivo, apesar do tratamento, portanto a avaliação não invasiva da fibrose é crucial no diagnóstico e acompanhamento desses pacientes.
A American Association for the Study of Liver Diseases (AASLD) sugere uma combinação de técnicas baseadas em exames de imagem e de sangue para detectar fibrose significativa e fibrose avançada, particularmente naqueles submetidos ao estadiamento inicial da fibrose.[28] Os exames de imagem podem ser preferencialmente incorporados no processo inicial de estadiamento da fibrose devido à sua maior precisão em relação às técnicas baseadas no sangue e podem ajudar a identificar fibrose avançada e cirrose em adultos com CBP crônica.[28] A elastografia transitória (ET) ou a elastografia por ressonância magnética são recomendadas pela AASLD para estadiar a fibrose em adultos com doença hepática crônica.[28] A AASLD desaconselha o uso de exames de imagem como um exame independente para avaliar a regressão ou progressão da fibrose hepática.[28]
O estágio de fibrose é um preditor independente de resultado na CBP, mesmo em pacientes com resposta bioquímica ao tratamento.[29] A medição da rigidez hepática (LSM) por ET é o melhor marcador substituto para fibrose grave.[30] A progressão da rigidez hepática é preditiva de mau resultado.[14] As diretrizes europeias sugerem a repetição do LSM a cada 2 anos em pacientes com doença em estágio inicial e a cada ano em pacientes com doença em estágio avançado.[30] Marcadores séricos de fibrose, incluindo níveis séricos de ácido hialurônico, pró-peptídeo aminoterminal procolágeno III, colágeno IV, teste de fibrose hepática aprimorada e FibroTest®, não são recomendados para o estadiamento da fibrose e devem ser usados apenas quando o teste radiológico não estiver disponível. Da mesma forma, pontuações não invasivas (por exemplo, APRI, FIB-4, AAR, largura de distribuição de glóbulos vermelhos para proporção de plaquetas, largura de distribuição de glóbulos vermelhos para relação de linfócitos e relação de neutrófilos para linfócitos) carecem de precisão diagnóstica e não são recomendados.[30]
Os pacientes com PBC tratados com ácido ursodesoxicólico demonstram um curso diferente da doença, dependendo das características basais (pré-tratamento) e da resposta bioquímica após 12 meses de tratamento. A estratificação de risco é necessária:[30]
Na linha basal - a distinção entre doença em estágio inicial e avançado é baseada na LSM por TE, níveis séricos de bilirrubina e albumina e, quando disponível, histologia.
No tratamento - a avaliação do prognóstico é baseada na avaliação da resposta bioquímica ao ácido ursodesoxicólico após 12 meses usando critérios qualitativos (por exemplo, critérios Paris-I, Paris-II, Rotterdam, Toronto, Rochester, Ehime) ou critérios quantitativos recentemente propostos (por exemplo, pontuação UK-PBC e escore GLOBE).[15][31][32] Vários estudos mostram um alto risco de eventos adversos para pacientes com resposta inadequada ao ácido ursodesoxicólico um ano após o início; no entanto, nenhuma abordagem única para classificar a resposta ao tratamento foi adotada uniformemente.[27] Ambos os escores UK-PBC e GLOBE foram desenvolvidos usando dados derivados e validados de grandes coortes, e demonstraram ser superiores aos critérios qualitativos e aos escores modelo para doença hepática terminal (Model End-Stage Liver Disease) e Child-Pugh.[15]
Os valores individuais da concentração de fosfatase alcalina e de transaminases não têm valor prognóstico. Em termos populacionais, a presença de FAN específico da CBP pode estar associada a um prognóstico mais desfavorável.[33][34]Entretanto, não está claro como a presença do FAN deve ser interpretada em um paciente individual e como deve ser usada para dar suporte às decisões relacionadas ao tratamento.[35][36] A pouca idade no momento do diagnóstico (<45 anos) e o sexo masculino também foram associados a um prognóstico desfavorável, assim como o achado de hepatite de interface na histologia e a elevação persistente das aminotransferases séricas.[27]
O uso deste conteúdo está sujeito ao nosso aviso legal