Os pacientes hemodinamicamente instáveis requerem reperfusão primária urgente, anticoagulação e cuidados de suporte.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Para pacientes com risco intermediário de um desfecho insatisfatório, é necessária anticoagulação e monitoramento contínuo. A reperfusão é geralmente empregada como terapia de resgate se ocorrer descompensação.
Pacientes com baixo risco de um desfecho desfavorável podem receber tratamento em âmbito ambulatorial, levando em consideração as circunstâncias pessoais do paciente e desde que todos os critérios a seguir sejam atendidos:[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Clinicamente estável com boa reserva cardiopulmonar
Sem contraindicações, como sangramento recente, doença renal ou hepática grave ou trombocitopenia grave (ou seja, <50,000/mm³)
Adesão esperada ao tratamento
O paciente se sente bem o suficiente para ser tratado em casa.
Pacientes diagnosticados incidentalmente com EP assintomática devem receber a mesma anticoagulação inicial e em longo prazo que aqueles com EP sintomática comparável.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Classificação da gravidade
Vários sistemas de classificação têm sido empregados para descrever a gravidade da EP, e a mortalidade em curto prazo pode ser avaliada por ferramentas de predição clínica, como o Índice de Gravidade de Embolia Pulmonar (PESI) ou escores PESI simplificados.[154]Tong C, Zhang Z. Evaluation factors of pulmonary embolism severity and prognosis. Clin Appl Thromb Hemost. 2015 Apr;21(3):273-84.
https://www.doi.org/10.1177/1076029613501540
http://www.ncbi.nlm.nih.gov/pubmed/24023267?tool=bestpractice.com
O termo "submaciça" foi aplicado à EP com extensão anatômica significativa, mas com normotensão, e maciça descreve EP anatomicamente extensa complicada por choque ou hipotensão.
A European Society of Cardiology categoriza a EP como:
Alto risco ao apresentar instabilidade hemodinâmica (choque ou hipotensão)
Alto risco intermediário quando se apresenta sem instabilidade hemodinâmica, mas com evidência de disfunção do ventrículo direito (VD) no exame de imagem, biomarcadores cardíacos anormais e parâmetros clínicos de gravidade (como um alto escore PESI)
Baixo risco intermediário quando se apresenta sem instabilidade hemodinâmica, com evidência de disfunção do VD no exame de imagem ou biomarcadores cardíacos elevados (mas não ambos) e parâmetros clínicos de gravidade (como um escore PESI alto)
Baixo risco quando nenhum desses fatores está presente.
Suspeita de EP em choque ou hipotensão
Os pacientes de alto risco (que apresentam choque ou hipotensão [ou seja, PA sistólica <90 mmHg]) necessitam de tratamento agressivo com reperfusão primária, anticoagulação e terapia de suporte.
As terapias de suporte e anticoagulação empírica (a menos que contraindicadas) devem ser instituídas sem atraso.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
A heparina não fracionada (HNF) pode ser preferível nessa população; a maioria dos estudos clínicos de terapias intervencionistas usou heparina como o componente anticoagulante do esquema.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Terapias de suporte
Os protocolos locais de reanimação devem ser seguidos.
Suporte respiratório
Deve-se administrar oxigênio suplementar em alta concentração, visando saturações de oxigênio de 94% a 98% (ou 88% a 92% em pacientes com risco de insuficiência respiratória hipercápnica).[155]O'Driscoll BR, Howard LS, Earis J, et al; British Thoracic Society Emergency Oxygen Guideline Group; BTS Emergency Oxygen Guideline Development Group. BTS guideline for oxygen use in adults in healthcare and emergency settings. Thorax. 2017 Jun;72(Suppl 1):ii1-90.
https://www.brit-thoracic.org.uk/document-library/clinical-information/oxygen/2017-emergency-oxygen-guideline/bts-guideline-for-oxygen-use-in-adults-in-healthcare-and-emergency-settings
http://www.ncbi.nlm.nih.gov/pubmed/28507176?tool=bestpractice.com
A intubação e a ventilação mecânica podem ser necessárias para pacientes com hipoxemia grave/insuficiência respiratória grave. A ventilação mecânica pode causar hipotensão; portanto a PA deve ser monitorada rigorosamente.
Fluidoterapia intravenosa
Se a PA sistólica for <90 mmHg, fluidoterapia intravenosa deverá ser administrada. Insuficiência aguda do ventrículo direito com débito sistêmico baixo resultante é a principal causa de morte em pacientes com EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Estudos indicam que a expansão agressiva do volume não tem benefícios e pode até agravar a função do ventrículo direito causando distensão mecânica excessiva ou mecanismos de reflexo que deprimem a contratilidade. No entanto, prova volêmica modesta (ou seja, 500 mL de cristaloide) pode ser benéfica em pacientes com EP, índice cardíaco baixo e PA normal.[159]Mercat A, Diehl JL, Meyer G, et al. Hemodynamic effects of fluid loading in acute massive pulmonary embolism. Crit Care Med. 1999 Mar;27(3):540-4.
http://www.ncbi.nlm.nih.gov/pubmed/10199533?tool=bestpractice.com
Agentes vasoativos
Caso a PA sistólica seja <90 mmHg, os vasopressores podem ser administrados em paralelo com (ou enquanto se aguarda) tratamento farmacológico, cirúrgico ou reperfusão intervencionista.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
A noradrenalina pode melhorar a função ventricular direita e a perfusão coronária ventricular direita.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
No entanto, seu uso provavelmente deve ser limitado a pacientes hipotensos.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
A dobutamina eleva a contratilidade com um aumento no volume sistólico e no débito cardíaco. No entanto, seu efeito vasodilatador sistêmico pode causar hipotensão.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
A adrenalina combina as propriedades benéficas da noradrenalina (vasoconstrição com aumento da perfusão ventricular direita, inotropismo positivo) e da dobutamina (inotropismo positivo), mas sem os efeitos vasodilatadores associados a esta última.[160]Layish DT, Tapson VF. Pharmacologic hemodynamic support in massive pulmonary embolism. Chest. 1997 Jan;111(1):218-24.
http://www.ncbi.nlm.nih.gov/pubmed/8996020?tool=bestpractice.com
Fase de iniciação da anticoagulação (5 a 21 dias)
Os pacientes que apresentam suspeita de EP devem receber um anticoagulante dosado de acordo com a fase de início da terapia (o período inicial após o diagnóstico da EP, com duração de 5 a 21 dias, dependendo do medicamento selecionado), a menos que contraindicado.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[161]Willoughby L, Adams DM, Evans RS, et al. Preemptive anticoagulation in patients with a high pretest probability of pulmonary embolism: are guidelines followed? Chest. 2018 May;153(5):1153-9.
https://www.doi.org/10.1016/j.chest.2017.11.007
http://www.ncbi.nlm.nih.gov/pubmed/29154971?tool=bestpractice.com
Se a EP for subsequentemente, descartada a anticoagulação poderá ser descontinuada. Nos pacientes com EP confirmada, a anticoagulação deve ser ajustada à dose da fase de tratamento após a conclusão da fase de iniciação, e deve continuar por pelo menos 3 meses.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Anticoagulação parenteral
O anticoagulante parenteral da fase inicial deve ser iniciado nos pacientes com probabilidade alta ou intermediária (pré-teste) de EP clínica, enquanto se aguardam os resultados de imagens diagnósticas. Se um anticoagulante parenteral (HNF, heparina de baixo peso molecular [HBPM] ou fondaparinux) for prescrito, ele deve se sobrepor ao início de um antagonista da vitamina K (AVK). A anticoagulação parenteral com HNF por um mínimo de 5 dias é reservada para os pacientes com EP de alto risco nos quais for considerada reperfusão primária (ou seja, terapia trombolítica sistêmica ou embolectomia).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Em pacientes com EP de risco alto intermediário ou baixo intermediário, HBPM ou fondaparinux são os anticoagulantes parenterais preferenciais na fase inicial devido às taxas mais baixas de sangramento importante e trombocitopenia induzida por heparina.
A anticoagulação parenteral pode ser interrompida assim que uma razão normalizada internacional (INR) terapêutica de 2.0 a 3.0 tenha sido estabelecida e pelo menos 5 dias de sobreposição com AVK tenham decorrido.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
A HNF possui meia-vida curta, é fácil de monitorar e é facilmente reversível com protamina.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Anticoagulantes orais diretos (AODs)
Dois dos anticoagulantes orais de ação direta, rivaroxabana e apixabana, podem ser prescritos sem a necessidade de pré-tratamento com um anticoagulante parenteral. No entanto, dabigatrana e edoxabana requerem terapia de adaptação com um anticoagulante parenteral por 5-10 dias.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Uma metanálise revelou que os anticoagulantes orais diretos têm eficácia similar a um regime de heparina/AVK, mas com risco reduzido de sangramento importante (risco relativo 0.61, IC de 95% 0.21 a 0.68).[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
[162]van Es N, Coppens M, Schulman S, et al. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood. 2014 Sep 18;124(12):1968-75.
http://www.bloodjournal.org/content/124/12/1968.long
http://www.ncbi.nlm.nih.gov/pubmed/24963045?tool=bestpractice.com
Da mesma forma, uma análise de rede relatou poucas diferenças estatisticamente significativas entre uma combinação de HBPM/AVK e outras estratégias de tratamento com anticoagulantes (para tromboembolismo venoso); no entanto, a HNF/AVK pode ser a estratégia menos eficaz e o início de apixabana pode estar associado ao menor risco de sangramento.[163]Castellucci LA, Cameron C, Le Gal G, et al. Clinical and safety outcomes associated with treatment of acute venous thromboembolism: a systematic review and meta-analysis. JAMA. 2014 Sep 17;312(11):1122-35.
https://www.doi.org/10.1001/jama.2014.10538
http://www.ncbi.nlm.nih.gov/pubmed/25226478?tool=bestpractice.com
Os AODs não requerem monitoramento hemostático ou do nível do medicamento, têm início de ação rápido e ação curta. Eles não interagem com os alimentos, mas podem interagir com outros agentes farmacoterapêuticos e requerem monitoramento da creatinina sérica. A dabigatrana pode ser revertida com o idarucizumabe. O andexanete alfa foi aprovado pela Food and Drug Administration dos EUA e pela European Medicines Agency para reverter a anticoagulação com apixabana e rivaroxabana em pacientes com sangramentos descontrolados ou que representem risco de vida. No momento, não há nenhum agente reversivo aprovado para a edoxabana.
Existem poucos ou nenhum dado para dar suporte ao uso de AODs em conjunto com terapia trombolítica durante a fase inicial. Depois que o paciente estiver estabilizado, os médicos devem adotar um processo de tomada de decisão compartilhada para selecionar a anticoagulação da fase de tratamento nessa população de pacientes, considerando as limitações de evidência e a pragmática do cuidado.
Populações específicas de pacientes
Um AVK é recomendado para pacientes com comprometimento renal grave (clearance da creatinina <30 mL/minuto).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
O apixabana também é adequado para uso em pacientes com disfunção renal grave ou doença renal em estágio terminal, embora as evidências de uso nessa população de pacientes sejam limitadas.[164]Pathak R, Pandit A, Karmacharya P, et al. Meta-analysis on risk of bleeding with apixaban in patients with renal impairment. Am J Cardiol. 2015 Feb 1;115(3):323-7.
https://www.doi.org/10.1016/j.amjcard.2014.10.042
http://www.ncbi.nlm.nih.gov/pubmed/25527282?tool=bestpractice.com
O American College of Chest Physicians (ACCP) recomenda apixabana, edoxabana ou rivaroxabana em vez de HBPM para a fase de iniciação em pacientes com câncer ativo (trombose associada ao câncer).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
AODs (particularmente edoxabana e rivaxobarana) estão associados a um risco maior de hemorragia digestiva do que a HBPM. Em pacientes com câncer gastrointestinal luminal, o ACCP recomenda apixabana ou HBPM como os agentes de preferência.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[  ]
How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2813/fullMostre-me a resposta A American Society of Hematology (ASH) recomenda rivaroxabana, apixabana ou HBPM para anticoagulação na fase de iniciação em pacientes com câncer ativo; a ASH reconhece que esta recomendação é condicional com base em evidências de qualidade muito baixa.[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
]
How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2813/fullMostre-me a resposta A American Society of Hematology (ASH) recomenda rivaroxabana, apixabana ou HBPM para anticoagulação na fase de iniciação em pacientes com câncer ativo; a ASH reconhece que esta recomendação é condicional com base em evidências de qualidade muito baixa.[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
A HBPM é preferencial em pacientes com insuficiência hepática grave e coagulopatia.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Os profissionais da saúde devem consultar o rótulo e/ou formulários locais antes de prescrever um AOD para um paciente com comprometimento hepático ou renal.
A fondaparinux apresenta baixo risco de induzir trombocitopenia induzida por heparina (TIH) e parece ser eficaz para pacientes com TIH suspeita ou confirmada.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[166]Kang M, Alahmadi M, Sawh S, et al. Fondaparinux for the treatment of suspected heparin-induced thrombocytopenia: a propensity score-matched study. Blood. 2015 Feb 5;125(6):924-9.
http://www.bloodjournal.org/content/125/6/924.long
http://www.ncbi.nlm.nih.gov/pubmed/25515959?tool=bestpractice.com
É contraindicado em pacientes com comprometimento renal grave.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Gestação
A HBPM é recomendada para gestantes (dose ajustada de acordo como peso) ou com suspeita de gravidez.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[167]Bates SM, Greer IA, Middeldorp S, et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012 Feb;141(2 Suppl):e691S-736S.
https://journal.chestnet.org/article/S0012-3692(12)60136-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/22315276?tool=bestpractice.com
Ela não atravessa a placenta, e normalmente não é necessário o monitoramento de rotina.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[168]Royal College of Obstetricians and Gynaecologists. Reducing the risk of venous thromboembolism during pregnancy and the puerperium. Green-top guideline No. 37a. Apr 2015 [internet publication].
https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf
[169]Bates SM, Rajasekhar A, Middeldorp S, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy. Blood Adv. 2018 Nov 27;2(22):3317-59.
https://www.doi.org/10.1182/bloodadvances.2018024802
http://www.ncbi.nlm.nih.gov/pubmed/30482767?tool=bestpractice.com
Outros anticoagulantes, incluindo AVKs, podem atravessar a placenta com risco concomitante de efeitos adversos fetais.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Os AODs são contraindicados na gestação.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[170]Cohen H, Arachchillage DR, Middeldorp S, et al. Management of direct oral anticoagulants in women of childbearing potential: guidance from the SSC of the ISTH. J Thromb Haemost. 2016 Aug;14(8):1673-6.
https://www.doi.org/10.1111/jth.13366
http://www.ncbi.nlm.nih.gov/pubmed/27346676?tool=bestpractice.com
O monitoramento clínico é preferível à anticoagulação em pacientes com EP subsegmentar (ou seja, sem comprometimento de mais artérias pulmonares proximais) que não apresentem trombose venosa profunda (TVP) proximal nos membros inferiores e com baixo risco de tromboembolismo venoso recorrente. A vigilância clínica envolve informar os pacientes sobre os sinais e sintomas clínicos de trombose progressiva a serem observados e a necessidade de reavaliar se estes estiverem presentes.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Reperfusão primária em pacientes em choque ou com hipotensão
A terapia trombolítica sistêmica (de preferência com alteplase ou reteplase; tenecteplase é uma alternativa) é recomendada em pacientes com comprometimento hemodinâmico (choque, PA sistólica <90 mmHg ou necessidade de vasopressor para manter a PA sistólica >90 mmHg), pois este grupo de pacientes tem uma alta taxa de mortalidade.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
[171]Zuo Z, Yue J, Dong BR, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2021 Apr 15;4:CD004437.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004437.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/33857326?tool=bestpractice.com
[172]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.
https://jamanetwork.com/journals/jama/fullarticle/1881311
http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com
[173]Ortel TL, Neumann I, Ageno W, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv. 2020 Oct 13;4(19):4693-738.
https://www.doi.org/10.1182/bloodadvances.2020001830
http://www.ncbi.nlm.nih.gov/pubmed/33007077?tool=bestpractice.com
[174]Meyer G, Vicaut E, Danays T, et al; PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014 Apr 10;370(15):1402-11.
https://www.nejm.org/doi/10.1056/NEJMoa1302097
http://www.ncbi.nlm.nih.gov/pubmed/24716681?tool=bestpractice.com
[175]Kline JA, Hernandez-Nino J, Jones AE. Tenecteplase to treat pulmonary embolism in the emergency department. J Thromb Thrombolysis. 2007 Apr;23(2):101-5.
https://www.doi.org/10.1007/s11239-006-9018-3
http://www.ncbi.nlm.nih.gov/pubmed/17221330?tool=bestpractice.com
O ACCP recomenda a terapia trombolítica sistêmica (a menos que seja contraindicada) usando uma veia periférica para pacientes com EP aguda associada à hipotensão que não apresentam alto risco de sangramento. O ACCP não faz recomendações específicas sobre agentes preferenciais devido à falta de dados comparativos.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
A terapia trombolítica sistêmica está associada a uma taxa de mortalidade por todas as causas mais baixa que a anticoagulação isolada em pacientes com EP de alto-risco (maciça) (EP aguda com hipotensão sustentada [ou seja, PA sistólica <90 mmHg por, pelo menos, 15 minutos]).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[171]Zuo Z, Yue J, Dong BR, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2021 Apr 15;4:CD004437.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004437.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/33857326?tool=bestpractice.com
[172]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.
https://jamanetwork.com/journals/jama/fullarticle/1881311
http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com
[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
Idealmente, a EP deve ser confirmada por exame de imagem antes da administração da terapia trombolítica.[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Entretanto, caso o paciente apresente risco iminente de parada cardíaca, o tratamento pode ser iniciado em bases clínicas apenas.[96]British Thoracic Society Standards of Care Committee Pulmonary Embolism Guideline Development Group. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax. 2003 Jun;58(6):470-83.
http://thorax.bmj.com/content/58/6/470.long
http://www.ncbi.nlm.nih.gov/pubmed/12775856?tool=bestpractice.com
A terapia trombolítica sistêmica induz a dissolução de coágulos e melhora a função ventricular direita, o fluxo sanguíneo pulmonar e a perfusão pulmonar.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
A trombólise associada à heparina apresentou uma taxa de mortalidade consideravelmente reduzida no prazo de 30 dias, comparada à heparina isolada (2.3% [24/1033] vs. 3.9% [40/1024], respectivamente; razão de chances [RC] 0.59, IC de 95% 0.36 a 0.96, P=0.03) em uma metanálise de pacientes com EP aguda.[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
Entretanto, a trombólise está associada a um risco significativamente aumentado de sangramentos maiores e menores, incluindo AVC hemorrágico.[171]Zuo Z, Yue J, Dong BR, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2021 Apr 15;4:CD004437.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004437.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/33857326?tool=bestpractice.com
[172]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.
https://jamanetwork.com/journals/jama/fullarticle/1881311
http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com
[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
Um número maior de pacientes que receberam terapia trombolítica associada à heparina apresentou um episódio de sangramento importante, comparado aos pacientes que receberam anticoagulante isolado (9.9% [96/974] vs. 3.6% [35/961], respectivamente; RC 2.91, IC de 95% 1.95 a 4.36).[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
A incidência registrada de hemorragia intracraniana ou fatal foi de 1.7% no grupo de trombólise e 0.3% no grupo de anticoagulante.[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
As contraindicações absolutas à trombólise incluem: acidente vascular cerebral (AVC) hemorrágico ou AVC de origem desconhecida a qualquer momento; AVC isquêmico nos 6 meses precedentes; danos ou neoplasias no sistema nervoso central (SNC); trauma maior/cirurgia/traumatismo cranioencefálico recente (nas 3 semanas precedentes); hemorragia digestiva dentro do último mês; risco de sangramento conhecido.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[177]Van de Werf F, Ardissino D, Betriu A, et al; task force on the management of acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2003 Jan;24(1):28-66.
https://academic.oup.com/eurheartj/article/24/1/28/562262
http://www.ncbi.nlm.nih.gov/pubmed/12559937?tool=bestpractice.com
As contraindicações relativas à trombólise incluem: ataque isquêmico transitório nos 6 meses precedentes; terapia anticoagulante oral; gestação ou dentro de 1 semana pós-parto; ressuscitação traumática (em relação a este episódio de EP); hipertensão refratária (PA sistólica >180 mmHg); doença hepática avançada; endocardite infecciosa; úlcera péptica ativa.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[177]Van de Werf F, Ardissino D, Betriu A, et al; task force on the management of acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2003 Jan;24(1):28-66.
https://academic.oup.com/eurheartj/article/24/1/28/562262
http://www.ncbi.nlm.nih.gov/pubmed/12559937?tool=bestpractice.com
A terapia trombolítica não é tipicamente recomendada para pacientes hemodinamicamente estáveis com EP aguda.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Em um ensaio duplo-cego randomizado, a terapia trombolítica com reperfusão primária associada a heparina em pacientes normotensos com EP de risco intermediário (disfunção ventricular direita aguda e lesão do miocárdio sem comprometimento hemodinâmico evidente) preveniu a descompensação hemodinâmica, comparada à heparina isolada, mas elevou os riscos de hemorragia importante e AVC.[174]Meyer G, Vicaut E, Danays T, et al; PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014 Apr 10;370(15):1402-11.
https://www.nejm.org/doi/10.1056/NEJMoa1302097
http://www.ncbi.nlm.nih.gov/pubmed/24716681?tool=bestpractice.com
Embolectomia cirúrgica ou terapia dirigida por cateter
A terapia trombolítica sistêmica aumenta o risco de sangramento, inclusive sangramento intracraniano.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[176]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.
https://academic.oup.com/eurheartj/article/36/10/605/514452
http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
A embolectomia pulmonar cirúrgica e a terapia dirigida por cateter (que geralmente envolve uma combinação de fragmentação mecânica e farmacoterapêutica do trombo) provavelmente apresentam menor risco de sangramento do que a terapia sistêmica.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[178]Dolovich LR, Ginsberg JS, Douketis JD, et al. A meta-analysis comparing low-molecular-weight heparins with unfractionated heparin in the treatment of venous thromboembolism: examining some unanswered questions regarding location of treatment, product type, and dosing frequency. Arch Intern Med. 2000 Jan 24;160(2):181-8.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/485206
http://www.ncbi.nlm.nih.gov/pubmed/10647756?tool=bestpractice.com
[179]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.
http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com
[180]Goldberg JB, Giri J, Kobayashi T, et al. Surgical management and mechanical circulatory support in high-risk pulmonary embolisms: historical context, current status, and future directions: a scientific statement from the American Heart Association. Circulation. 2023 Feb 28;147(9):e628-e47.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000001117
http://www.ncbi.nlm.nih.gov/pubmed/36688837?tool=bestpractice.com
A embolectomia pulmonar cirúrgica é recomendada para pacientes para quem a terapia trombolítica sistêmica não funcionou ou é totalmente contraindicada.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[180]Goldberg JB, Giri J, Kobayashi T, et al. Surgical management and mechanical circulatory support in high-risk pulmonary embolisms: historical context, current status, and future directions: a scientific statement from the American Heart Association. Circulation. 2023 Feb 28;147(9):e628-e47.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000001117
http://www.ncbi.nlm.nih.gov/pubmed/36688837?tool=bestpractice.com
As taxas de mortalidade após a embolectomia pulmonar variam de 4% a 27%.[181]Fukuda I, Daitoku K. Surgical Embolectomy for Acute Pulmonary Thromboembolism. Ann Vasc Dis. 2017 Jun 25;10(2):107-114.
https://www.doi.org/10.3400/avd.ra.17-00038
http://www.ncbi.nlm.nih.gov/pubmed/29034035?tool=bestpractice.com
Em uma pequena coorte de pacientes submetidos à embolectomia pulmonar cirúrgica para tromboembolismo pulmonar agudo maciço, a taxa de sobrevida de 10 anos foi de 84%.[182]Fukuda I, Taniguchi S, Fukui K, et al. Improved outcome of surgical pulmonary embolectomy by aggressive intervention for critically ill patients. Ann Thorac Surg. 2011 Mar;91(3):728-32.
https://www.doi.org/10.1016/j.athoracsur.2010.10.086
http://www.ncbi.nlm.nih.gov/pubmed/21352987?tool=bestpractice.com
A terapia direcionada por cateter, que normalmente envolve uma combinação de fragmentação mecânica e farmacoterapêutica do trombo, pode ser considerada para pacientes com EP aguda associada à hipotensão que também apresentam alto risco de sangramento, falha na trombólise sistêmica ou choque que provavelmente causará morte antes de a trombólise sistêmica poder ter efeito (por exemplo, em poucas horas), se houver conhecimento e recursos apropriados.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
A terapia direcionada por cateter utiliza um medicamento trombolítico de dose mais baixa (aproximadamente um terço da terapia trombolítica sistêmica de dose completa), e acredita-se que reduz os riscos de sangramentos em locais remotos (por exemplo, sangramento intracraniano ou gastrointestinal).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Uma metanálise de ensaios clínicos não randomizados de terapias dirigidas por cateter registrou uma taxa de sucesso clínico de 87% com um risco associado de complicações maiores e menores de 2% e 8%, respectivamente.[183]Kuo WT, Gould MK, Louie JD, at al. Catheter-directed therapy for the treatment of massive pulmonary embolism: systematic review and meta-analysis of modern techniques. J Vasc Interv Radiol. 2009 Nov;20(11):1431-40.
http://www.ncbi.nlm.nih.gov/pubmed/19875060?tool=bestpractice.com
A evidência é limitada por pequenos estudos, desenho do estudo (ou seja, não randomizado) e uso de endpoints de eficácia intermediários.[184]Jimenez D, Martin-Saborido C, Muriel A, et al. Efficacy and safety outcomes of recanalisation procedures in patients with acute symptomatic pulmonary embolism: systematic review and network meta-analysis. Thorax. 2018 May;73(5):464-71.
https://www.doi.org/10.1136/thoraxjnl-2017-210040
http://www.ncbi.nlm.nih.gov/pubmed/29133351?tool=bestpractice.com
Filtros de veia cava inferior
Um filtro de veia cava inferior (VCI) pode ser colocado em pacientes:[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[179]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.
http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com
Com EP aguda e uma contraindicação absoluta à terapia anticoagulante, como sangramento importante ativo
Com EP recorrente confirmada apesar da anticoagulação adequada.
As diretrizes do ACCP recomendam o uso de um filtro de VCI apenas para pacientes com EP aguda (por exemplo, diagnosticado no mês anterior) e uma contraindicação absoluta à terapia anticoagulante (por exemplo, sangramento importante ativo, trombocitopenia grave, alto risco de sangramento, lesão do sistema nervoso central). O ACCP não recomenda o uso de filtros de VCI em associação com a anticoagulação em pacientes com EP aguda.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Outras diretrizes consideram que as indicações relativas para o uso de filtro de VCI incluem a EP maciça com trombo venoso profundo residual em um paciente em risco de EP adicional, trombo iliofemoral ou de VCI flutuante e doença cardiopulmonar grave e trombose venosa profunda (TVP) (por exemplo, cor pulmonale com hipertensão pulmonar).[185]American College of Radiology; Society of Interventional Radiology. ACR-SIR-SPR practice parameter for the performance of inferior vena cava (IVC) filter placement for the prevention of pulmonary embolism. 2021 [internet publication].
https://www.acr.org/-/media/ACR/Files/Practice-Parameters/ivc-fliterplacement.pdf
Alguns centros inserem filtros de VCI de maneira intraoperatória ou imediatamente no pós-operatório em pacientes submetidos a embolectomia pulmonar cirúrgica.[186]Leacche M, Unic D, Goldhaber SZ, et al. Modern surgical treatment of massive pulmonary embolism: Results in 47 consecutive patients after rapid diagnosis and aggressive surgical approach. J Thorac Cardiovasc Surg. 2005 May;129(5):1018-23.
http://www.ncbi.nlm.nih.gov/pubmed/15867775?tool=bestpractice.com
[187]Aklog L, Williams CS, Byrne JG, et al. Acute pulmonary embolectomy: a contemporary approach. Circulation. 2002 Mar 26;105(12):1416-9.
http://circ.ahajournals.org/content/105/12/1416.long
http://www.ncbi.nlm.nih.gov/pubmed/11914247?tool=bestpractice.com
[188]Greelish JP, Leacche M, Solenkova NS, et al. Improved midterm outcomes for type A (central) pulmonary emboli treated surgically. J Thorac Cardiovasc Surg. 2011 Dec;142(6):1423-9.
https://www.jtcvs.org/article/S0022-5223(11)00280-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/21481423?tool=bestpractice.com
A colocação do filtro de VCI deve ocorrer assim que possível, caso seja o único tratamento que possa ser iniciado. Há pouca evidência disponível para sugerir o momento ideal da colocação. Entretanto, o maior risco de morte está nas primeiras 2 horas após a apresentação, que pode indicar que esse é um período de ocorrência razoável para a colocação do filtro.[189]Tow DE, Wagner HN. Urokinase pulmonary embolism trial: Phase I results. JAMA. 1970 Dec 21;214(12):2163-72.
https://jamanetwork.com/journals/jama/article-abstract/358702
Estudos observacionais sugerem que a colocação de um filtro venoso pode reduzir as taxas de mortalidade relacionadas à EP na fase aguda, mas com um aumento do risco de tromboembolismo venoso associado ao filtro.[190]Stein PD, Matta F, Keyes DC, et al. Impact of vena cava filters on in-hospital case fatality rate from pulmonary embolism. Am J Med. 2012 May;125(5):478-84.
https://www.amjmed.com/article/S0002-9343(11)00481-5/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/22310013?tool=bestpractice.com
[191]Muriel A, Jiménez D, Aujesky D, et al. Survival effects of inferior vena cava filter in patients with acute symptomatic venous thromboembolism and a significant bleeding risk. J Am Coll Cardiol. 2014 Apr 29;63(16):1675-83.
http://www.ncbi.nlm.nih.gov/pubmed/24576432?tool=bestpractice.com
Complicações associadas aos filtros de VCI permanentes são comuns, embora raramente sejam fatais.[191]Muriel A, Jiménez D, Aujesky D, et al. Survival effects of inferior vena cava filter in patients with acute symptomatic venous thromboembolism and a significant bleeding risk. J Am Coll Cardiol. 2014 Apr 29;63(16):1675-83.
http://www.ncbi.nlm.nih.gov/pubmed/24576432?tool=bestpractice.com
Complicações precoces (inclusive trombose no local da colocação) ocorrem em aproximadamente 10% dos pacientes. Complicações tardias são mais frequentes e incluem TVP recorrente (aproximadamente 20% dos pacientes) e síndrome pós-trombótica (até 40% dos pacientes).[192]Rajasekhar A, Streiff MB. Vena cava filters for management of venous thromboembolism: a clinical review. Blood Rev. 2013 Sep;27(5):225-41.
http://www.ncbi.nlm.nih.gov/pubmed/23932118?tool=bestpractice.com
[193]PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prévention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study. Circulation. 2005 Jul 19;112(3):416-22.
http://circ.ahajournals.org/content/112/3/416.long
http://www.ncbi.nlm.nih.gov/pubmed/16009794?tool=bestpractice.com
A oclusão da VCI afeta aproximadamente 22% dos pacientes em 5 anos e 33% em 9 anos, independentemente do uso e da duração de anticoagulação.[193]PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prévention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study. Circulation. 2005 Jul 19;112(3):416-22.
http://circ.ahajournals.org/content/112/3/416.long
http://www.ncbi.nlm.nih.gov/pubmed/16009794?tool=bestpractice.com
A anticoagulação pós-filtro deve ser considerada caso a caso, de acordo com as contraindicações relativas e absolutas.[194]Decousus H, Leizorovicz A, Parent F, et al; Prévention du Risque d'Embolie Pulmonaire par Interruption Cave Study Group. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. N Engl J Med. 1998 Feb 12;338(7):409-15.
https://www.nejm.org/doi/10.1056/NEJM199802123380701
http://www.ncbi.nlm.nih.gov/pubmed/9459643?tool=bestpractice.com
A anticoagulação deve ser iniciada se a contraindicação for resolvida ou se uma análise de risco/benefício sugerir que essa é uma conduta razoável.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Quando são usados filtros recuperáveis, eles devem ser removidos assim que o uso de anticoagulantes for seguro.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Estratificação prognóstica de pacientes com EP confirmada sem choque ou hipotensão: Índice de Gravidade de Embolia Pulmonar
Os pacientes com EP confirmada sem choque ou hipotensão requerem outra estratificação de risco, por exemplo com o índice de gravidade da embolia pulmonar (PESI) ou o índice simplificado de gravidade da embolia pulmonar (sPESI).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
O PESI classifica os pacientes com EP confirmada sem choque ou hipotensão em categorias de risco que variam de 1 a 5, associadas ao aumento da mortalidade em 30 dias. A categoria de risco PESI deriva da soma de pontos de 11 critérios clínicos; o sPESI tem apenas 6 critérios e apresenta uma estratificação de risco dicotômica (risco baixo [0 pontos] ou alto [≥1 ponto(s)] de mortalidade em 30 dias).
Estudos indicam que PESI e sPESI predizem mortalidade em curto prazo com precisão comparável, mas o último é mais fácil de usar.[195]Vinson DR, Ballard DW, Mark DG, et al; MAPLE Investigators of the KP CREST Network. Risk stratifying emergency department patients with acute pulmonary embolism: does the simplified Pulmonary Embolism Severity Index perform as well as the original? Thromb Res. 2016 Dec;148:1-8.
http://www.ncbi.nlm.nih.gov/pubmed/27764729?tool=bestpractice.com
[196]Zhou XY, Ben SQ, Chen HL, et al. The prognostic value of pulmonary embolism severity index in acute pulmonary embolism: a meta-analysis. Respir Res. 2012 Dec 4;13:111.
https://respiratory-research.biomedcentral.com/articles/10.1186/1465-9921-13-111
http://www.ncbi.nlm.nih.gov/pubmed/23210843?tool=bestpractice.com
Uma metanálise que avaliou a capacidade prognóstica do PESI/sPESI para mortalidade por todas as causas relatou sensibilidade e especificidade combinadas de 91% e 41%, respectivamente.[196]Zhou XY, Ben SQ, Chen HL, et al. The prognostic value of pulmonary embolism severity index in acute pulmonary embolism: a meta-analysis. Respir Res. 2012 Dec 4;13:111.
https://respiratory-research.biomedcentral.com/articles/10.1186/1465-9921-13-111
http://www.ncbi.nlm.nih.gov/pubmed/23210843?tool=bestpractice.com
O PESI foi usado para identificar pacientes adequados ao tratamento ambulatorial em estudos prospectivos.[197]Roy PM, Moumneh T, Penaloza A, et al. Outpatient management of pulmonary embolism. Thromb Res. 2017 Jul;155:92-100.
https://www.doi.org/10.1016/j.thromres.2017.05.001
http://www.ncbi.nlm.nih.gov/pubmed/28525830?tool=bestpractice.com
[198]Bledsoe JR, Woller SC, Stevens SM, et al. Management of Low-Risk Pulmonary Embolism Patients Without Hospitalization: The Low-Risk Pulmonary Embolism Prospective Management Study. Chest. 2018 Aug;154(2):249-256.
https://www.doi.org/10.1016/j.chest.2018.01.035
http://www.ncbi.nlm.nih.gov/pubmed/29410163?tool=bestpractice.com
Com base nas características sociais e na probabilidade de adesão ao tratamento, as diretrizes da European Society of Cardiology indicam que os pacientes de baixo risco (PESI classe I ou II) e, potencialmente, aqueles com um score sPESI de 0, podem ser considerados para a alta precoce e o tratamento ambulatorial.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Critérios do PESI e estratificação de riscoCriado pelo BMJ Knowledge Centre [Citation ends].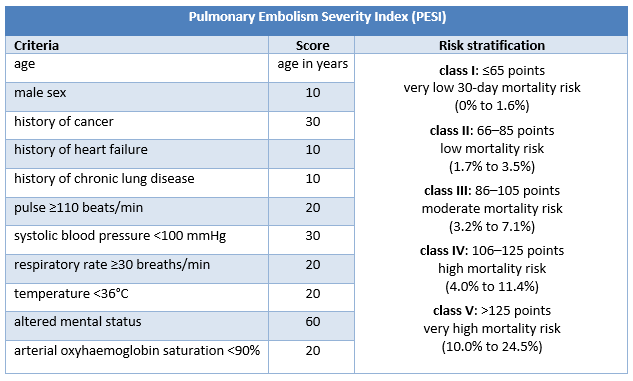 [Figure caption and citation for the preceding image starts]: Critérios do sPESI e estratificação de riscoCriado pelo BMJ Knowledge Centre [Citation ends].
[Figure caption and citation for the preceding image starts]: Critérios do sPESI e estratificação de riscoCriado pelo BMJ Knowledge Centre [Citation ends].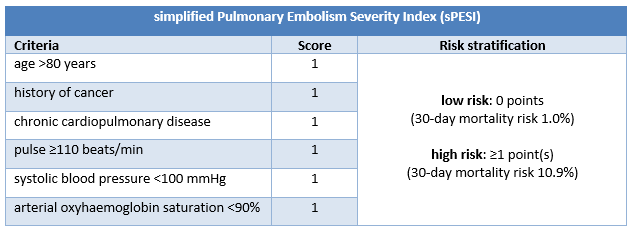
Trombólise de resgate
A função ventricular direita avaliada por ecocardiografia e o teste de troponina cardíaca devem ser considerados em pacientes com estratificação de risco PESI ≥III ou sPESI ≥1.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Em pacientes com EP confirmada sem choque ou hipotensão: a disfunção ventricular direita é preditiva de desfecho adverso e permite maior estratificação de risco; níveis elevados de troponina estão associados a aumento do risco de mortalidade em curto prazo, mortalidade relacionada à EP e eventos adversos graves.[130]Vanni S, Polidori G, Vergara R, et al. Prognostic value of ECG among patients with acute pulmonary embolism and normal blood pressure. Am J Med. 2009 Mar;122(3):257-64.
http://www.ncbi.nlm.nih.gov/pubmed/19272487?tool=bestpractice.com
[131]Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation. 2011 Apr 26;123(16):1788-830.
http://circ.ahajournals.org/content/123/16/1788.long
http://www.ncbi.nlm.nih.gov/pubmed/21422387?tool=bestpractice.com
[132]Weekes AJ, Thacker G, Troha D, et al. Diagnostic accuracy of right ventricular dysfunction markers in normotensive emergency department patients with acute pulmonary embolism. Ann Emerg Med. 2016 Sep;68(3):277-91.
http://www.ncbi.nlm.nih.gov/pubmed/26973178?tool=bestpractice.com
[199]Bajaj A, Saleeb M, Rathor P, et al. Prognostic value of troponins in acute nonmassive pulmonary embolism: A meta-analysis. Heart Lung. 2015 Jul-Aug;44(4):327-34.
https://www.doi.org/10.1016/j.hrtlng.2015.03.007
http://www.ncbi.nlm.nih.gov/pubmed/25976228?tool=bestpractice.com
[200]Becattini C, Vedovati MC, Agnelli G. Prognostic value of troponins in acute pulmonary embolism: a meta-analysis. Circulation. 2007 Jul 24;116(4):427-33.
https://www.doi.org/10.1161/CIRCULATIONAHA.106.680421
http://www.ncbi.nlm.nih.gov/pubmed/17606843?tool=bestpractice.com
Pacientes de risco alto intermediário
Os pacientes com estratificação de risco PESI ≥III, ou sPESI ≥1, com disfunção ventricular direita e teste positivo para troponina cardíaca pertencem a um grupo de risco intermediário-alto.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
A trombólise de resgate pode ser indicada para pacientes com risco alto-intermediário e para pacientes com outras características clínicas de comprometimento cardiopulmonar (por exemplo, frequência cardíaca elevada, frequência respiratória, pressão venosa jugular) que iniciaram a terapia anticoagulante, e:[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[179]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.
http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com
Estão se deteriorando (como visto por diminuição da PA sistólica, aumento da frequência cardíaca, agravamento das trocas gasosas, sinais de perfusão inadequada, agravamento da função do VD ou aumento dos biomarcadores cardíacos), mas ainda não desenvolveram hipotensão[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Apresentam sinais de descompensação hemodinâmica (por exemplo, PA sistólica <90 mmHg por, pelo menos, 15 minutos, ou queda da PA sistólica para ao menos 40 mmHg por, pelo menos, 15 minutos, com sinais de hipoperfusão de ´órgão-alvo).
A consideração do risco de sangramento determinará a escolha da terapia trombolítica.
Pacientes de risco baixo intermediário
Pacientes normotensos com estratificação de risco PESI ≥III ou sPESI ≥1, com ecocardiograma e/ou teste de troponina cardíaca normais são considerados de risco baixo-intermediário.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Os pacientes de risco baixo intermediário devem ser monitorados caso o teste de troponina cardíaca seja positivo (mesmo na ausência de disfunção ventricular direita); a terapia anticoagulante deve ser mantida em todos os pacientes de risco baixo-intermediário.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Outros índices prognósticos
O RIETE (Registro Informatizado de la Enfermedad TromboEmbolica venosa) e os critérios HESTIA podem ser úteis para selecionar os pacientes (com tromboembolismo venoso e baixo risco de desfechos clínicos adversos) que podem ser tratados em regime ambulatorial.[201]Trujillo-Santos J, Lozano F, Lorente MA, et al. A prognostic score to identify low-risk outpatients with acute deep vein thrombosis in the lower limbs. Am J Med. 2015 Jan;128(1):90.e9-15.
https://www.doi.org/10.1016/j.amjmed.2014.08.023
http://www.ncbi.nlm.nih.gov/pubmed/25242230?tool=bestpractice.com
[202]Zondag W, Vingerhoets LM, Durian MF, et al. Hestia criteria can safely select patients with pulmonary embolism for outpatient treatment irrespective of right ventricular function. J Thromb Haemost. 2013 Apr;11(4):686-92.
https://www.doi.org/10.1111/jth.12146
http://www.ncbi.nlm.nih.gov/pubmed/23336721?tool=bestpractice.com
[203]Weeda ER, Kohn CG, Peacock WF, et al. External Validation of the Hestia Criteria for Identifying Acute Pulmonary Embolism Patients at Low Risk of Early Mortality. Clin Appl Thromb Hemost. 2017 Oct;23(7):769-774.
https://www.doi.org/10.1177/1076029616651147
http://www.ncbi.nlm.nih.gov/pubmed/27225840?tool=bestpractice.com
Fase de tratamento da terapia anticoagulante
As diretrizes do ACCP recomendam que os pacientes que não tenham contraindicação recebam uma fase de tratamento de 3 meses de anticoagulação. Apixabana, dabigatrana, edoxabana ou rivaroxabana são recomendadas em vez de AVK.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Uma vez que a fase de tratamento esteja completa, todos os pacientes devem ser avaliados para terapia de fase prolongada.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Terapia anticoagulante de fase prolongada
A meta para a continuação da terapia anticoagulante na fase prolongada (ou seja, além dos primeiros 3 meses, e sem data de interrupção programada) é a prevenção secundária do tromboembolismo venoso.
As diretrizes do ACCP recomendam que os seguintes pacientes recebam anticoagulação de fase prolongada:[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Aqueles com EP diagnosticados na ausência de fatores precipitantes transitórios (EP sem fatores precipitantes ou EP com fatores de risco precipitantes persistentes). Esses pacientes devem receber um AOD
Aqueles com EP diagnosticados na ausência de um fator de risco transitório (EP sem fatores precipitantes ou com um fator de risco precipitante persistente) que não podem receber um AOD. Esses pacientes devem receber um AVK.
A anticoagulação de fase prolongada não é recomendada em pacientes com EP diagnosticados no contexto de um fator de risco transitório maior ou menor.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
A decisão de iniciar ou continuar a terapia prolongada deve ser baseada na preferência do paciente e no risco predito de tromboembolismo venoso recorrente ou sangramento.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
A predição precisa do risco de tromboembolismo venoso recorrente após um evento inicial é um desafio. A presença ou ausência de fatores provocadores temporários é o preditor mais potente para recorrência. Pacientes com uma grande provocação transitória (por exemplo, cirurgia) nos 3 meses anteriores ao evento de tromboembolismo venoso têm o menor risco de recorrência. Fatores de risco transitórios menores (por exemplo, hospitalização médica, uso de estrogênio, viagens de longa distância) até 2 meses após o diagnóstico predizem um risco intermediário de recorrência. Pacientes sem fator de risco identificável para tromboembolismo venoso (ou seja, tromboembolismo venoso não provocado) ou uma provocação persistente (por exemplo, câncer) estão em alto risco de recorrência.[20]Kearon C, Ageno W, Cannegieter SC, et al. Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH. J Thromb Haemost. 2016 Jul;14(7):1480-3.
https://www.doi.org/10.1111/jth.13336
http://www.ncbi.nlm.nih.gov/pubmed/27428935?tool=bestpractice.com
Acredita-se que os pacientes com EP não provocada recorrente e TVP proximal corram um risco especialmente alto de recorrência futura.[173]Ortel TL, Neumann I, Ageno W, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv. 2020 Oct 13;4(19):4693-738.
https://www.doi.org/10.1182/bloodadvances.2020001830
http://www.ncbi.nlm.nih.gov/pubmed/33007077?tool=bestpractice.com
Ao avaliar o risco de sangramento, os seguintes fatores devem ser considerados: idade >65 anos (particularmente >75 anos), sangramento prévio, câncer, insuficiência renal, insuficiência hepática, trombocitopenia, AVC prévio, diabetes mellitus, anemia, terapia antiagregante plaquetária, baixo controle do anticoagulante, comorbidade com capacidade funcional reduzida, cirurgia recente, quedas frequentes, abuso de álcool, uso de anti-inflamatórios não esteroidais.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Os pacientes sem nenhum desses fatores de risco são considerados em baixo risco; um fator de risco confere risco moderado a um paciente; e dois ou mais fatores de risco conferem alto risco a um paciente.
Vários modelos de predição de risco tentaram identificar pacientes sem provocação e/ou com provocação transitória menor que apresentam baixo risco de tromboembolismo venoso recorrente. Destes, o modelo HER-DOO2 foi avaliado em uma série de estudos de validação clínica prospectiva e foi usado para identificar uma subpopulação de pacientes com baixo risco de recorrência após a interrupção da terapia de anticoagulação (após a conclusão da fase de tratamento).[204]Rodger MA, Le Gal G, Anderson DR, et al. Validating the HERDOO2 rule to guide treatment duration for women with unprovoked venous thrombosis: multinational prospective cohort management study. BMJ. 2017 Mar 17;356:j1065.
https://www.doi.org/10.1136/bmj.j1065
http://www.ncbi.nlm.nih.gov/pubmed/28314711?tool=bestpractice.com
Escolha do agente
Em pacientes que recebem terapia de anticoagulação de fase prolongada, em geral não há necessidade de mudar o anticoagulante oral inicial. As diretrizes do ACCP recomendam o uso de apixabana ou rivaroxabana em dose reduzida para pacientes que recebem apixabana ou rivaroxabana; a escolha de um determinado medicamento e dose deve considerar o índice de massa corporal, a função renal e a adesão terapêutica esperada ao esquema posológico do paciente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Doses mais baixas de apixabana e rivaroxabana são igualmente eficazes para a terapia anticoagulante de fase prolongada e estão associadas a uma redução modesta no sangramento não importante em comparação com as doses de tratamento.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[205]Agnelli G, Buller HR, Cohen A, et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med. 2013 Feb 21;368(8):699-708.
https://www.doi.org/10.1056/NEJMoa1207541
http://www.ncbi.nlm.nih.gov/pubmed/23216615?tool=bestpractice.com
[206]Weitz JI, Lensing AW, Prins MH, et al; EINSTEIN CHOICE Investigators. Rivaroxaban or aspirin for extended treatment of venous thromboembolism. N Engl J Med. 2017 Mar 30;376(13):1211-22.
https://www.nejm.org/doi/10.1056/NEJMoa1700518
http://www.ncbi.nlm.nih.gov/pubmed/28316279?tool=bestpractice.com
Evidências de estudos com duração de ≥6 meses sugerem que não há diferenças entre anticoagulantes orais diretos e a anticoagulação convencional para o tratamento da EP.[207]Li M, Li J, Wang X, et al. Oral direct thrombin inhibitors or oral factor Xa inhibitors versus conventional anticoagulants for the treatment of pulmonary embolism. Cochrane Database Syst Rev. 2023 Apr 14;4(4):CD010957.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010957.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/37057837?tool=bestpractice.com
[208]Becattini C, Agnelli G. Risk stratification and management of acute pulmonary embolism. Hematology Am Soc Hematol Educ Program. 2016 Dec 2;2016(1):404-12.
http://asheducationbook.hematologylibrary.org/content/2016/1/404.long
http://www.ncbi.nlm.nih.gov/pubmed/27913508?tool=bestpractice.com
[  ]
How do oral direct thrombin inhibitors (DTIs) and oral factor Xa inhibitors compare with conventional anticoagulation for the treatment of pulmonary embolism?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4357/fullMostre-me a resposta[Evidência B]120fe7b2-87cd-4301-a316-38128bb67120ccaBComo os inibidores diretos da trombina orais e os inibidores do fator Xa orais se comparam à anticoagulação convencional para o tratamento da embolia pulmonar?
]
How do oral direct thrombin inhibitors (DTIs) and oral factor Xa inhibitors compare with conventional anticoagulation for the treatment of pulmonary embolism?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4357/fullMostre-me a resposta[Evidência B]120fe7b2-87cd-4301-a316-38128bb67120ccaBComo os inibidores diretos da trombina orais e os inibidores do fator Xa orais se comparam à anticoagulação convencional para o tratamento da embolia pulmonar?
A continuação do tratamento com anticoagulação de fase prolongada deve ser reavaliado pelo menos anualmente, e sempre que houver mudança significativa no estado clínico do paciente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
A evidência para continuar a terapia prolongada além de 4 anos é incerta. As diretrizes do ACCP recomendam a tomada de decisão compartilhada, levando em consideração os valores e preferências do paciente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Os pacientes devem ser reavaliados periodicamente quanto ao risco de sangramento, as responsabilidades da terapia e qualquer mudança nos valores e preferências.
Se a decisão for interromper a anticoagulação de fase prolongada, as diretrizes do ACCP recomendam administrar aspirina (a menos que seja contraindicado) para prevenir tromboembolismo venoso recorrente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Os benefícios do uso de aspirina devem ser equilibrados com o risco de sangramento e inconveniência do uso. A aspirina não deve ser considerada uma alternativa razoável para pacientes dispostos a se submeter à terapia de anticoagulação de ação prolongada, pois a aspirina é muito menos eficaz. O uso de aspirina deve sempre ser reavaliado quando um paciente interrompe a terapia anticoagulante (porque a aspirina pode ter sido interrompida quando a terapia anticoagulante foi iniciada).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Câncer ativo
Para pacientes com câncer ativo, as diretrizes do ACCP recomendam apixabana, edoxabana ou rivaroxabana em vez de HBPM para anticoagulação de fase prolongada.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
AODs (particularmente edoxabana e rivaxobarana) estão associados a um risco maior de hemorragia digestiva do que a HBPM. Em pacientes com câncer gastrointestinal luminal, o ACCP recomenda apixabana ou HBPM como os agentes de preferência.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[  ]
How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2813/fullMostre-me a resposta A ASH recomenda o uso de AODs ou HBPM para a fase prolongada; a ASH reconhece que esta recomendação é condicional com base em evidências de qualidade muito baixa.[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
]
How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2813/fullMostre-me a resposta A ASH recomenda o uso de AODs ou HBPM para a fase prolongada; a ASH reconhece que esta recomendação é condicional com base em evidências de qualidade muito baixa.[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
A terapia anticoagulante de fase prolongada é recomendada nesses pacientes (ou seja, sem data de interrupção programada) enquanto o câncer permanece ativo.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[165]Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021 Feb 23;5(4):927-74.
https://ashpublications.org/bloodadvances/article/5/4/927/475194/American-Society-of-Hematology-2021-guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/33570602?tool=bestpractice.com
Gestação
A terapia anticoagulante deve ser administrada por pelo menos 6 semanas após o parto em mulheres com alto risco de tromboembolismo venoso pós-parto e por uma duração total mínima do tratamento de 3 meses a partir do diagnóstico inicial da EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[168]Royal College of Obstetricians and Gynaecologists. Reducing the risk of venous thromboembolism during pregnancy and the puerperium. Green-top guideline No. 37a. Apr 2015 [internet publication].
https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf
A HBPM é usada durante o anteparto, pois outros anticoagulantes, incluindo AVKs, podem atravessar a placenta com risco concomitante de efeitos adversos fetais.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
A continuação do tratamento com HBPM ou AVKs é uma opção para mães que amamentam. Os AODs não são recomendados a lactantes porque são excretados no leite materno, e a segurança para o bebê em amamentação não foi estabelecida.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Comprometimento renal grave
O American College of Chest Physicians (ACCP) recomenda um AVK para pacientes com comprometimento renal grave (ou seja, clearance de creatinina <30 mL/minuto).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
O apixabana também é adequado para uso em pacientes com disfunção renal grave ou doença renal em estágio terminal, embora as evidências de uso nessa população de pacientes sejam limitadas.[164]Pathak R, Pandit A, Karmacharya P, et al. Meta-analysis on risk of bleeding with apixaban in patients with renal impairment. Am J Cardiol. 2015 Feb 1;115(3):323-7.
https://www.doi.org/10.1016/j.amjcard.2014.10.042
http://www.ncbi.nlm.nih.gov/pubmed/25527282?tool=bestpractice.com
Comprometimento hepático e coagulopatias
As diretrizes do ACCP recomendam HBMP nesta população de pacientes.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Os profissionais da saúde devem consultar o rótulo e/ou formulários locais antes de prescrever um anticoagulante oral direto para um paciente com comprometimento hepático.
Síndrome antifosfolipídica
Em pacientes com síndrome antifosfolipídica, as diretrizes do ACCP e da Sociedade Internacional de Trombose e Hemostasia recomendam um AVK como agente preferencial.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[209]Zuily S, Cohen H, Isenberg D, et al. Use of direct oral anticoagulants in patients with thrombotic antiphospholipid syndrome: guidance from the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost. 2020 Sep;18(9):2126-37.
https://www.doi.org/10.1111/jth.14935
http://www.ncbi.nlm.nih.gov/pubmed/32881337?tool=bestpractice.com
As evidências de ensaios clínicos randomizados e controlados sugerem que os AODs podem não ser tão eficazes quanto os AVKs para o tratamento da trombose entre pacientes com síndrome antifosfolipídica. Portanto, as diretrizes do ACCP recomendam evitar AODs nesses pacientes.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Pacientes com tromboembolismo venoso recorrente que recebem terapia anticoagulante
O tromboembolismo venoso recorrente é incomum entre os pacientes que recebem terapia anticoagulante com dose terapêutica, com exceção do câncer (7% a 9% de recorrência em terapia com HBPM).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[210]Posch F, Königsbrügge O, Zielinski C, et al. Treatment of venous thromboembolism in patients with cancer: a network meta-analysis comparing efficacy and safety of anticoagulants. Thromb Res. 2015 Sep;136(3):582-9.
https://www.doi.org/10.1016/j.thromres.2015.07.011
http://www.ncbi.nlm.nih.gov/pubmed/26210891?tool=bestpractice.com
Além de se estabelecer de maneira definitiva a presença de EP recidivante, deve-se levar em consideração a adesão à terapia anticoagulante ou a presença de neoplasia maligna subjacente.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
As diretrizes do ACCP recomendam uma mudança temporária para HBPM (por pelo menos 1 mês) para pacientes com EP recorrente que, acredita-se, aderiram a um anticoagulante não HBPM (ou dentro da faixa terapêutica se estiverem recebendo terapia com AVK).[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Uma dose mais alta de HBPM (de um quarto a um terço maior) é adequada para os pacientes com EP recidivante que estiverem recebendo HBPM.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Tromboembolismo venoso recorrente após a descontinuação da terapia anticoagulante
Para pacientes que não estão mais recebendo terapia anticoagulante e apresentam uma segunda EP sem fator de risco identificável (ou seja, não provocada), as diretrizes recomendam as seguintes durações de tratamento com anticoagulante:[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Risco de sangramento baixo ou moderado: terapia anticoagulante prolongada com reavaliação periódica para rever a relação risco-benefício
Alto risco de sangramento: interromper a anticoagulação após 3 meses.
 ]
A American Society of Hematology (ASH) recomenda rivaroxabana, apixabana ou HBPM para anticoagulação na fase de iniciação em pacientes com câncer ativo; a ASH reconhece que esta recomendação é condicional com base em evidências de qualidade muito baixa.[165]
]
A American Society of Hematology (ASH) recomenda rivaroxabana, apixabana ou HBPM para anticoagulação na fase de iniciação em pacientes com câncer ativo; a ASH reconhece que esta recomendação é condicional com base em evidências de qualidade muito baixa.[165] [Figure caption and citation for the preceding image starts]: Critérios do sPESI e estratificação de riscoCriado pelo BMJ Knowledge Centre [Citation ends].
[Figure caption and citation for the preceding image starts]: Critérios do sPESI e estratificação de riscoCriado pelo BMJ Knowledge Centre [Citation ends].
 ]
[Evidência B]
]
[Evidência B] ]
A ASH recomenda o uso de AODs ou HBPM para a fase prolongada; a ASH reconhece que esta recomendação é condicional com base em evidências de qualidade muito baixa.[165]
]
A ASH recomenda o uso de AODs ou HBPM para a fase prolongada; a ASH reconhece que esta recomendação é condicional com base em evidências de qualidade muito baixa.[165]