O tratamento da EP se baseia em uma abordagem diagnóstica algorítmica. A história e o exame físico são relativamente insensíveis e inespecíficos, então devem ser combinados com outros exames diagnósticos no processo de tomada de decisões clínicas.
Um alto índice de suspeita e o manejo rápido são necessários, pois o maior risco de morte está nas primeiras 2 horas após a apresentação.[8]Stein PD, Henry JW. Prevalence of acute pulmonary embolism among patients in a general hospital and at autopsy. Chest. 1995 Oct;108(4):978-81.
http://www.ncbi.nlm.nih.gov/pubmed/7555172?tool=bestpractice.com
[86]Bĕlohlávek J, Dytrych V, Linhart A. Pulmonary embolism, part I: Epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis and nonthrombotic pulmonary embolism. Exp Clin Cardiol. 2013 Spring;18(2):129-38.
http://www.ncbi.nlm.nih.gov/pubmed/23940438?tool=bestpractice.com
No entanto, a EP está presente apenas em uma pequena minoria de pacientes com suspeita da doença.
Probabilidade clínica
A probabilidade clínica, avaliada por uma regra de predição validada e/ou julgamento clínico, é a base de todas as estratégias de diagnósticos para embolia pulmonar (EP).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
Em pacientes hemodinamicamente estáveis com probabilidade clínica não alta (baixa ou intermediária) de EP, recomenda-se a medição do D-dímero para se avaliar a necessidade de um exame de imagem.[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
Em pacientes com probabilidade clínica muito baixa de EP, o teste do dímero D se reserva àqueles que não atendem a todos os critérios de exclusão da embolia pulmonar (CDEP).[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
Aqueles com alta probabilidade clínica de EP, ou com dímero D anormal, devem ser encaminhados imediatamente a uma angiografia pulmonar por tomografia computadorizada (ou exame de ventilação/perfusão [relação V/Q pulmonar] caso a APTC seja contraindicada), como qualquer paciente com suspeita de EP em choque ou hipotensão. Nos pacientes com alta probabilidade pré-teste de EP, a anticoagulação deve ser iniciada enquanto são aguardados os resultados dos exames de imagem.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[22]National Institute for Health and Care Excellence. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. Aug 2023 [internet publication].
https://www.nice.org.uk/guidance/ng158
Confirmação da EP
A confirmação do diagnóstico requer a documentação de um coágulo de sangue em uma artéria pulmonar por um estudo de imagem (como APTC). É essencial confirmar a EP com um exame definitivo, pois o tratamento está associado a um risco significativo de sangramento.
[Figure caption and citation for the preceding image starts]: Resumo: algorítimo diagnóstico da embolia pulmonarCriado pelo BMJ Knowledge Centre [Citation ends].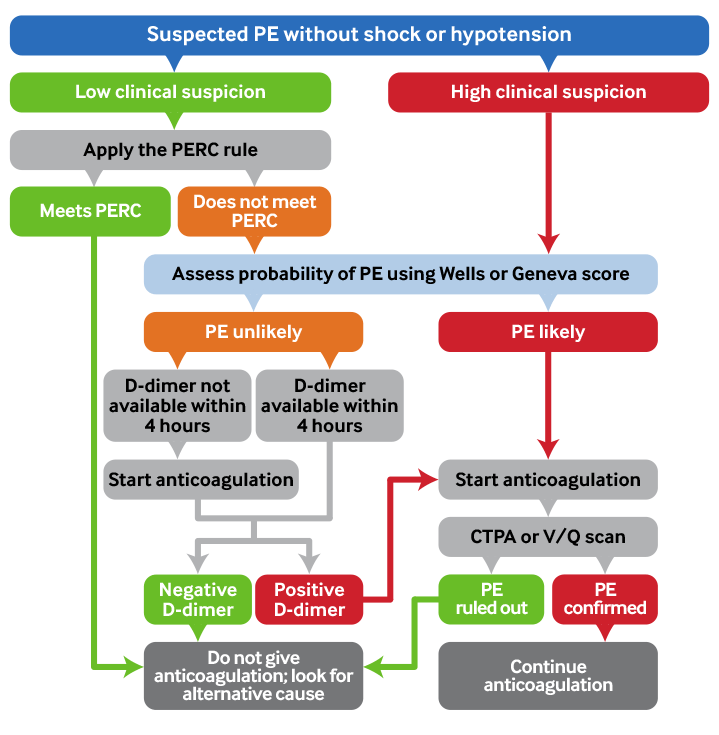
História
A história pode variar muito entre indivíduos. Muitos relatarão um início agudo de desconforto torácico ou dispneia, mas a EP pode se apresentar com sintomas mais incomuns, ou pode até mesmo ser assintomática.[88]Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011 Feb 8;57(6):700-6.
http://www.onlinejacc.org/content/57/6/700
http://www.ncbi.nlm.nih.gov/pubmed/21292129?tool=bestpractice.com
A dor torácica pleurítica e a dispneia são as características mais comuns.[88]Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011 Feb 8;57(6):700-6.
http://www.onlinejacc.org/content/57/6/700
http://www.ncbi.nlm.nih.gov/pubmed/21292129?tool=bestpractice.com
[89]Bajaj N, Bozarth AL, Guillot J, et al. Clinical features in patients with pulmonary embolism at a community hospital: analysis of 4 years of data. J Thromb Thrombolysis. 2014 Apr;37(3):287-92.
http://www.ncbi.nlm.nih.gov/pubmed/23681675?tool=bestpractice.com
Uma sensação de apreensão geralmente é relatada.[5]Bell WR, Simon TL, DeMets DL. The clinical features of submassive and massive pulmonary emboli. Am J Med. 1977 Mar;62(3):355-60.
http://www.ncbi.nlm.nih.gov/pubmed/842555?tool=bestpractice.com
[90]Stein PD, Willis PW 3rd, DeMets DL. History and physical examination in acute pulmonary embolism in patients without preexisting cardiac or pulmonary disease. Am J Cardiol. 1981 Feb;47(2):218-23.
http://www.ncbi.nlm.nih.gov/pubmed/7468469?tool=bestpractice.com
A hemoptise e a síncope são menos comuns; a última sugere uma carga trombótica maior, uma disfunção ventricular direita mais significativa e um prognóstico mais desfavorável.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[88]Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011 Feb 8;57(6):700-6.
http://www.onlinejacc.org/content/57/6/700
http://www.ncbi.nlm.nih.gov/pubmed/21292129?tool=bestpractice.com
[89]Bajaj N, Bozarth AL, Guillot J, et al. Clinical features in patients with pulmonary embolism at a community hospital: analysis of 4 years of data. J Thromb Thrombolysis. 2014 Apr;37(3):287-92.
http://www.ncbi.nlm.nih.gov/pubmed/23681675?tool=bestpractice.com
Devem ser determinados fatores de risco para tromboembolismo venoso.
Sinais e exame físico
Os sinais da EP incluem taquicardia, taquipneia, esforço respiratório elevado, febre (geralmente baixa) e, nos casos mais graves, hipotensão e sinais de hipoperfusão (choque).
Geralmente, o exame físico é inespecífico.[88]Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011 Feb 8;57(6):700-6.
http://www.onlinejacc.org/content/57/6/700
http://www.ncbi.nlm.nih.gov/pubmed/21292129?tool=bestpractice.com
Nos casos graves, podem estar presentes achados de sobrecarga ventricular direita, como pulsação venosa jugular elevada, perda da palpabilidade do ápice ventricular esquerdo (devido ao deslocamento posterior do ventrículo esquerdo por aumento do ventrículo direito) e terceira bulha cardíaca do lado direito.
A EP que tenha evoluído por certo um período de tempo pode apresentar achados físicos de hipertensão pulmonar, como ictus do ventrículo direito, sopro holossistólico de regurgitação tricúspide, componente pulmonar alto da segunda bulha cardíaca, pressão venosa jugular elevada e edema depressível dos membros.[91]Courtney DM, Kline JA, Kabrhel C, et al. Clinical features from the history and physical examination that predict the presence or absence of pulmonary embolism in symptomatic emergency department patients: results of a prospective, multicenter study. Ann Emerg Med. 2010 Apr;55(4):307-15.e1.
https://www.doi.org/10.1016/j.annemergmed.2009.11.010
http://www.ncbi.nlm.nih.gov/pubmed/20045580?tool=bestpractice.com
[92]Bajaj R, Ramanakumar A, Mamidala S, et al. Successful treatment of mobile right atrial thrombus and acute pulmonary embolism with intravenous tissue plasminogen activator. BMJ Case Rep. 2013 Jul 25;2013:bcr2013010255.
http://www.ncbi.nlm.nih.gov/pubmed/23892824?tool=bestpractice.com
[93]Matthews JC, McLaughlin V. Acute right ventricular failure in the setting of acute pulmonary embolism or chronic pulmonary hypertension: a detailed review of the pathophysiology, diagnosis, and management. Curr Cardiol Rev. 2008 Feb;4(1):49-59.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2774585
http://www.ncbi.nlm.nih.gov/pubmed/19924277?tool=bestpractice.com
Como, na maior parte dos casos, a EP se origina de trombose venosa profunda (TVP) dos membros inferiores, podem estar presentes achados físicos dessa doença.
Pacientes com suspeita de EP em choque ou hipotensão
O choque (hipoperfusão do órgãos-alvo e uma pressão arterial sistólica <90 mmHg ou necessidade de vasopressor para manter a pressão arterial sistólica >90 mmHg) ou a hipotensão (pressão arterial sistólica <90 mmHg ou >40 mmHg abaixo da linha basal conhecida por pelo menos 15 minutos) ocorrem em uma minoria de casos, mas pressagiam um alto risco de mortalidade.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Mais de 95% dos pacientes que se apresentam com EP aguda estão hemodinamicamente estáveis.[94]Laporte S, Mismetti P, Décousus H, et al; RIETE Investigators. Clinical predictors for fatal pulmonary embolism in 15,520 patients with venous thromboembolism: findings from the Registro Informatizado de la Enfermedad TromboEmbolica venosa (RIETE) Registry. Circulation. 2008 Apr 1;117(13):1711-6.
http://circ.ahajournals.org/content/117/13/1711.long
http://www.ncbi.nlm.nih.gov/pubmed/18347212?tool=bestpractice.com
Idealmente, a EP deve ser confirmada por APTC antes da administração de terapia trombolítica.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
No entanto, um exame de ventilação/perfusão (V/Q) pulmonar negativo descarta efetivamente a EP e é um procedimento que permite poupar radiação e recursos.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Caso o paciente apresente risco iminente de parada cardíaca, o tratamento pode ser iniciado em termos clínicos apenas.[96]British Thoracic Society Standards of Care Committee Pulmonary Embolism Guideline Development Group. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax. 2003 Jun;58(6):470-83.
http://thorax.bmj.com/content/58/6/470.long
http://www.ncbi.nlm.nih.gov/pubmed/12775856?tool=bestpractice.com
Pacientes com suspeita de EP sem choque ou hipotensão
Quando o histórico e o exame físico não conseguem descartar a EP, a probabilidade pré-teste de EP deve ser determinada utilizando uma regra de predição validada e/ou o julgamento clínico.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
Uma regra de predição pode ser preferível, principalmente para os médicos que raramente avaliam pacientes em relação a EP, pois o julgamento clínico não é padronizado.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
[97]Lucassen W, Geersing GJ, Erkens PM, et al. Clinical decision rules for excluding pulmonary embolism: a meta-analysis. Ann Intern Med. 2011 Oct 4;155(7):448-60.
https://www.doi.org/10.7326/0003-4819-155-7-201110040-00007
http://www.ncbi.nlm.nih.gov/pubmed/21969343?tool=bestpractice.com
Como avaliar a probabilidade clínica de embolia pulmonar (EP)
Os pacientes com suspeita de EP podem ser classificados em diferentes categorias de probabilidade clínica (pré-teste) que correspondem à prevalência de EP confirmada, utilizando o critério de Wells original (modificado), o critério de Wells simplificado (modificado), o escore de Genebra original (revisado) ou o escore de Genebra simplificado (revisado).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[98]Wells PS, Anderson DR, Rodger M, et al. Derivation of a simple clinical model to categorize patients' probability of pulmonary embolism: increasing the model's utility with the SimpliRED D-dimer. Thromb Haemost. 2000 Mar;83(3):416-20.
http://www.ncbi.nlm.nih.gov/pubmed/10744147?tool=bestpractice.com
[99]Le Gal G, Righini M, Roy PM, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med. 2006 Feb 7;144(3):165-71.
http://www.ncbi.nlm.nih.gov/pubmed/16461960?tool=bestpractice.com
Cada uma dessas ferramentas de decisão clínica atribui um valor (um único ponto ou pontos) a uma série de recursos de exame físico e histórico. A soma desses valores determina a probabilidade de EP.
[
Escore de Wells para embolia pulmonar
Opens in new window
]
[
Escore de Genebra revisado para estimativa da probabilidade clínica de embolia pulmonar em adultos
Opens in new window
]
[Figure caption and citation for the preceding image starts]: Critério de Wells original e simplificado (modificado)Criado pelo BMJ Knowledge Centre [Citation ends].
[Figure caption and citation for the preceding image starts]: Escore de Genebra original e simplificado (revisado)Criado pelo BMJ Knowledge Centre [Citation ends].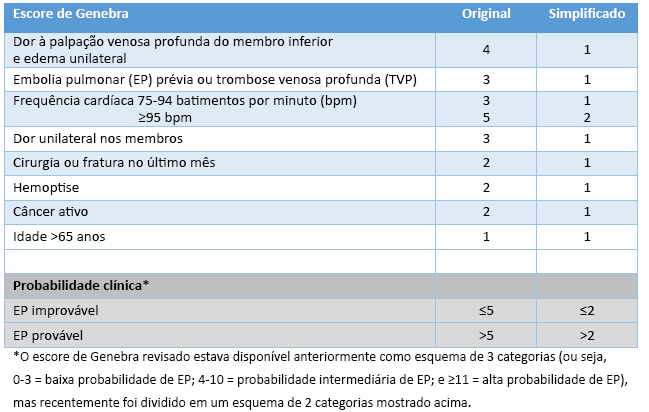
As versões simplificadas do critério de Wells modificado ou do escore de Genebra revisado podem ser preferíveis na prática clínica devido à sua facilidade de uso.[100]van Es N, Kraaijpoel N, Klok FA, et al. The original and simplified Wells rules and age-adjusted D-dimer testing to rule out pulmonary embolism: an individual patient data meta-analysis. J Thromb Haemost. 2017 Apr;15(4):678-84.
https://onlinelibrary.wiley.com/doi/full/10.1111/jth.13630
http://www.ncbi.nlm.nih.gov/pubmed/28106338?tool=bestpractice.com
Ambas as versões simplificadas já foram validadas; nenhuma se mostrou superior à outra.[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
[101]Hendriksen JM, Geersing GJ, Lucassen WA, et al. Diagnostic prediction models for suspected pulmonary embolism: systematic review and independent external validation in primary care. BMJ. 2015 Sep 8;351:h4438.
https://www.bmj.com/content/351/bmj.h4438.long
http://www.ncbi.nlm.nih.gov/pubmed/26349907?tool=bestpractice.com
No entanto, o escore de Genebra baseia-se totalmente em itens clínicos objetivos e pode ser mais reproduzível (o critério de Wells [original e simplificado] inclui o item clínico subjetivo "diagnóstico alternativo menos provável que EP").[102]Klok FA, Kruisman E, Spaan J, et al. Comparison of the revised Geneva score with the Wells rule for assessing clinical probability of pulmonary embolism. J Thromb Haemost. 2008 Jan;6(1):40-4.
https://onlinelibrary.wiley.com/doi/full/10.1111/j.1538-7836.2007.02820.x
http://www.ncbi.nlm.nih.gov/pubmed/17973649?tool=bestpractice.com
O critério de Wells e o escore de Genebra modificado classificam os pacientes de maneira dicotômica (EP improvável ou EP provável). No entanto, versões anteriores de cada ferramenta atribuíam probabilidades clínicas baixa, intermediária ou alta de EP. Caso a classificação de dois níveis seja usada, a EP é confirmada em 50% dos pacientes da categoria de EP provável, comparado a 12% dos pacientes da categoria de EP improvável. Caso a classificação de três níveis seja usada, a proporção de pacientes com EP confirmada será de cerca de 10% na categoria de probabilidade baixa, 30% na categoria de probabilidade intermediária e 65% na categoria de probabilidade alta.[103]Ceriani E, Combescure C, Le Gal G, et al. Clinical prediction rules for pulmonary embolism: a systematic review and meta-analysis. J Thromb Haemost. 2010 May;8(5):957-70.
https://www.doi.org/10.1111/j.1538-7836.2010.03801.x
http://www.ncbi.nlm.nih.gov/pubmed/20149072?tool=bestpractice.com
EP provável (alta probabilidade clínica)
A angiografia pulmonar por tomografia computadorizada (APTC) de múltiplos detectores deve ser solicitada para pacientes com EP provável (pré-teste).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
O exame de ventilação/perfusão (V/Q) descarta a EP de maneira efetiva, e é um procedimento que permite poupar radiação e recursos.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
A testagem do dímero D não deve ser realizada: um nível plasmático de dímero D normal não torna óbvia a necessidade para exame de imagem nesta população de pacientes.[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
EP improvável (probabilidade clínica intermediária ou baixa)
As diretrizes do American College of Physicians recomendam a aplicação dos CDEP para descartar a EP nos pacientes inicialmente avaliados como tendo uma probabilidade pré-teste muito baixa de EP.[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
Em pacientes que atendem a todos os critérios de CDEP (idade <50 anos; frequência cardíaca inicial <100 bpm; saturação de oxigênio inicial >94% em ar ambiente; ausência de edema unilateral dos membros inferiores; ausência de hemoptise; ausência de cirurgia ou trauma nas 4 semanas anteriores; ausência de histórico de tromboembolismo venoso; sem uso de estrogênio), o risco de EP é considerado inferior ao risco do teste; portanto, nenhum teste adicional é indicado. Os pacientes que não atendam a todos os critérios de CDEP podem ser classificados utilizando-se o teste do dímero D.[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
Uma metanálise de estudos que avaliou a precisão dos CDEP para descartar a EP indicou uma sensibilidade de 97%.[104]Singh B, Mommer SK, Erwin PJ, et al. Pulmonary embolism rule-out criteria (PERC) in pulmonary embolism - revisited: a systematic review and meta-analysis. Emerg Med J. 2013 Sep;30(9):701-6.
http://emj.bmj.com/content/30/9/701.long
http://www.ncbi.nlm.nih.gov/pubmed/23038695?tool=bestpractice.com
Teste de dímero D
O teste do dímero D é altamente sensível (>95%), mas inespecífico.
Um nível normal de dímero D no plasma abaixo do limite descarta a EP com segurança nos pacientes com EP improvável (intermediária ou baixa) no pré-teste, e não é necessário realizar nenhum outro teste.[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
O risco de EP dentro de 3 meses é <1% nesses pacientes.[105]Carrier M, Righini M, Djurabi RK, et al. VIDAS D-dimer in combination with clinical pre-test probability to rule out pulmonary embolism: a systematic review of management outcome studies. Thromb Haemost. 2009 May;101(5):886-92.
http://www.ncbi.nlm.nih.gov/pubmed/19404542?tool=bestpractice.com
[106]Agnelli G, Becattini C. Acute pulmonary embolism. N Engl J Med. 2010 Jul 15;363(3):266-74.
http://www.ncbi.nlm.nih.gov/pubmed/20592294?tool=bestpractice.com
O dímero D pode ser ajustado para a idade (o normal é <idade x 10 microgramas/L nos pacientes com ≥50 anos) ou probabilidade pré-teste de doença (corte de 1000 nanogramas/mL em pacientes de baixa probabilidade, ou 500 nanogramas/mL em pacientes de probabilidade intermediária) para aumentar a especificidade e, portanto, a porcentagem de pacientes em que se pode evitar um estudo de imagem.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[107]Kearon C, de Wit K, Parpia S, et al. Diagnosis of pulmonary embolism with d-Dimer adjusted to clinical probability. N Engl J Med. 2019 Nov 28;381(22):2125-34.
https://www.doi.org/10.1056/NEJMoa1909159
http://www.ncbi.nlm.nih.gov/pubmed/31774957?tool=bestpractice.com
[108]Righini M, Van Es J, Den Exter PL, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study. JAMA. 2014 Mar 19;311(11):1117-24.
https://www.doi.org/10.1001/jama.2014.2135
http://www.ncbi.nlm.nih.gov/pubmed/24643601?tool=bestpractice.com
Em pacientes com câncer, o uso de um corte de dímero D adequado à idade dobrou a proporção de pacientes nos quais a EP pôde ser excluída pela regra de decisão clínica e dímero D, sem exames de imagem.[109]Wilts IT, Le Gal G, Den Exter PL, et al. Performance of the age-adjusted cut-off for D-dimer in patients with cancer and suspected pulmonary embolism. Thromb Res. 2017 Apr;152:49-51.
http://www.ncbi.nlm.nih.gov/pubmed/28226257?tool=bestpractice.com
O algoritmo YEARS com limites de dímero D adaptados ao risco foi estudado em pacientes gestantes com suspeita de EP.[110]van der Pol LM, Tromeur C, Bistervels IM, et al. Pregnancy-adapted YEARS algorithm for diagnosis of suspected pulmonary embolism. N Engl J Med. 2019 Mar 21;380(12):1139-49.
https://www.doi.org/10.1056/NEJMoa1813865
http://www.ncbi.nlm.nih.gov/pubmed/30893534?tool=bestpractice.com
Os pacientes com nível anormal de dímero D devem ser submetidos a uma angiografia pulmonar por tomografia computadorizada (APTC) de múltiplos detectores (ou a uma relação V/Q pulmonar caso a APTC seja contraindicada) para confirmar ou descartar o diagnóstico de EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[87]Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015 Nov 3;163(9):701-11.
https://www.acpjournals.org/doi/10.7326/M14-1772
http://www.ncbi.nlm.nih.gov/pubmed/26414967?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Exames de imagem iniciais
A APTC confirma o diagnóstico pela visualização direta do trombo em uma artéria pulmonar; aparece como uma falha parcial ou completa do enchimento intraluminal. A razão de probabilidade para se confirmar uma EP com uma falha de enchimento nos ramos segmentar ou subsegmentar é de 24.1 (faixa de 12.4 a 46.7), enquanto a probabilidade para descartá-la é de 0.11 (faixa de 0.06 a 0.19), o que significa que a APTC tem a melhor precisão diagnóstica de todos os métodos de exames de imagem avançados não invasivos.[111]Perrier A, Roy PM, Sanchez O, et al. Multidetector-row computed tomography in suspected pulmonary embolism. N Engl J Med. 2005 Apr 28;352(17):1760-8.
https://www.nejm.org/doi/10.1056/NEJMoa042905
http://www.ncbi.nlm.nih.gov/pubmed/15858185?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Angiografia pulmonar por tomografia computadorizada (APTC) com contraste exibindo êmbolos arteriais pulmonares direitos subsegmentares (veja as setas)Do acervo de Seth W. Clemens; usado com permissão [Citation ends].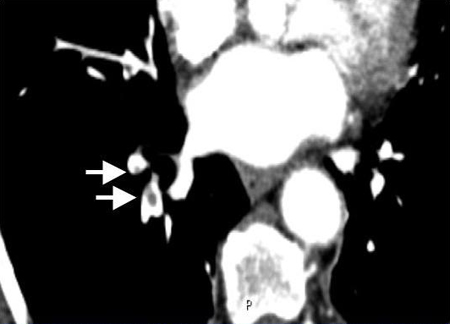
A relação V/Q pulmonar, de preferência utilizando uma tomografia computadorizada por emissão de fóton único (SPECT, que pode reduzir o número de exames não conclusivos) é uma alternativa à APTC.[112]Phillips JJ, Straiton J, Staff RT. Planar and SPECT ventilation/perfusion imaging and computed tomography for the diagnosis of pulmonary embolism: a systematic review and meta-analysis of the literature, and cost and dose comparison. Eur J Radiol. 2015 Jul;84(7):1392-400.
http://www.ncbi.nlm.nih.gov/pubmed/25868674?tool=bestpractice.com
Uma cintilografia V/Q negativa descarta a EP de maneira efetiva. A cintilografia V/Q é um procedimento que permite poupar radiação e recursos e pode ser adequado aos pacientes com contraindicação total ou relativa à TC (por exemplo, alergia ao contraste, insuficiência renal de moderada a grave, gravidez, pacientes jovens).[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
EP subsegmentar
A APTC parece aumentar a proporção de pacientes diagnosticados com EP subsegmentar sem diminuir o risco de tromboembolismo em 3 meses, levando a um potencial excesso de diagnósticos (pois a EP subsegmentar pode não justificar o tratamento com anticoagulantes em pacientes selecionados).[113]Carrier M, Righini M, Wells PS, et al. Subsegmental pulmonary embolism diagnosed by computed tomography: incidence and clinical implications. A systematic review and meta-analysis of the management outcome studies. J Thromb Haemost. 2010 Aug;8(8):1716-22.
https://onlinelibrary.wiley.com/doi/full/10.1111/j.1538-7836.2010.03938.x
http://www.ncbi.nlm.nih.gov/pubmed/20546118?tool=bestpractice.com
O risco de diagnósticos em excesso pode ser mitigado pela adesão a algoritmos diagnósticos que limitem o uso de exames de imagem nos pacientes com menor probabilidade da doença.[114]Adams DM, Stevens SM, Woller SC, et al. Adherence to PIOPED II investigators' recommendations for computed tomography pulmonary angiography. Am J Med. 2013 Jan;126(1):36-42.
https://www.doi.org/10.1016/j.amjmed.2012.05.028
http://www.ncbi.nlm.nih.gov/pubmed/23177546?tool=bestpractice.com
Outros exames de imagem
Uma radiografia torácica normal não descarta o EP como diagnóstico.[115]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
No entanto, a radiografia torácica pode descartar outras causas dos sintomas do paciente, como pneumotórax ou pneumonia.[115]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
A angiografia por ressonância magnética pode ser usada para avaliar as artérias centrais e segmentares.[115]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
Três diferentes técnicas estão disponíveis: angiografia melhorada por contraste de gadolínio (ARM-Gd), angiografia em tempo real (ARM-TR) e imagens da perfusão por RM.[116]Clemens S. Newer modalities for detection of pulmonary emboli. Am J Med. 2007 Oct;120(10 suppl 2):S2-12.
http://www.ncbi.nlm.nih.gov/pubmed/17916456?tool=bestpractice.com
Geralmente, a ecocardiografia transtorácica não é indicada para o diagnóstico de EP aguda, mas é útil para identificar a distensão ventricular direita e auxiliar na classificação da gravidade e na determinação do prognóstico.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[115]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
A evidência ecocardiográfica de trombos cardíacos do lado direito está significativamente associada a aumento da mortalidade a 30 dias nos pacientes diagnosticados com EP aguda.[117]Barrios D, Rosa-Salazar V, Morillo R, et al. Prognostic Significance of Right Heart Thrombi in Patients With Acute Symptomatic Pulmonary Embolism: Systematic Review and Meta-analysis. Chest. 2017 Feb;151(2):409-416.
https://www.doi.org/10.1016/j.chest.2016.09.038
http://www.ncbi.nlm.nih.gov/pubmed/27746202?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Angiografia melhorada por contraste de gadolínio (ARM-Gd) mostrando uma embolia pulmonar na artéria pulmonar principal direita (veja a seta)Do acervo de Seth W. Clemens; usado com permissão [Citation ends].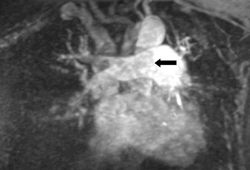
Apesar da precisão no diagnóstico, a angiografia pulmonar raramente é utilizada para diagnosticar ou descartar a EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[118]Kearon C. Diagnosis of suspected venous thromboembolism. Hematology Am Soc Hematol Educ Program. 2016 Dec 2;2016(1):397-403.
http://asheducationbook.hematologylibrary.org/content/2016/1/397.long
http://www.ncbi.nlm.nih.gov/pubmed/27913507?tool=bestpractice.com
Ela está associada ao risco de morbidade/mortalidade, e a APTC (menos invasiva) oferece uma precisão diagnóstica comparável.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[119]Stein PD, Athanasoulis C, Alavi A, et al. Complications and validity of pulmonary angiography in acute pulmonary embolism. Circulation. 1992 Feb;85(2):462-8.
http://www.ncbi.nlm.nih.gov/pubmed/1735144?tool=bestpractice.com
Investigações laboratoriais
Os exames laboratoriais iniciais, incluindo tempo de protrombina (TP), tempo de tromboplastina parcial ativada (TTPa) e razão normalizada internacional (INR), são importantes para auxiliar nas decisões sobre a segurança e o tipo da anticoagulação inicial selecionada. Os painéis de função hepática e renal também ajudam a determinar a escolha adequada da terapia anticoagulante, pois agentes diferentes requerem precauções ou são contraindicados nos casos de disfunção hepática ou renal.[120]Ansell JE. Management of venous thromboembolism: clinical guidance from the Anticoagulation Forum. J Thromb Thrombolysis. 2016 Jan;41(1):1-2.
https://www.doi.org/10.1007/s11239-015-1320-5
http://www.ncbi.nlm.nih.gov/pubmed/26780735?tool=bestpractice.com
O hemograma completo pode detectar anormalidades hematológicas.
A troponina pode ser usada para auxiliar na determinação da categoria de gravidade da EP aguda, que afeta as decisões de manejo. É sugerida em pacientes que apresentam uma categoria elevada no Índice de Gravidade de Embolia Pulmonar (PESI) ou anormalidades do ventrículo direito nas imagens.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Rastreamento da trombofilia
Normalmente, a trombofilia refere-se a cinco condições hereditárias (fator V de Leiden, gene da protrombina 20210A, deficiências de antitrombina, deficiência de proteína C e deficiência de proteína S) e à síndrome antifosfolipídica (uma doença adquirida). No entanto, muitas variantes genéticas e doenças adquiridas alteram o risco de trombose.[121]Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016 Jan;41(1):154-64.
https://link.springer.com/article/10.1007/s11239-015-1316-1
http://www.ncbi.nlm.nih.gov/pubmed/26780744?tool=bestpractice.com
As indicações para rastreamento são controversas. As indicações para rastreamento são controversas.[121]Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016 Jan;41(1):154-64.
https://link.springer.com/article/10.1007/s11239-015-1316-1
http://www.ncbi.nlm.nih.gov/pubmed/26780744?tool=bestpractice.com
[122]Connors JM. Thrombophilia testing and venous thrombosis. N Engl J Med. 2017 Sep 21;377(12):1177-87.
https://www.doi.org/10.1056/NEJMra1700365
http://www.ncbi.nlm.nih.gov/pubmed/28930509?tool=bestpractice.com
A trombofilia hereditária não altera de maneira suficiente o risco predito de trombose recorrente para afetar as decisões de tratamento, e uma abordagem conservadora à testagem é razoável.[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Algumas diretrizes sugerem a testagem apenas nas situações em que o resultado provavelmente alterará uma decisão clínica (como nos pacientes com TVP sem fatores precipitantes ou EP que estejam considerando interromper os anticoagulantes).[22]National Institute for Health and Care Excellence. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. Aug 2023 [internet publication].
https://www.nice.org.uk/guidance/ng158
Caso o rastreamento para trombofilia hereditária seja considerado, ele deve ser adiado até, pelo menos, 3 meses de terapia anticoagulante, pois alguns exames de trombofilia são influenciados pela presença de trombose aguda ou de terapia anticoagulante.[121]Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016 Jan;41(1):154-64.
https://link.springer.com/article/10.1007/s11239-015-1316-1
http://www.ncbi.nlm.nih.gov/pubmed/26780744?tool=bestpractice.com
A presença de uma trombofilia hereditária não aumenta de maneira significativa o risco previsto de tromboembolismo venoso recorrente após uma TVP com fatores precipitantes, e as diretrizes desestimulam a testagem neste cenário.[123]Hicks LK, Bering H, Carson KR, et al. The ASH Choosing Wisely®campaign: five hematologic tests and treatments to question. Hematology Am Soc Hematol Educ Program. 2013;2013:9-14.
https://www.doi.org/10.1182/asheducation-2013.1.9
http://www.ncbi.nlm.nih.gov/pubmed/24319155?tool=bestpractice.com
Síndrome antifosfolipídica
Os anticorpos antifosfolipídeos podem predizer um risco mais alto de trombose futura após um evento de tromboembolismo venoso inicial e podem afetar a escolha da terapia.[59]Garcia D, Erkan D. Diagnosis and management of the antiphospholipid syndrome. N Engl J Med. 2018 May 24;378(21):2010-21.
http://www.ncbi.nlm.nih.gov/pubmed/29791828?tool=bestpractice.com
Há controvérsias sobre a preferência entre um rastreamento amplo para anticorpos antifosfolipídeos ou um rastreamento apenas com base na suspeita clínica.[124]Fazili M, Stevens SM, Woller SC. Direct oral anticoagulants in antiphospholipid syndrome with venous thromboembolism: impact of the European Medicines Agency guidance. Res Pract Thromb Haemost. 2020 Jan;4(1):9-12.
https://www.doi.org/10.1002/rth2.12287
http://www.ncbi.nlm.nih.gov/pubmed/31989078?tool=bestpractice.com
[125]European Medicines Agency Pharmacovigilance Risk Assessment Committee (PRAC). PRAC recommendations on signals. Jun 2019 [internet publication].
https://www.ema.europa.eu/en/documents/prac-recommendation/prac-recommendations-signals-adopted-13-16-may-2019-prac-meeting_en.pdf
Algumas diretrizes sugerem o teste apenas em situações em que o resultado provavelmente alterará uma decisão clínica (como em pacientes com TVP ou EP sem fatores precipitantes que estejam considerando interromper os anticoagulantes; no entanto, essas diretrizes recomendam procurar aconselhamento especializado, pois esses testes podem ser afetados pelos anticoagulantes).[22]National Institute for Health and Care Excellence. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. Aug 2023 [internet publication].
https://www.nice.org.uk/guidance/ng158
Para o rastreamento de anticorpos antifosfolipídeos, os anticorpos anticardiolipina e antibeta 2-glicoproteína I podem ser realizados independentemente da presença de anticoagulantes; entretanto, a maioria dos anticoagulantes interfere nos ensaios de anticoagulante lúpico.[59]Garcia D, Erkan D. Diagnosis and management of the antiphospholipid syndrome. N Engl J Med. 2018 May 24;378(21):2010-21.
http://www.ncbi.nlm.nih.gov/pubmed/29791828?tool=bestpractice.com
A análise da gasometria arterial tem utilidade limitada
A hipoxemia é considerada um achado típico na EP aguda, mas a análise da gasometria arterial tem uma capacidade de diagnóstico muito limitada, isolada ou combinada com outras variáveis clínicas, quando há suspeita de EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[126]Rodger MA, Carrier M, Jones GN, et al. Diagnostic value of arterial blood gas measurement in suspected pulmonary embolism. Am J Respir Crit Care Med. 2000 Dec;162(6):2105-8.
https://www.atsjournals.org/doi/full/10.1164/ajrccm.162.6.2004204
http://www.ncbi.nlm.nih.gov/pubmed/11112122?tool=bestpractice.com
Uma PaO₂ <80 mmHg, uma PaCO₂ <36 mmHg, ou um gradiente alveolar-arterial anormal (A–aO₂) não são preditivos de EP nos pacientes com suspeita de EP.[126]Rodger MA, Carrier M, Jones GN, et al. Diagnostic value of arterial blood gas measurement in suspected pulmonary embolism. Am J Respir Crit Care Med. 2000 Dec;162(6):2105-8.
https://www.atsjournals.org/doi/full/10.1164/ajrccm.162.6.2004204
http://www.ncbi.nlm.nih.gov/pubmed/11112122?tool=bestpractice.com
Em pacientes com suspeita de EP aguda com resultados normais para a gasometria arterial, a EP não pôde ser descartada em 38% dos pacientes sem doença cardiopulmonar e em 14% dos pacientes com doença cardiopulmonar preexistente, respectivamente.[127]Stein PD, Goldhaber SZ, Henry JW, et al. Arterial blood gas analysis in the assessment of suspected acute pulmonary embolism. Chest. 1996 Jan;109(1):78-81.
http://www.ncbi.nlm.nih.gov/pubmed/8549223?tool=bestpractice.com
Outras investigações
O eletrocardiograma (ECG) não pode estabelecer ou descartar efetivamente o diagnóstico de EP, e os achados específicos podem apenas sugerir a EP.[89]Bajaj N, Bozarth AL, Guillot J, et al. Clinical features in patients with pulmonary embolism at a community hospital: analysis of 4 years of data. J Thromb Thrombolysis. 2014 Apr;37(3):287-92.
http://www.ncbi.nlm.nih.gov/pubmed/23681675?tool=bestpractice.com
[128]Brown G, Hogg K. Best evidence topic report: diagnostic utility of electrocardiogram for diagnosing pulmonary embolism. Emerg Med J. 2005 Oct;22(10):729-30.
http://emj.bmj.com/content/22/10/729.2.long
http://www.ncbi.nlm.nih.gov/pubmed/16189038?tool=bestpractice.com
[129]Sukhija R, Aronow WS, Ahn C, et al. Electrocardiographic abnormalities in patients with right ventricular dilation due to acute pulmonary embolism. Cardiology. 2006;105(1):57-60.
http://www.ncbi.nlm.nih.gov/pubmed/16254425?tool=bestpractice.com
No entanto, o ECG pode ser usado para avaliar a função ventricular direita de pacientes com EP sem choque ou hipotensão.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[21]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
A disfunção ventricular direita é preditiva de desfechos adversos e permite a classificação do risco nesses pacientes.[130]Vanni S, Polidori G, Vergara R, et al. Prognostic value of ECG among patients with acute pulmonary embolism and normal blood pressure. Am J Med. 2009 Mar;122(3):257-64.
http://www.ncbi.nlm.nih.gov/pubmed/19272487?tool=bestpractice.com
[131]Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation. 2011 Apr 26;123(16):1788-830.
http://circ.ahajournals.org/content/123/16/1788.long
http://www.ncbi.nlm.nih.gov/pubmed/21422387?tool=bestpractice.com
[132]Weekes AJ, Thacker G, Troha D, et al. Diagnostic accuracy of right ventricular dysfunction markers in normotensive emergency department patients with acute pulmonary embolism. Ann Emerg Med. 2016 Sep;68(3):277-91.
http://www.ncbi.nlm.nih.gov/pubmed/26973178?tool=bestpractice.com
Caso uma modalidade de exame de imagem definitiva não esteja disponível, o ECG pode ser considerado para pacientes com suspeita de EP em choque ou com hipotensão.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Populações de pacientes especiais
Os sinais e sintomas de tromboembolismo venoso podem ser menos específicos em gestantes que em pacientes não gestantes.[95]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Os níveis de dímero D aumentam durante uma gestação normal, complicando seu uso como exame para descartar uma suspeita de EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
No entanto, um número cada vez maior de evidências dá suporte ao uso de algoritmos de probabilidade pré-teste adaptados a pacientes gestantes com o dímero D.[110]van der Pol LM, Tromeur C, Bistervels IM, et al. Pregnancy-adapted YEARS algorithm for diagnosis of suspected pulmonary embolism. N Engl J Med. 2019 Mar 21;380(12):1139-49.
https://www.doi.org/10.1056/NEJMoa1813865
http://www.ncbi.nlm.nih.gov/pubmed/30893534?tool=bestpractice.com
[133]Righini M, Robert-Ebadi H, Elias A, et al. Diagnosis of pulmonary embolism during pregnancy: a multicenter prospective management outcome study. Ann Intern Med. 2018 Oct 23;169(11):766-73.
https://www.doi.org/10.7326/M18-1670
http://www.ncbi.nlm.nih.gov/pubmed/30357273?tool=bestpractice.com
As diretrizes respaldam o uso de algoritmos multietapas em vez de exames de imagem nas pacientes gestantes com suspeita de EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
Quando um algoritmo indica que o exame de imagem é indicado a uma paciente gestante com suspeita de EP, a exposição à radiação associada à imagem deve ser minimizada. Recomenda-se realizar uma ultrassonografia de compressão venosa bilateral para determinar a presença de trombose indicativa de EP nas gestantes com suspeita de EP.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
[134]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
A radiografia torácica é o primeiro procedimento de radiação que deve ser realizado nos casos de suspeita de EP.[134]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
Diante de uma radiografia torácica normal, as diretrizes de consenso da American Thoracic Society recomendam a cintilografia pulmonar (com cintilografia V/Q).[134]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
Gestantes com uma cintilografia V/Q não diagnóstica, que precisem de uma investigação mais profunda, podem ser submetidas à APTC.[134]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
As diretrizes da European Society of Cardiology sugerem a APTC nas pacientes com radiografia torácica anormal, e uma cintilografia V/Q ou APTC se a radiografia torácica estiver normal.[4]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://www.doi.org/10.1093/eurheartj/ehz405
http://www.ncbi.nlm.nih.gov/pubmed/31504429?tool=bestpractice.com
A dose administrada de radiofármacos deve ser reduzida pela metade quando os exames de pulmão forem indicados em gestantes; tempos de aquisição mais longos devem ser usados para se alcançar a imagem adequada.[112]Phillips JJ, Straiton J, Staff RT. Planar and SPECT ventilation/perfusion imaging and computed tomography for the diagnosis of pulmonary embolism: a systematic review and meta-analysis of the literature, and cost and dose comparison. Eur J Radiol. 2015 Jul;84(7):1392-400.
http://www.ncbi.nlm.nih.gov/pubmed/25868674?tool=bestpractice.com
Adolescentes e adultos jovens
A APTC deve ser usada com discrição, principalmente se a EP puder ser descartada por outros métodos não invasivos com menos exposição à radiação.[135]Arnold RW, Janitz E, Poulton TB, et al. Pulmonary CT angiography to evaluate for pulmonary embolism in children visiting adult-centered community hospitals. AJR Am J Roentgenol. 2011 Jun;196(6):W823-30.
https://www.ajronline.org/doi/full/10.2214/AJR.10.5951
http://www.ncbi.nlm.nih.gov/pubmed/21606276?tool=bestpractice.com




