A doença hepática gordurosa associada a disfunção metabólica (DHGDM) é um espectro de doenças, que varia desde o acúmulo de gordura hepática (esteatose) sem inflamação, até esteatose hepática, fibrose, cirrose e doença hepática em estágio terminal. Exames laboratoriais e de imagem auxiliam no diagnóstico. A biópsia hepática e a histologia são o padrão-ouro para o diagnóstico, mas são usadas com moderação devido à morbidade associada. Utilizam-se ferramentas de estratificação do risco para identificar os pacientes com maior probabilidade de se beneficiarem de uma biópsia hepática. Biomarcadores não invasivos no sangue ou em exames de imagem podem ser usados em cenários comunitários para estratificação do risco na avaliação diagnóstica de pacientes com DHGDM.[33]Wattacheril JJ, Abdelmalek MF, Lim JK, et al. AGA clinical practice update on the role of noninvasive biomarkers in the evaluation and management of nonalcoholic fatty liver disease: expert review. Gastroenterology. 2023 Oct;165(4):1080-8.
https://www.doi.org/10.1053/j.gastro.2023.06.013
http://www.ncbi.nlm.nih.gov/pubmed/37542503?tool=bestpractice.com
[34]Sterling RK, Duarte-Rojo A, Patel K, et al. AASLD practice guideline on imaging-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_imaging_based.807.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489518?tool=bestpractice.com
[35]Sterling RK, Patel K, Duarte-Rojo A, et al. AASLD practice guideline on blood-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_blood_based.810.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489523?tool=bestpractice.com
[36]Kaplan DE, Ripoll C, Thiele M, et al. AASLD practice guidance on risk stratification and management of portal hypertension and varices in cirrhosis. Hepatology. 2024 May 1;79(5):1180-211.
https://www.doi.org/10.1097/HEP.0000000000000647
http://www.ncbi.nlm.nih.gov/pubmed/37870298?tool=bestpractice.com
Uma combinação de técnicas baseadas em exames de imagem e de sangue pode ser usada para detectar a fibrose significativa e a fibrose avançada, particularmente naqueles submetidos a um estadiamento inicial da fibrose.[34]Sterling RK, Duarte-Rojo A, Patel K, et al. AASLD practice guideline on imaging-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_imaging_based.807.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489518?tool=bestpractice.com
Quadro clínico
Os pacientes podem relatar fadiga e mal-estar ou dor abdominal; no entanto, muitos são assintomáticos.[37]Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002 Apr 18;346(16):1221-31.
http://www.ncbi.nlm.nih.gov/pubmed/11961152?tool=bestpractice.com
[38]Sharma P, Arora A. Clinical presentation of alcoholic liver disease and non-alcoholic fatty liver disease: spectrum and diagnosis. Transl Gastroenterol Hepatol. 2020;5:19.
https://www.doi.org/10.21037/tgh.2019.10.02
http://www.ncbi.nlm.nih.gov/pubmed/32258523?tool=bestpractice.com
A apresentação mais comum é uma anormalidade leve nos testes da função hepática (TFHs) com elevação da fosfatase alcalina, aminotransferases ou bilirrubina durante uma investigação para hipertensão, diabetes ou obesidade. Estas também podem ser encontradas como parte de exames de sangue de rotina para avaliação anual de saúde ou para monitoramento de medicamentos, principalmente na terapia anti-hiperlipidemia. Os pacientes também podem apresentar DHG detectada incidentalmente na imagem abdominal.
Nos estágios mais iniciais, hepatomegalia leve pode ser a única anormalidade no exame.[39]Bacon BR, Faravash MJ, Janney CG, et al. Nonalcoholic steatohepatitis: an expanded clinical entity. Gastroenterology. 1994 Oct;107(4):1103-9.
http://www.ncbi.nlm.nih.gov/pubmed/7523217?tool=bestpractice.com
Nos estágios finais da doença, os pacientes podem apresentar sintomas e sinais característicos de doença hepática crônica (por exemplo, icterícia, esplenomegalia, ascite, encefalopatia hepática, edema e hematomas fáceis).
O diagnóstico de DHGDM requer a exclusão do uso de álcool como causa da doença hepática. Vários níveis de ingestão significativa de álcool têm sido sugeridos.[40]Liangpunsakul S, Chalasani N. What should we recommend to our patients with NAFLD regarding alcohol use? Am J Gastroenterol. 2012 Jul;107(7):976-8.
https://www.doi.org/10.1038/ajg.2012.20
http://www.ncbi.nlm.nih.gov/pubmed/22764020?tool=bestpractice.com
Uma dose padrão contém 14 g de álcool puro. A American Association for the Study of Liver Diseases define a ingestão leve de álcool como até 20 g/dia em mulheres e até 30 g/dia em homens, ingestão moderada como 21-39 g/dia em mulheres e 31-59 g/dia nos homens e ingestão excessiva de ≥40 g/dia nas mulheres e ≥60 g/dia nos homens.[3]Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, et al. AASLD practice guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023 May 1;77(5):1797-835.
https://journals.lww.com/hep/fulltext/2023/05000/aasld_practice_guidance_on_the_clinical_assessment.31.aspx
http://www.ncbi.nlm.nih.gov/pubmed/36727674?tool=bestpractice.com
As diretrizes da Ásia-Pacífico definem o consumo significativo de álcool como >140 g/semana em homens e >70 g/semana em mulheres.[8]Wong VW, Chan WK, Chitturi S, et al. Asia-Pacific working party on non-alcoholic fatty liver disease guidelines 2017 - part 1: definition, risk factors and assessment. J Gastroenterol Hepatol. 2018 Jan;33(1):70-85.
https://www.doi.org/10.1111/jgh.13857
http://www.ncbi.nlm.nih.gov/pubmed/28670712?tool=bestpractice.com
As diretrizes europeias definem o consumo significativo de álcool como ≥30 g/dia para homens e ≥20 g/dia para mulheres.[41]European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), European Association for the Study of Obesity (EASO). EASL-EASD-EASO clinical practice guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016 Jun;64(6):1388-402.
https://www.doi.org/10.1016/j.jhep.2015.11.004
http://www.ncbi.nlm.nih.gov/pubmed/27062661?tool=bestpractice.com
A ingestão de bebidas alcoólicas deve ser verificada por mais de um profissional da saúde e em ocasiões separadas para assegurar a consistência.
Um novo termo, "MetALD", foi cunhado pela AASLD para descrever aqueles com DHGDM que consomem quantidades maiores de bebidas alcoólicas por semana (140-350 g/semana para as mulheres e 210-420 g/semana para os homens) e têm DHG e fatores de risco cardiometabólicos.[1]Kanwal F, Neuschwander-Tetri BA, Loomba R, et al. Metabolic dysfunction-associated steatotic liver disease: update and impact of new nomenclature on the American Association for the Study of Liver Diseases practice guidance on nonalcoholic fatty liver disease. Hepatology. 2024 May 1;79(5):1212-9.
https://www.doi.org/10.1097/HEP.0000000000000670
http://www.ncbi.nlm.nih.gov/pubmed/38445559?tool=bestpractice.com
[2]American Association for the Study of Liver Diseases. New MASLD nomenclature. Jun 2023 [internet publication].
https://www.aasld.org/new-masld-nomenclature
Os medicamentos associados ao desenvolvimento de DHG incluem os estrogênios (tamoxifeno), corticosteroides, diltiazem, nifedipino, metotrexato, valproato, griseofulvina, tetraciclina intravenosa, amiodarona e terapia antirretroviral para HIV.
Exemplos de drogas associadas a um fenótipo histológico microvesicular puro são a aspirina, os anti-inflamatórios não esteroidais (AINEs), corticosteroides, o valproato, a tetraciclina, inibidores da transcriptase reversa nucleosídeos e a cocaína. As drogas associadas a um fenótipo histológico macrovesicular incluem os AINEs, corticosteroides, metotrexato, metoprolol, fluoruracila, cisplatina, irinotecano, tamoxifeno e hidrocarbonetos clorados. Um fenótipo histológico macrovesicular e microvesicular misto pode estar associado a medicamentos como a amiodarona, o valproato e o metotrexato. Medicamentos que incluem a amiodarona, o metotrexato, a fluoruracila, a cisplatina, o irinotecano e o tamoxifeno podem também estar associados a um fenótipo histológico esteato-hepático.[31]Fontana RJ, Liou I, Reuben A, et al. AASLD practice guidance on drug, herbal, and dietary supplement-induced liver injury. Hepatology. 2022 Jul 27 [Epub ahead of print].
https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32689
http://www.ncbi.nlm.nih.gov/pubmed/35899384?tool=bestpractice.com
O tratamento com metotrexato em longo prazo, em particular, está associado ao desenvolvimento de DHG e fibrose, principalmente na presença de outros fatores de risco conhecidos (obesidade, consumo de bebidas alcoólicas, doença hepática preexistente, diabetes, hiperlipidemia). Se for necessário tratamento com metotrexato em longo prazo, as recomendações incluem restringir o uso nos pacientes com suspeita de DHGDM aos que têm bioquímica hepática normal e não têm fibrose avançada, exames laboratoriais basais e durante o tratamento, realizando-se geralmente uma biópsia hepática se os resultados da elastografia transitória forem anormais ou se persistirem achados anormais na bioquímica hepática.[31]Fontana RJ, Liou I, Reuben A, et al. AASLD practice guidance on drug, herbal, and dietary supplement-induced liver injury. Hepatology. 2022 Jul 27 [Epub ahead of print].
https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32689
http://www.ncbi.nlm.nih.gov/pubmed/35899384?tool=bestpractice.com
Obesidade, resistência insulínica, diabetes, síndrome metabólica e dislipidemia estão todos associados à DHGDM.[7]Younossi ZM, Koenig AB, Abdelatif D, et al. Global epidemiology of nonalcoholic fatty liver disease-meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016 Jul;64(1):73-84.
https://www.doi.org/10.1002/hep.28431
http://www.ncbi.nlm.nih.gov/pubmed/26707365?tool=bestpractice.com
De forma notável, há uma alta prevalência de DHGDM magra nos países asiáticos, onde até 19% dos pacientes com DHGDM não são obesos.[3]Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, et al. AASLD practice guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023 May 1;77(5):1797-835.
https://journals.lww.com/hep/fulltext/2023/05000/aasld_practice_guidance_on_the_clinical_assessment.31.aspx
http://www.ncbi.nlm.nih.gov/pubmed/36727674?tool=bestpractice.com
A DHGDM magra deve ser diagnosticada nos indivíduos com DHGDM e índice de massa corporal <25 kg/m² (não asiáticos) ou índice de massa corporal <23 kg/m² (asiáticos).[42]Long MT, Noureddin M, Lim JK. AGA Clinical practice update: diagnosis and management of nonalcoholic fatty liver disease in lean individuals: expert review. Gastroenterology. 2022 Sep;163(3):764-74.e1
https://www.gastrojournal.org/article/S0016-5085(22)00628-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35842345?tool=bestpractice.com
Nesses pacientes, a resistência à insulina e a presença de adiposidade central podem servir como preditores mais fortes de doença.[43]Liu CJ. Prevalence and risk factors for non-alcoholic fatty liver disease in Asian people who are not obese. J Gastroenterol Hepatol. 2012 Oct;27(10):1555-60.
https://onlinelibrary.wiley.com/doi/10.1111/j.1440-1746.2012.07222.x
http://www.ncbi.nlm.nih.gov/pubmed/22741595?tool=bestpractice.com
Exames laboratoriais
As enzimas hepáticas devem ser solicitadas para todos os pacientes com suspeita de DHGDM.[8]Wong VW, Chan WK, Chitturi S, et al. Asia-Pacific working party on non-alcoholic fatty liver disease guidelines 2017 - part 1: definition, risk factors and assessment. J Gastroenterol Hepatol. 2018 Jan;33(1):70-85.
https://www.doi.org/10.1111/jgh.13857
http://www.ncbi.nlm.nih.gov/pubmed/28670712?tool=bestpractice.com
A elevação dos níveis de alanina aminotransferase (ALT) e aspartato aminotransferase (AST), entre 1 e 4 vezes o limite superior dos valores normais (LSN), ocorre em 50% a 90% dos pacientes com DHGDM.[44]Diehl AM, Goodman Z, Ishak KG. Alcohol-like liver disease in nonalcoholics: a clinical and histological comparison with alcohol-induced liver injury. Gastroenterology. 1988 Oct;95(4):1056-62.
http://www.ncbi.nlm.nih.gov/pubmed/3410220?tool=bestpractice.com
Os resultados raramente excedem 300 UI/L.[45]Kwo PY, Cohen SM, Lim JK. ACG clinical guideline: evaluation of abnormal liver chemistries. Am J Gastroenterol. 2017 Jan;112(1):18-35.
https://www.doi.org/10.1038/ajg.2016.517
http://www.ncbi.nlm.nih.gov/pubmed/27995906?tool=bestpractice.com
Os pacientes com qualquer tipo de DHGDM podem ter TFHs normais.[38]Sharma P, Arora A. Clinical presentation of alcoholic liver disease and non-alcoholic fatty liver disease: spectrum and diagnosis. Transl Gastroenterol Hepatol. 2020;5:19.
https://www.doi.org/10.21037/tgh.2019.10.02
http://www.ncbi.nlm.nih.gov/pubmed/32258523?tool=bestpractice.com
[46]Mofrad P, Contos MJ, Haque M, et al. Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values. Hepatology. 2003 Jun;37(6):1286-92.
https://www.doi.org/10.1053/jhep.2003.50229
http://www.ncbi.nlm.nih.gov/pubmed/12774006?tool=bestpractice.com
A proporção de AST:ALT na esteatose hepática associada à disfunção metabólica (EHDM) é tipicamente <1.[47]Angulo P, Lindor KD. Non-alcoholic fatty liver disease. J Gastroenterol Hepatol. 2002 Feb;(suppl 17):S186-90.
http://www.ncbi.nlm.nih.gov/pubmed/12000605?tool=bestpractice.com
Isto difere da hepatite alcoólica aguda, da qual a proporção geralmente é >2. A reversão da proporção nos pacientes com EHDM (proporção de AST:ALT >1) pode ser um indicador de fibrose hepática mais avançada.[37]Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002 Apr 18;346(16):1221-31.
http://www.ncbi.nlm.nih.gov/pubmed/11961152?tool=bestpractice.com
[48]Angulo P, Keach JC, Batts KP, et al. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology. 1999 Dec;30(6):1356-62.
http://www.ncbi.nlm.nih.gov/pubmed/10573511?tool=bestpractice.com
Elevações leves podem ser observadas na fosfatase alcalina e/ou gama-glutamiltransferase. A bilirrubina geralmente é normal, a menos que o paciente tenha doença hepática crônica descompensada.
O sangue também deve ser enviado para hemograma completo, eletrólitos (verificação de hiponatremia), função renal (creatinina e ureia), glicose, perfil lipídico e perfil de coagulação.
A insulina em jejum (microunidades/mL) e o cálculo do modelo de avaliação de homeostase (HOMA, glicose [mg/dL] × insulina/405) são utilizados para quantificar a resistência insulínica e a função das células beta.
Exames laboratoriais devem ser solicitados para descartar outras causas de doença hepática crônica. Eles incluem:[45]Kwo PY, Cohen SM, Lim JK. ACG clinical guideline: evaluation of abnormal liver chemistries. Am J Gastroenterol. 2017 Jan;112(1):18-35.
https://www.doi.org/10.1038/ajg.2016.517
http://www.ncbi.nlm.nih.gov/pubmed/27995906?tool=bestpractice.com
[49]Vuppalanchi R, Chalasani N. Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: selected practical issues in their evaluation and management. Hepatology. 2009 Jan;49(1):306-17.
https://www.doi.org/10.1002/hep.22603
http://www.ncbi.nlm.nih.gov/pubmed/19065650?tool=bestpractice.com
Anticorpo do vírus da hepatite C
Antígeno de superfície da hepatite B, anticorpo anti-superfície e anticorpo anti-núcleo
Perfil de ferro, incluindo ferro, capacidade total de ligação do ferro, porcentagem de saturação e ferritina
Marcadores autoimunes (incluindo fator antinuclear, anticorpo anti-músculo liso, anticorpo microssomal anti-fígado e rim, imunoglobulinas quantitativas)
Nível de alfa 1-antitripsina e fenótipo
Anticorpo mitocondrial anti-M2 para testar colangite biliar primária; e ceruloplasmina para rastreamento da doença de Wilson em faixas etárias adequadas (<40 anos)
Teste de mutação do gene HFE, se a ferritina estiver elevada, para rastrear hemocromatose hereditária.
Além disso, várias definições bioquímicas de lesão hepática clinicamente significativa induzida por medicamentos têm sido descritas e podem ajudar a descartar lesões hepáticas induzidas por medicamentos como causa da DHG:[31]Fontana RJ, Liou I, Reuben A, et al. AASLD practice guidance on drug, herbal, and dietary supplement-induced liver injury. Hepatology. 2022 Jul 27 [Epub ahead of print].
https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32689
http://www.ncbi.nlm.nih.gov/pubmed/35899384?tool=bestpractice.com
AST ou ALT sérica >5 × LSN, ou fosfatase alcalina (FAL) >2 × LSN (se a basal for anormal, use a linha basal pré-tratamento)
Bilirrubina sérica total >2.5 mg/dL com nível elevado de AST, ALT ou FAL
Razão normalizada internacional (INR) >1.5 com nível elevado de AST, ALT ou FAL.
Escore de risco de fibrose
Vários escores foram criados e validados para ajudar a determinar quais pacientes com DHGDM têm o maior risco de evolução para doença hepática em estágio terminal e para ajudar a orientar a tomada de decisão em relação à biópsia hepática. O Escore de Fibrose na DHGNA e o Escore de Fibrose 4 (FIB-4) são os escores não invasivos preferenciais para predizer a fibrose avançada.[50]Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a non-invasive system that indentifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45:846-854.
http://onlinelibrary.wiley.com/doi/10.1002/hep.21496/full
http://www.ncbi.nlm.nih.gov/pubmed/17393509?tool=bestpractice.com
[51]McPherson S, Armstrong MJ, Cobbold JF, et al. Quality standards for the management of non-alcoholic fatty liver disease (NAFLD): consensus recommendations from the British Association for the Study of the Liver and British Society of Gastroenterology NAFLD Special Interest Group. Lancet Gastroenterol Hepatol. 2022 Aug;7(8):755-69.
https://www.thelancet.com/journals/langas/article/PIIS2468-1253(22)00061-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35490698?tool=bestpractice.com
Nos pacientes adultos com DHGDM que necessitam de estadiamento de fibrose, a AASLD recomenda o uso de exames de sangue não invasivos em vez da não realização de exames para detectar fibrose avançada.[35]Sterling RK, Patel K, Duarte-Rojo A, et al. AASLD practice guideline on blood-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_blood_based.810.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489523?tool=bestpractice.com
A AASLD faz uma sugestão contrária ao uso de exames de sangue não invasivos para detectar a esteatose nos pacientes com DHGDM.[35]Sterling RK, Patel K, Duarte-Rojo A, et al. AASLD practice guideline on blood-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_blood_based.810.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489523?tool=bestpractice.com
O escore de fibrose da DHGNA utiliza a idade, a hiperglicemia, o índice de massa corporal (IMC), a contagem plaquetária, a albumina e a proporção AST:ALT para prever os pacientes com fibrose hepática avançada.[50]Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a non-invasive system that indentifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45:846-854.
http://onlinelibrary.wiley.com/doi/10.1002/hep.21496/full
http://www.ncbi.nlm.nih.gov/pubmed/17393509?tool=bestpractice.com
NAFLD Fibrosis Score
Opens in new window Ao se aplicar esse modelo, a biópsia hepática pode ser evitada em uma proporção substancial de pacientes. O índice FIB-4 utiliza a contagem plaquetária, a idade, a AST e a ALT.[52]Shah AG, Lydecker A, Murray K, et al. Comparison of noninvasive markers of fibrosis in patients with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2009 Oct;7(10):1104-12.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3079239
http://www.ncbi.nlm.nih.gov/pubmed/19523535?tool=bestpractice.com
Fibrosis 4 Score (FIB-4)
Opens in new window É improvável que os pacientes com DHGDM e um escore FIB-4 <1.3 tenham fibrose avançada.[33]Wattacheril JJ, Abdelmalek MF, Lim JK, et al. AGA clinical practice update on the role of noninvasive biomarkers in the evaluation and management of nonalcoholic fatty liver disease: expert review. Gastroenterology. 2023 Oct;165(4):1080-8.
https://www.doi.org/10.1053/j.gastro.2023.06.013
http://www.ncbi.nlm.nih.gov/pubmed/37542503?tool=bestpractice.com
A British Association for the Study of the Liver e o British Society of Gastroenterology NAFLD Special Interest Group recomendam que os pacientes com baixo risco de fibrose significativa sejam reavaliados a cada 3 anos com o uso de exames não invasivos.[51]McPherson S, Armstrong MJ, Cobbold JF, et al. Quality standards for the management of non-alcoholic fatty liver disease (NAFLD): consensus recommendations from the British Association for the Study of the Liver and British Society of Gastroenterology NAFLD Special Interest Group. Lancet Gastroenterol Hepatol. 2022 Aug;7(8):755-69.
https://www.thelancet.com/journals/langas/article/PIIS2468-1253(22)00061-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35490698?tool=bestpractice.com
Nos pacientes com DHGDM e um escore FIB-4 >1.3, uma combinação de dois ou mais exames não invasivos (de sangue e/ou de imagem) é preferencial para o estadiamento e a estratificação do risco.[33]Wattacheril JJ, Abdelmalek MF, Lim JK, et al. AGA clinical practice update on the role of noninvasive biomarkers in the evaluation and management of nonalcoholic fatty liver disease: expert review. Gastroenterology. 2023 Oct;165(4):1080-8.
https://www.doi.org/10.1053/j.gastro.2023.06.013
http://www.ncbi.nlm.nih.gov/pubmed/37542503?tool=bestpractice.com
O escore Enhanced Liver Fibrosis (ELF) usa um painel de três biomarcadores: inibidor tecidual de metaloproteinases 1 (TIMP-1), propeptídeo amino-terminal do procolágeno tipo III (PIIINP) e ácido hialurônico. O escore se correlaciona bem com os estágios de fibrose na doença hepática crônica.[53]Lichtinghagen R, Pietsch D, Bantel H, et al. The Enhanced Liver Fibrosis (ELF) score: normal values, influence factors and proposed cut-off values. J Hepatol. 2013 Aug;59(2):236-42.
https://www.doi.org/10.1016/j.jhep.2013.03.016
http://www.ncbi.nlm.nih.gov/pubmed/23523583?tool=bestpractice.com
Exames por imagem
A American Association for the Study of Liver Diseases (AASLD) recomenda o uso de exames de imagem não invasivos para detectar a fibrose significativa, a fibrose avançada e a cirrose nos adultos com DHGDM.[34]Sterling RK, Duarte-Rojo A, Patel K, et al. AASLD practice guideline on imaging-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_imaging_based.807.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489518?tool=bestpractice.com
Os exames de imagem podem ser incorporados preferencialmente no processo inicial de estadiamento da fibrose devido à sua maior acurácia em relação às técnicas baseadas no sangue e são recomendados para identificação da fibrose avançada e da cirrose nos adultos com DHGDM.[34]Sterling RK, Duarte-Rojo A, Patel K, et al. AASLD practice guideline on imaging-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_imaging_based.807.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489518?tool=bestpractice.com
Tanto a elastografia transitória por ultrassonografia quanto a elastografia por ressonância magnética são recomendadas pela AASLD para estadiar a fibrose nos adultos com doença hepática crônica.[34]Sterling RK, Duarte-Rojo A, Patel K, et al. AASLD practice guideline on imaging-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_imaging_based.807.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489518?tool=bestpractice.com
A AASLD desaconselha o uso de exames de imagem como um exame independente para avaliar a regressão ou progressão da fibrose hepática.[34]Sterling RK, Duarte-Rojo A, Patel K, et al. AASLD practice guideline on imaging-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_imaging_based.807.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489518?tool=bestpractice.com
Estudos de imagem podem determinar a presença e a quantidade de infiltração gordurosa. A ultrassonografia é uma modalidade de imagem inicial razoável.[8]Wong VW, Chan WK, Chitturi S, et al. Asia-Pacific working party on non-alcoholic fatty liver disease guidelines 2017 - part 1: definition, risk factors and assessment. J Gastroenterol Hepatol. 2018 Jan;33(1):70-85.
https://www.doi.org/10.1111/jgh.13857
http://www.ncbi.nlm.nih.gov/pubmed/28670712?tool=bestpractice.com
[41]European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), European Association for the Study of Obesity (EASO). EASL-EASD-EASO clinical practice guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016 Jun;64(6):1388-402.
https://www.doi.org/10.1016/j.jhep.2015.11.004
http://www.ncbi.nlm.nih.gov/pubmed/27062661?tool=bestpractice.com
[54]European Association for the Study of the Liver. EASL clinical practice guidelines on non-invasive tests for evaluation of liver disease severity and prognosis - 2021 update. J Hepatol. 2021 Sep;75(3):659-89.
https://www.doi.org/10.1016/j.jhep.2021.05.025
http://www.ncbi.nlm.nih.gov/pubmed/34166721?tool=bestpractice.com
Ela tem uma sensibilidade de 84.8% e uma especificidade de 93.6% para detectar o fígado gorduroso moderado a grave, em comparação com a histologia. O parâmetro de atenuação controlada, uma técnica baseada em ultrassonografia, fornece uma avaliação semiquantitativa da DHG no local de atendimento.[3]Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, et al. AASLD practice guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023 May 1;77(5):1797-835.
https://journals.lww.com/hep/fulltext/2023/05000/aasld_practice_guidance_on_the_clinical_assessment.31.aspx
http://www.ncbi.nlm.nih.gov/pubmed/36727674?tool=bestpractice.com
O parâmetro de atenuação controlada medido pela elastografia transitória (TE-CAP) tem uma boa acurácia diagnóstica para classificar a esteatose, e pode ser usado na prática clínica.[34]Sterling RK, Duarte-Rojo A, Patel K, et al. AASLD practice guideline on imaging-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_imaging_based.807.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489518?tool=bestpractice.com
Uma ressonância nuclear magnética (RNM) do fígado pode ser solicitada se houver suspeita de DHG mas não for detectada pela ultrassonografia.[8]Wong VW, Chan WK, Chitturi S, et al. Asia-Pacific working party on non-alcoholic fatty liver disease guidelines 2017 - part 1: definition, risk factors and assessment. J Gastroenterol Hepatol. 2018 Jan;33(1):70-85.
https://www.doi.org/10.1111/jgh.13857
http://www.ncbi.nlm.nih.gov/pubmed/28670712?tool=bestpractice.com
A RNM para avaliação de gordura por densidade de proteína (MRI-PDFF) se correlaciona bem com a DHG comprovada por biópsia e é mais precisa do que a ultrassonografia para identificar a DHG.[55]Idilman IS, Aniktar H, Idilman R, et al. Hepatic steatosis: quantification by proton density fat fraction with MR imaging versus liver biopsy. Radiology. 2013 Jun;267(3):767-75.
https://www.doi.org/10.1148/radiol.13121360
http://www.ncbi.nlm.nih.gov/pubmed/23382293?tool=bestpractice.com
[56]Park CC, Nguyen P, Hernandez C, et al. Magnetic resonance elastography vs transient elastography in detection of fibrosis and noninvasive measurement of steatosis in patients with biopsy-proven nonalcoholic fatty liver disease. Gastroenterology. 2017 Feb;152(3):598-607.e2.
http://www.ncbi.nlm.nih.gov/pubmed/27911262?tool=bestpractice.com
A MRI-PDFF pode quantificar a esteatose.[3]Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, et al. AASLD practice guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023 May 1;77(5):1797-835.
https://journals.lww.com/hep/fulltext/2023/05000/aasld_practice_guidance_on_the_clinical_assessment.31.aspx
http://www.ncbi.nlm.nih.gov/pubmed/36727674?tool=bestpractice.com
No entanto, a disponibilidade é limitada.
Os exames de imagem não invasivos, como a TE-CAP e a MRI-PDFF ou a espectroscopia por ressonância magnética, são superiores aos exames de sangue não invasivos e devem ser usados na avaliação da esteatose hepática em adultos com DHGDM, quando disponíveis.[34]Sterling RK, Duarte-Rojo A, Patel K, et al. AASLD practice guideline on imaging-based non-invasive liver disease assessments of hepatic fibrosis and steatosis. Hepatology. 15 Mar 2024 [Epub ahead of print].
https://journals.lww.com/hep/citation/9900/aasld_practice_guideline_on_imaging_based.807.aspx
http://www.ncbi.nlm.nih.gov/pubmed/38489518?tool=bestpractice.com
Para a identificação de fibrose avançada ou cirrose, o principal biomarcador é a rigidez hepática. A elastografia ultrassônica das ondas de cisalhamento é uma técnica não invasiva para avaliar a rigidez do fígado. A rigidez do tecido é deduzida a partir da análise de ondas de cisalhamento que são geradas por pulsos de ultrassom de alta intensidade.[57]American College of Radiology. ACR appropriateness criteria: chronic liver disease. 2019 [internet publication].
https://www.acr.org/Clinical-Resources/ACR-Appropriateness-Criteria
A elastografia por ressonância magnética é uma técnica alternativa para avaliar a rigidez hepática. É mais precisa do que a elastografia ultrassônica das ondas de cisalhamento para identificar fibrose e cirrose e tem melhor desempenho em pessoas com obesidade.[54]European Association for the Study of the Liver. EASL clinical practice guidelines on non-invasive tests for evaluation of liver disease severity and prognosis - 2021 update. J Hepatol. 2021 Sep;75(3):659-89.
https://www.doi.org/10.1016/j.jhep.2021.05.025
http://www.ncbi.nlm.nih.gov/pubmed/34166721?tool=bestpractice.com
[56]Park CC, Nguyen P, Hernandez C, et al. Magnetic resonance elastography vs transient elastography in detection of fibrosis and noninvasive measurement of steatosis in patients with biopsy-proven nonalcoholic fatty liver disease. Gastroenterology. 2017 Feb;152(3):598-607.e2.
http://www.ncbi.nlm.nih.gov/pubmed/27911262?tool=bestpractice.com
[57]American College of Radiology. ACR appropriateness criteria: chronic liver disease. 2019 [internet publication].
https://www.acr.org/Clinical-Resources/ACR-Appropriateness-Criteria
Biópsia hepática
Atualmente, a biópsia hepática é a melhor ferramenta diagnóstica para confirmar a DHGDM. Ela também é o meio mais específico e sensível para fornecer informações prognósticas importantes.[Figure caption and citation for the preceding image starts]: Biópsia em cunha do fígado de uma doadora de órgãos de 52 anos; biópsia mostrando esteatose mista micro e macrovesicular de grau moderado; não há inflamação lobular significativa ou necrose (hematoxilina e eosina, coloração H&E, x 200)Do acervo de Kapil B. Chopra, MD [Citation ends].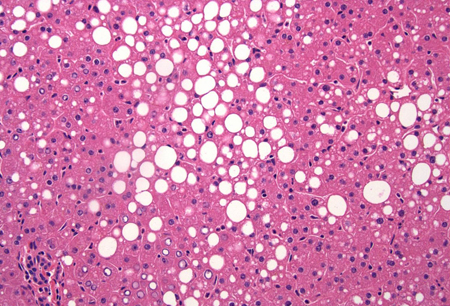 [Figure caption and citation for the preceding image starts]: Caso de esteatose hepática associada a disfunção metabólica; a biópsia mostra degeneração por balonamento dos hepatócitos (meio à direita) e inflamação lobular irregular em associação com esteatose mista micro e macrovesicular (H&E, x 200)Do acervo de Kapil B. Chopra, MD [Citation ends].
[Figure caption and citation for the preceding image starts]: Caso de esteatose hepática associada a disfunção metabólica; a biópsia mostra degeneração por balonamento dos hepatócitos (meio à direita) e inflamação lobular irregular em associação com esteatose mista micro e macrovesicular (H&E, x 200)Do acervo de Kapil B. Chopra, MD [Citation ends]. Quando há probabilidade de a doença ser benigna (testes da função hepática normais com exames de imagem que mostram leve infiltração gordurosa), a biópsia provavelmente não é necessária. Atualmente, o estadiamento da DHGDM pode ser realizado por uma combinação de técnicas radiológicas e laboratoriais, reduzindo enormemente a necessidade de biópsia hepática invasiva na maioria dos pacientes.[58]Dowman JK, Tomlinson JW, Newsome PN. Systematic review: the diagnosis and staging of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2011 Mar;33(5):525-40.
http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2036.2010.04556.x/full
http://www.ncbi.nlm.nih.gov/pubmed/21198708?tool=bestpractice.com
A biópsia hepática geralmente é reservada para pacientes selecionados, incluindo:[3]Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, et al. AASLD practice guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023 May 1;77(5):1797-835.
https://journals.lww.com/hep/fulltext/2023/05000/aasld_practice_guidance_on_the_clinical_assessment.31.aspx
http://www.ncbi.nlm.nih.gov/pubmed/36727674?tool=bestpractice.com
[8]Wong VW, Chan WK, Chitturi S, et al. Asia-Pacific working party on non-alcoholic fatty liver disease guidelines 2017 - part 1: definition, risk factors and assessment. J Gastroenterol Hepatol. 2018 Jan;33(1):70-85.
https://www.doi.org/10.1111/jgh.13857
http://www.ncbi.nlm.nih.gov/pubmed/28670712?tool=bestpractice.com
Quando há probabilidade de a doença ser benigna (testes da função hepática normais com exames de imagem que mostram leve infiltração gordurosa), a biópsia provavelmente não é necessária. Atualmente, o estadiamento da DHGDM pode ser realizado por uma combinação de técnicas radiológicas e laboratoriais, reduzindo enormemente a necessidade de biópsia hepática invasiva na maioria dos pacientes.[58]Dowman JK, Tomlinson JW, Newsome PN. Systematic review: the diagnosis and staging of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2011 Mar;33(5):525-40.
http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2036.2010.04556.x/full
http://www.ncbi.nlm.nih.gov/pubmed/21198708?tool=bestpractice.com
A biópsia hepática geralmente é reservada para pacientes selecionados, incluindo:[3]Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, et al. AASLD practice guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023 May 1;77(5):1797-835.
https://journals.lww.com/hep/fulltext/2023/05000/aasld_practice_guidance_on_the_clinical_assessment.31.aspx
http://www.ncbi.nlm.nih.gov/pubmed/36727674?tool=bestpractice.com
[8]Wong VW, Chan WK, Chitturi S, et al. Asia-Pacific working party on non-alcoholic fatty liver disease guidelines 2017 - part 1: definition, risk factors and assessment. J Gastroenterol Hepatol. 2018 Jan;33(1):70-85.
https://www.doi.org/10.1111/jgh.13857
http://www.ncbi.nlm.nih.gov/pubmed/28670712?tool=bestpractice.com
Pacientes com DHGDM que apresentam aumento do risco de esteatose hepática e/ou fibrose avançada (por exemplo, pacientes com síndrome metabólica, pacientes com escore de fibrose na DHGNA ou índice FIB-4 elevados ou aumento da rigidez hepática em exames de imagem)
Pacientes com uma possível causa alternativa de DHG ou doença hepática crônica coexistente (se essas causas alternativas/diagnósticos coexistentes não puderem ser descartadas por outros meios). Nos pacientes com suspeita de DHGDM e positividade de fator antinuclear em títulos maiores que 1:160 ou positividade de anticorpos antimúsculo liso em títulos maiores que 1:40, uma biópsia hepática pode ser considerada para descartar a presença de hepatite autoimune[49]Vuppalanchi R, Chalasani N. Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: selected practical issues in their evaluation and management. Hepatology. 2009 Jan;49(1):306-17.
https://www.doi.org/10.1002/hep.22603
http://www.ncbi.nlm.nih.gov/pubmed/19065650?tool=bestpractice.com
Pacientes nos quais a avaliação não invasiva da fibrose hepática é inconclusiva
Pacientes que apresentam elevações persistentes (>6 meses) nas enzimas hepáticas apesar de mudanças no estilo de vida
Pacientes que estão sendo considerados para entrada em um ensaio clínico.
A decisão de realizar uma biópsia hepática em um paciente com suspeita de DHGDM, bem como o momento da biópsia, deve ser uma decisão individualizada e compartilhada entre o paciente e um hepatologista. A American Gastroenterological Association recomenda a biópsia hepática nos pacientes com resultados de exames não invasivos indeterminados ou discordantes, ou que conflitem com outros achados clínicos, laboratoriais ou radiológicos, ou quando houver suspeita de etiologias alternativas para a doença hepática.[33]Wattacheril JJ, Abdelmalek MF, Lim JK, et al. AGA clinical practice update on the role of noninvasive biomarkers in the evaluation and management of nonalcoholic fatty liver disease: expert review. Gastroenterology. 2023 Oct;165(4):1080-8.
https://www.doi.org/10.1053/j.gastro.2023.06.013
http://www.ncbi.nlm.nih.gov/pubmed/37542503?tool=bestpractice.com
 [Figure caption and citation for the preceding image starts]: Caso de esteatose hepática associada a disfunção metabólica; a biópsia mostra degeneração por balonamento dos hepatócitos (meio à direita) e inflamação lobular irregular em associação com esteatose mista micro e macrovesicular (H&E, x 200)Do acervo de Kapil B. Chopra, MD [Citation ends].
[Figure caption and citation for the preceding image starts]: Caso de esteatose hepática associada a disfunção metabólica; a biópsia mostra degeneração por balonamento dos hepatócitos (meio à direita) e inflamação lobular irregular em associação com esteatose mista micro e macrovesicular (H&E, x 200)Do acervo de Kapil B. Chopra, MD [Citation ends]. Quando há probabilidade de a doença ser benigna (testes da função hepática normais com exames de imagem que mostram leve infiltração gordurosa), a biópsia provavelmente não é necessária. Atualmente, o estadiamento da DHGDM pode ser realizado por uma combinação de técnicas radiológicas e laboratoriais, reduzindo enormemente a necessidade de biópsia hepática invasiva na maioria dos pacientes.[58] A biópsia hepática geralmente é reservada para pacientes selecionados, incluindo:[3][8]
Quando há probabilidade de a doença ser benigna (testes da função hepática normais com exames de imagem que mostram leve infiltração gordurosa), a biópsia provavelmente não é necessária. Atualmente, o estadiamento da DHGDM pode ser realizado por uma combinação de técnicas radiológicas e laboratoriais, reduzindo enormemente a necessidade de biópsia hepática invasiva na maioria dos pacientes.[58] A biópsia hepática geralmente é reservada para pacientes selecionados, incluindo:[3][8]