Etiologia
A principal fonte de vitamina D para a maioria dos seres humanos é a exposição à luz solar. Evitar a exposição ao sol, inclusive com o uso excessivo de filtro solar e a estação do ano, a latitude e a hora do dia, influenciam fortemente na produção de vitamina D cutânea.[1][58] O aumento da pigmentação da pele resulta na fotoprodução menos eficaz de vitamina D e 25-hidroxivitamina D.[58][59] O envelhecimento também é considerado um fator de risco para a deficiência de vitamina D, porque a capacidade da pele de produzir vitamina D diminui com a idade.[58] O aumento do nível sanguíneo de vitamina D em adultos jovens de 20 a 30 anos após a exposição à radiação ultravioleta B é pelo menos três vezes maior em comparação com adultos mais velhos de 62 a 80 anos.[58]
A ingestão alimentar e suplementar inadequada de vitamina D é outra causa importante de deficiência de vitamina D.[11] Os lactentes que recebem nutrição unicamente do leite materno, sem suplementação de vitamina D, estão particularmente em risco.[60][61] Ao nascer, a maioria dos lactentes extremamente prematuros apresentam deficiência bioquímica de vitamina D. O risco é reduzido ou pode ser prevenido com suplementação de vitamina D.[62] Pacientes com síndromes de má absorção intestinal, inclusive doença celíaca, fibrose cística, doença de Crohn, doença de Whipple ou síndrome do intestino curto, bem como aqueles que foram submetidos à cirurgia de bypass gástrico, são incapazes de absorver vitamina D ou a absorvem de forma insuficiente.[2][63] Também existe uma possível relação bidirecional através da qual o baixo status de vitamina D pode impactar negativamente no curso clínico da doença intestinal subjacente, particularmente nas doenças inflamatórias intestinais (doença de Crohn, colite ulcerativa), pois a vitamina D tem o potencial de regular a imunidade da mucosa intestinal.[63]
A insuficiência hepática grave está associada à deficiência de vitamina D.[64] Os mecanismos potenciais para a deficiência de vitamina D na doença hepática crônica incluem fontes exógenas reduzidas de vitamina D (dieta, exposição limitada à luz solar), má absorção intestinal de vitamina D devido à colestase, produção reduzida de proteína de ligação da vitamina D e albumina devido a lesão hepática; hidroxilação hepática prejudicada e aumento do catabolismo da 25-hidroxivitamina D.[65] Quando >90% do fígado está comprometido, ele é incapaz de produzir 25-hidroxivitamina D suficiente.[3]
A vitamina D é lipossolúvel: quando é ingerida ou produzida na pele, a maior parte é incorporada inicialmente à gordura corporal. Para adultos com IMC >30, a gordura sequestra a vitamina D; portanto, a obesidade aumenta o risco de deficiência de vitamina D.[66] Adultos obesos precisam de duas a três vezes mais vitamina D tanto para tratar a deficiência de vitamina D quanto para prevenir sua recorrência.[2][67]
O uso de glicocorticoides, medicamentos antiepilépticos, terapia antirretroviral altamente ativa, rifampicina e erva-de-são-joão também podem causar deficiência de vitamina D devido à ativação dos receptores esteroides e xenobióticos, provocando a ativação do mecanismo enzimático que destrói a 25-hidroxivitamina D e a 1,25-di-hidroxivitamina D.[68]
Raramente, pode ocorrer uma síndrome de deficiência de vitamina D em consequência de vários distúrbios hereditários que reduzem ou impedem o metabolismo da vitamina D em 25-hidroxivitamina D ou 25-hidroxivitamina D em 1,25-di-hidroxivitamina D.[5] Estes incluem raquitismo dependente de vitamina D, raquitismo hipofosfatêmico ligado ao cromossomo X e raquitismo hipofosfatêmico autossômico dominante.[6][8]
Os distúrbios adquiridos de metabolismo de vitamina D, como doença renal crônica, resultam em retenção de fosfato, causando um aumento na produção do fator de crescimento de fibroblastos 23 (FGF-23) por osteócitos. O FGF-23 inibe a produção de 1,25-di-hidroxivitamina D e, inicialmente, resulta em hiperparatireoidismo secundário. [9] Os pacientes com doença renal crônica são incapazes de produzir 1,25-di-hidroxivitamina D suficiente para regular o metabolismo de cálcio. Nos estágios iniciais da doença renal crônica (estágio 2: TFG 60-89 mL/min/1.73; m²; estágio 3A: TFG 45-59 mL/min/1.73 m²), a retenção de fosfato causa um aumento nos níveis séricos de FGF-23 que, por sua vez, reduz a eficiência dos rins de produzir 1,25-di-hidroxivitamina D. Em estágios mais avançados (estágio 3B: TFG 30-44 mL/min/1.73; estágio 4: TFG 15-29 mL/min; e estágio 5: TFG <15 mL/min), os rins não conseguem produzir uma quantidade adequada de 1,25-di-hidroxivitamina D para manter o metabolismo do cálcio. m²; estágio 4: TFG 15-29 mL/min; e estágio 5: TFG <15 mL/min/1.73 m²; e estágio 5: TFG <15 mL/min/1.73 m²), os rins não conseguem produzir uma quantidade adequada de 1,25-di-hidroxivitamina D para manter o metabolismo do cálcio. A incapacidade de produzir uma quantidade suficiente de 1,25-di-hidroxivitamina resulta em hiperparatireoidismo secundário e doença óssea metabólica.[69]
Distúrbios granulomatosos (por exemplo, sarcoidose e tuberculose), hiperparatireoidismo primário e hipertireoidismo resultam no aumento do metabolismo de 25-hidroxivitamina D em 1,25-di-hidroxivitamina D. A produção elevada de 1,25-di-hidroxivitamina D resulta no aumento da expressão e produção de 25-hidroxivitamina D-24-hidroxilase nos rins, que cataboliza 25-hidroxivitamina D em um metabólito inativo hidrossolúvel, resultando em níveis reduzidos de 25-hidroxivitamina D.[2][3] Além disso, um tumor benigno ou maligno pode produzir uma quantidade excessiva do fator de crescimento de fibroblastos 23 (FGF-23), causando hipofosfatemia grave, baixos níveis de 1,25-di-hidroxivitamina D sérica e, consequentemente, osteomalácia oncogênica (também conhecida como osteomalácia induzida por tumor).[4]
Fisiopatologia
Metabolismo normal da vitamina D e ações sobre o metabolismo do cálcio e do fosfato
A vitamina D3 obtida pela produção induzida pela luz solar, e a vitamina D2 ou D3 obtida pela dieta, são biologicamente inativas e exigem a hidroxilação no fígado para formar a 25-hidroxivitamina D. Essa é a principal forma circulante de vitamina D usada para determinar o nível de vitamina D. A 25-hidroxivitamina D também é inativa e é hidroxilada nos rins em 1,25-di-hidroxivitamina D.[1][2][3]
Após sua formação, a 1,25-di-hidroxivitamina D vai para o intestino delgado e interage com seu receptor nuclear (receptor de vitamina D) para aumentar a eficácia do intestino de absorver o cálcio da dieta. Em um estado de deficiência de vitamina D, aproximadamente 10% a 15% do cálcio da dieta é absorvido, enquanto a suficiência de vitamina D aumenta a absorção de cálcio no intestino na faixa de 30% a 40%.[3] Às vezes, quando há uma necessidade maior de cálcio (inclusive em adolescentes durante a fase de crescimento, gravidez e lactação), a eficiência aumenta de 60% a 80%.
1,25-di-hidroxivitamina D também aumenta a absorção de fosfato, principalmente no jejuno. Em um estado de deficiência de vitamina D, aproximadamente 60% do fosfato da dieta é absorvido, e em um estado de suficiência de vitamina D, essa taxa é maior, chegando a 80%.[3] 1,25-di-hidroxivitamina D interage com seu receptor de vitamina D em osteoblastos. Isso resulta em um aumento da expressão e produção da principal proteína não colagenosa no osso, a osteocalcina. Além disso, isso estimula a expressão e produção do receptor ativador de fator nuclear kappa-B (RANKL). Essa proteína liga o receptor RANKL em monócitos. Essa interação induz esses monócitos a coalescer e se tornar um osteoclasto multinuclear que libera colagenases e HCl para destruir a matriz e liberar o cálcio na circulação.[3][Figure caption and citation for the preceding image starts]: Produção, metabolismo e funções biológicas da vitamina D no metabolismo do cálcio e na saúde óssea (D representa D2 e D3). Abreviações: CECa, canal epitelial de cálcio; FGF-23, fator de crescimento de fibroblastos 23; PLCa, calbindina; pré-D3, pré-vitamina D3; RANKL, ligante do receptor ativador de fator nuclear kappa-B; 1,25(OH)2D, 1,25-di-hidroxivitamina D; 1-OHase, 25-hidroxicolecalciferol 1-hidroxilase; 7-DHC, 7-dehidrocolesterol; 24-OHase, 1,25-di-hidroxivitamina D-24-hidroxilase; 25-OHase, vitamina D-25-hidroxilase; 25(OH)D, 25-hidroxivitamina DCriado por M.F. Holick, PhD, MD; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Estrutura química da vitamina DDo acervo de M.F. Holick, PhD, MD; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Estrutura química da vitamina DDo acervo de M.F. Holick, PhD, MD; usado com permissão [Citation ends].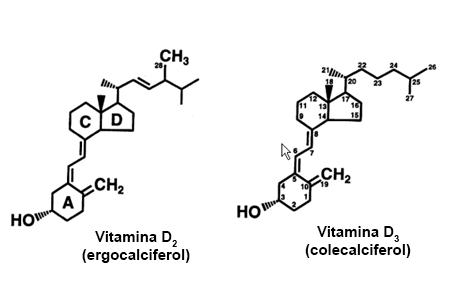
Ação esquelética da vitamina D
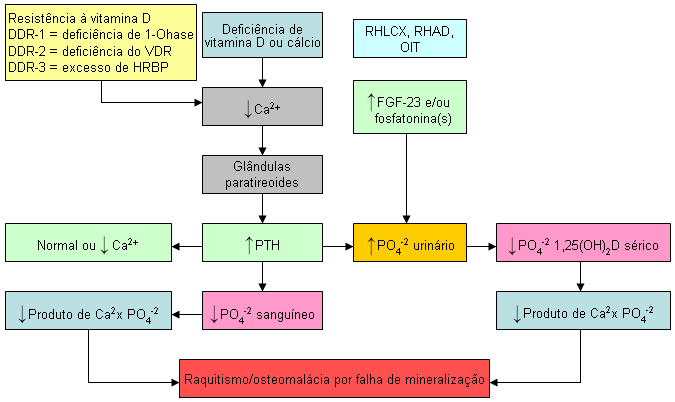
Crianças: a deficiência de vitamina D é a causa mais comum de raquitismo.[1][5] A deficiência de vitamina D evita a absorção eficiente de cálcio e fósforo alimentar. A má absorção de cálcio provoca uma queda no cálcio ionizado sérico, causando hiperparatireoidismo secundário. O paratormônio (PTH) diminui a reabsorção do fósforo nos rins, causando a perda de fósforo pela urina. Por isso, o cálcio sérico geralmente é normal em um lactente ou criança com deficiência de vitamina D. No entanto, o nível de fósforo sérico é baixo ou normal-baixo e, portanto, há um produto cálcio-fósforo inadequado, o que causa um defeito na mineralização da matriz de colágeno.
Adultos: a deficiência de vitamina D causa um aumento dos níveis de PTH, que por sua vez aumenta a atividade osteoclástica, provocando a remoção da matriz e do mineral do esqueleto. Por isso, a deficiência de vitamina D em adultos reduz o conteúdo mineral ósseo, causando osteopenia e osteoporose. Além disso, o hiperparatireoidismo secundário provoca a perda de fósforo nos rins, resultando em cálcio sérico normal com nível de fósforo sérico normal-baixo. O resultado é um produto cálcio-fósforo baixo no sangue, que impede que a matriz óssea seja mineralizada, causando osteomalácia. Por isso, para adultos, a deficiência de vitamina D está associada a cálcio sérico normal, fósforo sérico normal-baixo ou normal, PTH elevado e fosfatase alcalina normal ou elevada. O nível sanguíneo de 25-hidroxivitamina D é <75 nanomoles/L (<30 nanogramas/mL) e o nível de 1,25-di-hidroxivitamina D geralmente é normal ou elevado.[1][Figure caption and citation for the preceding image starts]: Efeitos diferenciais de vários distúrbios de cálcio, fosfato, ósseos e de metabolismo da vitamina D em níveis séricos de cálcio, fosfato e 1,25-di-hidroxivitamina D. Abreviações: FGF-23, fator de crescimento de fibroblastos 23; OIT, osteomalácia induzida por tumor; PLRH, proteína de ligação ribonuclear heteróloga; RHAD, raquitismo hipofosfatêmico autossômico dominante; RHLCX, raquitismo hipofosfatêmico ligado ao cromossomo X; RVD, resistente à vitamina D; 1-OHase, 25-hidroxicolecalciferol 1-hidroxilaseCriado por M.F. Holick, PhD, MD; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Biópsia óssea de osso trabecular demonstrando: (A) aumento da atividade osteoclástica devido ao hiperparatireoidismo secundário; (B) normal; (C) grandes fendas osteoides (área rosa clara), que são clássicas da osteomaláciaDo acervo de M.F. Holick, PhD, MD; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Biópsia óssea de osso trabecular demonstrando: (A) aumento da atividade osteoclástica devido ao hiperparatireoidismo secundário; (B) normal; (C) grandes fendas osteoides (área rosa clara), que são clássicas da osteomaláciaDo acervo de M.F. Holick, PhD, MD; usado com permissão [Citation ends].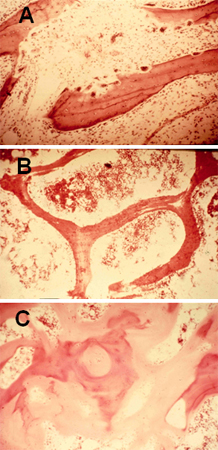
Ação não esquelética da vitamina D
A maioria dos tecidos e células do corpo tem um receptor de vitamina D. Além disso, muitos desses tecidos e células também têm uma 25-hidroxivitamina D-1-hidroxilase capaz de converter 25-hidroxivitamina D em 1,25-di-hidroxivitamina D.[1][3][21]
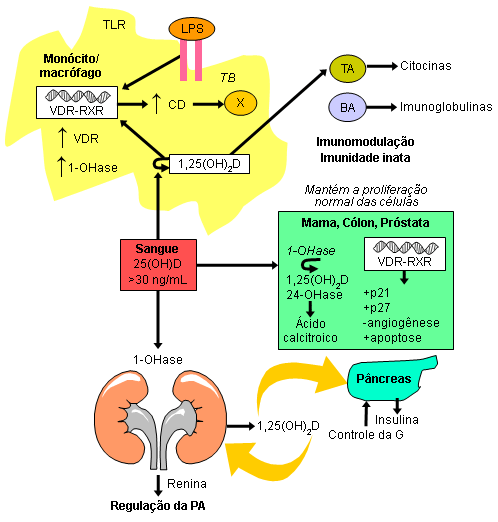
A vitamina D é um fator importante para a imunomodulação. Os linfócitos T e B ativados têm um receptor de vitamina D, e suas atividades imunológicas são reguladas pela 1,25-di-hidroxivitamina D.[1][21] Os macrófagos produzem 1,25-di-hidroxivitamina D com a finalidade de induzir a produção de catelicidina, uma proteína que mata agentes infecciosos, incluindo Mycobacterium tuberculosis.[55] Além disso, a 1,25-di-hidroxivitamina D produzida nos monócitos ou macrófagos provavelmente é liberada para agir localmente nos linfócitos T e B ativados, que regulam a síntese de citocina e imunoglobulina, respectivamente. Acredita-se que essas ações imunológicas tenham um papel na redução do risco de doenças autoimunes e infecciosas.[21]
Demonstrou-se que o risco de cânceres comuns é reduzido na presença de níveis de 25-hidroxivitamina D normais. Acredita-se que isso se deva à produção de 1,25-di-hidroxivitamina D na mama, cólon, próstata e outros tecidos, mantendo a proliferação e diferenciação celular normais. Acredita-se que o efeito da vitamina D na redução do diabetes do tipo 2 deva-se ao fato de a 1,25-di-hidroxivitamina D (produzida nos rins) entrar na circulação e realizar a down-regulação (down-regulation) da produção renal de renina, e estimular a secreção de insulina no pâncreas.[1][3][Figure caption and citation for the preceding image starts]: Produção extrarrenal de 1,25-di-hidroxivitamina D para modular a função imunológica, o crescimento celular e a produção de insulina. Abreviações: BA, linfócito B ativado; CD, catelicidina; G, glicemia; LPS, lipopolissacarídeos; TA, linfócito T ativado; TLR, receptor do tipo Toll; VDR-RXR, receptor de vitamina D-receptor de retinoide X; 1,25(OH)2D, 1,25-di-hidroxivitamina D; 1-OHase, 25-hidroxicolecalciferol 1-hidroxilase; 24-OHase, 1,25-di-hidroxivitamina D-24-hidroxilase; 25(OH)D, 25-hidroxivitamina DCriado por M.F. Holick, PhD, MD; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Representação esquemática da função parácrina e intracrina da vitamina D e seus metabólitos e ações da 1,25-diidroxivitamina D nos sistemas imunológico inato e adaptativo. Abreviação: 1,25(OH)2D: 1,25-dihidroxivitamina D; 25(OH)D: 25-hidroxivitamina D, IFN-Ƴ: interferon-Ƴ; IL: interleucina; MHC: complexo de histocompatibilidade de membrana, TH1: T auxiliar 1; TH2: T auxiliar 2; TH17: T auxiliar 17; Treg: célula T reguladora, TNF-α: fator de necrose tumoral-α; TLR2: receptor do tipo Toll 2; TLR4: receptor do tipo Toll 4Reproduzido com permissão de Holick MF, copyright 2020 [Citation ends].
[Figure caption and citation for the preceding image starts]: Representação esquemática da função parácrina e intracrina da vitamina D e seus metabólitos e ações da 1,25-diidroxivitamina D nos sistemas imunológico inato e adaptativo. Abreviação: 1,25(OH)2D: 1,25-dihidroxivitamina D; 25(OH)D: 25-hidroxivitamina D, IFN-Ƴ: interferon-Ƴ; IL: interleucina; MHC: complexo de histocompatibilidade de membrana, TH1: T auxiliar 1; TH2: T auxiliar 2; TH17: T auxiliar 17; Treg: célula T reguladora, TNF-α: fator de necrose tumoral-α; TLR2: receptor do tipo Toll 2; TLR4: receptor do tipo Toll 4Reproduzido com permissão de Holick MF, copyright 2020 [Citation ends].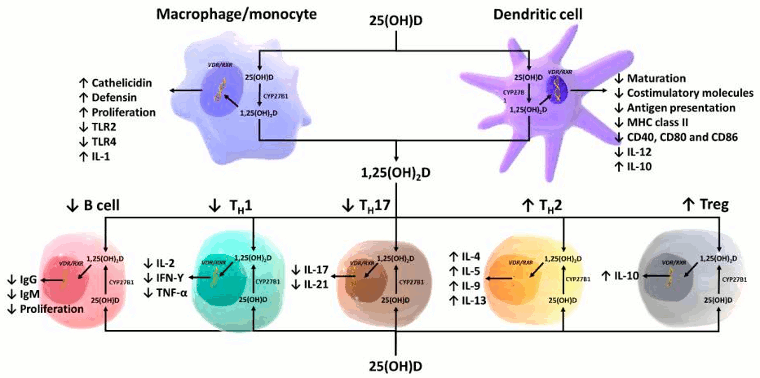
Classificação
Classificação etiológica[1][2][3]
Adquirida:
Nutricional
Relacionada à deficiência alimentar, má absorção ou falta de exposição aos raios ultravioleta B.
Induzida por medicamentos
Devido à destruição de 25-hidroxivitamina D e 1,25-di-hidroxivitamina D.
Doença renal crônica
Devido à síntese reduzida de 1,25-di-hidroxivitamina D.
Distúrbios granulomatosos
Os macrófagos no granuloma podem causar o aumento do metabolismo de 25-hidroxivitamina D em 1,25-di-hidroxivitamina D, provocando um aumento de expressão da enzima 24-hidroxilase, que por sua vez aumenta a destruição de 25-hidroxivitamina D e de 1,25-di-hidroxivitamina D, resultando na deficiência de vitamina D. Os níveis sanguíneos elevados de 1,25-di-hidroxivitamina D podem causar hipercalciúria e hipercalcemia.
Hiperparatireoidismo primário
Devido ao aumento do metabolismo de 25-hidroxivitamina D em 1,25-di-hidroxivitamina D. No entanto, é o aumento da produção de 1,25-di-hidroxivitamina D que aumenta a atividade de 25-hidroxivitamina D-24-hidroxilase (CYP24A) que, por sua vez, metaboliza 25 e 1,25-di-hidroxivitamina D em metabólitos inativos hidrossolúveis.
Hipertireoidismo
Devido ao metabolismo aumentado de 25-hidroxivitamina D.
Osteomalácia oncogênica
Devido à produção do fator de crescimento de fibroblastos 23 (FGF-23) por um tumor benigno ou maligno; a hiperfosfatúria e a hipofosfatemia graves causam osteomalácia. O FGF-23 inibe a 25-hidroxivitamina D-1 alfa-hidroxilase renal, resultando em níveis baixos de 1,25-di-hidroxivitamina D sérica.[4]
Hereditária:[5]
Raquitismo dependente de vitamina D do tipo 1
Devido a uma mutação pontual da 25-hidroxivitamina D-1α-hidroxilase ou mutações no CYP2R1 que reduzem a expressão ou função da enzima CYP2R1 codificada, a principal 25-hidroxilase; associado a um nível baixo ou não detectável de 1,25-di-hidroxivitamina D sérica.[6]
Raquitismo dependente de vitamina D do tipo 2 (também conhecido como raquitismo resistente à vitamina D)
Devido a mutações do gene receptor de vitamina D (VDR); associado a um nível muito elevado de 1,25-di-hidroxivitamina D sérica.[6]
Raquitismo dependente de vitamina D do tipo 3
Devido a uma mutação do gene CYP3A4 que causa um aumento acentuado no catabolismo da 1,25-di-hidroxivitamina D. Os indivíduos têm concentrações séricas detectáveis da vitamina D3 biologicamente inativa (gerada por exposição ao sol ou obtida da dieta), mas baixas concentrações séricas dos metabolitos da vitamina D 25-hidroxivitamina D e 1,25-di-hidroxivitamina D.[7]
Raquitismo hipofosfatêmico ligado ao cromossomo X
Devido a uma mutação do gene PHEX que provoca uma redução do metabolismo de FGF-23, causando hiperfosfatúria e hipofosfatemia graves, responsáveis pelo raquitismo grave. O nível de 1,25-di-hidroxivitamina D sérica é inadequadamente baixo para a presença de hipofosfatemia.[8]
Raquitismo hipofosfatêmico autossômico dominante
Devido a uma mutação do gene FGF-23 no local onde a proteína resultante é menos sensível à proteólise, causando níveis elevados de FGF-23 que causam hiperfosfatúria e hipofosfatemia graves, resultando em raquitismo intenso. O nível de 1,25-di-hidroxivitamina D sérica é inadequadamente baixo para a presença de hipofosfatemia.[8]
O uso deste conteúdo está sujeito ao nosso aviso legal