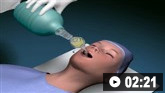
A HSA requer tratamento de emergência e encaminhamento precoce para uma unidade de cuidados neurocríticos dedicada.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[96]Diringer MN. Management of aneurysmal subarachnoid hemorrhage. Crit Care Med. 2009 Feb;37(2):432-40.
http://www.ncbi.nlm.nih.gov/pubmed/19114880?tool=bestpractice.com
Quando os pacientes são avaliados em cenários rurais ou comunitários, deve-se considerar fortemente o encaminhamento rápido para centros de cuidados terciários de alto volume com serviços de cuidados neurointensivos multidisciplinares, centros com capacidades abrangentes para AVC e cirurgiões cerebrovasculares/intervencionistas neuroendovasculares experientes.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[97]Diringer MN, Bleck TP, Claude Hemphill J 3rd, et al; Neurocritical Care Society. Critical care management of patients following aneurysmal subarachnoid hemorrhage: recommendations from the Neurocritical Care Society's Multidisciplinary Consensus Conference. Neurocrit Care. 2011 Sep;15(2):211-40.
http://www.ncbi.nlm.nih.gov/pubmed/21773873?tool=bestpractice.com
O tratamento cirúrgico ou endovascular do aneurisma roto deve ser realizado o mais cedo possível após a apresentação, de preferência em até 24 horas após o início, para melhorar o desfecho.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Estabilização e suporte cardiopulmonar
É vital a estabilização dos pacientes simultaneamente à investigação para prevenir complicações precoces indesejadas. É essencial estabelecer a necessidade de intubação endotraqueal e ventilação mecânica como primeira prioridade.[38]Axelrod KA, Diringer MN. Medical management of subarachnoid hemorrhage. In: Bhardwaj A, Alkayed NJ, Kirsch JR, et al, eds. Acute stroke: bench to bedside. New York, NY: Informa Healthcare; 2006. O nível de consciência deve ser avaliado usando a escala de coma de Glasgow, além da adequação das vias aéreas e da função cardiovascular.[39]Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis. 2013 Feb 7;35(2):93-112.
https://www.karger.com/Article/FullText/346087
http://www.ncbi.nlm.nih.gov/pubmed/23406828?tool=bestpractice.com
Um nível de consciência precário e convulsões na apresentação são fatores de risco para aspiração. Uma grande carga de hemorragia e a presença de hematoma subdural estão associadas à ocorrência de convulsões após a ruptura do aneurisma.[41]Ibrahim GM, Fallah A, Macdonald RL. Clinical, laboratory, and radiographic predictors of the occurrence of seizures following aneurysmal subarachnoid hemorrhage. J Neurosurg. 2013 Aug;119(2):347-52.
http://www.ncbi.nlm.nih.gov/pubmed/23581590?tool=bestpractice.com
Um exame neurológico completo deve ser realizado com atenção especial para a reação pupilar. Pupilas fixas e dilatadas em paciente comatoso estão associadas a um prognóstico desfavorável, especialmente quando presentes bilateralmente.[42]Clusmann H, Schaller C, Schramm J. Fixed and dilated pupils after trauma, stroke, and previous intracranial surgery: management and outcome. J Neurol Neurosurg Psychiatry. 2001 Aug;71(2):175-81.
https://pmc.ncbi.nlm.nih.gov/articles/PMC1737504
http://www.ncbi.nlm.nih.gov/pubmed/11459888?tool=bestpractice.com
Hemorragias intraoculares (secundárias ao aumento da pressão intracraniana) são observadas em 10% a 40% dos pacientes com HSA.[43]McCarron MO, Alberts MJ, McCarron P. A systematic review of Terson's syndrome: frequency and prognosis after subarachnoid haemorrhage. J Neurol Neurosurg Psychiatry. 2004 Mar;75(3):491-3.
https://jnnp.bmj.com/content/75/3/491.long
http://www.ncbi.nlm.nih.gov/pubmed/14966173?tool=bestpractice.com
Elas causam perda da visão no olho afetado. Isso está associado a um prognóstico mais desfavorável e aumento da mortalidade.[43]McCarron MO, Alberts MJ, McCarron P. A systematic review of Terson's syndrome: frequency and prognosis after subarachnoid haemorrhage. J Neurol Neurosurg Psychiatry. 2004 Mar;75(3):491-3.
https://jnnp.bmj.com/content/75/3/491.long
http://www.ncbi.nlm.nih.gov/pubmed/14966173?tool=bestpractice.com
A dilatação isolada de uma pupila e a perda do reflexo à luz podem indicar hérnia cerebral como resultado do aumento da pressão intracraniana. Um estado neurológico precário na internação parece ser um preditor de anormalidades cardíacas, as quais se acreditava serem secundárias à intensa ativação simpática.[44]Tung P, Kopelnik A, Banki N, et al. Predictors of neurocardiogenic injury after subarachnoid hemorrhage. Stroke. 2004 Feb;35(2):548-51.
http://www.ncbi.nlm.nih.gov/pubmed/14739408?tool=bestpractice.com
[45]Zaroff JG, Rordorf GA, Newell JB, et al. Cardiac outcome in patients with subarachnoid hemorrhage and electrocardiographic abnormalities. Neurosurgery. 1999 Jan;44(1):34-9.
http://www.ncbi.nlm.nih.gov/pubmed/9894961?tool=bestpractice.com
[46]Zaroff JG, Rordorf GA, Ogilvy CS, et al. Regional patterns of left ventricular systolic dysfunction after subarachnoid hemorrhage: evidence for neurally mediated cardiac injury. J Am Soc Echocardiogr. 2000 Aug;13(8):774-9.
http://www.ncbi.nlm.nih.gov/pubmed/10936822?tool=bestpractice.com
[47]Jain R, Deveikis J, Thompson BG. Management of patients with stunned myocardium associated with subarachnoid hemorrhage. AJNR Am J Neuroradiol. 2004 Jan;25(1):126-9.
http://www.ncbi.nlm.nih.gov/pubmed/14729541?tool=bestpractice.com
Deve ser instituído um rígido monitoramento dos sinais vitais (por exemplo, pressão arterial, ritmo e frequência cardíacas, e frequência respiratória).[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[48]Al-Shahi R, White PM, Davenport RJ, et al. Clinical review: subarachnoid haemorrhage. BMJ. 2006 Jul 29;333(7561):235-40.
Em pacientes com HSA aneurismática (HSAa) e aneurisma não protegido, recomenda-se monitoramento frequente da pressão arterial (PA) e controle da PA com medicação(ões) de ação curta para evitar hipotensão grave, hipertensão e variabilidade da PA.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Não há evidências suficientes para recomendar uma meta específica para a PA.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
A redução repentina e profunda da PA deve ser evitada.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[101]Ascanio LC, Enriquez-Marulanda A, Maragkos GA, et al. Effect of blood pressure variability during the acute period of subarachnoid hemorrhage on functional outcomes. Neurosurgery. 2020 Sep;87(4):779-87.
http://www.ncbi.nlm.nih.gov/pubmed/32078677?tool=bestpractice.com
Em pacientes que estiverem recebendo anticoagulantes, a reversão de emergência com agentes apropriados deve ser realizada para evitar o ressangramento.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
As estratégias de reversão devem seguir os padrões publicados atualmente para sangramento com risco à vida.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[102]Greenberg SM, Ziai WC, Cordonnier C, et al. 2022 Guideline for the management of patients with spontaneous intracerebral hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2022 Jul;53(7):e282-361.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000407
Se houver coagulopatia, ela deverá ser tratada de modo agressivo usando-se concentrado de complexo protrombínico (CCP) ou plasma fresco congelado (PFC) e vitamina K. Consulte Princípios de manejo da anticoagulação.
Eletrólitos e fluidos
O monitoramento rigoroso e o tratamento direcionado da volemia são razoáveis para manter a euvolemia.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[103]Mutoh T, Kazumata K, Terasaka S, et al. Early intensive versus minimally invasive approach to postoperative hemodynamic management after subarachnoid hemorrhage. Stroke. 2014 May;45(5):1280-4.
http://www.ncbi.nlm.nih.gov/pubmed/24692480?tool=bestpractice.com
[104]Chui J, Craen R, Dy-Valdez C, et al. Early goal-directed therapy during endovascular coiling procedures following aneurysmal subarachnoid Hhemorrhage: a pilot prospective randomized controlled study. J Neurosurg Anesthesiol. 2022 Jan;34(1):35-43.
http://www.ncbi.nlm.nih.gov/pubmed/32496448?tool=bestpractice.com
[105]Hoff R, Rinkel G, Verweij B, et al. Blood volume measurement to guide fluid therapy after aneurysmal subarachnoid hemorrhage: a prospective controlled study. Stroke. 2009 Jul;40(7):2575-7.
https://www.ahajournals.org/doi/10.1161/STROKEAHA.108.538116?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/19423854?tool=bestpractice.com
A indução de hipertensão e hipervolemia é potencialmente prejudicial devido à associação com morbidade excessiva, incluindo edema cerebral, transformação hemorrágica nas áreas de infarto, leucoencefalopatia reversível, infarto do miocárdio e insuficiência cardíaca congestiva.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[39]Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis. 2013 Feb 7;35(2):93-112.
https://www.karger.com/Article/FullText/346087
http://www.ncbi.nlm.nih.gov/pubmed/23406828?tool=bestpractice.com
[106]Tagami T, Kuwamoto K, Watanabe A, et al. Effect of triple-h prophylaxis on global end-diastolic volume and clinical outcomes in patients with aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2014 Dec;21(3):462-9.
http://www.ncbi.nlm.nih.gov/pubmed/24865266?tool=bestpractice.com
[107]Lennihan L, Mayer SA, Fink ME, et al. Effect of hypervolemic therapy on cerebral blood flow after subarachnoid hemorrhage: a randomized controlled trial. Stroke. 2000 Feb;31(2):383-91.
http://www.ncbi.nlm.nih.gov/pubmed/10657410?tool=bestpractice.com
[108]Rinkel GJ, Feigin VL, Algra A, et al. Circulatory volume expansion therapy for aneurysmal subarachnoid haemorrhage. Cochrane Database Syst Rev. 2004 Oct 18;(4):CD000483.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000483.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/15494997?tool=bestpractice.com
[109]Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. 2006 Apr;16(2):170-5.
http://www.ncbi.nlm.nih.gov/pubmed/16629742?tool=bestpractice.com
Portanto, o aumento hemodinâmico profilático não deve ser realizado para reduzir os danos iatrogênicos ao paciente.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Os desequilíbrios eletrolíticos (por exemplo, hiponatremia) são comuns e devem ser corrigidos. Se houver coagulopatia, ela deverá ser tratada de modo agressivo usando concentrado de complexo protrombínico ou plasma fresco congelado e vitamina K. A American Heart Association afirma que o uso de mineralocorticoides como a fludrocortisona é razoável para tratar natriurese e hiponatremia, conforme apoiado por vários ECRCs.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Entretanto, embora o uso de fludrocortisona reduza o excesso de excreção de sódio, o volume de urina e o uso de fluidoterapia intravenosa em pacientes com HSA, não foi demonstrado que ele afete consistentemente o desfecho.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[110]Nakagawa I, Hironaka Y, Nishimura F, et al. Early inhibition of natriuresis suppresses symptomatic cerebral vasospasm in patients with aneurysmal subarachnoid hemorrhage. Cerebrovasc Dis. 2013;35(2):131-7.
https://karger.com/ced/article-abstract/35/2/131/77653/Early-Inhibition-of-Natriuresis-Suppresses?redirectedFrom=fulltext
http://www.ncbi.nlm.nih.gov/pubmed/23406891?tool=bestpractice.com
[111]Mori T, Katayama Y, Kawamata T, et al. Improved efficiency of hypervolemic therapy with inhibition of natriuresis by fludrocortisone in patients with aneurysmal subarachnoid hemorrhage. J Neurosurg. 1999 Dec;91(6):947-52.
http://www.ncbi.nlm.nih.gov/pubmed/10584839?tool=bestpractice.com
[112]Mistry AM, Mistry EA, Ganesh Kumar N, et al. Corticosteroids in the management of hyponatremia, hypovolemia, and vasospasm in subarachnoid hemorrhage: a meta-analysis. Cerebrovasc Dis. 2016;42(3-4):263-71.
https://www.karger.com/Article/FullText/446251
http://www.ncbi.nlm.nih.gov/pubmed/27173669?tool=bestpractice.com
[113]Treggiari MM, Rabinstein AA, Busl KM, et al. Guidelines for the neurocritical care management of aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2023 Aug;39(1):1-28.
http://www.ncbi.nlm.nih.gov/pubmed/37202712?tool=bestpractice.com
Algumas diretrizes afirmam que não há evidências suficientes para dar suporte ao seu uso na manutenção de concentrações séricas normais de sódio ou na melhora do desfecho funcional.[113]Treggiari MM, Rabinstein AA, Busl KM, et al. Guidelines for the neurocritical care management of aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2023 Aug;39(1):1-28.
http://www.ncbi.nlm.nih.gov/pubmed/37202712?tool=bestpractice.com
Consulte Hiponatremia.
Analgesia
Analgesia deve ser fornecida a pacientes conscientes. O paracetamol pode ser usado como opção de primeira linha.[39]Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis. 2013 Feb 7;35(2):93-112.
https://www.karger.com/Article/FullText/346087
http://www.ncbi.nlm.nih.gov/pubmed/23406828?tool=bestpractice.com
Para dores intensas, opioides como codeína ou tramadol devem ser administrados.[39]Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis. 2013 Feb 7;35(2):93-112.
https://www.karger.com/Article/FullText/346087
http://www.ncbi.nlm.nih.gov/pubmed/23406828?tool=bestpractice.com
Se o paciente ainda sentir dor, pode ser necessária morfina ou oxicodona.[39]Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis. 2013 Feb 7;35(2):93-112.
https://www.karger.com/Article/FullText/346087
http://www.ncbi.nlm.nih.gov/pubmed/23406828?tool=bestpractice.com
Aspirina e anti-inflamatórios não esteroidais (AINEs) devem ser evitados antes da oclusão do aneurisma.[39]Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis. 2013 Feb 7;35(2):93-112.
https://www.karger.com/Article/FullText/346087
http://www.ncbi.nlm.nih.gov/pubmed/23406828?tool=bestpractice.com
O estado mental também precisa ser monitorado rigorosamente, especialmente em pacientes com risco de hidrocefalia aguda ou vasoespasmo. Portanto, recomenda-se o uso criterioso da analgesia.
Anticonvulsivantes
O uso profilático de anticonvulsivantes após a HSA é controverso.[114]Marigold R, Günther A, Tiwari D, et al. Antiepileptic drugs for the primary and secondary prevention of seizures after subarachnoid haemorrhage. Cochrane Database Syst Rev. 2013 Jun 5;(6):CD008710.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD008710.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/23740537?tool=bestpractice.com
[115]Feng R, Mascitelli J, Chartrain AG, et al. Anti-epileptic drug (AED) use in subarachnoid hemorrhage (SAH) and intracranial hemorrhage (ICH). Curr Pharm Des. 2017;23(42):6446-53.
http://www.ncbi.nlm.nih.gov/pubmed/29086673?tool=bestpractice.com
As diretrizes dos EUA sugerem que anticonvulsivantes profiláticos podem ser considerados em pacientes com HSAa e características de alto risco de convulsão (isto é, ruptura de aneurisma da artéria cerebral média, HSA de alto grau, hemorragia intracraniana, hidrocefalia e infarto cortical).[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Essas diretrizes não recomendam o uso rotineiro de anticonvulsivantes em pacientes com HSAa sem características de alto risco de convulsão, uma vez que a fenitoína para a profilaxia de convulsões está associada a morbidade e mortalidade excessivas.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[88]Rosengart AJ, Huo JD, Tolentino J, et al. Outcome in patients with subarachnoid hemorrhage treated with antiepileptic drugs. J Neurosurg. 2007 Aug;107(2):253-60.
http://www.ncbi.nlm.nih.gov/pubmed/17695377?tool=bestpractice.com
[116]Naidech AM, Kreiter KT, Janjua N, et al. Phenytoin exposure is associated with functional and cognitive disability after subarachnoid hemorrhage. Stroke. 2005 Mar;36(3):583-7.
https://www.ahajournals.org/doi/full/10.1161/01.STR.0000141936.36596.1e?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed
http://www.ncbi.nlm.nih.gov/pubmed/15662039?tool=bestpractice.com
O risco de convulsões é significativamente mais baixo após a embolização com molas que após a clipagem cirúrgica do aneurisma.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
O tratamento de curta duração pode ser uma profilaxia adequada, e algumas evidências sugerem que é melhor tolerado do que uma duração maior.[87]Chumnanvej S, Dunn IF, Kim DH. Three-day phenytoin prophylaxis is adequate after subarachnoid hemorrhage. Neurosurgery. 2007 Jan;60(1):99-102; discussion 102-3.
https://www.doi.org/10.1227/01.NEU.0000249207.66225.D9
http://www.ncbi.nlm.nih.gov/pubmed/17228257?tool=bestpractice.com
[117]Kodankandath TV, Farooq S, Wazni W, et al. Seizure prophylaxis in the immediate post-hemorrhagic period in patients with aneurysmal subarachnoid hemorrhage. J Vasc Interv Neurol. 2017 Dec;9(6):1-4.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5805895
http://www.ncbi.nlm.nih.gov/pubmed/29445430?tool=bestpractice.com
O uso rotineiro de anticonvulsivantes em longo prazo não é recomendado, mas pode ser considerado nos pacientes com fatores de risco conhecidos para transtorno convulsivo tardio.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Em pacientes com HSAa que apresentam convulsões, o tratamento com anticonvulsivantes por ≤7 dias é razoável para reduzir as complicações relacionadas a convulsões no período perioperatório.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Em pacientes com HSAa sem epilepsia prévia que apresentam convulsões, o tratamento com anticonvulsivantes além de 7 dias não é efetivo para reduzir o risco futuro de convulsões associadas à HSAa.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[39]Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis. 2013 Feb 7;35(2):93-112.
https://www.karger.com/Article/FullText/346087
http://www.ncbi.nlm.nih.gov/pubmed/23406828?tool=bestpractice.com
[114]Marigold R, Günther A, Tiwari D, et al. Antiepileptic drugs for the primary and secondary prevention of seizures after subarachnoid haemorrhage. Cochrane Database Syst Rev. 2013 Jun 5;(6):CD008710.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD008710.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/23740537?tool=bestpractice.com
Existem evidências de que nos EUA o levetiracetam pode ser o agente mais comumente prescrito para a prevenção de convulsões após HSAs.[118]Dewan MC, Mocco J. Current practice regarding seizure prophylaxis in aneurysmal subarachnoid hemorrhage across academic centers. J Neurointerv Surg. 2015 Feb;7(2):146-9.
https://jnis.bmj.com/content/7/2/146.long
http://www.ncbi.nlm.nih.gov/pubmed/24474163?tool=bestpractice.com
Um pequeno estudo prospectivo comparando o levetiracetam com a fenitoína para profilaxia de convulsões após uma lesão neurológica (incluindo HSA) encontrou os mesmos desfechos em relação a mortalidade e a controle de convulsões, mas os pacientes tratados com levetiracetam apresentaram melhores desfechos funcionais em longo prazo do que aqueles tratados com fenitoína (conforme avaliados pela Escala de Desfechos de Glasgow-Estendida e pela Escala de Classificação de Incapacidade (Glasgow Outcome Scale-Extended e Disability Rating Scale).[119]Szaflarski JP, Sangha KS, Lindsell CJ, et al. Prospective, randomized, single-blinded comparative trial of intravenous levetiracetam versus phenytoin for seizure prophylaxis. Neurocrit Care. 2010 Apr;12(2):165-72.
http://www.ncbi.nlm.nih.gov/pubmed/19898966?tool=bestpractice.com
Nimodipino
O início precoce de nimodipino (um bloqueador dos canais de cálcio) enteral é benéfico na prevenção de vasoespasmo, de isquemia cerebral tardia e na melhora dos desfechos funcionais em pacientes com HSA aneurismática.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[  ]
What are the effects of blood pressure (BP)‐lowering treatment for adults with a history of stroke or transient ischemic attack (TIA)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2269/fullMostre-me a resposta
]
What are the effects of blood pressure (BP)‐lowering treatment for adults with a history of stroke or transient ischemic attack (TIA)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2269/fullMostre-me a resposta
Pós-estabilização
Uma vez estabilizado, o paciente deve ser internado em uma unidade de cuidados neurocríticos dedicada.[97]Diringer MN, Bleck TP, Claude Hemphill J 3rd, et al; Neurocritical Care Society. Critical care management of patients following aneurysmal subarachnoid hemorrhage: recommendations from the Neurocritical Care Society's Multidisciplinary Consensus Conference. Neurocrit Care. 2011 Sep;15(2):211-40.
http://www.ncbi.nlm.nih.gov/pubmed/21773873?tool=bestpractice.com
Essas unidades reduzem de modo significativo a mortalidade intra-hospitalar e a duração da internação.[120]Suarez JI, Zaidat OO, Suri MF, et al. Length of stay and mortality in neurocritically ill patients: impact of a specialized neurocritical care team. Crit Care Med. 2004 Nov;32(11):2311-7.
http://www.ncbi.nlm.nih.gov/pubmed/15640647?tool=bestpractice.com
Na entrada na UTI, o estado neurológico deve ser classificado por meio de escalas, como a Escala de Hunt e Hess ou a Escala da World Federation of Neurological Surgeons (WFNS).[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Essas escalas são recomendadas para determinar a gravidade clínica inicial e predizer o desfecho.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Quanto mais alta a pontuação, pior o desfecho.[121]Broderick JP, Brott TG, Duldner JE, et al. Initial and recurrent bleeding are the major causes of death following subarachnoid hemorrhage. Stroke. 1994 Jul;25(7):1342-7.
http://www.ncbi.nlm.nih.gov/pubmed/8023347?tool=bestpractice.com
A escala da WFNS é preferencial em relação à escala de Hunt e Hess; ela é mais confiável porque usa o escore da Escala de coma de Glasgow para definir o estado mental.[35]Etminan N, de Sousa DA, Tiseo C, et al. European Stroke Organisation (ESO) guidelines on management of unruptured intracranial aneurysms. Eur Stroke J. 2022 Sep;7(3):V.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9446328
http://www.ncbi.nlm.nih.gov/pubmed/36082246?tool=bestpractice.com
Em contraste, a Escala de Hunt e Hess classifica o nível de consciência em torpor, estupor e coma profundo.[35]Etminan N, de Sousa DA, Tiseo C, et al. European Stroke Organisation (ESO) guidelines on management of unruptured intracranial aneurysms. Eur Stroke J. 2022 Sep;7(3):V.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9446328
http://www.ncbi.nlm.nih.gov/pubmed/36082246?tool=bestpractice.com
A escala de Fisher modificada pode ser usada para documentar e classificar a quantidade e distribuição de sangramento subaracnoide na TC da internação.[94]Frontera JA, Claassen J, Schmidt JM, et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: the modified fisher scale. Neurosurgery. 2006 Jul;59(1):21-7; discussion 21-7.
http://www.ncbi.nlm.nih.gov/pubmed/16823296?tool=bestpractice.com
Embora não seja definitiva, ela ajuda a predizer o risco potencial de vasoespasmo, que é uma complicação grave.
Antitussígenos e laxativos
A tosse pode ser suprimida com antitussígenos para prevenir potencial ressangramento. Medicamentos para tosse e resfriados que incluem opioides, como codeína ou hidrocodona, não devem ser usados em crianças e jovens de até 18 anos de idade, uma vez que os riscos (respiração lenta ou com dificuldade, uso indevido, abuso, dependência, superdosagem e morte) superam os benefícios quando usados para tosse nesses pacientes.[122]Food and Drug Administration. FDA drug safety communication: FDA requires labeling changes for prescription opioid cough and cold medicines to limit their use to adults 18 years and older. Jan 2018 [internet publication].
https://www.fda.gov/Drugs/DrugSafety/ucm590435.htm
Os laxativos são usados rotineiramente, já que o esforço durante a defecação pode potencialmente causar ressangramento.
Cirurgia e embolização com molas
Um neurocirurgião e um neurorradiologista intervencionista devem estar envolvidos na decisão sobre como tratar um aneurisma. A obliteração completa do aneurisma roto é indicada sempre que possível para reduzir o risco de ressangramento e retratamento.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[123]Johnston SC, Dowd CF, Higashida RT, et al. Predictors of rehemorrhage after treatment of ruptured intracranial aneurysms: the cerebral aneurysm rerupture after treatment (CARAT) study. Stroke. 2008 Jan;39(1):120-5.
https://www.ahajournals.org/doi/10.1161/STROKEAHA.107.495747?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/18048860?tool=bestpractice.com
[124]Pierot L, Barbe C, Herbreteau D, et al. Rebleeding and bleeding in the year following intracranial aneurysm coiling: analysis of a large prospective multicenter cohort of 1140 patients-analysis of recanalization after endovascular treatment of intracranial aneurysm (ARETA) Study. J Neurointerv Surg. 2020 Dec;12(12):1219-25.
http://www.ncbi.nlm.nih.gov/pubmed/32546636?tool=bestpractice.com
[125]Campi A, Ramzi N, Molyneux AJ, et al. Retreatment of ruptured cerebral aneurysms in patients randomized by coiling or clipping in the international subarachnoid aneurysm trial (ISAT). Stroke. 2007 May;38(5):1538-44.
https://www.ahajournals.org/doi/10.1161/STROKEAHA.106.466987?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/17395870?tool=bestpractice.com
A maioria dos cirurgiões opera os pacientes em bom estado neurológico durante as primeiras 72 horas para prevenir o ressangramento, uma prática que também parece estar associada a um melhor desfecho.[126]Dorhout Mees SM, Molyneux AJ, Kerr RS, et al. Timing of aneurysm treatment after subarachnoid hemorrhage: relationship with delayed cerebral ischemia and poor outcome. Stroke. 2012 Aug;43(8):2126-9.
http://www.ncbi.nlm.nih.gov/pubmed/22700527?tool=bestpractice.com
O tratamento deve ser individualizado de acordo com fatores específicos do paciente, como comorbidades clínicas e estado funcional pré-hemorrágico, e deve incorporar a decisão compartilhada com a família ou com os decisores substitutos.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
A AHA/ASA recomenda:[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Em pacientes com HSAa de alto grau, o tratamento do aneurisma é razoável, após discussão cuidadosa do prognóstico provável com os familiares, para otimizar o desfecho do paciente
Em pacientes com HSAa e idade avançada, o tratamento do aneurisma é razoável, após discussão cuidadosa do prognóstico com os familiares, para melhorar a sobrevida e o desfecho.
Em pacientes com HSAa que não melhoram após a correção das condições modificáveis e são considerados incuráveis devido a evidências de lesão neurológica irreversível, o tratamento do aneurisma não é benéfico.
Existem controvérsias sobre a escolha entre a clipagem cirúrgica e a embolização endovascular com molas. O aneurisma roto deve ser avaliado por especialista(s) com experiência endovascular e cirúrgica para determinar os riscos e benefícios relativos dos tratamentos cirúrgico ou endovascular de acordo com o paciente (por exemplo, idade, estado neurológico na internação, condições comórbidas) e características do aneurisma (por exemplo, tamanho e localização).[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Os resultados de um grande ensaio clínico internacional, prospectivo e randomizado geraram grandes controvérsias.[127]Diringer MN. To clip or to coil acutely ruptured intracranial aneurysms: update on the debate. Curr Opin Crit Care. 2005 Apr;11(2):121-5.
http://www.ncbi.nlm.nih.gov/pubmed/15758591?tool=bestpractice.com
[128]Molyneux A, Kerr R, Stratton I, et al; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet. 2002 Oct 26;360(9342):1267-74.
http://www.ncbi.nlm.nih.gov/pubmed/12414200?tool=bestpractice.com
[129]Molyneux AJ, Kerr RS, Yu LM, et al; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion. Lancet. 2005 Sep 3-9;366(9488):809-17.
http://www.ncbi.nlm.nih.gov/pubmed/16139655?tool=bestpractice.com
O International Subarachnoid Aneurysm Trial (ISAT) incluiu mais de 1000 pacientes em cada grupo de tratamento. Em 1 ano, 23.7% dos pacientes faleceram ou ficaram dependentes após a embolização com molas em comparação com 30.6% no grupo da clipagem.[128]Molyneux A, Kerr R, Stratton I, et al; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet. 2002 Oct 26;360(9342):1267-74.
http://www.ncbi.nlm.nih.gov/pubmed/12414200?tool=bestpractice.com
Críticas sobre o estudo incluem a distribuição desigual dos pacientes inscritos (quase todos de origem europeia), níveis distintos de experiência dos intervencionistas e cirurgiões e os critérios de inscrição para que os aneurismas sejam considerados adequados para o reparo cirúrgico ou endovascular.[127]Diringer MN. To clip or to coil acutely ruptured intracranial aneurysms: update on the debate. Curr Opin Crit Care. 2005 Apr;11(2):121-5.
http://www.ncbi.nlm.nih.gov/pubmed/15758591?tool=bestpractice.com
O acompanhamento em longo prazo dos pacientes inscritos no ISAT revelou que, apesar do risco elevado de sangramento recorrente no grupo de molas, o risco de morte a 5 anos permaneceu significativo em comparação com o grupo de clipagem.[130]Molyneux AJ, Kerr RS, Birks J, et al; ISAT Collaborators. Risk of recurrent subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the International Subarachnoid Aneurysm Trial (ISAT): long-term follow-up. Lancet Neurol. 2009 May;8(5):427-33.
https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(09)70080-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/19329361?tool=bestpractice.com
Outra publicação avaliando o acompanhamento de longo prazo (10 anos e mais) após o International Subarachnoid Aneurysm Trial (ISAT) concluiu que, apesar do alto risco de ressangramento, a probabilidade de sobrevivência livre de incapacitação é significativamente maior no grupo de tratamento endovascular que no grupo de tratamento neurocirúrgico.[131]Molyneux AJ, Birks J, Clarke A, et al. The durability of endovascular coiling versus neurosurgical clipping of ruptured cerebral aneurysms: 18 year follow-up of the UK cohort of the International Subarachnoid Aneurysm Trial (ISAT). Lancet. 2015 Feb 21;385(9969):691-7.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(14)60975-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/25465111?tool=bestpractice.com
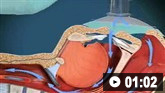
Na clipagem cirúrgica, uma craniotomia é realizada para expor o aneurisma e um clipe é colocado em seu colo para excluí-lo da circulação. As complicações da clipagem incluem ruptura do aneurisma, lesão das estruturas vasculares, AVC pós-operatório e clipagem de artérias perfurantes. A craniotomia não é necessária na embolização endovascular com molas. Um cateter arterial é inserido até o lúmen do aneurisma, onde molas de titânio são depositadas. Ocorre a formação de um trombo no lúmen, excluindo o aneurisma da circulação. Avanços tecnológicos contínuos refinaram a embolização com molas dos aneurismas, tornando esta técnica uma opção terapêutica para aneurismas complexos, os quais antes só podiam ser tratados com clipagem cirúrgica.[132]National Institute for Health and Care Excellence. Pipeline embolisation device for the treatment of complex intracranial aneurysms. January 2019 [internet publication].
https://www.nice.org.uk/guidance/MTG10
Ainda assim, há desvantagens em relação à embolização com molas, principalmente a embolização incompleta e recorrências que requerem uma nova intervenção.[133]Henkes H, Fischer S, Weber W, et al. Endovascular coil occlusion of 1811 intracranial aneurysms: early angiographic and clinical results. Neurosurgery. 2004 Feb;54(2):268-80.
http://www.ncbi.nlm.nih.gov/pubmed/14744273?tool=bestpractice.com
[134]Lozier AP, Connolly ES Jr, Lavine SD, et al. Guglielmi detachable coil embolization of posterior circulation aneurysms: a systematic review of the literature. Stroke. 2002 Oct;33(10):2509-18.
http://www.ncbi.nlm.nih.gov/pubmed/12364746?tool=bestpractice.com
[135]Murayama Y, Nien YL, Duckwiler G, et al. Guglielmi detachable coil embolization of cerebral aneurysms: 11 years' experience. J Neurosurg. 2003 May;98(5):959-66.
http://www.ncbi.nlm.nih.gov/pubmed/12744354?tool=bestpractice.com
[136]Raymond J, Guilbert F, Weill A, et al. Long-term angiographic recurrences after selective endovascular treatment of aneurysms with detachable coils. Stroke. 2003 Jun;34(6):1398-403.
https://www.ahajournals.org/doi/full/10.1161/01.STR.0000073841.88563.E9
http://www.ncbi.nlm.nih.gov/pubmed/12775880?tool=bestpractice.com
[137]Li H, Pan R, Wang H, et al. Clipping versus coiling for ruptured intracranial aneurysms: a systematic review and meta-analysis. Stroke. 2013 Jan;44(1):29-37.
https://www.ahajournals.org/doi/10.1161/STROKEAHA.112.663559
http://www.ncbi.nlm.nih.gov/pubmed/23238862?tool=bestpractice.com
Os eventos adversos potenciais do procedimento em si são AVC, ruptura do vaso e dissecção.
Para os pacientes com HSA de bom grau proveniente de aneurismas rotos da circulação anterior, igualmente adequados para abordagem primária com mola e clipagem, a AHA/ASA recomenda a abordagem primária com mola em preferência à clipagem para melhorar o desfecho funcional a 1 ano.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[128]Molyneux A, Kerr R, Stratton I, et al; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet. 2002 Oct 26;360(9342):1267-74.
http://www.ncbi.nlm.nih.gov/pubmed/12414200?tool=bestpractice.com
[138]Lindgren A, Vergouwen MD, van der Schaaf I, et al. Endovascular coiling versus neurosurgical clipping for people with aneurysmal subarachnoid haemorrhage. Cochrane Database Syst Rev. 2018 Aug;8(8):CD003085.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003085.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/30110521?tool=bestpractice.com
No entanto, a diretriz observa que ambas as opções de tratamento são razoáveis neste grupo de pacientes para alcançar um desfecho favorável no longo prazo.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
A AHA/ASA recomenda a abordagem com mola em preferência à clipagem nos pacientes com HSAa em decorrência de aneurismas rotos da circulação posterior que forem passíveis de inserção de mola, para melhorar os desfechos em curto e longo prazos.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[138]Lindgren A, Vergouwen MD, van der Schaaf I, et al. Endovascular coiling versus neurosurgical clipping for people with aneurysmal subarachnoid haemorrhage. Cochrane Database Syst Rev. 2018 Aug;8(8):CD003085.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003085.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/30110521?tool=bestpractice.com
[139]Spetzler RF, McDougall CG, Albuquerque FC, et al. The barrow ruptured aneurysm trial: 3-year results. J Neurosurg. 2013 Jul;119(1):146-57.
https://thejns.org/view/journals/j-neurosurg/119/1/article-p146.xml
http://www.ncbi.nlm.nih.gov/pubmed/23621600?tool=bestpractice.com
[140]Spetzler RF, McDougall CG, Zabramski JM, et al. The barrow ruptured aneurysm trial: 6-year results. J Neurosurg. 2015 Sep;123(3):609-17.
https://thejns.org/view/journals/j-neurosurg/123/3/article-p609.xml
http://www.ncbi.nlm.nih.gov/pubmed/26115467?tool=bestpractice.com
A idade do paciente pode informar a modalidade de tratamento. Para os pacientes com HSAa <40 anos de idade, a clipagem do aneurisma roto pode ser considerada o modo de tratamento preferencial para melhorar a durabilidade do tratamento e o desfecho. Uma maior expectativa de vida e uma melhor proteção contra nova ruptura favorecem a consideração da clipagem nos pacientes mais jovens.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[128]Molyneux A, Kerr R, Stratton I, et al; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet. 2002 Oct 26;360(9342):1267-74.
http://www.ncbi.nlm.nih.gov/pubmed/12414200?tool=bestpractice.com
[141]Mitchell P, Kerr R, Mendelow AD, et al. Could late rebleeding overturn the superiority of cranial aneurysm coil embolization over clip ligation seen in the international subarachnoid aneurysm trial? J Neurosurg. 2008 Mar;108(3):437-42.
http://www.ncbi.nlm.nih.gov/pubmed/18312088?tool=bestpractice.com
No entanto, para pacientes com mais de 70 anos de idade, a superioridade da abordagem com mola ou da clipagem para melhorar o desfecho não está bem estabelecida.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
[128]Molyneux A, Kerr R, Stratton I, et al; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet. 2002 Oct 26;360(9342):1267-74.
http://www.ncbi.nlm.nih.gov/pubmed/12414200?tool=bestpractice.com
[142]Ryttlefors M, Enblad P, Kerr RS, et al. International subarachnoid aneurysm trial of neurosurgical clipping versus endovascular coiling: subgroup analysis of 278 elderly patients. Stroke. 2008 Oct;39(10):2720-6.
https://www.ahajournals.org/doi/10.1161/STROKEAHA.107.506030?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/18669898?tool=bestpractice.com
Para pacientes com HSAa considerados recuperáveis e com nível de consciência deprimido devido a um grande hematoma intraparenquimatoso, a drenagem emergencial do coágulo deve ser realizada para reduzir a mortalidade.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Profilaxia para tromboembolismo venoso
Em pacientes com HSAa cujo aneurisma roto tiver sido protegido, recomenda-se profilaxia de tromboembolismo venoso farmacológica ou mecânica venosa (compressão pneumática intermitente) para reduzir o risco de tromboembolismo venoso.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Consulte Profilaxia do tromboembolismo venoso.
Outras terapias investigadas
Estatinas e sulfato de magnésio foram investigados por seu suposto efeito neuroprotetor no tratamento da HSA. Entretanto, nenhum dos dois demonstrou ser benéfico em termos de mortalidade e desfechos clínicos em pacientes com HSA.[113]Treggiari MM, Rabinstein AA, Busl KM, et al. Guidelines for the neurocritical care management of aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2023 Aug;39(1):1-28.
http://www.ncbi.nlm.nih.gov/pubmed/37202712?tool=bestpractice.com
[143]Liu J, Chen Q. Effect of statins treatment for patients with aneurysmal subarachnoid hemorrhage: a systematic review and meta-analysis of observational studies and randomized controlled trials. Int J Clin Exp Med. 2015 May 15;8(5):7198-208.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4509204
http://www.ncbi.nlm.nih.gov/pubmed/26221259?tool=bestpractice.com
[144]Dorhout Mees SM, Algra A, Vandertop WP, et al; MASH-2 Study Group. Magnesium for aneurysmal subarachnoid haemorrhage (MASH-2): a randomised placebo-controlled trial. Lancet. 2012 Jul 7;380(9836):44-9.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(12)60724-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/22633825?tool=bestpractice.com
[145]Ma J, Huang S, Ma L, et al. Endothelin-receptor antagonists for aneurysmal subarachnoid hemorrhage: an updated meta-analysis of randomized controlled trials. Crit Care. 2012 Oct 18;16(5):R198.
https://ccforum.biomedcentral.com/articles/10.1186/cc11686
http://www.ncbi.nlm.nih.gov/pubmed/23078672?tool=bestpractice.com
[146]Shen J, Shen J, Zhu K, et al. Efficacy of statins in cerebral vasospasm, mortality, and delayed cerebral ischemia in patients with aneurysmal subarachnoid hemorrhage: a systematic review and meta-analysis of randomized controlled trials. World Neurosurg. 2019 Nov;131:e65-e73.
https://www.doi.org/10.1016/j.wneu.2019.07.016
http://www.ncbi.nlm.nih.gov/pubmed/31295598?tool=bestpractice.com
A AHA/ASA não recomenda o uso rotineiro de terapia com estatinas ou sulfato de magnésio intravenoso para melhorar os desfechos.[37]Hoh BL, Ko NU, Amin-Hanjani S, et al. 2023 Guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American Heart Association/American Stroke Association. Stroke. 2023 Jul;54(7):e314-70.
https://www.ahajournals.org/doi/full/10.1161/STR.0000000000000436?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
http://www.ncbi.nlm.nih.gov/pubmed/37212182?tool=bestpractice.com
Os antagonistas do receptor de endotelina não demonstraram melhorar os desfechos funcionais ou a mortalidade em metanálises de ensaios clínicos randomizados e controlados.[145]Ma J, Huang S, Ma L, et al. Endothelin-receptor antagonists for aneurysmal subarachnoid hemorrhage: an updated meta-analysis of randomized controlled trials. Crit Care. 2012 Oct 18;16(5):R198.
https://ccforum.biomedcentral.com/articles/10.1186/cc11686
http://www.ncbi.nlm.nih.gov/pubmed/23078672?tool=bestpractice.com
[147]Pontes JPM, Santos MDC, Gibram FC, et al. Efficacy and safety of clazosentan after aneurysmal subarachnoid hemorrhage: an updated meta-analysis. Neurosurgery. 2023 Dec 1;93(6):1208-19.
http://www.ncbi.nlm.nih.gov/pubmed/37462365?tool=bestpractice.com
[  ]
What are the effects of endothelin receptor antagonists for people with subarachnoid hemorrhage?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2188/fullMostre-me a resposta Várias organizações recomendam fortemente contra os antagonistas do receptor de endotelina com base nessa falta de benefício e no aumento do risco de eventos adversos.[113]Treggiari MM, Rabinstein AA, Busl KM, et al. Guidelines for the neurocritical care management of aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2023 Aug;39(1):1-28.
http://www.ncbi.nlm.nih.gov/pubmed/37202712?tool=bestpractice.com
Os efeitos adversos mais comuns nos ensaios clínicos de fase 3 incluíram complicações pulmonares relacionadas à retenção de líquido, hipotensão e anemia.[113]Treggiari MM, Rabinstein AA, Busl KM, et al. Guidelines for the neurocritical care management of aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2023 Aug;39(1):1-28.
http://www.ncbi.nlm.nih.gov/pubmed/37202712?tool=bestpractice.com
Entretanto, com base em dois ensaios clínicos japoneses de fase 3 de embolização endovascular e clipagem cirúrgica, o clazosentan foi aprovado no Japão para a prevenção de vasoespasmo, infarto cerebral relacionado ao vasoespasmo e sintomas isquêmicos após HSA aneurismática.[148]Endo H, Hagihara Y, Kimura N, et al. Effects of clazosentan on cerebral vasospasm-related morbidity and all-cause mortality after aneurysmal subarachnoid hemorrhage: two randomized phase 3 trials in Japanese patients. J Neurosurg. 2022 Dec 1;137(6):1707-17.
https://thejns.org/view/journals/j-neurosurg/137/6/article-p1707.xml
http://www.ncbi.nlm.nih.gov/pubmed/35364589?tool=bestpractice.com
Em contraste com a maioria dos outros estudos, o pesquisador descobriu que o uso de clazosentan resultou em uma redução na morbidade e na mortalidade sem achados de segurança inesperados.[148]Endo H, Hagihara Y, Kimura N, et al. Effects of clazosentan on cerebral vasospasm-related morbidity and all-cause mortality after aneurysmal subarachnoid hemorrhage: two randomized phase 3 trials in Japanese patients. J Neurosurg. 2022 Dec 1;137(6):1707-17.
https://thejns.org/view/journals/j-neurosurg/137/6/article-p1707.xml
http://www.ncbi.nlm.nih.gov/pubmed/35364589?tool=bestpractice.com
Os antagonistas do receptor de endotelina não foram aprovados para esta indicação nos EUA e na Europa.
]
What are the effects of endothelin receptor antagonists for people with subarachnoid hemorrhage?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2188/fullMostre-me a resposta Várias organizações recomendam fortemente contra os antagonistas do receptor de endotelina com base nessa falta de benefício e no aumento do risco de eventos adversos.[113]Treggiari MM, Rabinstein AA, Busl KM, et al. Guidelines for the neurocritical care management of aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2023 Aug;39(1):1-28.
http://www.ncbi.nlm.nih.gov/pubmed/37202712?tool=bestpractice.com
Os efeitos adversos mais comuns nos ensaios clínicos de fase 3 incluíram complicações pulmonares relacionadas à retenção de líquido, hipotensão e anemia.[113]Treggiari MM, Rabinstein AA, Busl KM, et al. Guidelines for the neurocritical care management of aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2023 Aug;39(1):1-28.
http://www.ncbi.nlm.nih.gov/pubmed/37202712?tool=bestpractice.com
Entretanto, com base em dois ensaios clínicos japoneses de fase 3 de embolização endovascular e clipagem cirúrgica, o clazosentan foi aprovado no Japão para a prevenção de vasoespasmo, infarto cerebral relacionado ao vasoespasmo e sintomas isquêmicos após HSA aneurismática.[148]Endo H, Hagihara Y, Kimura N, et al. Effects of clazosentan on cerebral vasospasm-related morbidity and all-cause mortality after aneurysmal subarachnoid hemorrhage: two randomized phase 3 trials in Japanese patients. J Neurosurg. 2022 Dec 1;137(6):1707-17.
https://thejns.org/view/journals/j-neurosurg/137/6/article-p1707.xml
http://www.ncbi.nlm.nih.gov/pubmed/35364589?tool=bestpractice.com
Em contraste com a maioria dos outros estudos, o pesquisador descobriu que o uso de clazosentan resultou em uma redução na morbidade e na mortalidade sem achados de segurança inesperados.[148]Endo H, Hagihara Y, Kimura N, et al. Effects of clazosentan on cerebral vasospasm-related morbidity and all-cause mortality after aneurysmal subarachnoid hemorrhage: two randomized phase 3 trials in Japanese patients. J Neurosurg. 2022 Dec 1;137(6):1707-17.
https://thejns.org/view/journals/j-neurosurg/137/6/article-p1707.xml
http://www.ncbi.nlm.nih.gov/pubmed/35364589?tool=bestpractice.com
Os antagonistas do receptor de endotelina não foram aprovados para esta indicação nos EUA e na Europa.
 ]
]
 ]
Várias organizações recomendam fortemente contra os antagonistas do receptor de endotelina com base nessa falta de benefício e no aumento do risco de eventos adversos.[113] Os efeitos adversos mais comuns nos ensaios clínicos de fase 3 incluíram complicações pulmonares relacionadas à retenção de líquido, hipotensão e anemia.[113] Entretanto, com base em dois ensaios clínicos japoneses de fase 3 de embolização endovascular e clipagem cirúrgica, o clazosentan foi aprovado no Japão para a prevenção de vasoespasmo, infarto cerebral relacionado ao vasoespasmo e sintomas isquêmicos após HSA aneurismática.[148] Em contraste com a maioria dos outros estudos, o pesquisador descobriu que o uso de clazosentan resultou em uma redução na morbidade e na mortalidade sem achados de segurança inesperados.[148] Os antagonistas do receptor de endotelina não foram aprovados para esta indicação nos EUA e na Europa.
]
Várias organizações recomendam fortemente contra os antagonistas do receptor de endotelina com base nessa falta de benefício e no aumento do risco de eventos adversos.[113] Os efeitos adversos mais comuns nos ensaios clínicos de fase 3 incluíram complicações pulmonares relacionadas à retenção de líquido, hipotensão e anemia.[113] Entretanto, com base em dois ensaios clínicos japoneses de fase 3 de embolização endovascular e clipagem cirúrgica, o clazosentan foi aprovado no Japão para a prevenção de vasoespasmo, infarto cerebral relacionado ao vasoespasmo e sintomas isquêmicos após HSA aneurismática.[148] Em contraste com a maioria dos outros estudos, o pesquisador descobriu que o uso de clazosentan resultou em uma redução na morbidade e na mortalidade sem achados de segurança inesperados.[148] Os antagonistas do receptor de endotelina não foram aprovados para esta indicação nos EUA e na Europa.