Complicações
O ressangramento é uma complicação importante. A incidência é de 5.7% durante as primeiras 72 horas, e o risco cumulativo se aproxima de 22% a 1 mês após a HSA.[11][12] Os pacientes com sangramento com escore de Fisher modificado de III e IV têm maior probabilidade de apresentarem ressangramento.[94][95][175] O ressangramento é responsável por 8% a 22% da mortalidade e está associado de forma significativa a desfecho desfavorável.[11][12][49]
O uso rotineiro de terapia antifibrinolítica não melhora o desfecho funcional.[37][113] A terapia antifibrinolítica está associada a um aumento do risco de isquemia cerebral.[176][177] Por outro lado, a administração ultra-precoce de terapia antifibrinolítica pode reduzir o risco de ressangramento, mas este efeito não foi consistente entre todos os ensaios.[37][178][179][177] A obliteração imediata do aneurisma roto é o único tratamento comprovadamente efetivo para reduzir a probabilidade de ressangramento e, portanto, a mortalidade precoce.[37]
A hidrocefalia aguda ocorre em 15% a 20% dos pacientes durante as primeiras 72 horas e é uma hidrocefalia obstrutiva.[11][12][180] Sua ocorrência está relacionada à presença de sangue intraventricular e, em menor extensão, a um acúmulo grosso de sangue na cisterna.[180][181] A taxa de mortalidade em pacientes de HSA com hidrocefalia é maior que naqueles sem hidrocefalia.[180]
Em pacientes com HSAa e hidrocefalia sintomática aguda, deve ser realizada a derivação urgente do líquido cefalorraquidiano (LCR) (drenagem ventricular externa [DVE] e/ou drenagem lombar).[37] O uso de antibióticos profiláticos com a DVE não está estabelecido, mas é comumente adotado.[60] Os modos ideais de drenagem do LCR (intermitente vs contínuo), desmame do DVE (rápido vs gradual) e o momento do desmame do DVE (após a estabilização do aneurisma vs momento de risco de vasoespasmo) são incertos.[7][113][182] Não está claro se a fenestração microcirúrgica da lâmina terminal durante a clipagem cirúrgica do aneurisma protege contra a necessidade de um shunt permanente em pacientes com hidrocefalia.[183][Figure caption and citation for the preceding image starts]: Hidrocefalia comunicante no cenário de hemorragia subaracnoide; observe a dilatação do quarto corno e do corno temporal dos ventrículos lateraisCortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends].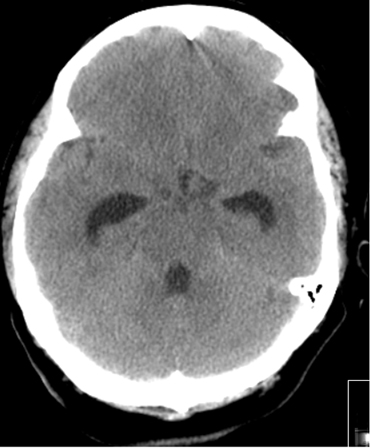
O vasoespasmo é um estreitamento tardio focal ou difuso de vasos de grande capacitância do círculo de Willis. É responsável por 23% dos óbitos relacionados à HSA.[49] A fisiopatologia do vasoespasmo é pouco compreendida, fato comprovado pelo uso de nomenclatura e definições variadas; no entanto, acredita-se que ele seja o resultado de uma vasculopatia tardia e reversível, de uma função autorreguladora insuficiente e de hipovolemia, culminando em uma redução global ou regional da perfusão cerebral, que provoca isquemia quando abaixo de um determinado limiar.[185] Além disso, a baixa hemoglobina pode prejudicar o fornecimento de oxigênio às regiões do cérebro com perfusão precária, agravando ainda mais esse problema.[186][187][188][189][190] A presença de oxiemoglobina no espaço subaracnoide parece ser necessária, e uma resposta inflamatória está implicada na patogênese.[191][192][193]
O vasoespasmo se desenvolve entre os dias 4 e 14 após a HSA e é observado na angiografia em 50% a 70% dos casos. Metade desses pacientes desenvolve deficits isquêmicos tardios (DIT) secundários à redução do fluxo sanguíneo cerebral (FSC) regional ou geral.[194] Se não tratado, o DIT evolui para um infarto cerebral permanente em 50% dos casos. Os deficits isquêmicos também podem ser observados na ausência de vasoespasmo angiográfico distinto. Acredita-se que isso se deva, em parte, à autorregulação alterada de vasos cerebrais distais, microtrombos em tais vasos e/ou despolarização de disseminação cortical.[195] Os fatores de risco para o DIT são mau estado geral no momento da admissão, quantidade e duração da exposição ao sangramento subaracnoide, acúmulos de sangue espesso nas cisternas e fissuras, sangue intraventricular e duração da ausência de consciência.[176][181][196][197][198] Embora a presença de sangue no espaço subaracnoide seja necessária para o desenvolvimento de vasoespasmo, a clipagem cirúrgica, durante a qual a maioria do sangue subaracnoide é lavado, parece não oferecer menos risco de vasoespasmo em relação à embolização endovascular com molas.[199][200][Figure caption and citation for the preceding image starts]: Vasoespasmo grave da artéria carótida interna esquerda distal e das artérias cerebrais média e anterior proximais antes (A) e depois (B) da infusão intra-arterial de nicardipino e da angioplastia transluminal com balãoCortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends].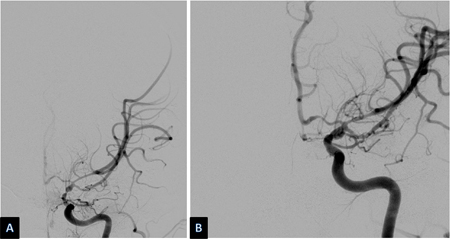 [Figure caption and citation for the preceding image starts]: Infarto frontal esquerdo (setas) em um paciente com vasoespasmo relacionado à hemorragia subaracnoideCortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Infarto frontal esquerdo (setas) em um paciente com vasoespasmo relacionado à hemorragia subaracnoideCortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends].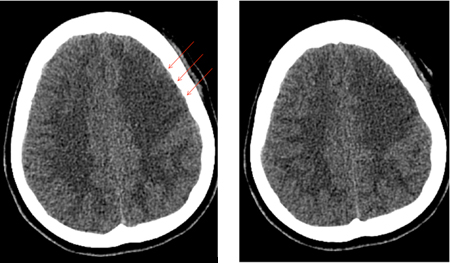
O diagnóstico de DIT é clínico, feito após a exclusão de ressangramento, hidrocefalia, convulsões, desequilíbrios eletrolíticos e outros distúrbios metabólicos. Clinicamente, os pacientes desenvolvem alteração do estado de consciência ou deficits neurológicos focais flutuantes agudos a subagudos.[11][12][192]
No entanto, o diagnóstico pode ser desafiador e, embora exames neurológicos seriados sejam importantes, eles têm valor limitado nos pacientes com HSAa de alto grau.[37] Nos pacientes com suspeita de vasoespasmo ou exame neurológico limitado, a ATG ou perfusão por TC (CTP) pode ser útil para detectar vasoespasmo e predizer uma ICT.[37] A CTP não é invasiva e, vale destacar, mede a perfusão e não somente o diâmetro arterial ou as velocidades de fluxo.[201] A angiotomografia (ATG) e a CTP mostraram uma excelente acurácia no diagnóstico de vasoespasmo. Os escores de vasoespasmo na ATG são preditores diretos de ICT e de um desfecho neurológico desfavorável, e a CTP permite a predição precoce de anormalidades da perfusão.[37] Entretanto, essas técnicas de imagem por TC não permitem uma intervenção terapêutica (por exemplo, angioplastia transluminal com balão e vasodilatadores intra-arteriais) da mesma forma que a angiografia permite.[202] A ATG é altamente correlacionada com a angiografia convencional para vasos intracranianos proximais maiores, com decrescente correlação nas artérias menores e mais distais.[67][203] A ATG mostra alta sensibilidade (91%) para detectar vasoespasmo central quando se desenvolvem sintomas.[37][204] O monitoramento por ultrassonografia com Doppler transcraniano (DTC) é uma técnica de neuromonitoramento à beira do leito não invasiva e segura que permite avaliação repetitiva e dinâmica do vasoespasmo após uma HSA.[37] É razoável usar o DTC para detectar vasoespasmo e predizer uma ICT, mas ele é menos confiável que a angiografia.[37][205][206] O DTC depende do operador, pode ser limitado pela anatomia do paciente (janela do osso temporal insatisfatória) e pode ser afetado por outras medidas fisiológicas (como a frequência cardíaca e a PA).[37][207][208] Nos pacientes com HSAa de alto grau, o monitoramento contínuo por EEG (EEGc) pode ser útil para predizer uma ICT.[37][209]
Em pacientes sem vasoespasmo sintomático, a indução de hipertensão e hipervolemia é potencialmente prejudicial devido à associação com um excesso de morbidade, incluindo edema cerebral, transformação hemorrágica nas áreas de infarto, leucoencefalopatia reversível, infarto do miocárdio e insuficiência cardíaca congestiva.[37][39][106][107][108][109] Em vez disso, a manutenção da euvolemia pode ser benéfica na prevenção de ICT e na melhora dos desfechos funcionais.[37] Entretanto, em pacientes com HSA e vasoespasmo sintomático, a elevação dos valores da PA sistólica pode ser razoável para reduzir a progressão e a gravidade da ICT.[37][210][211] Os pacientes sintomáticos devem ser mantidos hipervolêmicos (pressão venosa central ≥8 cm H₂O) e com hipertensão induzida pelo uso de vasopressores. São usados fluidos isotônicos. A hipertensão deve ser ajustada a uma pressão arterial média (PAM) pelo menos 15% mais alta que a PAM média do paciente, até que ocorra melhora clínica ou efeitos adversos. Os médicos devem estar cientes da possibilidade de desenvolvimento de síndrome de encefalopatia posterior reversível no contexto de uma pressão arterial elevada. Em geral, o diagnóstico é anunciado pela deterioração clínica e confirmado por ressonância nuclear magnética.[212]
O triplo H (hipertensão, hipervolemia e hemodiluição), também conhecido como terapia hipertensiva hipervolêmica (THH) ou hiperdinâmica, é seguro, mesmo em pacientes com doença cardíaca prévia.[194] A melhora clínica pode ser acentuada, mas são necessários grandes estudos prospectivos de desfecho da THH.[108] Uma revisão sistemática de estudos não controlados sugeriu que a hipertensão parece ser mais eficaz no aumento do fluxo sanguíneo cerebral (FSC) que a hemodiluição ou a hipervolemia.[213] Ensaios clínicos randomizados e controlados são difíceis de conduzir, devido à multiplicidade de fatores que afetam o desfecho na HSA.
Técnicas endovasculares, como a angioplastia transluminal com balão e vasodilatadores intra-arteriais, reverterão o estreitamento arterial, apesar da melhora clínica não ser consistente.[214][215] A ASA/AHA recomenda que, nos pacientes com HSAa e vasoespasmo grave, a angioplastia cerebral pode ser razoável para reverter o vasoespasmo cerebral e reduzir a progressão e a gravidade da ICT.[37] Existem algumas evidências que dão suporte à angioplastia precoce (dentro de 2 horas desde o início dos sintomas) para proporcionar uma melhora clínica sustentada.[216] Idade avançada e estado neurológico precário na apresentação são preditivos de um desfecho clínico desfavorável após a angioplastia.[217] O nimodipino enteral, um antagonista do canal de cálcio, é administrado para a profilaxia do vasoespasmo.[37] Ele reduz o risco de um desfecho desfavorável e de isquemia secundária após a HSA aneurismática.[218][219]
[  ]
Apesar de seu uso amplamente difundido, estudos sobre corticosteroides na HSA não conseguiram mostrar efeitos positivos sobre a ICT ou o desfecho em geral.[220] O tirilazade, um varredor de radicais livres esteroide e não glicocorticoide com 21 aminoácidos, foi estudado em vários ensaios clínicos controlados para a prevenção de vasoespasmo. Ele é bem tolerado, mas apresentou efeitos inconsistentes no desfecho geral em diferentes estudos.[221][222][223][224][225]
[
]
Apesar de seu uso amplamente difundido, estudos sobre corticosteroides na HSA não conseguiram mostrar efeitos positivos sobre a ICT ou o desfecho em geral.[220] O tirilazade, um varredor de radicais livres esteroide e não glicocorticoide com 21 aminoácidos, foi estudado em vários ensaios clínicos controlados para a prevenção de vasoespasmo. Ele é bem tolerado, mas apresentou efeitos inconsistentes no desfecho geral em diferentes estudos.[221][222][223][224][225]
[  ]
Estudos investigaram o uso da sinvastatina e da pravastatina na HSA com resultados mistos.[226][227][228][229] O uso rotineiro de terapia com estatinas para melhorar os desfechos não é recomendado.[37] Estudos que investigaram o uso de agentes antiplaquetários na HSA, especialmente após a embolização endovascular com molas, mostraram resultados controversos sobre o risco de ICT e o desfecho em geral. Esses achados controversos, juntamente com um aumento do risco de complicações hemorrágicas, resultaram em uma adoção menos universal dessa prática.[230][231]
[
]
Estudos investigaram o uso da sinvastatina e da pravastatina na HSA com resultados mistos.[226][227][228][229] O uso rotineiro de terapia com estatinas para melhorar os desfechos não é recomendado.[37] Estudos que investigaram o uso de agentes antiplaquetários na HSA, especialmente após a embolização endovascular com molas, mostraram resultados controversos sobre o risco de ICT e o desfecho em geral. Esses achados controversos, juntamente com um aumento do risco de complicações hemorrágicas, resultaram em uma adoção menos universal dessa prática.[230][231]
[  ]
[Figure caption and citation for the preceding image starts]: Espasmo das artérias basilar e vertebral esquerdas distais antes (à esquerda) e depois (à direita) da infusão intra-arterial de nicardipinoCortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends].
]
[Figure caption and citation for the preceding image starts]: Espasmo das artérias basilar e vertebral esquerdas distais antes (à esquerda) e depois (à direita) da infusão intra-arterial de nicardipinoCortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends].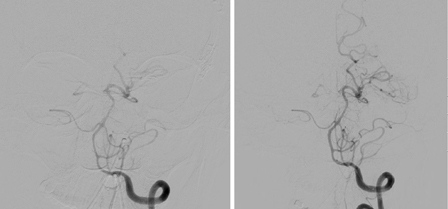
O efeito de compostos farmacológicos com formas de liberação controlada no vasoespasmo e no DIT tem atraído muito interesse. Implantes de nicardipino de liberação prolongada são colocados no espaço subaracnoide no momento da clipagem cirúrgica do aneurisma. Uma pequena série de casos e um ensaio clínico randomizado duplo-cego usando tais implantes relataram uma incidência de DIT menor que a esperada.[232][233][234][235]
Outros medicamentos usados em um sistema intracraniano de liberação controlada incluem a papaverina, o fasudil e doadores de óxido nítrico.[236] São necessários ensaios clínicos controlados mais amplos antes do uso disseminado dessa técnica. A papaverina, embora seja um vasodilatador historicamente efetivo, é geralmente evitada devido ao risco de neurotoxicidade.[37][237] O uso de agentes trombolíticos gotejados durante a cirurgia e/ou após a estabilização do aneurisma no espaço intratecal poderia ser benéfico. Eles eliminam o sangue do espaço subaracnoide necessário para o desenvolvimento do vasoespasmo. Uma metanálise concluiu que embora esses compostos pudessem melhorar o desfecho, os estudos analisados apresentavam limitações, incluindo um risco considerável de viés.[238] Outra intervenção que elimina o sangue do espaço subaracnoide é a drenagem lombar (DL) do líquido espinhal. Ensaios de DL mostram um benefício na incidência de vasoespasmo e ICT, mas nenhum efeito nos desfechos funcionais ou mortalidade em 6 meses.[239] Estudos sobre outras formas de administração intracraniana de nicardipino (intratecal, intraventricular e intracisternal) produziram resultados mistos. Na ausência de ensaios clínicos randomizados e controlados positivos, essas formas alternativas de administração intracraniana são reservadas para casos graves de vasoespasmo e ICT quando houve fracasso da terapia.[235]
Não se sabe se o vasoespasmo angiográfico assintomático precisa ser tratado.[240] Exceto em um estudo retrospectivo com o uso de albumina, a expansão de volume profilática em pacientes assintomáticos não conseguiu mostrar um impacto sobre o desfecho.[107][108][241]
Arritmias e alterações no eletrocardiograma (ECG) inespecíficas são comuns.[44][49][50][51] Anormalidades na contratilidade da parede ventricular ocorrem em 27% dos pacientes. Um padrão poupador do ápice é observado em metade dos pacientes afetados. Essas anormalidades raramente causam insuficiência cardíaca e quase sempre são reversíveis.[47][242][243][Figure caption and citation for the preceding image starts]: Eletrocardiograma (ECG) realizado no momento da internação de um paciente com hemorragia subaracnoide; observe as ondas T altas e com picos (1 de 2)Cortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Mesmo paciente, 24 horas depois; observe a normalização das ondas T (2 de 2)Cortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Mesmo paciente, 24 horas depois; observe a normalização das ondas T (2 de 2)Cortesia do Dr. Salah Keyrouz; usado com permissão [Citation ends].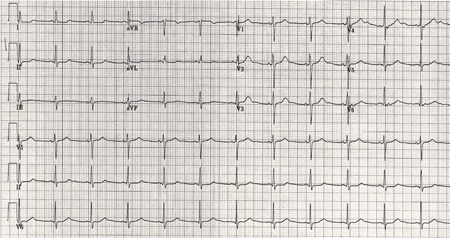
O tratamento da insuficiência cardíaca é de suporte. Betabloqueadores podem ser administrados para alterações no ECG do tipo isquêmico, acompanhadas pela liberação de troponinas; no entanto, não há evidências para dar suporte a esta prática.
Edema pulmonar ocorre em até 23% dos pacientes.
O edema pulmonar é grave, exigindo suporte ventilatório em 6% dos casos.
É controverso o fato de ela ser um preditor independente do desfecho ou se simplesmente está associada à gravidade da HSA.[244][245][246][247]
A hiperglicemia à internação, durante a cirurgia para o aneurisma ou dentro de 72 horas após a apresentação da HSA tem sido associada a vasoespasmo, isquemia cerebral tardia, desfechos funcionais desfavoráveis em curto e longo prazos e risco de morte tanto em pacientes com diabetes quanto nos sem diabetes em vários estudos.[37][247][248][249][250] A AHA/ASA recomenda que, em pacientes com HSA, o controle glicêmico efetivo, o manejo rigoroso da hiperglicemia e a prevenção da hipoglicemia são razoáveis para melhorar o desfecho.[37] No entanto, os dados são conflitantes sobre qual limiar glicêmico deve ser almejado, quais intensidades de monitoramento e tratamento devem ser utilizadas e se tudo isso afeta o desfecho.[37] Resta determinar se o controle glicêmico rigoroso pode levar a hipoglicemia ou crise metabólica sistêmica ou cerebral em no cérebro gravemente lesado e potencialmente agravar a lesão cerebral e o desfecho.[37] Até que existam evidências mais consistentes em relação ao tratamento da hiperglicemia na HSA, os médicos devem se abster de certas estratégias de manejo agressivo (ou seja, infusão contínua de insulina) como utilizadas em pacientes em estado crítico.[251]
Estudos recentes utilizando monitoramento por EEG sugerem uma incidência de convulsões de 7.8% a 15.2%.[37][170][171][172] A incidência cumulativa de epilepsia (definida como 2 ou mais convulsões não provocadas) é de 12% a 5 anos.[173] Ela está associada de modo independente a recuperação funcional e qualidade de vida desfavoráveis.[172][174] O risco de convulsões é significativamente mais baixo após a embolização com molas do que após a clipagem cirúrgica do aneurisma.[37]
Os fatores de risco para o desenvolvimento de convulsões precoces associadas à HSA incluem grau clínico (grau Hunt e Hess [HH] ≥3), presença de aneurisma na artéria cerebral média e hidrocefalia.[37] O monitoramento contínuo por EEG (EEGc) é razoável para detectar convulsões nos pacientes com HSA e exame neurológico flutuante, estado mental deprimido, aneurisma roto da artéria cerebral média (ACM), HSA de alto grau, hemorragia intracraniana (HIC), hidrocefalia ou infarto cortical.[37]
O uso profilático de anticonvulsivantes após a HSA é controverso.[114][115]
As diretrizes dos EUA sugerem que anticonvulsivantes profiláticos podem ser considerados nos pacientes com HSA e características de alto risco para convulsão (ou seja, aneurisma roto da ACM, HSA de alto grau, HIC, hidrocefalia e infarto cortical).[37] Essas diretrizes não recomendam o uso rotineiro de anticonvulsivantes em pacientes com HSA sem características de alto risco para convulsão, uma vez que a fenitoína para prevenção de convulsões e/ou profilaxia de convulsões está associada a excessos de morbidade e mortalidade.[37][88][116] O tratamento de curta duração pode ser uma profilaxia adequada, e algumas evidências sugerem que ele é melhor tolerado do que uma duração maior.[87][117] O uso rotineiro de anticonvulsivantes em longo prazo não é recomendado, mas pode ser considerado nos pacientes com fatores de risco conhecidos para transtorno convulsivo tardio.[37] Nos pacientes com HSA que se apresentam com convulsões, o tratamento com anticonvulsivantes por ≤7 dias é razoável para reduzir complicações relacionadas às convulsões no período perioperatório.[37] Em pacientes com HSA sem epilepsia prévia que apresentam convulsões, o tratamento com anticonvulsivantes além de 7 dias não é efetivo para reduzir o risco futuro de convulsões associadas à HSA.[37][39][114]
Na unidade de terapia intensiva neurológica (UTIN), a febre parece ser um preditor independente de desfecho desfavorável.[37] Ela está associada a uma internação mais prolongada tanto na UTI quanto no hospital.[252] O cateterismo intraventricular é um fator de risco para a febre inexplicada na UTIN. A HSA aumenta o risco de desenvolvimento de febre infecciosa e inexplicada, o que poderia estar associado a um desfecho pior.[253][254] Deve-se sempre buscar por uma etiologia infecciosa. Amostras de sangue, escarro, urina e líquido cefalorraquidiano (se aplicável) devem ser obtidas para cultura e coloração de Gram.
Se ocorrer febre, os antibióticos deverão ser suspensos até que existam evidências claras de uma infecção. Em pacientes com HSA com febre refratária a medicamentos antipiréticos, a eficácia do manejo terapêutico da temperatura (TTM), como tratamento farmacológico, dispositivos de resfriamento de superfície com ou sem ciclo de feedback e dispositivos endovasculares de embolização com molas durante a fase aguda da HSAa, é incerta.[37][255][256] É razoável considerar atingir a normotermia durante uma lesão cerebral ativa ou em andamento, ao mesmo tempo em que considera as consequências do MTT. O MTT pode estar associado a complicações como tremores, necessitando de controle farmacológico. O tremor deve ser monitorado e controlado para limitar o risco de lesões secundárias.[37][257]
Mais de 50% dos sobreviventes relatam problemas de comprometimento cognitivo (por exemplo, problemas de humor e memória), resultando em impacto negativo no estado funcional, na saúde emocional e na qualidade de vida.[160][161] A depressão pode ocorrer em cerca de um terço dos sobreviventes de HSAa; ansiedade e transtorno do estresse pós-traumático podem ser observados em 15% a 20% dos pacientes.[258][259][260] Recomenda-se o uso de escores de classificação validados ou medidas de desfechos relatados pelo paciente antes da alta hospitalar para rastrear para deficits físicos, cognitivos, comportamentais e de qualidade de vida.[37] Recomenda-se o uso de ferramentas de rastreamento validadas no período pós-agudo para identificar uma disfunção cognitiva; é razoável escolher a Avaliação Cognitiva de Montreal (Montreal Cognitive Assessment, MoCA) em vez do Miniexame do Estado Mental (Mini-Mental State Examination, MEEM) para identificar o comprometimento cognitivo.[37] Nos pacientes com depressão, recomendam-se psicoterapia e farmacoterapia para reduzir os sintomas.[37]
A mortalidade intra-hospitalar é de cerca de 20%, com a mortalidade por todas as causas aumentando para 25% em 6 meses após a HSA. Em um estudo, 35% dos pacientes estavam "mortos ou incapacitados" (definido como Escala de Rankin modificada ≥4) em 6 meses.[159]
A hidrocefalia crônica é uma complicação bem conhecida após a HSA aneurismática, que ocorre em >20% dos pacientes.[184] Nos pacientes com HSAa e hidrocefalia sintomática crônica associada, recomenda-se a derivação permanente do LCR para melhorar o desfecho neurológico.[37] A fenestração de rotina da lâmina terminal não é indicada para reduzir a taxa de dependência de derivação.[37][183]
O uso deste conteúdo está sujeito ao nosso aviso legal