O melanoma inicial pode ser assintomático. A história de uma lesão pigmentada nova ou que apresenta alteração deve ser obtida.
História
As perguntas devem se concentrar em quando a lesão foi observada pela primeira vez, embora aproximadamente 25% a 42% dos melanomas surjam de um nevo melanocítico preexistente, do qual muitos não suspeitam.[19]Greene MH, Clark WH Jr, Tucker MA, et al. Acquired precursors of cutaneous malignant melanoma: the familial dysplastic nevus syndrome. N Engl J Med. 1985 Jan 10;312(2):91-7.
http://www.ncbi.nlm.nih.gov/pubmed/3964923?tool=bestpractice.com
[20]Weatherhead SC, Haniffa M, Lawrence CM. Melanomas arising from naevi and de novo melanomas - does origin matter? Br J Dermatol. 2007 Jan;156(1):72-6.
http://www.ncbi.nlm.nih.gov/pubmed/17199569?tool=bestpractice.com
[21]Shitara D, Nascimento MM, Puig S, et al. Nevus-associated melanomas: clinicopathologic features. Am J Clin Pathol. 2014 Oct;142(4):485-91.
https://academic.oup.com/ajcp/article/142/4/485/1766613
http://www.ncbi.nlm.nih.gov/pubmed/25239415?tool=bestpractice.com
Outra pergunta útil está relacionada à mudança de tamanho, formato, coloração ou ulceração da lesão. Se a lesão for pruriginosa ou estiver sangrando, haverá uma grande suspeita.[50]Abbasi NR, Shaw HM, Rigel DS, et al. Early diagnosis of cutaneous melanoma: revisiting the ABCD criteria. JAMA. 2004 Dec 8;292(22):2771-6.
http://www.ncbi.nlm.nih.gov/pubmed/15585738?tool=bestpractice.com
Crescimentos sem nenhuma história de lesão pigmentada são descritos como melanomas nodulares, amelanóticos ou desmoplásicos.
Alguns marcadores ajudam a identificar os pacientes com risco elevado:[15]Colantonio S, Bracken MB, Beecker J. The association of indoor tanning and melanoma in adults: systematic review and meta-analysis. J Am Acad Dermatol. 2014 May;70(5):847-57.
http://www.ncbi.nlm.nih.gov/pubmed/24629998?tool=bestpractice.com
[17]Gandini S, Sera F, Cattaruzza MS, et al. Meta-analysis of risk factors for cutaneous melanoma: III. Family history, actinic damage and phenotypic factors. Eur J Cancer. 2005 Sep;41(14):2040-59.
http://www.ncbi.nlm.nih.gov/pubmed/16125929?tool=bestpractice.com
[33]English DR, Armstrong BK, Kricker A, et al. Sunlight and cancer. Cancer Causes Control. 1997 May;8(3):271-83.
http://www.ncbi.nlm.nih.gov/pubmed/9498892?tool=bestpractice.com
[35]Gilchrest BA, Eller MS, Geller AC, et al. The pathogenesis of melanoma induced by ultraviolet radiation. N Engl J Med. 1999 Apr 29;340(17):1341-8.
http://www.ncbi.nlm.nih.gov/pubmed/10219070?tool=bestpractice.com
[36]Elwood JM, Jospson J. Melanoma and sun exposure: an overview of published studies. Int J Cancer. 1997 Oct 9;73(2):198-203.
http://www.ncbi.nlm.nih.gov/pubmed/9335442?tool=bestpractice.com
[39]van der Leest RJ, Liu L, Coebergh JW, et al. Risk of second primary in situ and invasive melanoma in a Dutch population-based cohort: 1989-2008. Br J Dermatol. 2012 Dec;167(6):1321-30.
http://www.ncbi.nlm.nih.gov/pubmed/22759226?tool=bestpractice.com
[40]Greene MH, Clark WH Jr, Tucker MA, et al. High risk of malignant melanoma in melanoma-prone families with dysplastic nevi. Ann Intern Med. 1985 Apr;102(4):458-65.
http://www.ncbi.nlm.nih.gov/pubmed/3977193?tool=bestpractice.com
[41]Gandini S, Sera F, Cattaruzza MS, et al. Meta-analysis of risk factors for cutaneous melanoma: I. Common and atypical naevi. Eur J Cancer. 2005 Jan;41(1):28-44.
https://www.ejcancer.com/article/S0959-8049(04)00832-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/15617989?tool=bestpractice.com
[42]Kanzler MH, Mraz-Gernhard S. Primary cutaneous malignant melanoma and its precursor lesions: diagnostic and therapeutic overview. J Am Acad Dermatol. 2001 Aug;45(2):260-76.
http://www.ncbi.nlm.nih.gov/pubmed/11464189?tool=bestpractice.com
[44]Swerdlow AJ, English JS, Qiao Z. The risk of melanoma in patients with congenital nevi: a cohort study. J Am Acad Dermatol. 1995 Apr;32(4):595-9.
http://www.ncbi.nlm.nih.gov/pubmed/7896948?tool=bestpractice.com
[45]Olsen CM, Knight LL, Green AC. Risk of melanoma in people with HIV/AIDS in the pre- and post-HAART eras: a systematic review and meta-analysis of cohort studies. PLoS One. 2014 Apr 16;9(4):e95096.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3989294
http://www.ncbi.nlm.nih.gov/pubmed/24740329?tool=bestpractice.com
[46]Robbins HA, Clarke CA, Arron ST, et al. Melanoma risk and survival among organ transplant recipients. J Invest Dermatol. 2015 Nov;135(11):2657-65.
https://www.jidonline.org/article/S0022-202X(15)41852-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/26270022?tool=bestpractice.com
[47]Kraemer KH, Lee MM, Scotto J. Xeroderma pigmentosum. Cutaneous, ocular, and neurologic abnormalities in 830 published cases. Arch Dermatol. 1987 Feb;123(2):241-50.
http://www.ncbi.nlm.nih.gov/pubmed/3545087?tool=bestpractice.com
[51]Psaty EL, Scope A, Halpern AC, et al. Defining the patient at high risk for melanoma. Int J Dermatol. 2010 Apr;49(4):362-76.
https://onlinelibrary.wiley.com/doi/10.1111/j.1365-4632.2010.04381.x/full
http://www.ncbi.nlm.nih.gov/pubmed/20465687?tool=bestpractice.com
História pessoal ou familiar de melanoma
História pessoal de câncer de pele (inclusive danos actínicos)
Tipo de pele I ou II (pele branca) de Fitzpatrick
Olhos claros
Alta densidade de sardas
Cabelo ruivo ou louro
Uso prévio de câmara de bronzeamento
História de queimaduras solares na infância
Grande número de nevos melanocíticos
Presença de nevos melanocíticos atípicos (anteriormente chamados nevos displásicos)
Presença de nevos melanocíticos congênitos grandes (>20 cm)
Síndromes genéticas com predisposição a câncer de pele (por exemplo, xeroderma pigmentoso)
Imunossupressão (ou seja, medicamentos imunossupressores, história de terapia extensa com psoraleno + raios ultravioleta A [PUVA] ou HIV).
Sintomas constitucionais, como tosse, perda de peso, fadiga, sudorese noturna e cefaleia, podem ser sintomas de metástase sistêmica em um paciente com história de melanoma.
[Figure caption and citation for the preceding image starts]: Classificação do tipo de pele de FitzpatrickCriado pelo BMJ Knowledge Centre [Citation ends].
Exame físico
Os pacientes devem submeter-se a um exame físico completo da superfície inteira da pele, incluindo o couro cabeludo e as membranas mucosas.
O mnemônico de sinais de melanoma ABCD (Assimetria, Borda, Cor e Diâmetro) da American Cancer Society é útil para detecção precoce de melanoma por médicos e pacientes.[52]McGovern TW, Litaker MS. Clinical predictors of malignant pigmented lesions. A comparison of the Glasgow seven-point checklist and the American Cancer Society's ABCDs of pigmented lesions. J Dermatol Surg Oncol. 1992 Jan;18(1):22-6.
http://www.ncbi.nlm.nih.gov/pubmed/1740563?tool=bestpractice.com
A adição da letra E para "evolução" tem sido proposta para aumentar a sensibilidade e a especificidade do diagnóstico com o uso da regra do ABCD.[50]Abbasi NR, Shaw HM, Rigel DS, et al. Early diagnosis of cutaneous melanoma: revisiting the ABCD criteria. JAMA. 2004 Dec 8;292(22):2771-6.
http://www.ncbi.nlm.nih.gov/pubmed/15585738?tool=bestpractice.com
Assimetria da lesão
Borda irregular
Cor variável
Diâmetro >6 mm
Evolução.
Foi reportada uma especificidade de 0.88 e uma sensibilidade de 0.73 para o melanoma, se forem observadas 2 de 3 das características a seguir: contorno irregular, diâmetro >6 mm e variação da cor.[52]McGovern TW, Litaker MS. Clinical predictors of malignant pigmented lesions. A comparison of the Glasgow seven-point checklist and the American Cancer Society's ABCDs of pigmented lesions. J Dermatol Surg Oncol. 1992 Jan;18(1):22-6.
http://www.ncbi.nlm.nih.gov/pubmed/1740563?tool=bestpractice.com
Além dos ABCDEs do melanoma, qualquer lesão melanocítica que tenha aparência atípica com relação aos sinais circundantes do paciente deve levantar suspeitas. Esse achado foi denominado "sinal do patinho feio".[50]Abbasi NR, Shaw HM, Rigel DS, et al. Early diagnosis of cutaneous melanoma: revisiting the ABCD criteria. JAMA. 2004 Dec 8;292(22):2771-6.
http://www.ncbi.nlm.nih.gov/pubmed/15585738?tool=bestpractice.com
[53]Grob JJ, Bonerandi JJ. The ugly duckling sign: identification of the common characteristics of nevi in an individual as a basis for melanoma screening. Arch Dermatol. 1998 Jan;134(1):103-4.
http://www.ncbi.nlm.nih.gov/pubmed/9449921?tool=bestpractice.com
Lesões de melanoma precoce, principalmente aquelas que acometem partes expostas ao sol e locais nas extremidades, podem ser completamente maculares.[Figure caption and citation for the preceding image starts]: Melanoma com disseminação superficialDo acervo pessoal do Dr. Hobart Walling e Dr. Brian Swick. [Citation ends].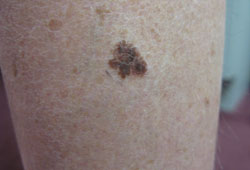 Entretanto, com a progressão, elas geralmente desenvolvem um componente papular ou nodular.[Figure caption and citation for the preceding image starts]: Melanoma nodularDo acervo pessoal do Dr. Hobart Walling e Dr. Brian Swick. [Citation ends].
Entretanto, com a progressão, elas geralmente desenvolvem um componente papular ou nodular.[Figure caption and citation for the preceding image starts]: Melanoma nodularDo acervo pessoal do Dr. Hobart Walling e Dr. Brian Swick. [Citation ends].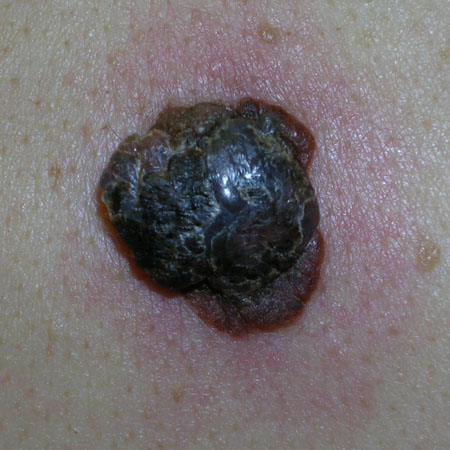
Melanomas com características atípicas, como aqueles que não têm pigmento (melanomas amelanóticos) ou que se parecem com ceratoses seborreicas, podem ser difíceis de diagnosticar sem um alto índice de suspeita.
Os melanomas nodulares tendem a crescer rapidamente e, com frequência, não seguem os critérios do ABCD.[54]Kalkhoran S, Milne O, Zalaudek I, et al. Historical, clinical, and dermoscopic characteristics of thin nodular melanoma. Arch Dermatol. 2010 Mar;146(3):311-8.
https://jamanetwork.com/journals/jamadermatology/fullarticle/209659
http://www.ncbi.nlm.nih.gov/pubmed/20231503?tool=bestpractice.com
No contexto de faixas pigmentadas no leito ungueal e na matriz (melanoníquia estriada), a extensão do pigmento na dobra ungueal, proximal ou lateral é conhecida como sinal de Hutchinson e é preocupante no que se refere ao melanoma.[55]Ronger S, Touzet S, Ligeron C, et al. Dermoscopic examination of nail pigmentation. Arch Dermatol. 2002 Oct;138(10):1327-33.
http://www.ncbi.nlm.nih.gov/pubmed/12374538?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Melanoma subungueal in situDo acervo pessoal do Dr. Hobart Walling e Dr. Brian Swick. [Citation ends].
Massas subcutâneas entre a lesão cutânea e o grupo de linfonodos drenantes devem levantar suspeita clínica de metástases em trânsito (intralinfáticas). A linfadenopatia fixa é preocupante com relação à metástase nodal regional.
Dermatoscopia
No Reino Unido, recomenda-se que qualquer lesão suspeita de melanoma ao exame físico seja avaliada posteriormente com dermatoscopia.[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
[57]Koblinski JE, Ahrns HT, Morse MJ, et al. Dermoscopy for the identification of amelanotic acral melanoma. J Am Podiatr Med Assoc. 2022 Mar 16;112(1):20-184.
https://www.doi.org/10.7547/20-184
http://www.ncbi.nlm.nih.gov/pubmed/36459055?tool=bestpractice.com
[58]Williams NM, Rojas KD, Reynolds JM, et al. Assessment of diagnostic accuracy of dermoscopic structures and patterns used in melanoma detection: a systematic review and meta-analysis. JAMA Dermatol. 2021 Sep 1;157(9):1078-88.
https://jamanetwork.com/journals/jamadermatology/fullarticle/2782522
http://www.ncbi.nlm.nih.gov/pubmed/34347005?tool=bestpractice.com
[59]Lan J, Wen J, Cao S, et al. The diagnostic accuracy of dermoscopy and reflectance confocal microscopy for amelanotic/hypomelanotic melanoma: a systematic review and meta-analysis. Br J Dermatol. 2020 Aug;183(2):210-9.
http://www.ncbi.nlm.nih.gov/pubmed/31747045?tool=bestpractice.com
Nos EUA, a biópsia de pele é o método preferencial para avaliação adicional das lesões suspeitas.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Na avaliação dermatoscópica, a lesão cutânea geralmente é coberta com um líquido de imersão. A lesão cutânea é inspecionada com uma lente de aumento manual conectada a uma fonte luminosa. Os dermatoscópios com fonte de luz polarizada não requerem líquido de imersão.
A função mais importante da dermatoscopia é realizar a distinção entre melanoma e lesões melanocíticas benignas. Entretanto, a técnica também é útil para distinguir lesões melanocíticas de lesões pigmentadas não melanocíticas, como ceratoses seborreicas, carcinomas basocelulares pigmentados e lesões vasculares.
[Figure caption and citation for the preceding image starts]: Dermatoscopia: a função mais importante da dermatoscopia é realizar a distinção entre melanoma e lesões melanocíticas benignas© DermNet New Zealand; usado com permissão [Citation ends].
O uso da dermatoscopia, por profissionais treinados, resulta em maior precisão diagnóstica em comparação com o exame a olho nu isoladamente.[60]Vestergaard ME, Macaskill P, Holt PE, et al. Dermoscopy compared with naked eye examination for the diagnosis of primary melanoma: A meta-analysis of studies performed in a clinical setting. Br J Dermatol. 2008 Sep;159(3):669-76.
http://www.ncbi.nlm.nih.gov/pubmed/18616769?tool=bestpractice.com
Utilizando a dermatoscopia, a sensibilidade não absoluta para o diagnóstico de melanoma aumentou em 19% (83.2% com dermoscopia versus 69.6% sem dermoscopia).[61]Menzies SW, Zalaudek I. Why perform dermoscopy? The evidence for its role in the routine management of pigmented skin lesions. Arch Dermatol. 2006 Sep;142(9):1211-2.
http://www.ncbi.nlm.nih.gov/pubmed/16983009?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Principais características dermatoscópicas do melanoma: (A) melanoma que se manifesta com glóbulos e pontos atípicos de diferentes tamanhos e formas (setas amarelas), áreas irregulares de rede atípica (seta de ponta azul) e véu branco-azulado (seta azul). (B) Melanoma com vasculatura polimorfa difusa, que consiste em vasos com formato de serpentina, pontilhados e glomerulares, e pode ser encontrada em toda a lesão (setas de ponta amarela); além disso, são observadas áreas irregulares de rede atípica (setas de ponta azul). (C) Melanoma com disseminação superficial com pseudópodes distribuídos assimetricamente ao redor da lesão (setas de ponta preta). (D) Melanoma com a estrutura de regressão cinza-azulada polvilhada (asterisco preto); também são observadas linhas brancas brilhantes em toda a lesão (setas vermelhas) com um véu branco-azulado central (seta de ponta vermelha).Wolner ZJ et al. Enhancing skin cancer diagnosis with dermoscopy. Dermatol Clin. 2017 Oct;35(4):417-37; usado com permissão [Citation ends].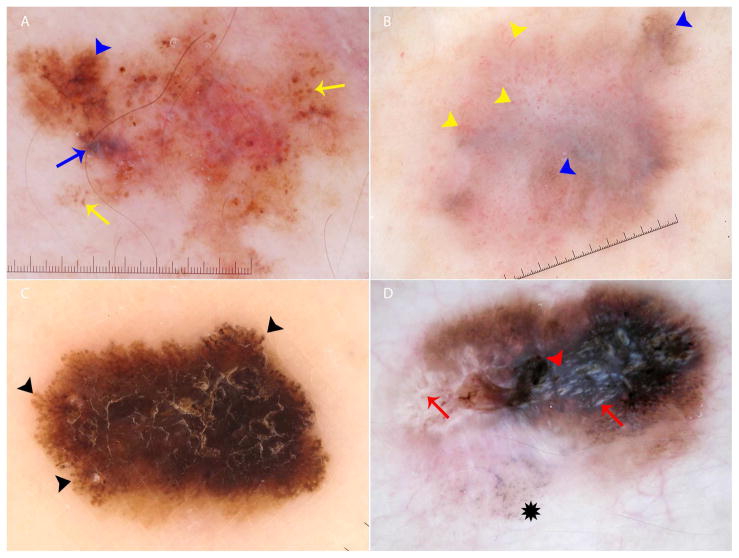
Biópsia de pele
A análise histopatológica de uma lesão pigmentada atípica nova ou em mudança é essencial no diagnóstico. Toda lesão suspeita deve ser submetida à biópsia. A excisão de lesões pigmentadas permite que o dermatopatologista faça um diagnóstico preciso do melanoma. Além disso, ela influencia no prognóstico e na extensão de uma cirurgia adicional ou de outro tratamento.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
O manejo ideal é uma excisão completa da lesão em espessura total com uma margem de 1-3 mm.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
[62]Amin MB, Edge S, Greene F, et al, eds. AJCC cancer staging manual. 8th ed. New York, NY: Springer; 2017. A biópsia incisional ou por punção da espessura total da porção clinicamente mais espessa ou mais atípica da lesão é aceitável e pode ser preferencial em certas áreas anatômicas (por exemplo, palmas/solas, dígitos, rosto, orelhas), ou para as lesões muito grandes. Biópsias "exploratórias" múltiplas 3podem ajudar a orientar o tratamento das lesões muito grandes.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
A biópsia de pele confirma o diagnóstico de melanoma e fornece informações prognósticas. Os indicadores de prognóstico incluem a espessura do tumor medida como espessura de Breslow (profundidade da invasão medida em milímetros, do topo da camada celular granular até o ponto de penetração mais profundo do tumor na derme ou na tela subcutânea), ulceração, contagem mitótica, invasão vascular e satélites microscópicos.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
[63]Breslow A. Thickness, cross-sectional areas and depth of invasion in the prognosis of cutaneous melanoma. Ann Surg. 1970 Nov;172(5):902-8.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1397358
http://www.ncbi.nlm.nih.gov/pubmed/5477666?tool=bestpractice.com
Um prognóstico desfavorável está associado à maior profundidade de invasão, ulceração, maior contagem mitótica, invasão vascular, regressão e presença de satélites microscópicos.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Imuno-histoquímica
A imuno-histoquímica é cada vez mais utilizada para interpretar biópsias que não são facilmente classificadas com base em características histopatológicas.[64]Davis LE, Shalin SC, Tackett AJ. Current state of melanoma diagnosis and treatment. Cancer Biol Ther. 2019;20(11):1366-79.
https://www.tandfonline.com/doi/full/10.1080/15384047.2019.1640032
http://www.ncbi.nlm.nih.gov/pubmed/31366280?tool=bestpractice.com
[65]Dinehart MS, Dinehart SM, Sukpraprut-Braaten S, et al. Immunohistochemistry utilization in the diagnosis of melanoma. J Cutan Pathol. 2020 May;47(5):446-50.
http://www.ncbi.nlm.nih.gov/pubmed/31955450?tool=bestpractice.com
Pode ajudar a distinguir lesões melanocíticas de tumores de origem diferente e lesões melanocíticas benignas de malignas.[66]Ivan D, Prieto VG. Use of immunohistochemistry in the diagnosis of melanocytic lesions: applications and pitfalls. Future Oncol. 2010 Jul;6(7):1163-75.
http://www.ncbi.nlm.nih.gov/pubmed/20624128?tool=bestpractice.com
Os marcadores melanocíticos que podem ser usados na análise imuno-histoquímica incluem Melan-A/MART-1, S-100, FTMI, tirosinase, HMB45, SOX10 e PRAME.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
[64]Davis LE, Shalin SC, Tackett AJ. Current state of melanoma diagnosis and treatment. Cancer Biol Ther. 2019;20(11):1366-79.
https://www.tandfonline.com/doi/full/10.1080/15384047.2019.1640032
http://www.ncbi.nlm.nih.gov/pubmed/31366280?tool=bestpractice.com
[67]Garbe C, Amaral T, Peris K, et al. European consensus-based interdisciplinary guideline for melanoma. Part 1: diagnostics - update 2022. Eur J Cancer. 2022 Jul:170:236-55.
https://www.ejcancer.com/article/S0959-8049(22)00152-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35570085?tool=bestpractice.com
[68]Lezcano C, Jungbluth AA, Busam KJ. Immunohistochemistry for PRAME in dermatopathology. Am J Dermatopathol. 2023 Nov 1;45(11):733-47.
http://www.ncbi.nlm.nih.gov/pubmed/37856737?tool=bestpractice.com
Análise genômica do melanoma
Serve para identificar mutações genéticas comuns associadas ao melanoma. Cada vez mais, perfis genéticos são realizados para testar mutações de interesse.
análise mutacional em BRAF
Aproximadamente 40% dos melanomas contêm uma mutação ativadora no gene BRAF, mais comumente na posição V600. A troca de uma valina por glutamato no códon 600 (V600E) é responsável por 75% a 90% das mutações em BRAF no melanoma. Outras mutações menos comuns incluem a troca de valina por lisina (V600K) em 10% a 30% das mutações em BRAF e a troca de valina por arginina (V600R) em 1% a 3% dos casos. Essas mutações causam a ativação constitutiva da proteína quinase ativada por mitógenos que sinaliza a via.[26]Long GV, Menzies AM, Nagrial AM, et al. Prognostic and clinicopathologic associations of oncogenic BRAF in metastatic melanoma. J Clin Oncol. 2011 Apr 1;29(10):1239-46.
http://ascopubs.org/doi/full/10.1200/jco.2010.32.4327
http://www.ncbi.nlm.nih.gov/pubmed/21343559?tool=bestpractice.com
[27]Jakob JA, Bassett RL Jr, Ng CS, et al. NRAS mutation status is an independent prognostic factor in metastatic melanoma. Cancer. 2012 Aug 15;118(16):4014-23.
http://onlinelibrary.wiley.com/doi/10.1002/cncr.26724/full
http://www.ncbi.nlm.nih.gov/pubmed/22180178?tool=bestpractice.com
[28]Menzies AM, Haydu LE, Visintin L, et al. Distinguishing clinicopathologic features of patients with V600E and V600K BRAF-mutant metastatic melanoma. Clin Cancer Res. 2012 Jun 15;18(12):3242-9.
https://clincancerres.aacrjournals.org/content/18/12/3242.long
http://www.ncbi.nlm.nih.gov/pubmed/22535154?tool=bestpractice.com
As recomendações para a análise mutacional do BRAF variam de acordo com o país. Geralmente, é realizado em pacientes que necessitarão de terapia sistêmica e naqueles com alto risco de recorrência para os quais a terapia futura direcionada ao BRAF pode ser apropriada.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
No Reino Unido, a imuno-histoquímica é recomendada como teste inicial para BRAF V600E, se disponível.[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Ela é rápida, com alta sensibilidade e especificidade para a mutação V600E em BRAF.[69]Long GV, Wilmott JS, Capper D, et al. Immunohistochemistry is highly sensitive and specific for the detection of V600E BRAF mutation in melanoma. Am J Surg Pathol. 2013 Jan;37(1):61-5.
http://www.ncbi.nlm.nih.gov/pubmed/23026937?tool=bestpractice.com
Se a imuno-histoquímica for inconclusiva ou negativa, um teste genético em BRAF diferente deverá ser tentado.[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Está disponível um ensaio molecular automatizado para identificar as mutações em BRAF na posição V600, mas ele detecta prontamente apenas a mutação V600E.[70]Chapman PB, Hauschild A, Robert C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med. 2011 Jun 30;364(26):2507-16.
http://www.nejm.org/doi/full/10.1056/NEJMoa1103782#t=article
http://www.ncbi.nlm.nih.gov/pubmed/21639808?tool=bestpractice.com
Várias outras plataformas, incluindo pirossequenciamento, sequenciamento de última geração e sequenciamento de Sanger, detectam todas as mutações V600 conhecidas.
Todos os pacientes com teste positivo para mutação V600 em BRAF são elegíveis para terapia com inibidores de BRAF/MEK.
Análise de mutação em NRAS
Mutações em NRAS ativam as vias da proteína quinase ativada por mitógenos (MAPK) e fosfatidilinositol-3 quinase (PI3K), promovendo assim a proliferação e sobrevivência tumoral, são encontradas em aproximadamente 15% a 25% dos melanomas e estão associadas à doença de rápida progressão.[25]Lee JH, Choi JW, Kim YS. Frequencies of BRAF and NRAS mutations are different in histological types and sites of origin of cutaneous melanoma: a meta-analysis. Br J Dermatol. 2011 Apr;164(4):776-84.
http://www.ncbi.nlm.nih.gov/pubmed/21166657?tool=bestpractice.com
[71]Gutiérrez-Castañeda LD, Nova JA, Tovar-Parra JD. Frequency of mutations in BRAF, NRAS, and KIT in different populations and histological subtypes of melanoma: a systemic review. Melanoma Res. 2020 Feb;30(1):62-70.
https://journals.lww.com/melanomaresearch/Fulltext/2020/02000/Frequency_of_mutations_in_BRAF,_NRAS,_and_KIT_in.6.aspx
http://www.ncbi.nlm.nih.gov/pubmed/31274706?tool=bestpractice.com
Mais de 80% das mutações em NRAS envolvem uma mutação pontual que leva à substituição da glutamina por leucina na posição 61, e no melanoma são geralmente mutuamente exclusivas das mutações em BRAF.
Os métodos de detecção incluem análise de fusão de alta resolução pós-reação em cadeia da polimerase.
Análise de mutação em CDKN2A
Mutações no gene CDKN2A no cromossomo 9 foram encontradas em famílias com a síndrome do nevo atípico e em 39% das famílias com tendência a desenvolver melanoma.[18]Soura E, Eliades PJ, Shannon K, et al. Hereditary melanoma: update on syndromes and management: genetics of familial atypical multiple mole melanoma syndrome. J Am Acad Dermatol. 2016 Mar;74(3):395-407; quiz 408-10.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4761105
http://www.ncbi.nlm.nih.gov/pubmed/26892650?tool=bestpractice.com
[38]Goldstein AM, Chan M, Harland M, et al. Features associated with germline CDKN2A mutations: a GenoMEL study of melanoma-prone families from three continents. J Med Genet. 2007 Feb;44(2):99-106.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2598064
http://www.ncbi.nlm.nih.gov/pubmed/16905682?tool=bestpractice.com
Sequenciamento de nova geração ou ensaios de gene único podem ser usados para testes moleculares no cenário de pesquisa.
Estadiamento clínico do melanoma: sistema de estadiamento de tumor-nodo-metástase (TNM) do American Joint Committee on Cancer (8a edição)
O sistema de estadiamento do AJCC (American Joint Committee on Cancer) descreve a extensão da doença com base nos seguintes fatores anatômicos: tamanho e extensão do tumor primário (T); comprometimento dos linfonodos regionais (N); e presença ou ausência de metástases à distância (M).[62]Amin MB, Edge S, Greene F, et al, eds. AJCC cancer staging manual. 8th ed. New York, NY: Springer; 2017. Fatores de prognóstico não anatômicos (por exemplo, grau do tumor, biomarcadores) podem ser usados para complementar o estadiamento de certos tipos de câncer.
Em geral, o melanoma cutâneo é categorizado como:[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Doença localizada (sem evidência de metástases, estádio I-II)
Doença regional (estádio III)
Doença metastática distante (estádio IV).
Exames por imagem
A ultrassonografia de grupos de linfonodos pode ser realizada antes da biópsia do linfonodo sentinela, se o exame físico dos linfonodos for ambíguo. A ultrassonografia não é necessária para linfonodos clinicamente suspeitos, pois a biópsia é indicada. Quaisquer linfonodos suspeitos identificados na ultrassonografia devem ser submetidos à biópsia.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Imagem de corte transversal de linha basal
As recomendações das diretrizes para o uso de imagens de corte transversal de linha basal diferem.
No Reino Unido, a tomografia computadorizada com contraste de corpo inteiro e cérebro (CE-CT) deve ser considerada para pessoas com melanoma em estádio IIB.[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
O estadiamento com CE-CT deve ser oferecido a todos os pacientes com melanoma IIC a IV. Se disponível, uma ressonância nuclear magnética (RNM) cerebral pode ser usada em vez de uma CE-TC cerebral.[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Uma RNM de corpo inteiro e cérebro, em vez de CE-CT, deve ser oferecida para:[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Para pessoas com melanoma em estádio IIIC a IV e um dos seguintes fatores de risco, uma RNM cerebral de estadiamento, em vez de uma CE-CT, pode ser considerada:[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Se o tratamento adjuvante for iniciado mais de 8 semanas após o estadiamento inicial, uma repetição do estadiamento deve ser considerada antes de iniciar o tratamento adjuvante.[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Os exames de imagem de rotina não são recomendados para as pessoas com melanoma em estádio IA, e não devem ser considerados antes da biópsia do linfonodo sentinela (BLS), a menos que haja suspeita de metástases linfonodais ou à distância.[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Uma diretriz europeia recomenda que exames de imagem cerebral basais com ressonância nuclear magnética (RNM) com contraste intravenoso ou TC sejam considerados para os pacientes com melanoma em estádio IIC com prognóstico desfavorável, e são indicados para todos os pacientes com melanoma em estádios III a IV.[67]Garbe C, Amaral T, Peris K, et al. European consensus-based interdisciplinary guideline for melanoma. Part 1: diagnostics - update 2022. Eur J Cancer. 2022 Jul:170:236-55.
https://www.ejcancer.com/article/S0959-8049(22)00152-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35570085?tool=bestpractice.com
A RNM com contraste intravenoso é o método preferencial para imagens cerebrais, pois é melhor na detecção de metástases cerebrais do que a TC.[67]Garbe C, Amaral T, Peris K, et al. European consensus-based interdisciplinary guideline for melanoma. Part 1: diagnostics - update 2022. Eur J Cancer. 2022 Jul:170:236-55.
https://www.ejcancer.com/article/S0959-8049(22)00152-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/35570085?tool=bestpractice.com
Nos EUA, a imagem transversal basal para estadiamento deve ser considerada para pacientes com melanoma em estádio IIIa (linfonodo sentinela positivo) e é indicada para todos os pacientes com melanoma em estádio IIIb, IIIc, IIId e IV. Os estudos de imagem devem incluir tórax, abdome e pelve, além do pescoço, se clinicamente indicado. TC ou tomografia por emissão de pósitrons com fluordesoxiglicose/tomografia computadorizada (FDG-CT/PET) podem ser usadas.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
FDG-CT/PET tem a maior especificidade, sensibilidade e razão de chances de diagnóstico para metástases à distância.[72]Xing Y, Bronstein Y, Ross MI, et al. Contemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis. J Natl Cancer Inst. 2011 Jan 19;103(2):129-42.
https://academic.oup.com/jnci/article/103/2/129/2568844
http://www.ncbi.nlm.nih.gov/pubmed/21081714?tool=bestpractice.com
Para os estádios IIIb, IIIc e IIId, exames de imagem cerebral para estadiamento basal podem ser indicados antes do início da terapia, e são recomendados para todos os pacientes com melanoma em estádio IV.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Os exames de imagem também devem ser realizados para avaliar quaisquer sintomas ou sinais sugestivos de possíveis metástases (por exemplo, cefaleia), se presentes, em qualquer estádio da doença.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Biópsia do linfonodo sentinela
A biópsia do linfonodo sentinela (BLS) baseia-se no conceito de que um tumor será drenado para um primeiro linfonodo em particular dentro de um grupo de linfonodos. Pode haver vários grupos de linfonodos drenantes e vários linfonodos sentinelas, dependendo dos padrões de drenagem linfática individuais.
Um traçador ou um corante azul é injetado por via intradérmica no sítio da lesão primária (antes da excisão local ampla) para identificar o linfonodo sentinela.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
A BLS pode ser realizada em pacientes selecionados com melanoma em estádio I e estádio II. Ela permite o estadiamento preciso de pacientes sem evidência clínica ou radiológica de metástases nodais e fornece informações prognósticas.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
As diretrizes do Reino Unido recomendam considerar a BLS como um procedimento de estadiamento (em vez de terapêutico) para pacientes com espessura de Breslow de 0.8 a 1.0 mm, com pelo menos uma das seguintes características:[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Para pessoas sem características prognósticas adversas, a BLS deve ser considerada com uma espessura de Breslow superior a 1.0 mm.[56]National Institute for Health and Care Excellence. Melanoma: assessment and management. Jul 2022 [internet publication].
https://www.nice.org.uk/guidance/NG14
Considere protelar a BLS em gestantes até o período pós-parto.
As diretrizes da NCCN recomendam que a BLS seja discutida com os pacientes com doença em estádio IB ou II com as seguintes considerações:[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Espessura do tumor <0.8 mm com ulceração
Espessura do tumor de 0.8 a 1.0 mm com ou sem ulceração
Espessura do tumor >0.5 mm que apresenta características prognósticas adversas adicionais (por exemplo, idade ≤42 anos, localização na cabeça/pescoço, invasão linfovascular e/ou índice mitótico ≥2/mm²)
A probabilidade de uma BLS positiva é de 5% a 10% para esses pacientes, com aumento do risco para os pacientes com múltiplas características prognósticas adversas.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
A BLS geralmente não é recomendada para os pacientes com tumores <0.8 mm de espessura sem ulceração ou características prognósticas adversas, a menos que haja incerteza significativa sobre a adequação do microestadiamento (por exemplo, margens profundas positivas ou amostragem limitada de uma lesão maior). O risco de BLS positiva nesses pacientes é <5%.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Um ensaio clínico de fase 3 relatou que a BLS não melhora a sobrevida global para pacientes com melanoma, mas a análise de subgrupo do Multicenter Selective Lymphadenectomy Trial (MSLT)-I mostrou que a BLS melhora a sobrevida livre de doença em 10 anos para pacientes com melanomas entre 1.2 mm e 3.5 mm de espessura.[73]Morton DL, Thompson JF, Cochran AJ, et al. Final trial report of sentinel-node biopsy versus nodal observation in melanoma. N Engl J Med. 2014 Feb 13;370(7):599-609.
http://www.ncbi.nlm.nih.gov/pubmed/24521106?tool=bestpractice.com
[  ]
How does sentinel lymph node biopsy plus dissection compare with observation in people with localized primary cutaneous melanoma?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.848/fullMostre-me a resposta No entanto, evidências subsequentes de uma revisão sistemática demonstraram que a BLS está associada a uma melhor sobrevida global nos pacientes com melanoma cutâneo de cabeça e pescoço.[74]Zhang Y, Liu C, Wang Z, et al. Sentinel lymph node biopsy in head and neck cutaneous melanomas: a PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore). 2021 Feb 5;100(5):e24284.
https://journals.lww.com/md-journal/fulltext/2021/02050/sentinel_lymph_node_biopsy_in_head_and_neck.59.aspx
http://www.ncbi.nlm.nih.gov/pubmed/33592872?tool=bestpractice.com
]
How does sentinel lymph node biopsy plus dissection compare with observation in people with localized primary cutaneous melanoma?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.848/fullMostre-me a resposta No entanto, evidências subsequentes de uma revisão sistemática demonstraram que a BLS está associada a uma melhor sobrevida global nos pacientes com melanoma cutâneo de cabeça e pescoço.[74]Zhang Y, Liu C, Wang Z, et al. Sentinel lymph node biopsy in head and neck cutaneous melanomas: a PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore). 2021 Feb 5;100(5):e24284.
https://journals.lww.com/md-journal/fulltext/2021/02050/sentinel_lymph_node_biopsy_in_head_and_neck.59.aspx
http://www.ncbi.nlm.nih.gov/pubmed/33592872?tool=bestpractice.com
Exames laboratoriais
A lactato desidrogenase (LDH) sérica tem valor prognóstico em pacientes com melanoma em estádio IV e foi incorporada ao sistema de estadiamento do AJCC para melanoma.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
[62]Amin MB, Edge S, Greene F, et al, eds. AJCC cancer staging manual. 8th ed. New York, NY: Springer; 2017.[75]Swetter SM, Tsao H, Bichakjian CK, et al. Guidelines of care for the management of primary cutaneous melanoma. J Am Acad Dermatol. 2019 Jan;80(1):208-50.
https://www.jaad.org/article/S0190-9622(18)32588-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30392755?tool=bestpractice.com
Pacientes com metástases à distância e LDH elevada estão na categoria de maior risco.[14]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: melanoma - cutaneous [internet publication].
https://www.nccn.org/guidelines/category_1
Algumas evidências sugerem que a LDH pode servir como um potencial biomarcador para identificar pacientes que se beneficiariam do tratamento anti-PD 1/PD-L1.[76]Xu J, Zhao J, Wang J, et al. Prognostic value of lactate dehydrogenase for melanoma patients receiving anti-PD-1/PD-L1 therapy: a meta-analysis. Medicine (Baltimore). 2021 Apr 9;100(14):e25318.
https://journals.lww.com/md-journal/fulltext/2021/04090/prognostic_value_of_lactate_dehydrogenase_for.50.aspx
http://www.ncbi.nlm.nih.gov/pubmed/33832106?tool=bestpractice.com
Geralmente, nenhum exame de sangue é necessário em pacientes com outros estádios de melanoma, a menos que tenham sintomas sistêmicos.

 Entretanto, com a progressão, elas geralmente desenvolvem um componente papular ou nodular.[Figure caption and citation for the preceding image starts]: Melanoma nodularDo acervo pessoal do Dr. Hobart Walling e Dr. Brian Swick. [Citation ends].
Entretanto, com a progressão, elas geralmente desenvolvem um componente papular ou nodular.[Figure caption and citation for the preceding image starts]: Melanoma nodularDo acervo pessoal do Dr. Hobart Walling e Dr. Brian Swick. [Citation ends].



 ]
No entanto, evidências subsequentes de uma revisão sistemática demonstraram que a BLS está associada a uma melhor sobrevida global nos pacientes com melanoma cutâneo de cabeça e pescoço.[74]
]
No entanto, evidências subsequentes de uma revisão sistemática demonstraram que a BLS está associada a uma melhor sobrevida global nos pacientes com melanoma cutâneo de cabeça e pescoço.[74]