Abordagem
A MG comumente afeta mulheres adultas jovens (abaixo de 40 anos) e homens idosos (acima de 60 anos), mas pode ocorrer em qualquer idade.[36][37]
Após uma revisão da história médica do paciente e de achados típicos ao exame físico, o diagnóstico de MG pode ser estabelecido por testes sorológicos e clínicos. Se o teste sorológico não tiver nada digno de nota, deverão ser realizados testes clínicos neurofisiológicos. Testes de função pulmonar podem ajudar a prever se a respiração está afetada, de modo a ajudar a evitar uma crise miastênica.
História
Os aspectos típicos são fraqueza e fatigabilidade dos músculos esqueléticos, com uma distribuição característica. A doença geralmente se apresenta em uma de três formas diferentes: ocular, orofaríngea ou generalizada.
Dependendo da forma inicial predominante, pacientes com MG podem apresentar uma variedade de sintomas, inclusive ptose, diplopia, disartria (transtorno da fala), disfagia (dificuldade de deglutição), paresia facial, fraqueza muscular proximal e dispneia. Caracteristicamente, a fraqueza nos membros se agrava com atividade (fadiga) e melhora com repouso, e as flutuações frequentemente (mas nem sempre) mostram uma variação diurna (melhor pela manhã que no fim do dia).
Com menos frequência, os pacientes podem apresentar fraqueza predominante ou exclusivamente dos membros, às vezes chamada de MG das cinturas escapular e pélvica.
Exame físico
A gravidade clínica da MG geralmente é graduada funcional e regionalmente.[4][68][69]
A fraqueza muscular com fadiga pode ser localizada ou generalizada, envolvendo as pálpebras, os músculos extraoculares, a face, a orofaringe, o pescoço, os músculos respiratórios e os membros. Ptose e diplopia ocorrem precocemente na maioria dos pacientes.[22] A duração da ptose (que, geralmente, é superior a 3 minutos em pessoas saudáveis) é verificada pedindo-se ao paciente para olhar para cima e anotando o tempo até que a ptose se desenvolva. Levantar a pálpebra superior pode induzir ptose na pálpebra contralateral. Resfriar a pálpebra por 2 a 5 minutos com uma compressa de gelo melhora a ptose em mais de 95% dos pacientes com MG, mas pode não melhorar a ptose grave.[70][71]
Entre 50% e 60% dos pacientes que se apresentam com sintomas puramente oculares evoluirão e desenvolverão MG generalizada, e o mesmo ocorrerá com a grande maioria em até 1 ou 2 anos.[23][Figure caption and citation for the preceding image starts]: Ptose da pálpebra superior esquerda em paciente com miastenia gravisForoozan R, Sambursky R. Ocular myasthenia gravis and inflammatory bowel disease: a case report and literature review. Br J Ophthalmol. 2003 Sep;87(9):1186-7. [Citation ends].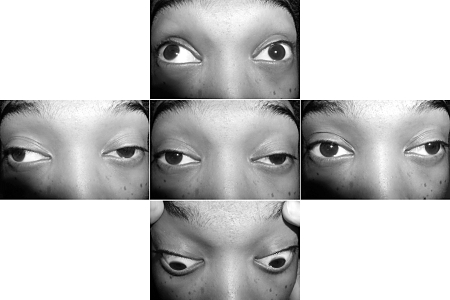
Quando os músculos faciais e orofaríngeos são afetados, pode ocorrer um sorriso achatado ou transversal característico, ou voz nasalada e dificuldade na mastigação e deglutição.
O exame físico dos membros revela fraqueza muscular proximal com fadiga. O tempo de abdução do braço é verificado pedindo-se aos pacientes que mantenham os braços estendidos; pessoas saudáveis normalmente podem manter os braços suspensos por mais de 3 minutos.
Não deve haver perda muscular aparente (com exceção da língua e, com menos frequência, do palato em pacientes com MG com anticorpos antitirosina quinase músculo específica [MuSK]), e os reflexos são normais. As sensações estão intactas (a menos que outro distúrbio também esteja presente) e não há disfunção autonômica.
Em casos de crises miastênicas, ocorre grave comprometimento respiratório e/ou bulbar.
Características da MG positiva para MuSK
Pacientes com MG positiva para MuSK apresentam um dos três fenótipos; os dois primeiros são considerados característicos:[5][24]
Grave fraqueza faciofaríngea, com atrofia dos músculos envolvidos em doença prolongada
Fraqueza respiratória e cervical predominante, com frequente evolução para crise miastênica; ou
Aspectos clínicos indistinguíveis de MG negativa para MuSK.
Os seguintes aspectos clínicos diferenciam MG positiva para MuSK da MG negativa para MuSK:[5]
Características oculares não são comuns, mas podem ocorrer.
Presença de atrofia facial e da língua por exame clínico e ressonância nuclear magnética (RNM).
A fraqueza nos membros é leve.
Pacientes com fraqueza muscular cervical e respiratória proeminente podem apresentar testes eletrodiagnósticos normais nos músculos da face e dos membros. É necessário o teste dos músculos envolvidos para estabelecer o diagnóstico.
A fraqueza tende a ser mais intensa; 23% dos pacientes evoluíram para crise e 85% apresentaram classe máxima da Myasthenia Gravis Foundation of America (MGFA) de III ou superior em uma clínica.
Resposta clínica insatisfatória à terapia com inibidor da colinesterase.
Características da MG positiva para LRP4, cortactina, agrina e colágeno Q
Pacientes com MG e anticorpos contra LRP4 geralmente apresentam MG leve a moderada, semelhante a alguns pacientes com anticorpos contra o receptor de acetilcolina (AChR); o espectro completo da gravidade dos sintomas foi relatado em um estudo.[9][10][13][50][72] São necessários estudos adicionais para caracterizar completamente os fenótipos clínicos, bem como quaisquer padrões de idade de início, diferenças entre sexos e grupos étnicos/raciais, para LRP4.
Um pequeno número de pacientes com anticorpos anticortactina e nenhum anticorpo detectável contra AChR (usando os testes padrão) ou MuSK detectados demonstrou doença leve a moderada, inclusive MG ocular, com padrão semelhante ao observado na MG positiva para AChR.[17][18][19][21] Não se sabe se algum desses pacientes apresentava anticorpos contra LRP4, agrina, colágeno Q ou AChR que fossem detectados apenas com tecnologia de AChR agrupado com base em células.
As características da MG em pacientes com anticorpos contra agrina ou colágeno Q ainda não foram estabelecidas.
Visão geral das investigações
A MG é um diagnóstico clínico apoiado por testes sorológicos, eletrofisiológicos e farmacológicos.
Teste sorológico
Todos os pacientes devem ser submetidos a teste sorológico.
Ensaio de ligação e modulação padrão para anticorpos anti-AChR: anticorpos anti-AChR são detectados em 80% a 90% dos pacientes com MG generalizada e em 50% dos pacientes com MG ocular, com 99% de especificidade em ambos os casos.[70] O título absoluto não se correlaciona com a gravidade da MG, apesar de ter sido sugerido que níveis de anticorpos anti-AChR de alta modulação se correlacionam com a gravidade em alguns estudos.[2][22]
Ensaio baseado em células para anticorpos anti-AChR: identifica pacientes com MG, que, em geral, parecem similares a pacientes identificados por testes de AChR padrão, com aumento na porcentagem de doença com início pré-puberal.[73]
Ensaio de anticorpos anti-MuSK: se o teste padrão para anticorpos anti-AChR for negativo, prossiga com o teste sorológico para anticorpos anti-MuSK. Anticorpos anti-MuSK são detectados em até 70% dos pacientes com MG generalizada soronegativos para anticorpos anti-AChR.[5][62] Nos EUA, os anticorpos anti-MuSK são comuns na população negra; 70% das mulheres negras com MG generalizada soronegativa apresentam anticorpos anti-MuSK.[5]
Ensaios de anticorpo antirreceptor de músculo estriado: ensaios para anticorpos anti-titina e anti-rianodina não são realizados rotineiramente em todos os pacientes, e os anticorpos são raros em pacientes sem timoma que não sejam pacientes com "início tardio".[74] Eles são detectados em 75% a 95% dos pacientes com timoma e MG. A presença desses anticorpos pode indicar recorrência de timoma.[75]
O teste para anticorpos contra LRP4, agrina, colágeno Q ou cortactina não está amplamente disponível e não está claro o quão específicos esses anticorpos são para MG, mas os anticorpos contra LRP4 podem ser úteis no cenário clínico apropriado.[10] Os anticorpos contra a cortactina são observados em miopatias, o que sugere que o teste para anticorpos anticortactina não seriam úteis como teste diagnóstico para a MG.[17][19]
Teste eletrofisiológico
Se o teste sorológico não apresentar nada digno de nota ou houver características clínicas atípicas, o exame eletrofisiológico deve ser realizado.
A estimulação nervosa repetitiva (ENR) com uma baixa frequência deverá mostrar um decremento. Nesse procedimento, são aplicados choques elétricos ao nervo e os potenciais de ação são registrados por meio de eletrodos de superfície colocados sobre o músculo.[70] A melhora de um decremento basal após exercício breve (facilitação pós-exercício) e o decremento acentuado 2 a 3 minutos após o exercício (exaustão pós-exercício) são aspectos eletrodiagnósticos típicos. A sensibilidade é de 79% na MG generalizada e 50% na MG ocular, enquanto a especificidade é de 97%.[70] Um decréscimo de 7% a 8% foi sugerido como ponto de corte para os músculos faciais.[76] Ampliar o número de músculos testados aumenta a chance de demonstrar decréscimo significativo.[77]
Se a RNS for negativa ou duvidosa, recomenda-se uma eletromiografia de fibra única (SFEMG). A SFEMG é uma medida da transmissão da junção neuromuscular (JNM) entre duas ou mais fibras musculares adjacentes inervadas pelo mesmo axônio motor. A SFEMG pode mostrar uma maior variabilidade das latências motoras (jitter) ou falha completa na transmissão da JNM (bloqueio) nas fibras musculares. Quando realizado na musculatura facial, o teste é positivo em 86% a 92% dos pacientes com MG ocular, com especificidade de 70% a 96%. Em pacientes com MG generalizada, a especificidade e a sensibilidade relatadas são de até 98%.[70] Este teste não é específico para MG, e é importante ter certeza de que não há evidência de desnervação ou miopatia nos músculos testados.
Exames por imagem
Uma tomografia computadorizada (TC) do tórax deve ser realizada em todos os pacientes recém-diagnosticados para detectar timoma (que ocorre em aproximadamente 15% dos pacientes com MG) ou hiperplasia tímica (que ocorre em 75% dos pacientes com MG).[Figure caption and citation for the preceding image starts]: Tomografia computadorizada mostrando massa mediastinal anteriorHamid UI, Jones JM. Mediastinal mass. BMJ Case Reports 2010 Oct 4;2010:bcr1120092471. [Citation ends].
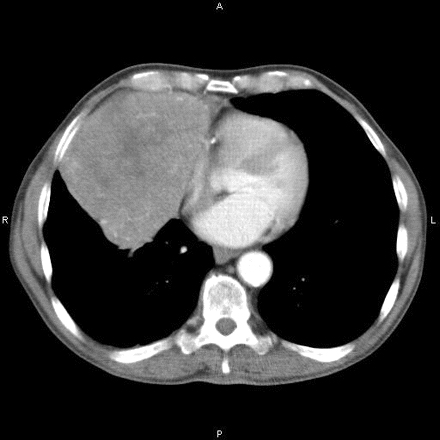
A RNM de rotina não oferece nenhum benefício adicional. A RNM por deslocamento químico e ponderada por difusão pode ser capaz de identificar hiperplasia folicular de centro germinativo e diferenciá-la do timo normal.[78][79]
Outros exames a serem considerados
O "teste do gelo" pode ser um exame diagnóstico útil para um paciente com ptose significativa. Resfriar a pálpebra por 2 a 5 minutos com uma compressa de gelo melhora a ptose em >95% dos pacientes com MG, mas pode não melhorar a ptose grave.[70][71]
O teste de edrofônio (Tensilon) é de grande interesse histórico, mas pode ser usado ocasionalmente por neuro-oftalmologistas e neurologistas para avaliação de oftalmoparesia e/ou ptose isolada.
Pacientes com certas formas de MG congênita podem nem sempre se apresentar na primeira infância. Eles geralmente serão soronegativos (há relatos raros de anticorpos anti-MuSK em algumas famílias), mas podem ter testes neurofisiológicos anormais, às vezes diferentes de, mas em alguns tipos idênticos aos, da MG autoimune. Se houver preocupações, o teste genético para síndromes miastênicas congênitas pode ser realizado.
Crise miastênica
A crise miastênica é uma emergência médica. É definida como uma exacerbação da MG que requer ventilação mecânica. As indicações para ventilação mecânica são capacidade vital forçada (CVF) de 15 mL/kg ou menos (normal ≥60 mL/kg) e/ou força inspiratória negativa (NIF) de 20 cm H₂O ou menos (normal ≥70 cm H₂O). São tomadas medidas seriadas da CVF e da NIF.
É necessário um alto índice de suspeita clínica para a crise miastênica, pois os pacientes podem inicialmente parecer estáveis.[23][80] Os médicos não devem esperar por gasometria arterial anormal, pois ela ocorre em um estágio tardio na evolução, depois da descompensação clínica. O julgamento clínico deve sempre ser um suplemento e, se houver necessidade, substituir os parâmetros respiratórios.[81]
A crise miastênica pode ser provocada por infecções (particularmente, infecções respiratórias), aspiração, medicamentos como corticosteroides em altas doses, cirurgia, medicamentos contraindicados ou relativamente contraindicados na MG, não adesão à medicação, administração de inibidores de checkpoint imunes como terapia oncológica ou trauma.[57][58][80][81][82] Pacientes mais velhos e pacientes que também têm outras doenças autoimunes parecem ter maior risco de evoluir para crise miastênica.[83]
Devem ser tomadas medidas adequadas para eliminar os fatores desencadeadores. A fraqueza da musculatura orofaríngea também pode contribuir para insuficiência respiratória.
Como colher uma amostra de sangue venoso da fossa antecubital usando uma agulha a vácuo.
O uso deste conteúdo está sujeito ao nosso aviso legal