A abordagem ao tratamento depende de se a constipação é diagnosticada como uma condição primária ou secundária (por exemplo, constipação induzida por medicamento, gestação, doença de Parkinson). Causas secundárias são tratadas apropriadamente. Na constipação induzida por medicamento, a etapa inicial é retirar o medicamento, se possível. A constipação em gestantes é tratada com fibras e laxantes, tendo em conta a supressão dos suplementos de ferro.[21]Rao SSC, Qureshi WA, Yan Y, et al. Constipation, hemorrhoids, and anorectal disorders in pregnancy. Am J Gastroenterol. 2022 Oct;117(10s):16-25.
https://journals.lww.com/ajg/fulltext/2022/10001/constipation,_hemorrhoids,_and_anorectal_disorders.4.aspx
[22]Kothari S, Afshar Y, Friedman LS, et al. AGA clinical practice update on pregnancy-related gastrointestinal and liver disease: expert review. Gastroenterology. 2024 Oct;167(5):1033-45.
https://www.doi.org/10.1053/j.gastro.2024.06.014
http://www.ncbi.nlm.nih.gov/pubmed/39140906?tool=bestpractice.com
O manejo inicial da constipação primária dependerá de se a apresentação é aguda (<3 meses) ou crônica (≥3 meses). O manejo inicial da constipação crônica, independentemente da causa, foca em mudanças na dieta e no estilo de vida, garantindo-se uma ingestão adequada de fibras e modificação alimentar. Se a condição persistir, devem ser usados laxantes, e as potenciais causas subjacentes devem ser consideradas.[Figure caption and citation for the preceding image starts]: Algoritmo de tratamento para constipação (não induzida por opioides). PEG: polietilenoglicol (macrogóis)Criado pelo BMJ Knowledge Centre a partir de material fornecido por Satish Rao, MD e Ashok Attaluri, MD [Citation ends].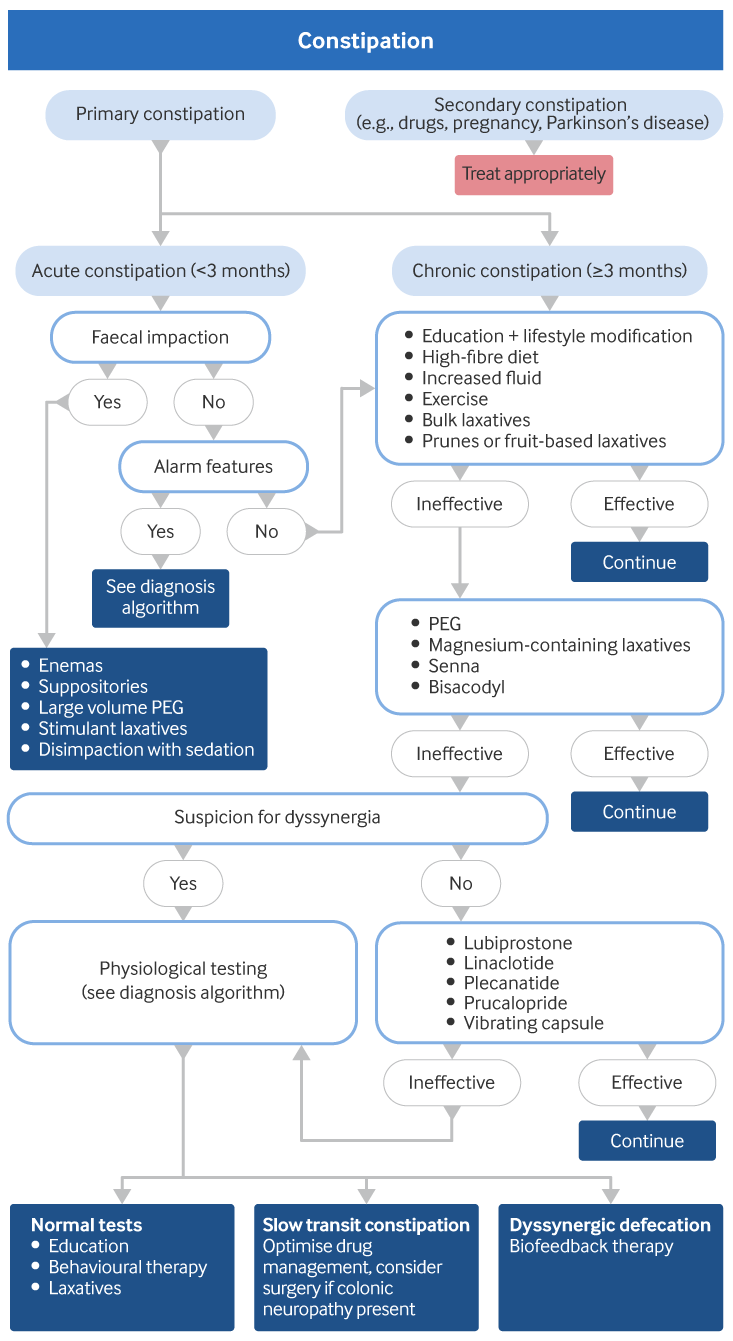
Manejo inicial da constipação primária aguda (sintomas <3 meses)
Quando a constipação se apresenta agudamente, é importante considerar as causas secundárias possíveis, incluindo câncer colorretal. Investigações adicionais podem ser realizadas para se excluírem causas secundárias. Enemas, supositórios, soluções com grandes volumes de polietilenoglicóis (PEG, também conhecidos como macrogóis), laxantes estimulantes ou desimpactação com sedação podem ser necessários se houver impactação fecal. O tipo de enema ou medicamentos e a necessidade de sedação/anestesia variam e dependem do cenário clínico e das características individuais do paciente (por exemplo, idade do paciente, ansiedade, primeiro episódio ou episódios recorrentes). Enemas são contraindicados para pacientes com neutropenia, trombocitopenia, obstrução intestinal, cirurgia colorretal ou ginecológica recente, colite inflamatória, megacólon tóxico, infecção ou inflamação abdominal, trauma anal ou retal recente, dor abdominal não diagnosticada ou radioterapia pélvica recente.[51]De Giorgio R, Zucco FM, Chiarioni G, et al. Management of opioid-induced constipation and bowel dysfunction: expert opinion of an Italian multidisciplinary panel. Adv Ther. 2021 Jul;38(7):3589-621.
https://link.springer.com/article/10.1007/s12325-021-01766-y
http://www.ncbi.nlm.nih.gov/pubmed/34086265?tool=bestpractice.com
[52]Larkin PJ, Cherny NI, La Carpia D, et al. Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(suppl 4):iv111-25.
https://www.annalsofoncology.org/article/S0923-7534(19)31697-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30016389?tool=bestpractice.com
Se a impactação fecal estiver ausente e causas secundárias forem excluídas, o tratamento será o mesmo que o para pacientes com constipação crônica. Isso inclui orientações sobre dieta e estilo de vida, além de laxantes ou ameixas secas e/ou laxativos (consulte a seção sobre constipação primária crônica abaixo para obter detalhes adicionais).
Manejo inicial da constipação primária crônica (sintomas ≥3 meses)
As etapas iniciais no manejo inicial da constipação primária crônica são:
Educação do paciente
Mudanças no estilo de vida
Postura corporal correta[53]Wald A. Update on the management of constipation. JAMA. 2019 Dec;322(22):2239-40.
http://www.ncbi.nlm.nih.gov/pubmed/31682683?tool=bestpractice.com
Dieta rica em fibras
Maior consumo de fluidos
Exercícios regulares
Laxantes expansores do volume fecal, ameixas secas ou laxantes à base de frutas (consulte a seção sobre laxantes abaixo para obter detalhes adicionais).
Mudanças alimentares e de estilo de vida podem ser úteis, e as evidências sugerem que podem ser mais efetivas quando combinadas.[18]Serra J, Pohl D, Azpiroz F, et al. European society of neurogastroenterology and motility guidelines on functional constipation in adults. Neurogastroenterol Motil. 2020 Feb;32(2):e13762.
https://onlinelibrary.wiley.com/doi/10.1111/nmo.13762
http://www.ncbi.nlm.nih.gov/pubmed/31756783?tool=bestpractice.com
Estudos encontraram resultados conflitantes que sugerem que o exercício e o aumento da ingestão de líquidos isolados podem não ser efetivos em pacientes com constipação, mas um estudo não controlado que combinou educação sobre padrões alimentares, ingestão de líquidos, atividade física e uso de laxantes relatou melhora significativa na constipação e na qualidade de vida.[18]Serra J, Pohl D, Azpiroz F, et al. European society of neurogastroenterology and motility guidelines on functional constipation in adults. Neurogastroenterol Motil. 2020 Feb;32(2):e13762.
https://onlinelibrary.wiley.com/doi/10.1111/nmo.13762
http://www.ncbi.nlm.nih.gov/pubmed/31756783?tool=bestpractice.com
Os pacientes são orientados a aumentarem o consumo diário de fibras alimentares. Uma dieta com deficiência de fibras pode causar constipação, enquanto uma dieta rica em fibras aumenta o peso das fezes e acelera o tempo de trânsito colônico.[32]van der Schoot A, Drysdale C, Whelan K, et al. The effect of fiber supplementation on chronic constipation in adults: an updated systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr. 2022 Oct;116(4):953-69.
https://www.sciencedirect.com/science/article/pii/S0002916523036146?via%3Dihub
http://www.ncbi.nlm.nih.gov/pubmed/35816465?tool=bestpractice.com
[33]Tucker DM, Sandstead HH, Logan GM Jr, et al. Dietary fiber and personality factors as determinants of stool output. Gastroenterology. 1981 Nov;81(5):879-83.
http://www.ncbi.nlm.nih.gov/pubmed/6269944?tool=bestpractice.com
O American Gastroenterological Association-American College of Gastroenterology (AGA-ACG) sugere o uso de suplementos de fibra para o tratamento da constipação idiopática crônica.[54]Chang L, Chey WD, Imdad A, et al. American Gastroenterological Association-American College of Gastroenterology clinical practice guideline: pharmacological management of chronic idiopathic constipation. Am J Gastroenterol. 2023 Jun 1;118(6):936-54.
https://journals.lww.com/ajg/fulltext/2023/06000/american_gastroenterological_association_american.13.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37204227?tool=bestpractice.com
Em pessoas com baixo consumo de calorias, um aumento no consumo de calorias também é aconselhado. Já foi demonstrado que uma ingestão inadequada de calorias pode causar constipação.[35]Chun AB, Sokol MS, Kaye WH, et al. Colonic and anorectal function in constipated patients with anorexia nervosa. Am J Gastroenterol. 1997 Oct;92(10):1879-83.
http://www.ncbi.nlm.nih.gov/pubmed/9382057?tool=bestpractice.com
Os pacientes também devem ser orientados em relação à ingestão adequada de líquidos, estimulados a praticar exercícios leves regularmente e aconselhados a dedicar um tempo à defecação e evitar adiar as evacuações intestinais quando for percebida uma necessidade de defecar.[34]Muller-Lissner SA, Kamm MA, Scarpignato C, et al. Myths and misconceptions about chronic constipation. Am J Gastroenterol. 2005 Jan;100(1):232-42.
http://www.ncbi.nlm.nih.gov/pubmed/15654804?tool=bestpractice.com
Laxantes para constipação primária
Os laxantes são a base do tratamento farmacológico e são considerados terapia de longo prazo em pacientes que não respondem a mudanças no estilo de vida ou na dieta. O paciente deve experimentar cada classe de medicamentos por no mínimo 6 semanas e depois retornar para exames para avaliar a resposta à terapia. Se não houver resposta clínica satisfatória, ou se houver efeitos adversos problemáticos, o paciente deve ser trocado para outra classe de medicamento.
A dissinergia deve ser considerada se os laxantes forem inefetivos após aproximadamente 6-8 semanas.[9]Bharucha AE, Dorn SD, Lembo A, et al. American Gastroenterological Association medical position statement on constipation. Gastroenterology. 2013 Jan;144(1):211-7.
http://www.gastrojournal.org/article/S0016-5085(12)01545-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/23261064?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Resumo de laxantes para a constipação crônicaCriado pelo BMJ Knowledge Centre [Citation ends].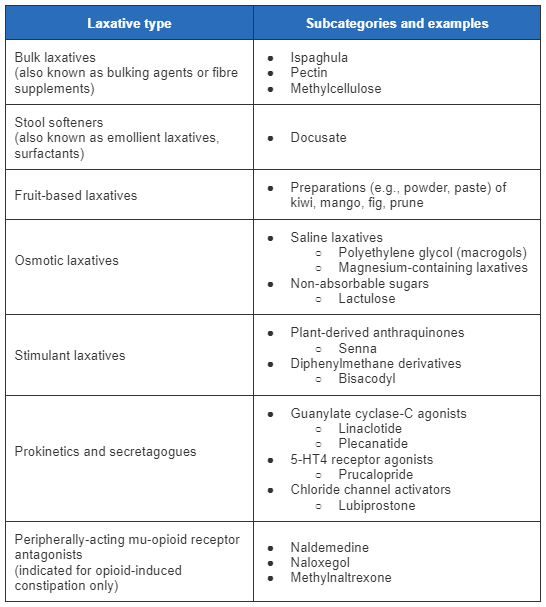
Opções de primeira linha
Laxantes expansores do volume fecal (suplementos de fibra), ameixas secas ou laxantes à base de frutas são a terapia de primeira linha preferida. Em pacientes que reclamam de fezes duras e esforço ao defecar, os amolecedores de fezes podem ser usados.
Em pacientes que têm fezes soltas ocasionalmente entre episódios de constipação, um laxante formador de volume pode ser preferido. Em uma metanálise de 16 ensaios clínicos randomizados e controlados (ECRCs), os suplementos de fibra demonstraram ser efetivos para melhorar a constipação crônica (RR 1.48, IC de 95% 1.17 a 1.88), com efeitos significativos pelos suplementos de ispágula e pectina em doses mais altas (>10 g/dia) para os tratamentos mais longos (≥4 semanas).[32]van der Schoot A, Drysdale C, Whelan K, et al. The effect of fiber supplementation on chronic constipation in adults: an updated systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr. 2022 Oct;116(4):953-69.
https://www.sciencedirect.com/science/article/pii/S0002916523036146?via%3Dihub
http://www.ncbi.nlm.nih.gov/pubmed/35816465?tool=bestpractice.com
Os laxantes em massa não são absorvidos sistemicamente e são considerados seguros para administração durante a gravidez.[22]Kothari S, Afshar Y, Friedman LS, et al. AGA clinical practice update on pregnancy-related gastrointestinal and liver disease: expert review. Gastroenterology. 2024 Oct;167(5):1033-45.
https://www.doi.org/10.1053/j.gastro.2024.06.014
http://www.ncbi.nlm.nih.gov/pubmed/39140906?tool=bestpractice.com
Os laxantes expansores de volume podem produzir excesso de gases, levando à flatulência e à distensão abdominal, o que pode impedir os pacientes de continuarem o tratamento.[55]Schiller LR. Review article: the therapy of constipation. Aliment Pharmacol Ther. 2001 Jun;15(6):749-63.
https://onlinelibrary.wiley.com/doi/full/10.1046/j.1365-2036.2001.00982.x?sid=nlm%3Apubmed
http://www.ncbi.nlm.nih.gov/pubmed/11380313?tool=bestpractice.com
As ameixas (secas) são uma alternativa natural a laxantes e mostraram, em um estudo cego, randomizado e controlado, ser tão efetivos quanto a ispaghula (casca de ispaghula) na melhora dos sintomas de constipação.[56]Attaluri A, Donahoe R, Valestin J, et al. Randomised clinical trial: dried plums (prunes) vs. psyllium for constipation. Aliment Pharmacol Ther. 2011 Apr;33(7):822-8.
http://www.ncbi.nlm.nih.gov/pubmed/21323688?tool=bestpractice.com
O kiwi também pode ser efetivo e está associado a menos insatisfação dos pacientes que ameixas secas ou ispágula, mas uma revisão sistemática relatou que as evidências são de certeza baixa a muito baixa.[57]Chey SW, Chey WD, Jackson K, et al. Exploratory comparative effectiveness trial of green kiwifruit, psyllium, or prunes in US patients with chronic constipation. Am J Gastroenterol. 2021 Jun;116(6):1304-12.
http://www.ncbi.nlm.nih.gov/pubmed/34074830?tool=bestpractice.com
[58]Eltorki M, Leong R, Ratcliffe EM. Kiwifruit and kiwifruit extracts for treatment of constipation: a systematic review and meta-analysis. Can J Gastroenterol Hepatol. 2022;2022:7596920.
https://www.hindawi.com/journals/cjgh/2022/7596920
http://www.ncbi.nlm.nih.gov/pubmed/36247043?tool=bestpractice.com
Os laxantes à base de frutas incluem preparações (por exemplo, pó, pasta) de kiwi, manga, ameixas secas ou figo.[59]Rao SSC, Brenner DM. Efficacy and safety of over-the-counter therapies for chronic constipation: an updated systematic review. Am J Gastroenterol. 2021 Jun;116(6):1156-81.
https://journals.lww.com/ajg/fulltext/2021/06000/efficacy_and_safety_of_over_the_counter_therapies.14.aspx
http://www.ncbi.nlm.nih.gov/pubmed/33767108?tool=bestpractice.com
Estudos sugerem que eles são bem tolerados, com poucos ou nenhum efeito adverso gastrointestinal relatado.
Os amolecedores de fezes como o docusato (um surfactante que, acredita-se, hidrata e amacia as fezes ao diminuir a tensão na interface óleo/água das fezes) são um dos medicamentos de venda livre usados com mais frequência para o tratamento da constipação.[59]Rao SSC, Brenner DM. Efficacy and safety of over-the-counter therapies for chronic constipation: an updated systematic review. Am J Gastroenterol. 2021 Jun;116(6):1156-81.
https://journals.lww.com/ajg/fulltext/2021/06000/efficacy_and_safety_of_over_the_counter_therapies.14.aspx
http://www.ncbi.nlm.nih.gov/pubmed/33767108?tool=bestpractice.com
No entanto, os dados clínicos continuam inconsistentes, e não há novos estudos de eficácia desde 2004. Em um estudo, o docusato não demonstrou ser mais eficaz que placebo, e foi significativamente inferior à ispágula.[60]Ramkumar D, Rao SS. Efficacy and safety of traditional medical therapies for chronic constipation: systematic review. Am J Gastroenterol. 2005 Apr;100(4):936-71.
http://www.ncbi.nlm.nih.gov/pubmed/15784043?tool=bestpractice.com
Os efeitos adversos dos amolecedores de fezes incluem gosto amargo na boca, náuseas, diarreia e cólicas.
Opções de segunda linha
Se não houver resposta clínica (definida como satisfação do paciente com os hábitos intestinais e sintomas associados) após pelo menos 6 semanas de terapia e não houver suspeita de dissinergia, os laxantes osmóticos, como lactulose, o PEG (macrogóis) ou laxantes contendo magnésio são considerados.[54]Chang L, Chey WD, Imdad A, et al. American Gastroenterological Association-American College of Gastroenterology clinical practice guideline: pharmacological management of chronic idiopathic constipation. Am J Gastroenterol. 2023 Jun 1;118(6):936-54.
https://journals.lww.com/ajg/fulltext/2023/06000/american_gastroenterological_association_american.13.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37204227?tool=bestpractice.com
[61]Lee-Robichaud H, Thomas K, Morgan J, et al. Lactulose versus polyethylene glycol for chronic constipation. Cochrane Database Syst Rev. 2010 Jul 7;(7):CD007570.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD007570.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/20614462?tool=bestpractice.com
[62]Belsey JD, Geraint M, Dixon TA. Systematic review and meta analysis: polyethylene glycol in adults with non-organic constipation. Int J Clin Pract. 2010 Jun;64(7):944-55.
http://www.ncbi.nlm.nih.gov/pubmed/20584228?tool=bestpractice.com
Muitas vezes, uma única classe de laxantes é usada ao máximo possível. Uma metanálise mostrou que o polietilenoglicol (PEG; macrogóis) é melhor que a lactulose na melhora das medidas de desfecho da frequência de evacuações por semana, forma das fezes, alívio da dor abdominal e necessidade de produtos adicionais.[61]Lee-Robichaud H, Thomas K, Morgan J, et al. Lactulose versus polyethylene glycol for chronic constipation. Cochrane Database Syst Rev. 2010 Jul 7;(7):CD007570.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD007570.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/20614462?tool=bestpractice.com
Com base nas evidências, o AGA-ACG fez uma recomendação forte para o uso do PEG (após ou em conjunto com suplementos de fibra) no manejo da constipação idiopática crônica, e recomendações fracas para o uso da lactulose ou do óxido de magnésio.[54]Chang L, Chey WD, Imdad A, et al. American Gastroenterological Association-American College of Gastroenterology clinical practice guideline: pharmacological management of chronic idiopathic constipation. Am J Gastroenterol. 2023 Jun 1;118(6):936-54.
https://journals.lww.com/ajg/fulltext/2023/06000/american_gastroenterological_association_american.13.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37204227?tool=bestpractice.com
Lactulose e PEG são considerados seguros para administração durante a gravidez.[22]Kothari S, Afshar Y, Friedman LS, et al. AGA clinical practice update on pregnancy-related gastrointestinal and liver disease: expert review. Gastroenterology. 2024 Oct;167(5):1033-45.
https://www.doi.org/10.1053/j.gastro.2024.06.014
http://www.ncbi.nlm.nih.gov/pubmed/39140906?tool=bestpractice.com
Os principais efeitos adversos dos laxantes osmóticos incluem distensão abdominal, diarreia, dor epigástrica, flatulência, náuseas, vômitos e, raramente, hipernatremia e hipocalemia. Os efeitos adversos comuns dos laxantes que contêm magnésio incluem as náuseas, a diarreia e a hipermagnesemia.
Os laxantes estimulantes, como o bisacodil e a senna, são outra opção nesse estágio. Eles também podem ser usados como laxantes de resgate em pacientes já em uso de outra classe de laxantes (a serem usados se o paciente não tiver evacuações por 3 dias).[63]Kamm MA, Mueller-Lissner S, Wald A, et al. Oral bisacodyl is effective and well-tolerated in patients with chronic constipation. Clin Gastroenterol Hepatol. 2011 Jul;9(7):577-83.
http://www.ncbi.nlm.nih.gov/pubmed/21440672?tool=bestpractice.com
Revisões sistemáticas constataram que, embora os laxantes estimulantes sejam efetivos, é comum haver diarreia e dor abdominal, o que pode afetar sua tolerabilidade.[59]Rao SSC, Brenner DM. Efficacy and safety of over-the-counter therapies for chronic constipation: an updated systematic review. Am J Gastroenterol. 2021 Jun;116(6):1156-81.
https://journals.lww.com/ajg/fulltext/2021/06000/efficacy_and_safety_of_over_the_counter_therapies.14.aspx
http://www.ncbi.nlm.nih.gov/pubmed/33767108?tool=bestpractice.com
[64]Luthra P, Camilleri M, Burr NE, et al. Efficacy of drugs in chronic idiopathic constipation: a systematic review and network meta-analysis. Lancet Gastroenterol Hepatol. 2019 Nov;4(11):831-44.
http://www.ncbi.nlm.nih.gov/pubmed/31474542?tool=bestpractice.com
O AGA-ACG recomenda o bisacodil para uso diário por até 4 semanas, ou como terapia de resgate. Sugere-se um aumento gradual na dose para aumentar a tolerabilidade. Eles também sugerem a senna para o manejo da constipação idiopática crônica.[54]Chang L, Chey WD, Imdad A, et al. American Gastroenterological Association-American College of Gastroenterology clinical practice guideline: pharmacological management of chronic idiopathic constipation. Am J Gastroenterol. 2023 Jun 1;118(6):936-54.
https://journals.lww.com/ajg/fulltext/2023/06000/american_gastroenterological_association_american.13.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37204227?tool=bestpractice.com
Os laxantes estimulantes devem ser evitados durante a gravidez, pois os dados de segurança são conflitantes.[21]Rao SSC, Qureshi WA, Yan Y, et al. Constipation, hemorrhoids, and anorectal disorders in pregnancy. Am J Gastroenterol. 2022 Oct;117(10s):16-25.
https://journals.lww.com/ajg/fulltext/2022/10001/constipation,_hemorrhoids,_and_anorectal_disorders.4.aspx
Uma revisão sistemática que avaliou ECRCs de medicamentos de venda livre para a constipação concluiu que o PEG e a senna foram respaldados por boas evidências.[59]Rao SSC, Brenner DM. Efficacy and safety of over-the-counter therapies for chronic constipation: an updated systematic review. Am J Gastroenterol. 2021 Jun;116(6):1156-81.
https://journals.lww.com/ajg/fulltext/2021/06000/efficacy_and_safety_of_over_the_counter_therapies.14.aspx
http://www.ncbi.nlm.nih.gov/pubmed/33767108?tool=bestpractice.com
Suplementos de fibra (ispágula); laxantes à base de frutas (preparações de kiwi, manga, ameixas secas, figo); sais de magnésio; estimulantes (bisacodil); e iogurte com galacto-oligossacarídeos/ameixas secas/óleo de linhaça foram recomendados com evidências moderadas. Não houve evidências suficientes para o docusato, a inulina, frutose-oligossacarídeos e polidextrose.[59]Rao SSC, Brenner DM. Efficacy and safety of over-the-counter therapies for chronic constipation: an updated systematic review. Am J Gastroenterol. 2021 Jun;116(6):1156-81.
https://journals.lww.com/ajg/fulltext/2021/06000/efficacy_and_safety_of_over_the_counter_therapies.14.aspx
http://www.ncbi.nlm.nih.gov/pubmed/33767108?tool=bestpractice.com
Opções de terceira linha
Se os sintomas persistirem após pelo menos 6 semanas de laxantes tradicionais e não houver suspeita de dissinergia, novos agentes que exigem prescrição podem ser considerados. As opções incluem lubiprostona, linaclotide, plecanatide ou prucalopride. Esses medicamentos são geralmente usados como monoterapia e não em combinação com outros laxantes. O AGA-ACG recomenda o linaclotide, plecanatide ou prucalopride, e sugere a lubiprostona para os pacientes com constipação idiopática crônica que não responder aos agentes de venda livre.[54]Chang L, Chey WD, Imdad A, et al. American Gastroenterological Association-American College of Gastroenterology clinical practice guideline: pharmacological management of chronic idiopathic constipation. Am J Gastroenterol. 2023 Jun 1;118(6):936-54.
https://journals.lww.com/ajg/fulltext/2023/06000/american_gastroenterological_association_american.13.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37204227?tool=bestpractice.com
Eles não são recomendados para pacientes grávidas, pois há escassez de dados de segurança para uso na gestação.
Foi demonstrado que a lubiprostona (um ativador do canal de cloreto) é mais eficaz que o placebo em aumentar o número de evacuações espontâneas, reduzir o esforço, melhorar a consistência das fezes e aliviar os sintomas da constipação crônica.[65]Johanson JF, Panas R, Holland PC, et al. Long-term efficacy of lubiprostone for the treatment of chronic constipation. Gastroenterology. 2006;130(suppl 2):M1171.[66]Johanson JF, Gargano MA, Holland PC, et al. Initial and sustained effects of lubiprostone, a chloride channel-2 (ClC2) activator for the treatment of constipation: data from a 4-week phase III study. Am J Gastroenterol. 2005;100(suppl 9):S328.[67]Barish CF, Drossman D, Johanson JF, et al. Efficacy and safety of lubiprostone in patients with chronic constipation. Dig Dis Sci. 2010 Apr;55(4):1090-7.
http://www.ncbi.nlm.nih.gov/pubmed/20012484?tool=bestpractice.com
[68]Ford AC, Suares NC. Effect of laxatives and pharmacological therapies in chronic idiopathic constipation: systematic review and meta-analysis. Gut. 2011 Feb;60(2):209-18.
http://www.ncbi.nlm.nih.gov/pubmed/21205879?tool=bestpractice.com
Os eventos adversos mais comuns incluem náuseas (31%), cefaleia (13%), diarreia (13%), dor abdominal (7%) e distensão (7%). A lubiprostona foi retirada do mercado no Reino Unido por razões comerciais.
Linaclotide e plecanatide são agonistas da guanilato ciclase C. Demonstrou-se que esta classe farmacológica é mais efetiva que o placebo em ensaios clínicos, em que foram demonstradas melhoras sustentáveis e rápidas dos hábitos intestinais, sintomas abdominais e intestinais e qualidade de vida em pacientes com constipação crônica.[69]Johnston JM, Kurtz CB, Macdougall JE, et al. Linaclotide improves abdominal pain and bowel habits in a phase IIb study of patients with irritable bowel syndrome with constipation. Gastroenterology. 2010 Dec;139(6):1877-1886.e2.
http://www.ncbi.nlm.nih.gov/pubmed/20801122?tool=bestpractice.com
[70]Lembo AJ, Schneier HA, Shiff SJ, et al. Two randomized trials of linaclotide for chronic constipation. N Engl J Med. 2011 Aug 11;365(6):527-36.
http://www.ncbi.nlm.nih.gov/pubmed/21830967?tool=bestpractice.com
[71]DeMicco M, Barrow L, Hickey B, et al. Randomized clinical trial: efficacy and safety of plecanatide in the treatment of chronic idiopathic constipation. Therap Adv Gastroenterol. 2017 Nov;10(11):837-51.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5673020
http://www.ncbi.nlm.nih.gov/pubmed/29147135?tool=bestpractice.com
O linaclotide demonstrou acelerar o trânsito intestinal em pessoas saudáveis e em mulheres com síndrome do intestino irritável-constipação.[72]Currie MG, Kurtz CB, Mahajan-Miklos S, et al. Effects of a single dose administration of MD-1100 on safety, tolerability, exposure, and stool consistency in healthy subjects. Am J Gastroenterol. 2005;100:S328.[73]Johnston JM, Drossman DA, Lembo A, et al. Late-breaking abstract 65A: Linaclotide improves bowel habits and patient reported outcomes in subjects with chronic constipation. Am J Gastroenterol. 2006;101(suppl 2):S470-S494. O plecanatide demonstrou similarmente aumentar o monofosfato de guanosina cíclico (cGMP) intracelular e promover secreção luminal através do receptor do regulador da condutância transmembrana da fibrose cística (CFTR) para facilitar as evacuações.[71]DeMicco M, Barrow L, Hickey B, et al. Randomized clinical trial: efficacy and safety of plecanatide in the treatment of chronic idiopathic constipation. Therap Adv Gastroenterol. 2017 Nov;10(11):837-51.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5673020
http://www.ncbi.nlm.nih.gov/pubmed/29147135?tool=bestpractice.com
O linaclotide e o plecanatide parece ter poucos efeitos adversos.
A prucaloprida é um agonista do receptor 5-HT4, com propriedades procinéticas. A prucaloprida foi o laxante mais eficaz em 12 semanas, de acordo com uma metanálise.[64]Luthra P, Camilleri M, Burr NE, et al. Efficacy of drugs in chronic idiopathic constipation: a systematic review and network meta-analysis. Lancet Gastroenterol Hepatol. 2019 Nov;4(11):831-44.
http://www.ncbi.nlm.nih.gov/pubmed/31474542?tool=bestpractice.com
Cefaleia, náuseas, dor abdominal e diarreia foram relatadas por mais de 10% dos 4000 pacientes nos três ensaios clínicos de fase 3.[74]Camilleri M, Kerstens R, Rykx A, et al. A placebo-controlled trial of prucalopride for severe chronic constipation. N Engl J Med. 2008 May 29;358(22):2344-54.
http://www.nejm.org/doi/full/10.1056/NEJMoa0800670#t=article
http://www.ncbi.nlm.nih.gov/pubmed/18509121?tool=bestpractice.com
[75]Quigley EM, Vandeplassche L, Kerstens R, et al. Clinical trial: the efficacy, impact on quality of life, and safety and tolerability of prucalopride in severe chronic constipation - a 12-week, randomized, double-blind, placebo-controlled study. Aliment Pharmacol Ther. 2009 Feb 1;29(3):315-28.
http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2036.2008.03884.x/full
http://www.ncbi.nlm.nih.gov/pubmed/19035970?tool=bestpractice.com
[76]Yiannakou Y, Piessevaux H, Bouchoucha M, et al. A randomized, double-blind, placebo-controlled, phase 3 trial to evaluate the efficacy, safety, and tolerability of prucalopride in men with chronic constipation. Am J Gastroenterol. 2015 May;110(5):741-8.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4424376
http://www.ncbi.nlm.nih.gov/pubmed/25869393?tool=bestpractice.com
Nenhum efeito adverso cardíaco clinicamente relevante foi relatado. Em uma metanálise de 14 ECRCs (total de 4328 pacientes), uma dose diária mais baixa obteve o número máximo de evacuações espontâneas semanais, em comparação com doses mais altas, e as doses mais altas foram associadas a um número maior de eventos adversos causados pelo tratamento.[77]Yang T, Wang K, Cao Y, et al. Different doses of prucalopride in treating chronic idiopathic constipation: a meta-analysis and Bayesian analysis. BMJ Open. 2021 Feb;11(2):e039461.
https://bmjopen.bmj.com/content/11/2/e039461.long
http://www.ncbi.nlm.nih.gov/pubmed/33589446?tool=bestpractice.com
Nos EUA, a FDA aprovou uma cápsula vibratória para o tratamento da constipação crônica em adultos que não tiverem apresentado melhora dos sintomas com laxantes após pelo menos 1 mês. A cápsula vibratória é um dispositivo não farmacológico que induz mecanicamente contrações colônicas.[78]Ron Y, Halpern Z, Safadi R, et al. Safety and efficacy of the vibrating capsule, an innovative non-pharmacological treatment modality for chronic constipation. Neurogastroenterol Motil. 2015 Jan;27(1):99-104.
http://www.ncbi.nlm.nih.gov/pubmed/25484196?tool=bestpractice.com
Em um ensaio clínico duplo-cego de fase 3 realizado com pacientes com constipação crônica, uma proporção consideravelmente maior de pacientes que receberam a cápsula vibratória apresentou ≥1 evacuação espontânea completa por semana, em comparação com aqueles que receberam uma cápsula simulada placebo (39.3% versus 22.1%).[79]Rao SSC, Quigley EMM, Chey WD, et al. Randomized placebo-controlled phase 3 trial of vibrating capsule for chronic constipation. Gastroenterology. 2023 Jun;164(7):1202-10.e6.
https://www.gastrojournal.org/article/S0016-5085(23)00149-X/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/36822371?tool=bestpractice.com
Os estudos também relataram melhoras na qualidade de vida e efeitos adversos gastrointestinais leves.[79]Rao SSC, Quigley EMM, Chey WD, et al. Randomized placebo-controlled phase 3 trial of vibrating capsule for chronic constipation. Gastroenterology. 2023 Jun;164(7):1202-10.e6.
https://www.gastrojournal.org/article/S0016-5085(23)00149-X/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/36822371?tool=bestpractice.com
[80]Zhu JH, Qian YY, Pan J, et al. Efficacy and safety of vibrating capsule for functional constipation (VICONS): a randomised, double-blind, placebo-controlled, multicenter trial. EClinicalMedicine. 2022 May;47:101407.
https://www.thelancet.com/action/showPdf?pii=S2589-5370%2822%2900137-7
http://www.ncbi.nlm.nih.gov/pubmed/35518121?tool=bestpractice.com
Caso não haja nenhuma evacuação em ≥3 dias consecutivos com o uso da cápsula vibratória, considere a terapia adjuvante com laxante.
Enemas, supositórios e manobras digitais normalmente não são recomendados para o manejo da constipação crônica. No entanto, eles são comumente usados, apesar da ausência de evidências robustas. Os supositórios não estão associados a qualquer risco óbvio, mas os enemas devem ser evitados nos pacientes com desequilíbrio eletrolítico ou fluídico.[18]Serra J, Pohl D, Azpiroz F, et al. European society of neurogastroenterology and motility guidelines on functional constipation in adults. Neurogastroenterol Motil. 2020 Feb;32(2):e13762.
https://onlinelibrary.wiley.com/doi/10.1111/nmo.13762
http://www.ncbi.nlm.nih.gov/pubmed/31756783?tool=bestpractice.com
Constipação induzida por opioides
O uso dos opioides deve ser reavaliado sempre que necessário. Outras causas ou fatores subjacentes que puderem contribuir para a constipação também devem ser considerados e descartados.[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
Os laxantes tradicionais são recomendados como terapia de primeira linha para a constipação induzida por opioides. Os laxantes osmóticos ou estimulantes são preferíveis.[52]Larkin PJ, Cherny NI, La Carpia D, et al. Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(suppl 4):iv111-25.
https://www.annalsofoncology.org/article/S0923-7534(19)31697-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30016389?tool=bestpractice.com
[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
Se a resposta a um único agente for inadequada, algumas diretrizes recomendam a combinação de um laxante osmótico e um estimulante antes de intensificar a terapia.[52]Larkin PJ, Cherny NI, La Carpia D, et al. Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(suppl 4):iv111-25.
https://www.annalsofoncology.org/article/S0923-7534(19)31697-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30016389?tool=bestpractice.com
[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
O docusato normalmente não é recomendado, devido à ausência de evidências.[52]Larkin PJ, Cherny NI, La Carpia D, et al. Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(suppl 4):iv111-25.
https://www.annalsofoncology.org/article/S0923-7534(19)31697-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30016389?tool=bestpractice.com
As fibras (inclusive laxantes formadores de volume fecal, como a ispágula) podem ser úteis para os pacientes com dieta com deficiência de fibras, mas não costumam ser recomendadas para o tratamento da constipação induzida por opioides porque não afetam a motilidade colônica.[51]De Giorgio R, Zucco FM, Chiarioni G, et al. Management of opioid-induced constipation and bowel dysfunction: expert opinion of an Italian multidisciplinary panel. Adv Ther. 2021 Jul;38(7):3589-621.
https://link.springer.com/article/10.1007/s12325-021-01766-y
http://www.ncbi.nlm.nih.gov/pubmed/34086265?tool=bestpractice.com
[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
Os antagonistas do receptor mu-opioide de ação periférica, como a naldemedina, o naloxegol e a metilnaltrexona, são recomendados para a constipação induzida por opioides refratária a laxantes.[18]Serra J, Pohl D, Azpiroz F, et al. European society of neurogastroenterology and motility guidelines on functional constipation in adults. Neurogastroenterol Motil. 2020 Feb;32(2):e13762.
https://onlinelibrary.wiley.com/doi/10.1111/nmo.13762
http://www.ncbi.nlm.nih.gov/pubmed/31756783?tool=bestpractice.com
[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
Eles podem ser usados como monoterapia, mas normalmente são usados em combinação com um laxante osmótico ou estimulante.[82]National Institute for Health and Care Excellence. Naldemedine for treating opioid-induced constipation. Sep 2020 [internet publication].
https://www.nice.org.uk/guidance/ta651
Os dados que apoiam a naldemedina são provenientes de um ensaio clínico de fase 2 e três ensaios clínicos de fase 3.[83]Webster LR, Yamada T, Arjona Ferreira JC. A phase 2b, Randomized, double-blind placebo-controlled study to evaluate the efficacy and safety of naldemedine for the treatment of opioid-induced constipation in patients with chronic noncancer pain. Pain Med. 2017 Dec;18(12):2350-60.
https://academic.oup.com/painmedicine/article/18/12/2350/3078985?login=false
http://www.ncbi.nlm.nih.gov/pubmed/28371937?tool=bestpractice.com
[84]Hale M, Wild J, Reddy J, et al. Naldemedine versus placebo for opioid-induced constipation (COMPOSE-1 and COMPOSE-2): two multicentre, phase 3, double-blind, randomised, parallel-group trials. Lancet Gastroenterol Hepatol. 2017 Aug;2(8):555-64.
http://www.ncbi.nlm.nih.gov/pubmed/28576452?tool=bestpractice.com
[85]Webster LR, Nalamachu S, Morlion B, et al. Long-term use of naldemedine in the treatment of opioid-induced constipation in patients with chronic noncancer pain: a randomized, double-blind, placebo-controlled phase 3 study. Pain. 2018 May;159(5):987-94.
https://journals.lww.com/pain/fulltext/2018/05000/long_term_use_of_naldemedine_in_the_treatment_of.18.aspx
http://www.ncbi.nlm.nih.gov/pubmed/29419653?tool=bestpractice.com
A eficácia de naloxegol foi comprovada em um ensaio clínico de fase 2 e dois ECRCs de fase 3.[86]Webster L, Dhar S, Eldon M, et al. A phase 2, double-blind, randomized, placebo-controlled, dose-escalation study to evaluate the efficacy, safety, and tolerability of naloxegol in patients with opioid-induced constipation. Pain. 2013 Sep;154(9):1542-50.
http://www.ncbi.nlm.nih.gov/pubmed/23726675?tool=bestpractice.com
[87]Chey WD, Webster L, Sostek M, et al. Naloxegol for opioid-induced constipation in patients with noncancer pain. N Engl J Med. 2014 Jun 19;370(25):2387-96.
http://www.ncbi.nlm.nih.gov/pubmed/24896818?tool=bestpractice.com
[88]Chey WD, Brenner DM, Cash BD, et al. Efficacy and safety of naloxegol in patients with chronic non-cancer pain who experience opioid induced constipation: a pooled analysis of two global, randomized controlled studies. J Pain Res. 2023;16:2943-53.
https://www.dovepress.com/efficacy-and-safety-of-naloxegol-in-patients-with-chronic-non-cancer-p-peer-reviewed-fulltext-article-JPR
http://www.ncbi.nlm.nih.gov/pubmed/37664485?tool=bestpractice.com
A qualidade das evidências que dão suporte à metilnaltrexona não é tão robusta.[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
De cinco ECRCs, apenas três examinaram um desfecho de ≥3 evacuações espontâneas por semana, e a maioria dos estudos foi realizada em pacientes com câncer. No entanto, a formulação subcutânea da metilnaltrexona é vantajosa para os pacientes que não toleram medicamentos por via oral.[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
Os efeitos adversos mais comuns da metilnaltrexona são cólica abdominal e flatulência. Surgiram preocupações acerca de dor abdominal grave e perfuração intestinal em pacientes com câncer avançado que recebiam metilnaltrexona para constipação induzida por opioides. Essas preocupações levaram a Food and Drug Administration (FDA) a publicar um aviso para os médicos nos EUA para administrar com certa atenção a metilnaltrexona em pacientes com suspeita de lesões na parede intestinal conhecidas, e para interromper o tratamento com metilnaltrexona imediatamente se os sintomas gastrointestinais piorarem.[89]US Food and Drug Administration (FDA). MedWatch safety information: Relistor (methylnaltrexone bromide) subcutaneous injections. August 2013 [internet publication].
https://www.accessdata.fda.gov/drugsatfda_docs/label/2013/021964s011lbl.pdf
Independentemente disso, uma análise combinada mostrou redução na mortalidade por todas as causas em pacientes com câncer e sem câncer com constipação induzida por opioides que tomaram metilnaltrexona, em comparação com placebo.[90]Webster LR, Brenner D, Israel RJ, et al. Reductions in all-cause mortality associated with the use of methylnaltrexone for opioid-induced bowel disorders: a pooled analysis. Pain Med. 2023 Mar;24(3):341-50.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9977130
http://www.ncbi.nlm.nih.gov/pubmed/36102822?tool=bestpractice.com
Uma revisão Cochrane de antagonistas do receptor mu-opioide de ação periférica para a disfunção intestinal induzida por opioides concluiu que evidências de certeza moderada apoiam a eficácia da naldemedina para indivíduos com câncer, e da metilnaltrexona subcutânea para indivíduos em recebimento de cuidados paliativos.[91]Candy B, Jones L, Vickerstaff V, et al. Mu-opioid antagonists for opioid-induced bowel dysfunction in people with cancer and people receiving palliative care. Cochrane Database Syst Rev. 2022 Sep;9(9):CD006332.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006332.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36106667?tool=bestpractice.com
A lubiprostona também está aprovada pela FDA para o tratamento da constipação induzida por opioides em adultos com dor não relacionada aocâncer, e ensaios clínicos de fase 3 constataram que a lubiprostona foi mais eficaz que placebo para a constipação induzida por opioides.[92]Webster LR, Brewer RP, Lichtlen P, et al. Efficacy of lubiprostone for the treatment of opioid-induced constipation, analyzed by opioid class. Pain Med. 2018 Jun;19(6):1195-205.
https://academic.oup.com/painmedicine/article/19/6/1195/4396351?login=false
http://www.ncbi.nlm.nih.gov/pubmed/29897589?tool=bestpractice.com
Entretanto, na prática, os antagonistas do receptor mu-opioide de ação periférica e laxantes (por exemplo, PEG ou compostos de magnésio) são preferíveis, devido ao alto custo da lubiprostona. Outros procinéticos e secretagogos (por exemplo, linaclotide, plecanatide, prucalopride) não estão aprovados pela FDA para a constipação induzida por opioides.
Os pacientes com constipação induzida por opioides também devem ser orientados sobre mudanças alimentares e no estilo de vida adequadas, ajustadas de acordo com o cenário clínico e as doenças subjacentes.[52]Larkin PJ, Cherny NI, La Carpia D, et al. Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(suppl 4):iv111-25.
https://www.annalsofoncology.org/article/S0923-7534(19)31697-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30016389?tool=bestpractice.com
[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
Não há evidências para dar suporte ao uso de enemas e supositórios para o tratamento da constipação induzida por opioides, e seu uso é limitado pela inconveniência e preocupações de segurança.[51]De Giorgio R, Zucco FM, Chiarioni G, et al. Management of opioid-induced constipation and bowel dysfunction: expert opinion of an Italian multidisciplinary panel. Adv Ther. 2021 Jul;38(7):3589-621.
https://link.springer.com/article/10.1007/s12325-021-01766-y
http://www.ncbi.nlm.nih.gov/pubmed/34086265?tool=bestpractice.com
[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
No entanto, medidas de defecação, como enemas, supositórios, solução de PEG em grande volume, laxantes estimulantes ou desimpactação com sedação podem ser necessários se houver impactação fecal.[51]De Giorgio R, Zucco FM, Chiarioni G, et al. Management of opioid-induced constipation and bowel dysfunction: expert opinion of an Italian multidisciplinary panel. Adv Ther. 2021 Jul;38(7):3589-621.
https://link.springer.com/article/10.1007/s12325-021-01766-y
http://www.ncbi.nlm.nih.gov/pubmed/34086265?tool=bestpractice.com
[52]Larkin PJ, Cherny NI, La Carpia D, et al. Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(suppl 4):iv111-25.
https://www.annalsofoncology.org/article/S0923-7534(19)31697-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30016389?tool=bestpractice.com
[81]Crockett SD, Greer KB, Heidelbaugh JJ, et al. American Gastroenterological Association Institute guideline on the medical management of opioid-induced constipation. Gastroenterology. 2019 Jan;156(1):218-26.
https://www.gastrojournal.org/article/S0016-5085(18)34782-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/30340754?tool=bestpractice.com
Enemas são contraindicados para os pacientes com neutropenia, trombocitopenia, obstrução intestinal, cirurgia colorretal ou ginecológica recente, colite inflamatória, megacólon tóxico, infecção ou inflamação abdominal, trauma anal ou retal recente, dor abdominal não diagnosticada ou radioterapia pélvica recente.[51]De Giorgio R, Zucco FM, Chiarioni G, et al. Management of opioid-induced constipation and bowel dysfunction: expert opinion of an Italian multidisciplinary panel. Adv Ther. 2021 Jul;38(7):3589-621.
https://link.springer.com/article/10.1007/s12325-021-01766-y
http://www.ncbi.nlm.nih.gov/pubmed/34086265?tool=bestpractice.com
[52]Larkin PJ, Cherny NI, La Carpia D, et al. Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(suppl 4):iv111-25.
https://www.annalsofoncology.org/article/S0923-7534(19)31697-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/30016389?tool=bestpractice.com
Suspeita de dissinergia
Os pacientes com suspeita de dissinergia já teriam sido tratados da mesma maneira que pacientes com constipação primária crônica, com educação, modificações no estilo de vida, dieta rica em fibras, laxantes expansores do volume fecal, maior consumo de líquidos e exercícios. Também podem ser tratados com laxantes osmóticos ou estimulantes e/ou amolecedores de fezes.
Quando eles são inefetivos, a possibilidade de dissinergia deve ser considerada.[9]Bharucha AE, Dorn SD, Lembo A, et al. American Gastroenterological Association medical position statement on constipation. Gastroenterology. 2013 Jan;144(1):211-7.
http://www.gastrojournal.org/article/S0016-5085(12)01545-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/23261064?tool=bestpractice.com
Os sintomas associados incluem a sensação de bloqueio anal, esforço e uso de manobras digitais para auxiliar na defecação. O diagnóstico é confirmado com testes fisiológicos. Consulte Abordagem do diagnóstico.
O biofeedback (retreinamento do intestino) foi considerado efetivo no tratamento da dissinergia.[93]Rao SS, Seaton K, Miller M, et al. Randomized controlled trial of biofeedback, sham feedback, and standard therapy for dyssynergic defecation. Clin Gastroenterol Hepatol. 2007 Mar;5(3):331-8.
http://www.ncbi.nlm.nih.gov/pubmed/17368232?tool=bestpractice.com
[94]Rao SS, Kinkade K, Miller MJ, et al. Randomized controlled trial of long term outcome of biofeedback therapy (BT) for dyssynergic defecation. Am J Gastroenterol. 2005;100:386.[95]Heymen S, Wexner SD, Vickers D, et al. Prospective, randomized trial comparing for biofeedback techniques for patients with constipation. Dis Colon Rectum. 1999 Nov;42(11):1388-93.
http://www.ncbi.nlm.nih.gov/pubmed/10566525?tool=bestpractice.com
[96]Chiarioni G, Whitehead WE, Pezza V, et al. Biofeedback is superior to laxatives for normal transit constipation due to pelvic floor dyssynergia. Gastroenterology. 2006 Mar;130(3):657-64.
http://www.ncbi.nlm.nih.gov/pubmed/16530506?tool=bestpractice.com
As técnicas de biofeedback usadas para melhorar a coordenação dos músculos abdominais e anorretais incluem:
Treinamento do músculo diafragmático com defecação simulada
Retreinamento manométrico conduzido do assoalho pélvico
Treinamento de defecação simulada.
Três ECRCs compararam a terapia de biofeedback com o feedback simulado ou terapia farmacológica ou placebo; os três ensaios constataram que a terapia de biofeedback foi mais efetiva.[93]Rao SS, Seaton K, Miller M, et al. Randomized controlled trial of biofeedback, sham feedback, and standard therapy for dyssynergic defecation. Clin Gastroenterol Hepatol. 2007 Mar;5(3):331-8.
http://www.ncbi.nlm.nih.gov/pubmed/17368232?tool=bestpractice.com
[95]Heymen S, Wexner SD, Vickers D, et al. Prospective, randomized trial comparing for biofeedback techniques for patients with constipation. Dis Colon Rectum. 1999 Nov;42(11):1388-93.
http://www.ncbi.nlm.nih.gov/pubmed/10566525?tool=bestpractice.com
[96]Chiarioni G, Whitehead WE, Pezza V, et al. Biofeedback is superior to laxatives for normal transit constipation due to pelvic floor dyssynergia. Gastroenterology. 2006 Mar;130(3):657-64.
http://www.ncbi.nlm.nih.gov/pubmed/16530506?tool=bestpractice.com
Dois ECRCs relataram melhora sustentada (1 ano) dos sintomas e função colorretal, confirmando a eficácia de longo prazo da terapia de biofeedback.[94]Rao SS, Kinkade K, Miller MJ, et al. Randomized controlled trial of long term outcome of biofeedback therapy (BT) for dyssynergic defecation. Am J Gastroenterol. 2005;100:386.[96]Chiarioni G, Whitehead WE, Pezza V, et al. Biofeedback is superior to laxatives for normal transit constipation due to pelvic floor dyssynergia. Gastroenterology. 2006 Mar;130(3):657-64.
http://www.ncbi.nlm.nih.gov/pubmed/16530506?tool=bestpractice.com
Um estudo comparou a terapia de biofeedback em casa com a terapia de biofeedback padrão com 6 sessões em consultório ao longo de 3 meses e relatou que, aproximadamente, 70% dos pacientes de ambos os grupos alcançaram os desfechos primários (isto é, normalização da dissinergia e melhora no número de evacuações espontâneas completas por semana).[97]Rao SSC, Valestin JA, Xiang X, et al. Home-based versus office-based biofeedback therapy for constipation with dyssynergic defecation: a randomised controlled trial. Lancet Gastroenterol Hepatol. 2018 Nov;3(11):768-77.
http://www.ncbi.nlm.nih.gov/pubmed/30236904?tool=bestpractice.com
Sessenta por cento dos pacientes com defecação dissinérgica tinham sensação retal prejudicada, e o condicionamento sensorial retal forneceu benefício terapêutico adicional.[94]Rao SS, Kinkade K, Miller MJ, et al. Randomized controlled trial of long term outcome of biofeedback therapy (BT) for dyssynergic defecation. Am J Gastroenterol. 2005;100:386.[98]Rao SS, Enck P, Loening-Baucke V. Biofeedback therapy for defecation disorders. Dig Dis. 1997;15(suppl 1):78-92.
http://www.ncbi.nlm.nih.gov/pubmed/9177947?tool=bestpractice.com
Um ECRC constatou que o treinamento sensorial assistido por baróstato foi superior ao treinamento sensorial assistido por seringa.[99]Rao SSC, Yan Y, Erdogan A, et al. Barostat or syringe-assisted sensory biofeedback training for constipation with rectal hyposensitivity: a randomized controlled trial. Neurogastroenterol Motil. 2022 Mar;34(3):e14226.
https://onlinelibrary.wiley.com/doi/10.1111/nmo.14226
http://www.ncbi.nlm.nih.gov/pubmed/34431186?tool=bestpractice.com
Em pacientes com dissinergia confirmada, o uso de laxantes deve ser suspenso gradualmente. As mudanças no estilo de vida e na dieta são continuadas, incluindo ingestão diária adequada de fluidos e maior consumo de fibras na dieta.
Constipação crônica persistente apesar de terapia medicamentosa e medidas de estilo de vida
Os pacientes com sintomas persistentes (durante vários meses a anos) que não respondem ao tratamento clínico podem ser encaminhados para um centro especializado para consideração de cirurgia, o que pode incluir colectomia e cecostomia. Esses pacientes passam por uma avaliação de motilidade do intestino delgado e do trato gastrointestinal superior, junto com uma avaliação detalhada da motilidade colônica com manometria colônica. A cirurgia é reservada aos pacientes refratários com neuropatia colônica grave e motilidades gástrica e do intestino delgado relativamente preservadas. Todos os outros pacientes continuam em tratamento clínico.
Se os pacientes tiverem tido falhas em todas as terapias e houver evidência de disfunção de motilidade não limitada ao cólon (em outras palavras, se eles tiverem alteração da motilidade gástrica ou do intestino delgado), a cirurgia tem pouca probabilidade de produzir benefício. O tratamento adicional envolve uma abordagem multidisciplinar, incluindo abordar nutrição, terapia comportamental, biofeedback, psicoterapia e laxantes cíclicos. As evidências para esse tipo de terapia são principalmente anedóticas.
Cecostomia geralmente é preferida em pacientes institucionalizados e em pacientes com lesões neurológicas em quem parece haver uma alta taxa de sucesso, com resultados satisfatórios de 40% a 78%.[100]Lees NP, Hodson P, Hill J, et al. Long-term results of the antegrade continent enema procedure for constipation in adults. Colorectal Dis. 2004 Sep;6(5):362-8.
http://www.ncbi.nlm.nih.gov/pubmed/15335371?tool=bestpractice.com
Várias técnicas de colectomia foram defendidas para o tratamento de constipação crônica, incluindo colectomia segmentar, anastomose ileorretal, anastomose ileosigmoide, anastomose cecorretal, anastomose ileoanal com proctocolectomia e formação de bolsa ou ileostomia.[101]Pemberton JH, Rath DM, Ilstrup DM. Evaluation and surgical treatment of severe chronic constipation. Ann Surg. 1991 Oct;214(4):403-11.
http://www.ncbi.nlm.nih.gov/pubmed/1953096?tool=bestpractice.com
A cirurgia também mostrou estar associada com um maior grau de satisfação do paciente.[102]Arebi N, Kalli T, Howson W, et al. Systematic review of abdominal surgery for chronic idiopathic constipation. Colorectal Dis. 2011 Dec;13(12):1335-43.
http://www.ncbi.nlm.nih.gov/pubmed/20969711?tool=bestpractice.com
A maioria dessas cirurgias pode ser realizada laparoscopicamente.

