O diagnóstico da síndrome miastênica de Lambert-Eaton (LEMS) é corroborado por exames eletrofisiológicos e sorológicos. O câncer é constatado no início da doença ou subsequentemente em 40% a 54% dos pacientes com LEMS associada a câncer (CA-LEMS); o câncer pulmonar de células pequenas (CPCP) é o câncer mais comumente associado.[2]O'Neill JH, Murray NM, Newsom-Davis J. The Lambert-Eaton myasthenic syndrome. A review of 50 cases. Brain. 1988 Jun;111(pt 3):577-96.
http://www.ncbi.nlm.nih.gov/pubmed/2838124?tool=bestpractice.com
[8]Titulaer MJ, Wirtz PW, Willems LN, et al. Screening for small-cell lung cancer: a follow-up study of patients with Lambert-Eaton myasthenic syndrome. J Clin Oncol. 2008 Sep 10;26(26):4276-81.
http://www.ncbi.nlm.nih.gov/pubmed/18779614?tool=bestpractice.com
[9]Titulaer MJ, Lang B, Verschuuren JJ. Lambert-Eaton myasthenic syndrome: from clinical characteristics to therapeutic strategies. Lancet Neurol. 2011 Dec;10(12):1098-107.
http://www.ncbi.nlm.nih.gov/pubmed/22094130?tool=bestpractice.com
Por isso, é essencial fazer uma avaliação cuidadosa para verificar a presença de um câncer subjacente.
Na ausência de neoplasia maligna, a comprovação de um distúrbio autoimune coexistente no início da evolução da LEMS aumenta a probabilidade de uma LEMS não paraneoplásica (NCA-LEMS). O hormônio estimulante da tireoide deve ser dosado em todos os pacientes com LEMS para verificar a presença de disfunção tireoidiana comórbida. Se o paciente estiver sintomático, deve-se considerar a avaliação para um outro distúrbio autoimune coexistente (por exemplo, artrite reumatoide, lúpus eritematoso sistêmico [LES], vasculite sistêmica, anemia perniciosa). Entretanto, o monitoramento de rotina para distúrbios autoimunes não é necessário, a menos que os sintomas justifiquem.
Anamnese e exame físico
A anamnese deve incluir uma avaliação dos fatores de risco conhecidos para o CPCP (por exemplo, história de tabagismo), e para qualquer distúrbio autoimune coexistente ou história familiar de distúrbio autoimune.[10]Wirtz PW, Bradshaw J, Wintzen AR, et al. Associated autoimmune diseases in patients with the Lambert-Eaton myasthenic syndrome and their families. J Neurol. 2004 Oct;251(10):1255-9.
http://www.ncbi.nlm.nih.gov/pubmed/15503107?tool=bestpractice.com
[12]Wirtz PW, Smallegange TM, Wintzen AR, et al. Differences in clinical features between the Lambert-Eaton myasthenic syndrome with and without cancer: an analysis of 227 published cases. Clin Neurol Neurosurg. 2002 Sep;104(4):359-63.
http://www.ncbi.nlm.nih.gov/pubmed/12140105?tool=bestpractice.com
O início dos sintomas da LEMS ocorre em idade mais avançada, tipicamente entre os 50 e 60 anos, embora crianças e adultos jovens possam raramente ser afetados. Geralmente, o início dos sintomas é insidioso, mas pode ser mais agudo em associação com uma infecção, com exposição a agentes bloqueadores neuromusculares, ou em associação com malignidade. A dispneia pode indicar uma fraqueza respiratória ou bulbar intensa, e é uma emergência neurológica.
Fadiga generalizada, fraqueza proximal nas pernas e xerostomia são sintomas iniciais comuns e podem oscilar durante o dia. A fraqueza começa na região proximal das pernas, tipicamente na flexão e abdução do quadril, com avanço variável e, subsequentemente, em geral afeta a região proximal dos braços. Os músculos distais dos membros podem estar envolvidos; isso é mais comum na CA-LEMS.[1]Titulaer MJ, Wirtz PW, Kuks JB, et al. The Lambert-Eaton myasthenic syndrome 1988-2008: a clinical picture in 97 patients. J Neuroimmunol. 2008 Sep 15;201-2:153-8.
http://www.ncbi.nlm.nih.gov/pubmed/18644631?tool=bestpractice.com
A fraqueza objetiva geralmente é leve, comparada aos sintomas relatados. Os reflexos tendinosos estão reduzidos ou ausentes na maioria dos pacientes, mas podem estar preservados no início da doença. Frequentemente, os reflexos hipoativos podem ser potencializados por uma contração curta e isométrica do músculo apropriado.[2]O'Neill JH, Murray NM, Newsom-Davis J. The Lambert-Eaton myasthenic syndrome. A review of 50 cases. Brain. 1988 Jun;111(pt 3):577-96.
http://www.ncbi.nlm.nih.gov/pubmed/2838124?tool=bestpractice.com
A força pode melhorar após o exercício e, em seguida, diminuir enquanto a atividade é mantida. Pode-se observar uma marcha 'anserina'.
A disartria é comum, ocorrendo em até 71% dos pacientes com LEMS, embora geralmente ela ocorra tardiamente na evolução da doença.[1]Titulaer MJ, Wirtz PW, Kuks JB, et al. The Lambert-Eaton myasthenic syndrome 1988-2008: a clinical picture in 97 patients. J Neuroimmunol. 2008 Sep 15;201-2:153-8.
http://www.ncbi.nlm.nih.gov/pubmed/18644631?tool=bestpractice.com
A presença de fraqueza ocular proeminente com ptose e diplopia binocular no início da evolução da doença pode simular miastenia gravis. A disfagia é relatada em até 43% dos pacientes com LEMS. É importante que ela seja identificada, pois uma dificuldade proeminente de deglutição pode requerer uma terapia mais agressiva.[1]Titulaer MJ, Wirtz PW, Kuks JB, et al. The Lambert-Eaton myasthenic syndrome 1988-2008: a clinical picture in 97 patients. J Neuroimmunol. 2008 Sep 15;201-2:153-8.
http://www.ncbi.nlm.nih.gov/pubmed/18644631?tool=bestpractice.com
Boca seca (xerostomia) é o sintoma autonômico encontrado com mais frequência, ocorrendo em até 78% dos pacientes e, frequentemente, precede outros sintomas.[1]Titulaer MJ, Wirtz PW, Kuks JB, et al. The Lambert-Eaton myasthenic syndrome 1988-2008: a clinical picture in 97 patients. J Neuroimmunol. 2008 Sep 15;201-2:153-8.
http://www.ncbi.nlm.nih.gov/pubmed/18644631?tool=bestpractice.com
Isso pode se manifestar no paciente como um 'gosto metálico'. Outras manifestações incluem dilatação pupilar ou hipotensão ortostática. Impotência masculina e avanço da fraqueza para os músculos extraoculares, bulbares e distais nos primeiros 6 meses após o início é altamente sugestivo de CA-LEMS.[1]Titulaer MJ, Wirtz PW, Kuks JB, et al. The Lambert-Eaton myasthenic syndrome 1988-2008: a clinical picture in 97 patients. J Neuroimmunol. 2008 Sep 15;201-2:153-8.
http://www.ncbi.nlm.nih.gov/pubmed/18644631?tool=bestpractice.com
Uma evidência de ataxia cerebelar é incomum; se presente, sugere uma síndrome paraneoplásica mais disseminada associada a um CPCP subjacente com uma síndrome cerebelar paraneoplásica com canais de cálcio dependentes de voltagem (VGCCs) do tipo P/Q reduzidos na camada molecular do cerebelo.[1]Titulaer MJ, Wirtz PW, Kuks JB, et al. The Lambert-Eaton myasthenic syndrome 1988-2008: a clinical picture in 97 patients. J Neuroimmunol. 2008 Sep 15;201-2:153-8.
http://www.ncbi.nlm.nih.gov/pubmed/18644631?tool=bestpractice.com
[21]Fukuda T, Motomura M, Nakao Y, et al. Reduction of P/Q-type calcium channels in the postmortem cerebellum of paraneoplastic cerebellar degeneration with Lambert-Eaton myasthenic syndrome. Ann Neurol. 2003 Jan;53(1):21-8.
http://www.ncbi.nlm.nih.gov/pubmed/12509844?tool=bestpractice.com
Eletrofisiologia
Os exames eletrofisiológicos devem ser realizados para a maioria dos pacientes. Estudos de condução nervosa e de estimulação nervosa repetitiva (RNS) de baixa frequência são realizados como testes iniciais.
Estudos de condução nervosa: normalmente a amplitude inicial do potencial de ação muscular composto é baixa na LEMS. Após 10 segundos de exercício isométrico, observa-se uma facilitação ≥100% em pelo menos um músculo em 90% dos pacientes com LEMS. A facilitação pós-exercício varia, mas é maior nos músculos distais.[22]Tim RW, Massey JM, Sanders DB. Lambert-Eaton myasthenic syndrome (LEMS). Clinical and electrodiagnostic features and response to therapy in 59 patients. Ann N Y Acad Sci. 1998 May 13;841:823-6.
http://www.ncbi.nlm.nih.gov/pubmed/9668336?tool=bestpractice.com
Os pacientes negativos para anticorpos contra VGCC podem ter uma facilitação menos pronunciada.[23]Oh SJ, Hatanaka Y, Claussen GC, et al. Electrophysiological differences in seropositive and seronegative Lambert-Eaton myasthenic syndrome. Muscle Nerve. 2007 Feb;35(2):178-83.
http://www.ncbi.nlm.nih.gov/pubmed/17058271?tool=bestpractice.com
RNS de baixa frequência: um decréscimo de >10% na amplitude entre o primeiro e o quarto potenciais de ação muscular composto provocado pela estimulação de baixa frequência (2 a 3 Hz) é uma medida sensível para a LEMS, com quase 100% de sensibilidade quando os músculos distais dos membros são estudados.[22]Tim RW, Massey JM, Sanders DB. Lambert-Eaton myasthenic syndrome (LEMS). Clinical and electrodiagnostic features and response to therapy in 59 patients. Ann N Y Acad Sci. 1998 May 13;841:823-6.
http://www.ncbi.nlm.nih.gov/pubmed/9668336?tool=bestpractice.com
Falso-negativos podem ser observados nos membros frios e/ou com relaxamento incompleto dos músculos. Esse achado é relativamente menos específico, pois pode ser observado em outras doenças da junção neuromuscular (por exemplo, miastenia gravis), e em processos neuropáticos motores (por exemplo, esclerose lateral amiotrófica). Um padrão de decréscimo progressivo da amplitude do potencial de ação muscular composto é normalmente observado na LEMS, em vez do padrão clássico em “forma de sela” observado na miastenia gravis.[24]Sanders DB, Cao L, Massey JM, et al. Is the decremental pattern in Lambert-Eaton syndrome different from that in myasthenia gravis? Clin Neurophysiol. 2014 Jun;125(6):1274-7.
http://www.ncbi.nlm.nih.gov/pubmed/24332471?tool=bestpractice.com
[25]Baslo MB, Deymeer F, Serdaroglu P, et al. Decrement pattern in Lambert-Eaton myasthenic syndrome is different from myasthenia gravis. Neuromuscul Disord. 2006 Jul;16(7):454-8.
http://www.ncbi.nlm.nih.gov/pubmed/16806929?tool=bestpractice.com
RNS de alta frequência: a RNS realizada a 20 a 50 Hz para demonstrar que a facilitação tetânica não é significativamente superior em termos diagnósticos em relação à facilitação pós-exercício com 10 segundos de exercício isométrico voluntário máximo. Uma facilitação pós-exercício ou tetânica de pelo menos 100%, com RNS de alta frequência no músculo abdutor do quinto dedo é razoavelmente específica para o diagnóstico de LEMS.[23]Oh SJ, Hatanaka Y, Claussen GC, et al. Electrophysiological differences in seropositive and seronegative Lambert-Eaton myasthenic syndrome. Muscle Nerve. 2007 Feb;35(2):178-83.
http://www.ncbi.nlm.nih.gov/pubmed/17058271?tool=bestpractice.com
[26]AAEM Quality Assurance Committee, American Association of Electrodiagnostic Medicine. Practice parameter for repetitive nerve stimulation and single fiber EMG evaluation of adults with suspected myasthenia gravis or Lambert-Eaton myasthenic syndrome: summary statement. Muscle Nerve. 2001 Sep;24(9):1236-8.
http://www.aanem.org/AANEM/media/AANEM/Documents/Practice/Practice%20Guidelines/myastheniagravis.pdf
http://www.ncbi.nlm.nih.gov/pubmed/11494280?tool=bestpractice.com
Na LEMS, a facilitação pós-exercício dura alguns segundos, ao contrário do botulismo, em que a facilitação pode ser sustentada por vários minutos.
Eletromiografia de fibra única: investigação altamente sensível para disfunção da junção neuromuscular.[26]AAEM Quality Assurance Committee, American Association of Electrodiagnostic Medicine. Practice parameter for repetitive nerve stimulation and single fiber EMG evaluation of adults with suspected myasthenia gravis or Lambert-Eaton myasthenic syndrome: summary statement. Muscle Nerve. 2001 Sep;24(9):1236-8.
http://www.aanem.org/AANEM/media/AANEM/Documents/Practice/Practice%20Guidelines/myastheniagravis.pdf
http://www.ncbi.nlm.nih.gov/pubmed/11494280?tool=bestpractice.com
[27]Oh SJ, Ohira M. Single-fiber EMG and clinical correlation in Lambert-Eaton myasthenic syndrome. Muscle Nerve. 2013 May;47(5):664-7.
http://www.ncbi.nlm.nih.gov/pubmed/23505075?tool=bestpractice.com
Registros de ≥2 fibras musculares inervadas pelo mesmo axônio, obtidos com eletrodos de agulhas especializadas, mostram um aumento anormal da variabilidade dos intervalos de tempo entre os potenciais de ação na fibra muscular (jitter), ou falha na transmissão neuromuscular (bloqueio). Assim como em outros distúrbios da junção neuromuscular pré-sináptica (por exemplo, botulismo), o jitter e o bloqueio na LEMS dependem da frequência, melhorando com taxas maiores de disparos motores axonais, tanto por ativação voluntária como por estimulação axonal.[Figure caption and citation for the preceding image starts]: Potenciais de ação muscular compostos (músculo abdutor do quinto dedo) após estimulação do nervo ulnar; (A) em repouso; (B) imediatamente após 10 segundos de contração voluntária máxima demonstrando facilitação de 1500% pós-exercícioDo acervo do Dr Vern C. Juel [Citation ends].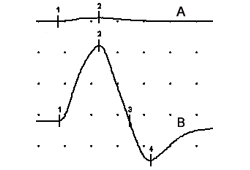
Sorologia de autoanticorpos
A sorologia para VGCCs deve ser avaliada. Anticorpos anti-VGCCs são relatados em 76% a 95% dos pacientes com LEMS.[3]Sanders DB, Juel VC. Chapter 9 The Lambert-Eaton myasthenic syndrome. Handb Clin Neurol. 2008;91:273-83.
http://www.ncbi.nlm.nih.gov/pubmed/18631847?tool=bestpractice.com
[20]Lennon VA, Kryzer TJ, Griesmann GE, et al. Calcium-channel antibodies in the Lambert-Eaton syndrome and other paraneoplastic syndromes. N Engl J Med. 1995 Jun 1;332(22):1467-74.
http://www.nejm.org/doi/full/10.1056/NEJM199506013322203#t=article
http://www.ncbi.nlm.nih.gov/pubmed/7739683?tool=bestpractice.com
[28]Nakao YK, Motomura M, Fukudome T, et al. Seronegative Lambert-Eaton myasthenic syndrome: study of 110 Japanese patients. Neurology. 2002 Dec 10;59(11):1773-5.
http://www.ncbi.nlm.nih.gov/pubmed/12473768?tool=bestpractice.com
No entanto, os títulos de anticorpos não se correlacionam com a gravidade da doença e podem cair ou desaparecer com imunossupressão.[29]Leys K, Lang B, Johnston I, et al. Calcium channel autoantibodies in the Lambert-Eaton myasthenic syndrome. Ann Neurol. 1991 Mar;29(3):307-14.
http://www.ncbi.nlm.nih.gov/pubmed/1645944?tool=bestpractice.com
Além disso, baixos títulos de anticorpos anti-VGCC foram encontrados no lúpus eritematoso sistêmico e na artrite reumatoide, e em alguns pacientes (<5%) com miastenia gravis, embora o teste utilizando ômega-conotoxina, possa fornecer maior especificidade.[20]Lennon VA, Kryzer TJ, Griesmann GE, et al. Calcium-channel antibodies in the Lambert-Eaton syndrome and other paraneoplastic syndromes. N Engl J Med. 1995 Jun 1;332(22):1467-74.
http://www.nejm.org/doi/full/10.1056/NEJM199506013322203#t=article
http://www.ncbi.nlm.nih.gov/pubmed/7739683?tool=bestpractice.com
[30]Lang B, Johnston I, Leys K, et al. Autoantibody specificities in Lambert-Eaton myasthenic syndrome. Ann N Y Acad Sci. 1993 Jun 21;681:382-93.
http://www.ncbi.nlm.nih.gov/pubmed/8395152?tool=bestpractice.com
Uma sorologia adicional de autoanticorpos também pode trazer benefícios.
A presença de anticorpos em resposta ao domínio IV da subunidade alfa-1A do VGCC tipo P/Q é altamente sugestiva de LEMS não associada a câncer (38% dos pacientes com NCA-LEMS em comparação com 5% dos pacientes com CA-LEMS).[31]Pellkofer HL, Armbruster L, Krumbholz M, et al. Lambert-Eaton myasthenic syndrome differential reactivity of tumor versus non-tumor patients to subunits of the voltage-gated calcium channel. J Neuroimmunol. 2008 Nov 15;204(1-2):136-9.
http://www.ncbi.nlm.nih.gov/pubmed/18809213?tool=bestpractice.com
A presença de anticorpos anti-SOX1 mostra 64% de sensibilidade em CA-LEMS para CPCP. Os anticorpos anti-SOX1 raramente são observados na NCA-LEMS; portanto, a presença de anticorpos anti-SOX1 deve levar a uma pesquisa abrangente para CPCP. Entretanto, esses anticorpos são também observados em síndromes neurológicas paraneoplásicas positivas para Hu (32%) e no CPCP sem sintomas neurológicos (22%).[32]Sabater L, Titulaer M, Saiz A, et al. SOX1 antibodies are markers of paraneoplastic Lambert-Eaton myasthenic syndrome. Neurology. 2008 Mar 18;70(12):924-8.
http://www.ncbi.nlm.nih.gov/pubmed/18032743?tool=bestpractice.com
A presença de anticorpos do receptor da acetilcolina (AChR) ou da MuSK (tirosina quinase músculo específica) sugere fortemente uma miastenia gravis, apesar de até 13% dos pacientes com LEMS terem anticorpos anti-AChR e as síndromes de sobreposição miastenia gravis/LEMS ocorrerem raramente.[33]Lennon VA. Serologic profile of myasthenia gravis and distinction from the Lambert-Eaton myasthenic syndrome. Neurology. 1997;48(suppl 5):S23-S27.
tipagem HLA (antígeno leucocitário humano)
A associação de haplótipos do HLA pode também ser analisada. A presença de haplótipos específicos não é diagnóstica para LEMS, mas pode contribuir para distinguir a LEMS não associada a câncer da LEMS associada a câncer. Observa-se uma frequência mais alta de HLA DR3, B8 ou A1 em NCA-LEMS (HLA DR3, 67%; B8, 64%; A1, 52%) do que em CA-LEMS (HLA-DR, 30%; B8, 20%; A1, 18%).[7]Titulaer MJ, Verschuuren JJ. Lambert-Eaton myasthenic syndrome: tumor versus nontumor forms. Ann N Y Acad Sci. 2008;1132:129-34.
http://www.ncbi.nlm.nih.gov/pubmed/18567862?tool=bestpractice.com
Quarenta e um por cento dos pacientes com LEMS não associada a câncer têm todos os três haplótipos, em comparação com 5% dos pacientes com LEMS associada ao câncer.[7]Titulaer MJ, Verschuuren JJ. Lambert-Eaton myasthenic syndrome: tumor versus nontumor forms. Ann N Y Acad Sci. 2008;1132:129-34.
http://www.ncbi.nlm.nih.gov/pubmed/18567862?tool=bestpractice.com
Outros estudos
Uma TC de tórax deve ser solicitada para todos os pacientes com suspeita de CA-LEMS.[34]Ivanovski T, Miralles F. Lambert-Eaton myasthenic syndrome: early diagnosis is key. Degener Neurol Neuromuscul Dis. 2019 May 13:9:27-37.
https://www.dovepress.com/lambert-eaton-myasthenic-syndrome-early-diagnosis-is-key-peer-reviewed-fulltext-article-DNND
http://www.ncbi.nlm.nih.gov/pubmed/31191084?tool=bestpractice.com
O câncer é encontrado no início da doença ou posteriormente em cerca de 50% dos pacientes com LEMS.[2]O'Neill JH, Murray NM, Newsom-Davis J. The Lambert-Eaton myasthenic syndrome. A review of 50 cases. Brain. 1988 Jun;111(pt 3):577-96.
http://www.ncbi.nlm.nih.gov/pubmed/2838124?tool=bestpractice.com
[8]Titulaer MJ, Wirtz PW, Willems LN, et al. Screening for small-cell lung cancer: a follow-up study of patients with Lambert-Eaton myasthenic syndrome. J Clin Oncol. 2008 Sep 10;26(26):4276-81.
http://www.ncbi.nlm.nih.gov/pubmed/18779614?tool=bestpractice.com
[9]Titulaer MJ, Lang B, Verschuuren JJ. Lambert-Eaton myasthenic syndrome: from clinical characteristics to therapeutic strategies. Lancet Neurol. 2011 Dec;10(12):1098-107.
http://www.ncbi.nlm.nih.gov/pubmed/22094130?tool=bestpractice.com
O CPCP é o câncer mais comumente associado; a LEMS precede o diagnóstico do CPCP em até 69% dos pacientes com LEMS.[3]Sanders DB, Juel VC. Chapter 9 The Lambert-Eaton myasthenic syndrome. Handb Clin Neurol. 2008;91:273-83.
http://www.ncbi.nlm.nih.gov/pubmed/18631847?tool=bestpractice.com
[7]Titulaer MJ, Verschuuren JJ. Lambert-Eaton myasthenic syndrome: tumor versus nontumor forms. Ann N Y Acad Sci. 2008;1132:129-34.
http://www.ncbi.nlm.nih.gov/pubmed/18567862?tool=bestpractice.com
Se uma TC do tórax inicial for negativa, deve-se considerar TCs de acompanhamento e outros exames de imagem.[8]Titulaer MJ, Wirtz PW, Willems LN, et al. Screening for small-cell lung cancer: a follow-up study of patients with Lambert-Eaton myasthenic syndrome. J Clin Oncol. 2008 Sep 10;26(26):4276-81.
http://www.ncbi.nlm.nih.gov/pubmed/18779614?tool=bestpractice.com
Subsequentemente, o CPCP é diagnosticado em até 96% dos pacientes com CA-LEMS em até 1 ano após o diagnóstico.[8]Titulaer MJ, Wirtz PW, Willems LN, et al. Screening for small-cell lung cancer: a follow-up study of patients with Lambert-Eaton myasthenic syndrome. J Clin Oncol. 2008 Sep 10;26(26):4276-81.
http://www.ncbi.nlm.nih.gov/pubmed/18779614?tool=bestpractice.com
A tomografia por emissão de pósitrons com flúor-2-deoxiglicose corporal total poderá detectar o CPCP quando a TC do tórax for normal.[8]Titulaer MJ, Wirtz PW, Willems LN, et al. Screening for small-cell lung cancer: a follow-up study of patients with Lambert-Eaton myasthenic syndrome. J Clin Oncol. 2008 Sep 10;26(26):4276-81.
http://www.ncbi.nlm.nih.gov/pubmed/18779614?tool=bestpractice.com
[34]Ivanovski T, Miralles F. Lambert-Eaton myasthenic syndrome: early diagnosis is key. Degener Neurol Neuromuscul Dis. 2019 May 13:9:27-37.
https://www.dovepress.com/lambert-eaton-myasthenic-syndrome-early-diagnosis-is-key-peer-reviewed-fulltext-article-DNND
http://www.ncbi.nlm.nih.gov/pubmed/31191084?tool=bestpractice.com
[35]Titulaer MJ, Soffietti R, Dalmau J, et al. Screening for tumours in paraneoplastic syndromes: report of an EFNS task force. Eur J Neurol. 2011 Jan;18(1):19-e3.
http://onlinelibrary.wiley.com/doi/10.1111/j.1468-1331.2010.03220.x/full
http://www.ncbi.nlm.nih.gov/pubmed/20880069?tool=bestpractice.com
Se esses estudos não fornecerem informações suficientes, e se houver um risco significativo de câncer pulmonar, sobretudo em fumantes, ou se os sintomas estiverem presentes por <2 anos, uma broncoscopia poderá ser útil, embora um estudo sugira que essa contribuição seria pequena.[3]Sanders DB, Juel VC. Chapter 9 The Lambert-Eaton myasthenic syndrome. Handb Clin Neurol. 2008;91:273-83.
http://www.ncbi.nlm.nih.gov/pubmed/18631847?tool=bestpractice.com
[8]Titulaer MJ, Wirtz PW, Willems LN, et al. Screening for small-cell lung cancer: a follow-up study of patients with Lambert-Eaton myasthenic syndrome. J Clin Oncol. 2008 Sep 10;26(26):4276-81.
http://www.ncbi.nlm.nih.gov/pubmed/18779614?tool=bestpractice.com
TFPs seriados podem ser indicados em pacientes com dispneia e suspeita de crise respiratória. A indicação para ventilação mecânica inclui CVF ≤15 mL/kg e força inspiratória negativa ≤20 cm H₂O.
Anormalidades nas gasometrias arteriais (GAs) e na oxigenação de pulso podem não refletir o grau de fraqueza respiratória, pois, em ambos os testes, as anormalidades ocorrem tardiamente na evolução, após descompensação clínica.
