Cáncer de tiroides
- Descripción general
- Teoría
- Diagnóstico
- Manejo
- Seguimiento
- Recursos
Algoritmo de tratamiento
Tenga en cuenta que las formulaciones/vías y dosis pueden diferir entre los nombres y marcas de los fármacos, las fórmulas de los fármacos o las localizaciones. Las recomendaciones de tratamiento son específicas para cada grupo de pacientes: ver aviso legal
papilar, folicular u oncocítica
vigilancia activa o cirugía (lobectomía o tiroidectomía total ± disección central del cuello)
Para los pacientes con tumores de muy bajo riesgo (por ejemplo, microcarcinomas papilares unifocales [≤1 cm] sin indicios de extensión extracapsular ni metástasis en los ganglios linfáticos), puede considerarse la vigilancia activa con seguimiento ecográfico de la tiroides y los ganglios linfáticos del cuello cada 6-12 meses.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [59]National Institute for Health and Care Excellence. Thyroid cancer: assessment and management. Dec 2022 [internet publication]. https://www.nice.org.uk/guidance/ng230 [66]Tuttle RM, Alzahrani AS. Risk stratification in differentiated thyroid cancer: from detection to final follow-up. J Clin Endocrinol Metab. 2019 Mar 15;104(9):4087-100. https://academic.oup.com/jcem/article/104/9/4087/5380478 http://www.ncbi.nlm.nih.gov/pubmed/30874735?tool=bestpractice.com [69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer [70]Saravana-Bawan B, Bajwa A, Paterson J, et al. Active surveillance of low-risk papillary thyroid cancer: a meta-analysis. Surgery. 2020 Jan;167(1):46-55. http://www.ncbi.nlm.nih.gov/pubmed/31526581?tool=bestpractice.com
La orientación no recomiendan de forma rutinaria la aspiración con aguja fina (AAF) para un diagnóstico citológico en nódulos de menos de 1 cm con características de riesgo bajo; sin embargo, esta política varía internacionalmente, ya que algunos países realizan una AAF y una citología en nódulos sospechosos antes de ofrecer vigilancia activa.[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [71]Ito Y, Miyauchi A, Oda H. Low-risk papillary microcarcinoma of the thyroid: a review of active surveillance trials. Eur J Surg Oncol. 2018 Mar;44(3):307-15. https://www.ejso.com/article/S0748-7983(17)30370-0/fulltext http://www.ncbi.nlm.nih.gov/pubmed/28343733?tool=bestpractice.com
La vigilancia activa puede ser la opción preferida en pacientes de edad avanzada y en personas con alto riesgo quirúrgico.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer
La transición a la cirugía durante la vigilancia activa está indicada si el paciente lo solicita o si hay cambios clínicos (por ejemplo, metástasis en los ganglios linfáticos comprobadas por biopsia; metástasis a distancia; invasión al nervio laríngeo, la tráquea o el esófago recidivantes; evidencia radiológica de diseminación extratiroidea; crecimiento del cáncer de 3 mm en cualquier dimensión o un aumento de volumen del 50%).[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [71]Ito Y, Miyauchi A, Oda H. Low-risk papillary microcarcinoma of the thyroid: a review of active surveillance trials. Eur J Surg Oncol. 2018 Mar;44(3):307-15. https://www.ejso.com/article/S0748-7983(17)30370-0/fulltext http://www.ncbi.nlm.nih.gov/pubmed/28343733?tool=bestpractice.com
Para todos los demás cánceres de tiroides, generalmente se recomienda la cirugía para el tratamiento inicial.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [59]National Institute for Health and Care Excellence. Thyroid cancer: assessment and management. Dec 2022 [internet publication]. https://www.nice.org.uk/guidance/ng230 [69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer La tiroidectomía total se considera el tratamiento quirúrgico estándar. Sin embargo, en pacientes con un tumor de entre 1 cm y 4 cm de diámetro sin extensión extratiroidea y sin evidencia clínica de metástasis en los ganglios linfáticos, puede considerarse la opción de lobectomía como procedimiento quirúrgico inicial.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com Es importante que los pacientes entiendan que los hallazgos intraoperatorios durante la lobectomía pueden requerir la finalización de una tiroidectomía total (tiroidectomía completa).[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
Se requiere cirugía (por ejemplo, tiroidectomía total o lobectomía) para confirmar (histológicamente) un diagnóstico de carcinoma folicular u oncocítico porque la citología por AAF no distingue de manera confiable entre el adenoma folicular u oncocítico (benigno) y el carcinoma.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
Si se diagnostica un carcinoma folicular u oncocítico invasivo después de una lobectomía inicial, puede ser necesaria una tiroidectomía completa posterior dependiendo de la invasividad del tumor.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
La tiroidectomía completa es necesaria si los pacientes tienen carcinoma folicular u oncocítico invasivo, es decir: ampliamente invasivo (invasión macroscópica de la glándula tiroidea con o sin tejidos blandos y vasos sanguíneos adyacentes), o angioinvasivo encapsulado con afectación de ≥4 vasos sanguíneos.[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
Por lo general, se prefiere la monitorización de la enfermedad en un paciente con carcinoma folicular u oncocítico invasivo, es decir: mínimamente invasivo (tumor encapsulado con invasión capsular microscópica y sin invasión vascular), o angioinvasivo encapsulado con afectación de <4 vasos sanguíneos.[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
Las complicaciones de la tiroidectomía total incluyen un mayor riesgo de daño recurrente del nervio laríngeo o hipoparatiroidismo.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx El riesgo de hipoparatiroidismo permanente es más elevado en la tiroidectomía total que en la tiroidectomía subtotal. Se debe derivar al paciente a un cirujano experimentado.
La disección terapéutica del cuello central para pacientes con ganglios centrales clínicamente afectados debe acompañar a la tiroidectomía total para proporcionar el aclaramiento de la enfermedad del cuello central.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com La disección profiláctica central del cuello es controvertida.[69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer En algunos centros se recomienda, pero la reducción de la recidiva locorregional se acompaña de una mayor tasa de efectos adversos postoperatorios.[74]Chen L, Wu YH, Lee CH, et al. Prophylactic central neck dissection for papillary thyroid carcinoma with clinically uninvolved central neck lymph nodes: a systematic review and meta-analysis. World J Surg. 2018 Sep;42(9):2846-57. http://www.ncbi.nlm.nih.gov/pubmed/29488066?tool=bestpractice.com
Supresión de TSH
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
La tiroidectomía total requiere terapia de reemplazo de hormona tiroidea (por ejemplo, levotiroxina).
Dado que la hormona estimulante de la tiroides (TSH) circulante estimula la proliferación en los tirocitos normales y en la mayoría de las células cancerosas de la tiroides, se usan dosis supresoras de TSH del tratamiento con hormona tiroidea.[14]Cabanillas ME, McFadden DG, Durante C. Thyroid cancer. Lancet. 2016 Dec 3;388(10061):2783-95. http://www.ncbi.nlm.nih.gov/pubmed/27240885?tool=bestpractice.com
El uso de la supresión de la hormona tiroidea debe basarse en el riesgo inicial de enfermedad y en la evaluación de riesgos continua del estado de la enfermedad (véase el apartado Criterios diagnósticos para la estratificación del riesgo). Se debe utilizar la menor cantidad posible de hormona tiroidea.[72]Biondi B, Cooper DS. Thyroid hormone suppression therapy. Endocrinol Metab Clin North Am. 2019 Mar;48(1):227-37. http://www.ncbi.nlm.nih.gov/pubmed/30717904?tool=bestpractice.com
En pacientes con enfermedad de alto riesgo, se recomienda mantener un nivel sérico de TSH de <0.1 mUI/L.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com También se recomienda mantener un nivel sérico de la TSH de <0.1 mUI/L (pero no necesariamente indetectable) en pacientes con enfermedad estructural residual o una respuesta bioquímicamente incompleta si son jóvenes o con bajo riesgo de complicaciones como el hipertiroidismo subclínico exógeno.[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [72]Biondi B, Cooper DS. Thyroid hormone suppression therapy. Endocrinol Metab Clin North Am. 2019 Mar;48(1):227-37. http://www.ncbi.nlm.nih.gov/pubmed/30717904?tool=bestpractice.com
En los pacientes con enfermedad de riesgo intermedio, se recomienda mantener una concentración sérica de TSH de 0.1 a 0.5 mUI/L.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com
En pacientes con enfermedad de bajo riesgo, los niveles séricos de TSH deben mantenerse en el rango de bajo a normal (0.5 a 2.0 mUI/L).[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer
Los pacientes con enfermedad de bajo riesgo que se hayan sometido a una lobectomía pueden no necesitar terapia de sustitución de hormona tiroidea si su TSH sérica se mantiene en un rango objetivo de bajo a normal.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com
Las dosis supresoras de TSH de la terapia de reposición de hormonas tiroideas pueden dar lugar a un hipertiroidismo subclínico exógeno, que a su vez puede provocar resultados adversos como osteoporosis, fracturas y enfermedades cardiovasculares, incluida la fibrilación auricular.[72]Biondi B, Cooper DS. Thyroid hormone suppression therapy. Endocrinol Metab Clin North Am. 2019 Mar;48(1):227-37. http://www.ncbi.nlm.nih.gov/pubmed/30717904?tool=bestpractice.com La pérdida ósea es especialmente preocupante en el caso de la supresión de la TSH en mujeres posmenopáusicas no tratadas con estrógenos, pero el efecto de la supresión de la TSH en la tasa de fracturas no está claro.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [73]Brancatella A, Marcocci C. TSH suppressive therapy and bone. Endocr Connect. 2020 Jul;9(7):R158-72. https://ec.bioscientifica.com/view/journals/ec/9/7/EC-20-0167.xml http://www.ncbi.nlm.nih.gov/pubmed/32567550?tool=bestpractice.com
Opciones primarias
levotiroxina: consulte a un especialista para obtener información sobre la dosis
tratamiento con yodo radioactivo
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
La evaluación del riesgo (basada en los hallazgos quirúrgicos y patológicos) y la evaluación del estado de la enfermedad postoperatoria (incluidas las mediciones de tiroglobulina sérica [Tg] y la ecografía del cuello) son necesarias para orientar la selección de los pacientes para la terapia con yodo radioactivo.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [54]Webb RC, Howard RS, Stojadinovic A, et al. The utility of serum thyroglobulin measurement at the time of remnant ablation for predicting disease-free status in patients with differentiated thyroid cancer: a meta-analysis involving 3947 patients. J Clin Endocrinol Metab. 2012 Aug;97(8):2754-63. https://academic.oup.com/jcem/article/97/8/2754/2823340 http://www.ncbi.nlm.nih.gov/pubmed/22639291?tool=bestpractice.com [75]Tuttle RM, Ahuja S, Avram AM, et al. Controversies, consensus, and collaboration in the use of (131)I therapy in differentiated thyroid cancer: a joint statement from the American Thyroid Association, the European Association of Nuclear Medicine, the Society of Nuclear Medicine and Molecular Imaging, and the European Thyroid Association. Thyroid. 2019 Apr;29(4):461-70. https://www.liebertpub.com/doi/10.1089/thy.2018.0597 http://www.ncbi.nlm.nih.gov/pubmed/30900516?tool=bestpractice.com [76]Pacini F, Fuhrer D, Elisei R, et al. 2022 ETA consensus statement: what are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J. 2022 Jan 1;11(1):e210046. https://etj.bioscientifica.com/view/journals/etj/11/1/ETJ-21-0046.xml http://www.ncbi.nlm.nih.gov/pubmed/34981741?tool=bestpractice.com
Se recomienda el uso de la terapia con yodo radiactivo tras la tiroidectomía total en pacientes con enfermedad de alto riesgo y en pacientes seleccionados con enfermedad de riesgo intermedio.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [76]Pacini F, Fuhrer D, Elisei R, et al. 2022 ETA consensus statement: what are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J. 2022 Jan 1;11(1):e210046. https://etj.bioscientifica.com/view/journals/etj/11/1/ETJ-21-0046.xml http://www.ncbi.nlm.nih.gov/pubmed/34981741?tool=bestpractice.com
La terapia con yodo radiactivo no se recomienda de forma rutinaria para pacientes con enfermedad de bajo riesgo, pero deben tenerse en cuenta las características que influyen en el riesgo de recurrencia, las implicaciones del seguimiento de la enfermedad y las preferencias de la paciente.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [77]Leboulleux S, Bournaud C, Chougnet CN, et al. Thyroidectomy without radioiodine in patients with low-risk thyroid cancer. N Engl J Med. 2022 Mar 10;386(10):923-32. https://www.nejm.org/doi/10.1056/NEJMoa2111953 http://www.ncbi.nlm.nih.gov/pubmed/35263518?tool=bestpractice.com
La selección de la dosis óptima de yodo radioactivo terapéutico puede ser un desafío y debe basarse en una evaluación de riesgos e individualizada (p. ej., guiada por los factores del paciente y el objetivo del tratamiento).[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [75]Tuttle RM, Ahuja S, Avram AM, et al. Controversies, consensus, and collaboration in the use of (131)I therapy in differentiated thyroid cancer: a joint statement from the American Thyroid Association, the European Association of Nuclear Medicine, the Society of Nuclear Medicine and Molecular Imaging, and the European Thyroid Association. Thyroid. 2019 Apr;29(4):461-70. https://www.liebertpub.com/doi/10.1089/thy.2018.0597 http://www.ncbi.nlm.nih.gov/pubmed/30900516?tool=bestpractice.com [76]Pacini F, Fuhrer D, Elisei R, et al. 2022 ETA consensus statement: what are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J. 2022 Jan 1;11(1):e210046. https://etj.bioscientifica.com/view/journals/etj/11/1/ETJ-21-0046.xml http://www.ncbi.nlm.nih.gov/pubmed/34981741?tool=bestpractice.com Consulte las orientaciones locales.
Se requieren niveles elevados de hormona estimulante de la tiroides (TSH) para inducir la captación de yodo radiactivo en las células tiroideas.[76]Pacini F, Fuhrer D, Elisei R, et al. 2022 ETA consensus statement: what are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J. 2022 Jan 1;11(1):e210046. https://etj.bioscientifica.com/view/journals/etj/11/1/ETJ-21-0046.xml http://www.ncbi.nlm.nih.gov/pubmed/34981741?tool=bestpractice.com La administración de TSH humana recombinante exógena (rhTSH) es el método preferido de preparación para la terapia con yodo radioactivo para la mayoría de los pacientes.[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
Después de la terapia con yodo radioactivo, se debe obtener una gammagrafía de yodo radioactivo de cuerpo entero para estadificar la enfermedad y documentar la avidez de yodo radioactivo de cualquier lesión estructural.[78]Gulec SA, Ahuja S, Avram AM, et al. A joint statement from the American Thyroid Association, the European Association of Nuclear Medicine, the European Thyroid Association, the Society of Nuclear Medicine and Molecular Imaging on current diagnostic and theranostic approaches in the management of thyroid cancer. Thyroid. 2021 Jul;31(7):1009-19. https://www.liebertpub.com/doi/10.1089/thy.2020.0826 http://www.ncbi.nlm.nih.gov/pubmed/33789450?tool=bestpractice.com
El uso de una gammagrafía "diagnóstica" con yodo radioactivo después de la cirugía, pero antes de la terapia con yodo radioactivo, es controvertido.[75]Tuttle RM, Ahuja S, Avram AM, et al. Controversies, consensus, and collaboration in the use of (131)I therapy in differentiated thyroid cancer: a joint statement from the American Thyroid Association, the European Association of Nuclear Medicine, the Society of Nuclear Medicine and Molecular Imaging, and the European Thyroid Association. Thyroid. 2019 Apr;29(4):461-70.
https://www.liebertpub.com/doi/10.1089/thy.2018.0597
http://www.ncbi.nlm.nih.gov/pubmed/30900516?tool=bestpractice.com
[76]Pacini F, Fuhrer D, Elisei R, et al. 2022 ETA consensus statement: what are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J. 2022 Jan 1;11(1):e210046.
https://etj.bioscientifica.com/view/journals/etj/11/1/ETJ-21-0046.xml
http://www.ncbi.nlm.nih.gov/pubmed/34981741?tool=bestpractice.com
Una gammagrafía diagnóstica con yodo radioactivo puede aportar información relevante para la toma de decisiones clínicas sólo en pacientes seleccionados.[78]Gulec SA, Ahuja S, Avram AM, et al. A joint statement from the American Thyroid Association, the European Association of Nuclear Medicine, the European Thyroid Association, the Society of Nuclear Medicine and Molecular Imaging on current diagnostic and theranostic approaches in the management of thyroid cancer. Thyroid. 2021 Jul;31(7):1009-19.
https://www.liebertpub.com/doi/10.1089/thy.2020.0826
http://www.ncbi.nlm.nih.gov/pubmed/33789450?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Captación incrementada de yodo radioactivo en ambos campos pulmonares y el mediastino, debida a la metástasis pulmonar miliar de un carcinoma papilar de tiroidesGkountouvas A, Chatjimarkou F, Thomas D, et al. Miliary lung metastasis due to papillary thyroid carcinoma. BMJ Case Reports. 2009; doi:10.1136/bcr.06.2008.0322 [Citation ends].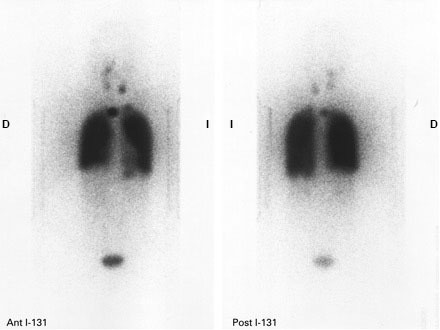
observación y vigilancia ± cirugía ± terapia con yodo radiactivo ± terapias locales dirigidas (p. ej., radioterapia de haz externo, ablación térmica)
El riesgo de recurrencia se determina en el momento del diagnóstico y se reevalúa como un continuo en respuesta a las terapias tempranas.[66]Tuttle RM, Alzahrani AS. Risk stratification in differentiated thyroid cancer: from detection to final follow-up. J Clin Endocrinol Metab. 2019 Mar 15;104(9):4087-100. https://academic.oup.com/jcem/article/104/9/4087/5380478 http://www.ncbi.nlm.nih.gov/pubmed/30874735?tool=bestpractice.com Las pruebas de tiroglobulina sérica y la ecografía del cuello son los pilares del seguimiento del cáncer diferenciado de tiroides.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer
La recurrencia puede ser bioquímica o estructural.
El tratamiento de los pacientes que presentan recidiva bioquímica (es decir, concentraciones de tiroglobulina en aumento o recientemente elevadas), sin evidencia de enfermedad estructural, comprende la observación y la vigilancia con estudios por imágenes adecuados realizados a intervalos de tiempo guiados por el tiempo de duplicación de la tiroglobulina.[79]Scharpf J, Tuttle M, Wong R, et al. Comprehensive management of recurrent thyroid cancer: an American Head and Neck Society consensus statement. Head Neck. 2016 Dec;38(12):1862-9. https://onlinelibrary.wiley.com/doi/10.1002/hed.24513 http://www.ncbi.nlm.nih.gov/pubmed/27717219?tool=bestpractice.com
Los pacientes con sospecha de recidiva estructural en el cuello (enfermedad persistente o recidivante comprobada por biopsia) pueden requerir terapias adicionales o puede manejarse con observación e imágenes transversales seriadas (p. ej., tomografía computarizada [TC] o resonancia magnética [RM] realzadas con contraste) con una frecuencia suficiente para identificar el avance clínicamente significativo de la enfermedad.[79]Scharpf J, Tuttle M, Wong R, et al. Comprehensive management of recurrent thyroid cancer: an American Head and Neck Society consensus statement. Head Neck. 2016 Dec;38(12):1862-9. https://onlinelibrary.wiley.com/doi/10.1002/hed.24513 http://www.ncbi.nlm.nih.gov/pubmed/27717219?tool=bestpractice.com La enfermedad estructural recidivante que mida 8-10 mm o más en la imagen anatómica en el cuello central y lateral, respectivamente, se considera para cirugía de revisión.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com [79]Scharpf J, Tuttle M, Wong R, et al. Comprehensive management of recurrent thyroid cancer: an American Head and Neck Society consensus statement. Head Neck. 2016 Dec;38(12):1862-9. https://onlinelibrary.wiley.com/doi/10.1002/hed.24513 http://www.ncbi.nlm.nih.gov/pubmed/27717219?tool=bestpractice.com
Las metástasis se observan con mayor frecuencia en pacientes con subtipos histológicos malignos, y se pueden presentar hasta en 10% de los pacientes con cáncer de tiroides diferenciado.[69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer [80]Tumino D, Frasca F, Newbold K. Updates on the management of advanced, metastatic, and radioiodine refractory differentiated thyroid cancer. Front Endocrinol (Lausanne). 2017 Nov 20;8:312. https://www.frontiersin.org/articles/10.3389/fendo.2017.00312/full http://www.ncbi.nlm.nih.gov/pubmed/29209273?tool=bestpractice.com Para el tratamiento del cáncer de tiroides diferenciado metastásico, la American Thyroid Association recomienda una jerarquía preferida de escisión quirúrgica de la enfermedad locorregional, terapia con yodo radiactivo para la enfermedad que responde al yodo radiactivo (con terapia supresora de la hormona estimulante de la tiroides [TSH]), terapias locales dirigidas (p. ej., radioterapia de haz externo, ablación térmica) y terapia sistémica con inhibidores de cinasas.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com
Para pacientes con enfermedad metastásica asintomática estable o lentamente progresiva, se puede usar la terapia con hormona tiroidea supresora de TSH sola.[1]Haugen BR, Alexander EK, Bible KC, et al; American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133. https://www.liebertpub.com/doi/10.1089/thy.2015.0020 http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com
Si las metástasis a distancia responden al yodo radiactivo, la terapia con yodo radiactivo se repite cada 6 a 12 meses según la tasa de crecimiento y la respuesta.[81]Verburg FA, Hänscheid H, Luster M. Radioactive iodine (RAI) therapy for metastatic differentiated thyroid cancer. Best Pract Res Clin Endocrinol Metab. 2017 Jun;31(3):279-90. http://www.ncbi.nlm.nih.gov/pubmed/28911724?tool=bestpractice.com A medida que los tumores progresan, pueden perder su capacidad de concentrar yodo radiactivo.[33]Fugazzola L, Elisei R, Fuhrer D, et al. 2019 European Thyroid Association guidelines for the treatment and follow-up of advanced radioiodine-refractory thyroid cancer. Eur Thyroid J. 2019 Oct;8(5):227-45. https://etj.bioscientifica.com/view/journals/etj/8/5/ETJ502229.xml http://www.ncbi.nlm.nih.gov/pubmed/31768334?tool=bestpractice.com
terapias dirigidas
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
El tratamiento con inhibidores de cinasas u otras terapias dirigidas se puede considerar para los pacientes con cáncer de tiroides diferenciado progresivo que no son aptos para el tratamiento local o que no responden al mismo (incluso la cirugía y la terapia con yodo radioactivo).
Se recomiendan pruebas genéticas para identificar posibles mutaciones/alteraciones accionables (p. ej., NTRK, BRAF, RET, deficiencia en la reparación de errores de emparejamiento [dMMR], inestabilidad de microsatélites [MSI], carga mutacional tumoral [TMB]) antes de iniciar el tratamiento.[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [46]Filetti S, Durante C, Hartl DM, et al. ESMO clinical practice guideline update on the use of systemic therapy in advanced thyroid cancer. Ann Oncol. 2022 Jul;33(7):674-84. https://www.annalsofoncology.org/article/S0923-7534(22)00694-9/fulltext http://www.ncbi.nlm.nih.gov/pubmed/35491008?tool=bestpractice.com [82]Shonka DC Jr, Ho A, Chintakuntlawar AV, et al. American Head and Neck Society Endocrine Surgery Section and International Thyroid Oncology Group consensus statement on mutational testing in thyroid cancer: defining advanced thyroid cancer and its targeted treatment. Head Neck. 2022 Jun;44(6):1277-300. http://www.ncbi.nlm.nih.gov/pubmed/35274388?tool=bestpractice.com
Si se indica terapia sistémica, se recomiendan los siguientes inhibidores de cinasas como opciones de primera línea: lenvatinib or sorafenib.[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
Los inhibidores alternativos de la cinasa que se pueden considerar son los siguientes: cabozantinib (si se presenta avance tras lenvatinib o sorafenib); larotrectinib o entrectinib o repotrectinib (para tumores sólidos avanzados positivos para la fusión del gen NTRK); selpercatinib o pralsetinib (para tumores positivos para la fusión del gen RET).[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
Las terapias dirigidas que se pueden considerar para los pacientes con tumores sólidos recurrentes o metastásicos irresecables que han avanzado después de un tratamiento anterior sin opciones de tratamiento alternativas satisfactorias incluyen: pembrolizumab (un anticuerpo monoclonal que bloquea el receptor de muerte programada 1 [PD-1] para pacientes con tumores con TMB alto [≥10 mutaciones/megabase], o tumores con MSI alto o dMMR); o dabrafenib más trametinib (para pacientes con mutación BRAF V600E).[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
La secuencia óptima de la terapia sistémica en este contexto no está clara. La toma de decisiones debe basarse en factores como la respuesta esperada al tratamiento, el perfil de seguridad del fármaco y la preferencia del paciente.
Véase el protocolo local de la especialidad para consultar las normas de dosificación.
Opciones primarias
sorafenib
O
lenvatinib
Opciones secundarias
cabozantinib
O
larotrectinib
O
entrectinib
O
repotrectinib
O
selpercatinib
O
pralsetinib
Opciones terciarias
pembrolizumab
O
dabrafenib
y
trametinib
anaplásico
cirugía + quimiorradiación
El cáncer de tiroides anaplásico suele diagnosticarse en un estadio avanzado (a menudo con metástasis a distancia), muestra un comportamiento extremadamente agresivo y se asocia a un pronóstico muy malo.[13]Bible KC, Kebebew E, Brierley J, et al. 2021 American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2021 Mar;31(3):337-86. https://www.liebertpub.com/doi/10.1089/thy.2020.0944 http://www.ncbi.nlm.nih.gov/pubmed/33728999?tool=bestpractice.com [69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer
La participación multidisciplinaria temprana, incluido el equipo de cuidados paliativos, es importante para respaldar la toma de decisiones del paciente.[13]Bible KC, Kebebew E, Brierley J, et al. 2021 American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2021 Mar;31(3):337-86. https://www.liebertpub.com/doi/10.1089/thy.2020.0944 http://www.ncbi.nlm.nih.gov/pubmed/33728999?tool=bestpractice.com La determinación de la extensión de la enfermedad y la evaluación de las mutaciones influyen en las opciones de tratamiento (incluida la elegibilidad para participar en ensayos clínicos) y los objetivos de la atención.[13]Bible KC, Kebebew E, Brierley J, et al. 2021 American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2021 Mar;31(3):337-86. https://www.liebertpub.com/doi/10.1089/thy.2020.0944 http://www.ncbi.nlm.nih.gov/pubmed/33728999?tool=bestpractice.com
La combinación de múltiples modalidades terapéuticas (cirugía, radioterapia, terapia sistémica [quimioterapia, terapia dirigida]) es el enfoque más eficaz para el tratamiento del cáncer de tiroides anaplásico, pero debe individualizarse para equilibrar de manera óptima los riesgos y los beneficios.
La terapia con yodo radioactivo no se utiliza porque los tumores anaplásicos no absorben el yodo radioactivo.[13]Bible KC, Kebebew E, Brierley J, et al. 2021 American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2021 Mar;31(3):337-86. https://www.liebertpub.com/doi/10.1089/thy.2020.0944 http://www.ncbi.nlm.nih.gov/pubmed/33728999?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
Si es posible, se practica una tiroidectomía total. Determinar si un paciente es candidato para la cirugía depende de la resecabilidad del tumor, el grado de invasión local, la necesidad de una traqueotomía urgente, la presencia de metástasis a distancia y el estado funcional del paciente y los objetivos del tratamiento.[13]Bible KC, Kebebew E, Brierley J, et al. 2021 American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2021 Mar;31(3):337-86. https://www.liebertpub.com/doi/10.1089/thy.2020.0944 http://www.ncbi.nlm.nih.gov/pubmed/33728999?tool=bestpractice.com El reemplazo de la hormona tiroidea es necesario después de la tiroidectomía total.
Independientemente del estado quirúrgico, la radioterapia debe considerarse de forma temprana en el tratamiento del cáncer de tiroides anaplásico.[83]Rao SN, Smallridge RC. Anaplastic thyroid cancer: an update. Best Pract Res Clin Endocrinol Metab. 2022 May 27;101678. http://www.ncbi.nlm.nih.gov/pubmed/35668021?tool=bestpractice.com
La quimioterapia con paclitaxel, docetaxel o tratamientos combinados (p. ej., carboplatino/paclitaxel, docetaxel/doxorrubicina) se asocia con tasas de respuesta muy bajas y toxicidades significativas. Sin embargo, se puede considerar la quimioterapia por su efecto radiosensibilizante cuando se combina con radioterapia, o como un puente hacia la terapia dirigida para pacientes que esperan los resultados del perfil molecular.[13]Bible KC, Kebebew E, Brierley J, et al. 2021 American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2021 Mar;31(3):337-86. https://www.liebertpub.com/doi/10.1089/thy.2020.0944 http://www.ncbi.nlm.nih.gov/pubmed/33728999?tool=bestpractice.com
Véase el protocolo local de la especialidad para consultar las normas de dosificación de la quimioterapia.
Opciones primarias
paclitaxel
O
docetaxel
O
paclitaxel
y
carboplatino
O
docetaxel
y
doxorubicina
terapias dirigidas
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
El uso de la terapia dirigida en pacientes con cáncer de tiroides anaplásico depende de los resultados de las pruebas genéticas.[13]Bible KC, Kebebew E, Brierley J, et al. 2021 American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2021 Mar;31(3):337-86. https://www.liebertpub.com/doi/10.1089/thy.2020.0944 http://www.ncbi.nlm.nih.gov/pubmed/33728999?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [46]Filetti S, Durante C, Hartl DM, et al. ESMO clinical practice guideline update on the use of systemic therapy in advanced thyroid cancer. Ann Oncol. 2022 Jul;33(7):674-84. https://www.annalsofoncology.org/article/S0923-7534(22)00694-9/fulltext http://www.ncbi.nlm.nih.gov/pubmed/35491008?tool=bestpractice.com [84]Maniakas A, Zafereo M, Cabanillas ME. Anaplastic thyroid cancer: new horizons and challenges. Endocrinol Metab Clin North Am. 2022 Jun;51(2):391-401. http://www.ncbi.nlm.nih.gov/pubmed/35662448?tool=bestpractice.com [85]Wang JR, Zafereo ME, Dadu R, et al. Complete surgical resection following neoadjuvant dabrafenib plus trametinib in BRAF(V600E)-mutated anaplastic thyroid carcinoma. Thyroid. 2019 Aug;29(8):1036-43. https://pmc.ncbi.nlm.nih.gov/articles/PMC6707029 http://www.ncbi.nlm.nih.gov/pubmed/31319771?tool=bestpractice.com
Dabrafenib más trametinib: se puede considerar antes de la cirugía (para mejorar la resecabilidad) en pacientes con la mutación BRAF V600E y enfermedad locorregional.
Larotrectinib o entrectinib o repotrectinib: para pacientes con tumores sólidos avanzados positivos para la fusión del gen NTRK.
Selpercatinib o pralsetinib: para pacientes con tumores positivos para la fusión del gen RET.
Inmunoterapia; por ejemplo, pembrolizumab, para pacientes con tumores con alta carga mutacional tumoral (TMB-H; ≥10 mutaciones/megabase).
Véase el protocolo local de la especialidad para consultar las normas de dosificación.
Opciones primarias
dabrafenib
y
trametinib
O
larotrectinib
O
entrectinib
O
repotrectinib
O
selpercatinib
O
pralsetinib
Opciones secundarias
pembrolizumab
medular
cirugía
La cirugía para los pacientes con carcinoma medular tiroideo esporádico o hereditario es la tiroidectomía total y la disección de los ganglios linfáticos del compartimiento central, cuya extensión depende de los niveles de calcitonina sérica y de los hallazgos ecográficos.[4]Wells SA Jr, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015 Jun;25(6):567-610. https://www.liebertpub.com/doi/10.1089/thy.2014.0335 http://www.ncbi.nlm.nih.gov/pubmed/25810047?tool=bestpractice.com [53]Viola D, Elisei R. Management of medullary thyroid cancer. Endocrinol Metab Clin North Am. 2019 Mar;48(1):285-301. http://www.ncbi.nlm.nih.gov/pubmed/30717909?tool=bestpractice.com [69]European Society for Medical Oncology. Clinical practice guidelines - thyroid cancer. 2019 [internet publication]. https://www.esmo.org/guidelines/guidelines-by-topic/endocrine-and-neuroendocrine-cancers/thyroid-cancer [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx
reposición de hormonas tiroideas
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
Se requiere reemplazo de hormona tiroidea (por ejemplo, levotiroxina) después de la tiroidectomía total para mantener los niveles séricos de hormona estimulante de la tiroides (TSH) en el rango eutiroideo.[4]Wells SA Jr, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015 Jun;25(6):567-610. https://www.liebertpub.com/doi/10.1089/thy.2014.0335 http://www.ncbi.nlm.nih.gov/pubmed/25810047?tool=bestpractice.com
El carcinoma medular tiroideo no es sensible a la TSH; por lo tanto, no se requieren dosis supresoras de TSH.
Opciones primarias
levotiroxina: consulte a un especialista para obtener información sobre la dosis
cirugía ± radioterapia externa ± tratamientos focales
Las recurrencias se tratan con cirugía adicional más radioterapia externa si no se puede lograr un control local.[86]Hadoux J, Pacini F, Tuttle RM, et al. Management of advanced medullary thyroid cancer. Lancet Diabetes Endocrinol. 2016 Jan;4(1):64-71. http://www.ncbi.nlm.nih.gov/pubmed/26608066?tool=bestpractice.com
En la enfermedad metastásica, la cirugía puede estar indicada para pacientes en los que una sola o unas pocas metástasis se localizan en el cerebro, los pulmones o el hígado.[86]Hadoux J, Pacini F, Tuttle RM, et al. Management of advanced medullary thyroid cancer. Lancet Diabetes Endocrinol. 2016 Jan;4(1):64-71. http://www.ncbi.nlm.nih.gov/pubmed/26608066?tool=bestpractice.com Los tratamientos focales que incluyen radioterapia externa, radiocirugía estereotáxica, ablación por radiofrecuencia o quimioembolización se utilizan según el sitio de las metástasis.[4]Wells SA Jr, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015 Jun;25(6):567-610. https://www.liebertpub.com/doi/10.1089/thy.2014.0335 http://www.ncbi.nlm.nih.gov/pubmed/25810047?tool=bestpractice.com [86]Hadoux J, Pacini F, Tuttle RM, et al. Management of advanced medullary thyroid cancer. Lancet Diabetes Endocrinol. 2016 Jan;4(1):64-71. http://www.ncbi.nlm.nih.gov/pubmed/26608066?tool=bestpractice.com
terapias dirigidas
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
Los inhibidores de cinasas han producido tasas de respuesta altas en pacientes con carcinoma medular tiroideo metastásico.[86]Hadoux J, Pacini F, Tuttle RM, et al. Management of advanced medullary thyroid cancer. Lancet Diabetes Endocrinol. 2016 Jan;4(1):64-71. http://www.ncbi.nlm.nih.gov/pubmed/26608066?tool=bestpractice.com
Los inhibidores de la multicinasa cabozantinib y vandetanib se recomiendan para la terapia sistémica de primera línea en pacientes con carcinoma medular tiroideo metastásico progresivo.[4]Wells SA Jr, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015 Jun;25(6):567-610. https://www.liebertpub.com/doi/10.1089/thy.2014.0335 http://www.ncbi.nlm.nih.gov/pubmed/25810047?tool=bestpractice.com [37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [46]Filetti S, Durante C, Hartl DM, et al. ESMO clinical practice guideline update on the use of systemic therapy in advanced thyroid cancer. Ann Oncol. 2022 Jul;33(7):674-84. https://www.annalsofoncology.org/article/S0923-7534(22)00694-9/fulltext http://www.ncbi.nlm.nih.gov/pubmed/35491008?tool=bestpractice.com [82]Shonka DC Jr, Ho A, Chintakuntlawar AV, et al. American Head and Neck Society Endocrine Surgery Section and International Thyroid Oncology Group consensus statement on mutational testing in thyroid cancer: defining advanced thyroid cancer and its targeted treatment. Head Neck. 2022 Jun;44(6):1277-300. http://www.ncbi.nlm.nih.gov/pubmed/35274388?tool=bestpractice.com
Los inhibidores de RET selpercatinib y pralsetinib se recomiendan para pacientes con carcinoma medular tiroideo recidivante o metastásico con mutación RET.[37]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: thyroid carcinoma [internet publication]. https://www.nccn.org/professionals/physician_gls/default.aspx [46]Filetti S, Durante C, Hartl DM, et al. ESMO clinical practice guideline update on the use of systemic therapy in advanced thyroid cancer. Ann Oncol. 2022 Jul;33(7):674-84. https://www.annalsofoncology.org/article/S0923-7534(22)00694-9/fulltext http://www.ncbi.nlm.nih.gov/pubmed/35491008?tool=bestpractice.com
Véase el protocolo local de la especialidad para consultar las normas de dosificación.
Opciones primarias
cabozantinib
O
vandetanib
Opciones secundarias
selpercatinib
O
pralsetinib
reposición de hormonas tiroideas
Tratamiento adicional recomendado para ALGUNOS pacientes del grupo seleccionado
Se requiere reemplazo de hormona tiroidea (por ejemplo, levotiroxina) después de la tiroidectomía total para mantener los niveles séricos de hormona estimulante de la tiroides (TSH) en el rango eutiroideo.[4]Wells SA Jr, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015 Jun;25(6):567-610. https://www.liebertpub.com/doi/10.1089/thy.2014.0335 http://www.ncbi.nlm.nih.gov/pubmed/25810047?tool=bestpractice.com
El carcinoma medular tiroideo no es sensible a la TSH; por lo tanto, no se requieren dosis supresoras de TSH.
Opciones primarias
levotiroxina: consulte a un especialista para obtener información sobre la dosis

Seleccione un grupo de pacientes para consultar nuestras recomendaciones
Tenga en cuenta que las formulaciones/vías y dosis pueden diferir entre los nombres y marcas de los fármacos, las fórmulas de los fármacos o las localizaciones. Las recomendaciones de tratamiento son específicas para cada grupo de pacientes. Véase el descargo de responsabilidad
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad