Enfermedad de Cushing (adenoma hipofisario)
La enfermedad de Cushing está causada por tumores hipofisarios secretores de hormona adrenocorticotrópica (ACTH). El objetivo final del tratamiento es eliminar el adenoma hipofisario causante de la enfermedad y normalizar los niveles de cortisol, y al mismo tiempo preservar la función hipofisaria.
El tratamiento de primera línea es la resección transesfenoidal (o TSS por las siglas en inglés de 'transsphenoidal surgery') del adenoma hipofisario causal realizada por un cirujano con experiencia.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[66]Nieman LK, Biller BM, Findling JW, et al. Treatment of Cushing’s syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2015 Aug;100(8):2807-31.
https://academic.oup.com/jcem/article/100/8/2807/2836065
http://www.ncbi.nlm.nih.gov/pubmed/26222757?tool=bestpractice.com
[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
La cirugía puede realizarse mediante un abordaje endoscópico o microscópico. Los resultados para los microadenomas son comparables entre ambas técnicas.[70]Broersen LHA, Biermasz NR, van Furth WR, et al. Endoscopic vs. microscopic transsphenoidal surgery for Cushing's disease: a systematic review and meta-analysis. Pituitary. 2018 Oct;21(5):524-34.
https://link.springer.com/article/10.1007%2Fs11102-018-0893-3
http://www.ncbi.nlm.nih.gov/pubmed/29767319?tool=bestpractice.com
Aún no está claro si el abordaje endoscópico de los macroadenomas aporta algún beneficio adicional.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[70]Broersen LHA, Biermasz NR, van Furth WR, et al. Endoscopic vs. microscopic transsphenoidal surgery for Cushing's disease: a systematic review and meta-analysis. Pituitary. 2018 Oct;21(5):524-34.
https://link.springer.com/article/10.1007%2Fs11102-018-0893-3
http://www.ncbi.nlm.nih.gov/pubmed/29767319?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Algoritmo para el tratamiento de la enfermedad de Cushing (DST = test de supresión con dexametasona, por sus siglas en inglés ). CSPI= cateterismo de senos petrosos inferiores. ACTH = hormona adrenocorticotrópica. *La cirugía hipofisaria debe ser realizada por un cirujano experimentado. † Ausencia de adenoma con tinción para ACTH. §Se requiere una monitorización permanente para detectar hipopituitarismo y una neoplasia secundaria en el campo de radiación. ¶Sobre la dosis máxima tolerada del fármaco)Fleseriu M et al. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75; utilizado con autorización [Citation ends].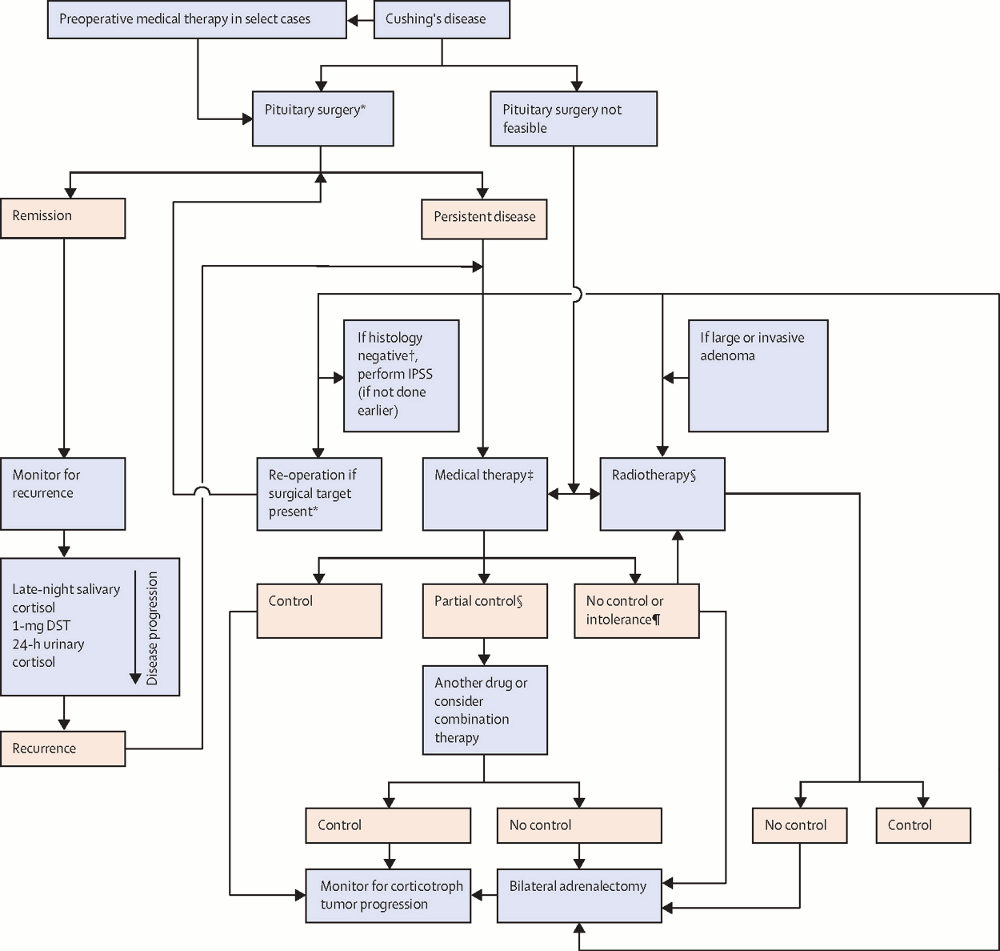
Muchos pacientes reciben tratamiento de respaldo con corticosteroides después de una cirugía de la hipófisis, pero se debe evaluar la remisión durante la primera semana postoperatoria.[68]Hammer GD, Tyrrell JB, Lamborn KR, et al. Transsphenoidal microsurgery for Cushing's disease: initial outcome and long-term results. J Clin Endocrinol Metab. 2004 Dec;89(12):6348-57.
https://academic.oup.com/jcem/article/89/12/6348/2844760
http://www.ncbi.nlm.nih.gov/pubmed/15579802?tool=bestpractice.com
Para ello, se mide el cortisol matutino al menos 24 horas después de la última dosis de corticosteroides. Los pacientes con un cortisol matutino postoperatorio <55 nanomoles/L (<2 microgramos/dL) se consideran que están en remisión y pueden hacer la transición al seguimiento a largo plazo. Los pacientes con un cortisol matutino postoperatorio de >138 nanomoles/L (>5 microgramos/dL) requieren una evaluación adicional y posiblemente un tratamiento adicional. Los pacientes con un cortisol matutino entre 55 y 138 nanomol/L (2 y 5 microgramos/dL) deben seguirse con mediciones adicionales para detectar un descenso posterior en los niveles de cortisol matutino. Las personas con niveles matutinos de cortisol >55 nanomoles/L (>2 microgramos/dL) después de la cirugía tienen 2.5 veces más probabilidades de tener recurrencias que aquellas con niveles de cortisol <55 nanomoles/L (<2 microgramos/dL).[71]Abu Dabrh AM, Singh Ospina NM, Al Nofal A, et al. Predictors of biochemical remission and recurrence after surgical and radiation treatments of Cushing disease: a systematic disease: a systematic review and meta-analysis. Endocr Pract. 2016 Apr;22(4):466-75.
http://www.ncbi.nlm.nih.gov/pubmed/26789343?tool=bestpractice.com
[72]Patil CG, Prevedello DM, Lad SP, et al. Late recurrences of Cushing's disease after initial successful transsphenoidal surgery. J Clin Endocrinol Metab. 2008 Feb;93(2):358-62.
https://academic.oup.com/jcem/article/93/2/358/2597991
http://www.ncbi.nlm.nih.gov/pubmed/18056770?tool=bestpractice.com
[73]Fleseriu M, Hamrahian AH, Hoffman AR, et al; AACE Neuroendocrine and Pituitary Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology Disease State Clinical Review: diagnosis of recurrence in Cushing disease. Endocr Pract. 2016 Dec;22(12):1436-48.
http://www.ncbi.nlm.nih.gov/pubmed/27643842?tool=bestpractice.com
El hipocortisolismo postoperatorio es un predictor de remisión, de ahí que algunos centros aboguen por detener el tratamiento con corticosteroides habitual tras la cirugía hipofisaria y monitorizar los niveles de cortisol cada 8 horas o la aparición de síntomas de insuficiencia suprarrenal.[74]Sughrue ME, Shah JK, Devin JK, et al. Utility of the immediate postoperative cortisol concentrations in patients with Cushing's disease. Neurosurgery. 2010 Sep;67(3):688-95.
http://www.ncbi.nlm.nih.gov/pubmed/20651632?tool=bestpractice.com
Si se produce una insuficiencia suprarrenal o se documentan niveles bajos de cortisol, se inicia el tratamiento con corticosteroides. Otros centros comienzan el tratamiento con corticosteroides de manera rutinaria inmediatamente después de la cirugía y evalúan la remisión del hipercortisolismo más adelante en la evolución postoperatoria.[75]Hameed N, Yedinak CG, Brzana J, et al. Remission rate after transsphenoidal surgery in patients with pathologically confirmed Cushing's disease, the role of cortisol, ACTH assessment and immediate reoperation: a large single center experience. Pituitary. 2013 Dec;16(4):452-8.
http://www.ncbi.nlm.nih.gov/pubmed/23242860?tool=bestpractice.com
La administración de corticosteroides generalmente se disminuye rápidamente hasta alcanzar dosis fisiológicas en el plazo de 1 semana o menos (generalmente en el momento del alta hospitalaria). Las pruebas para ver si el eje hipotálamo-hipofisario-suprarrenal (HHS) se ha recuperado pueden realizarse durante el seguimiento a los 3 meses de la intervención. La prueba suele ser un cortisol matutino antes de que el paciente tome la dosis de la mañana de hidrocortisona, si se ha mantenido el tratamiento con hidrocortisona. Los niveles de cortisol >552 nanomoles/L (>20 microgramos/dL) indican la recuperación del eje. Niveles <83 nanomol/L (<3 microgramos/dL) indican una necesidad continua de corticosteroides. Los niveles entre 83 nanomoles/L (3 microgramos/dL) y 552 nanomoles/L (20 microgramos/dL) deben motivar la realización de pruebas adicionales (prueba de estimulación con cosintropina, prueba de tolerancia a la insulina o prueba con metirapona). Una vez establecida la recuperación del eje HHS, los pacientes deben someterse a pruebas ante la posibilidad de recurrencia. La prueba de cortisol salival parece ser un mejor predictor de la recurrencia temprana.[73]Fleseriu M, Hamrahian AH, Hoffman AR, et al; AACE Neuroendocrine and Pituitary Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology Disease State Clinical Review: diagnosis of recurrence in Cushing disease. Endocr Pract. 2016 Dec;22(12):1436-48.
http://www.ncbi.nlm.nih.gov/pubmed/27643842?tool=bestpractice.com
[76]Danet-Lamasou M, Asselineau J, Perez P, et al. Accuracy of repeated measurements of late-night salivary cortisol to screen for early-stage recurrence of Cushing's disease following pituitary surgery. Clin Endocrinol (Oxf). 2015 Feb;82(2):260-6.
http://www.ncbi.nlm.nih.gov/pubmed/24975391?tool=bestpractice.com
Se debe considerar el tratamiento adicional en pacientes con fracaso de la cirugía inicial hipofisaria o con recurrencia de la enfermedad. La incidencia de recidivas en la enfermedad de Cushing es elevada, y el 50% de las recidivas se producen durante los primeros 50 meses tras la primera intervención quirúrgica.[77]Braun LT, Rubinstein G, Zopp S, et al. Recurrence after pituitary surgery in adult Cushing's disease: a systematic review on diagnosis and treatment. Endocrine. 2020 Nov;70(2):218-31.
https://www.doi.org/10.1007/s12020-020-02432-z
http://www.ncbi.nlm.nih.gov/pubmed/32743767?tool=bestpractice.com
Las terapias estándares incluyen la repetición de la cirugía de la hipófisis, radioterapia, adrenalectomía bilateral o tratamiento médico.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
[78]Reincke M, Ritzel K, Osswald A, et al. A critical re-appraisal of bilateral adrenalectomy for ACTH-dependent Cushing's syndrome. Eur J Endocrinol. 2015 Oct;173(4):M23-32.
https://eje.bioscientifica.com/view/journals/eje/173/4/M23.xml
http://www.ncbi.nlm.nih.gov/pubmed/25994948?tool=bestpractice.com
Las tasas de éxito de estas opciones terapéuticas varían entre el 25% (para algunos tratamientos médicos) y el 100% (adrenalectomía bilateral). Las opciones de tratamiento tienen ventajas, limitaciones y efectos secundarios específicos, por lo que las decisiones terapéuticas deben individualizarse en función de las necesidades específicas del paciente y del riesgo de complicaciones.[77]Braun LT, Rubinstein G, Zopp S, et al. Recurrence after pituitary surgery in adult Cushing's disease: a systematic review on diagnosis and treatment. Endocrine. 2020 Nov;70(2):218-31.
https://www.doi.org/10.1007/s12020-020-02432-z
http://www.ncbi.nlm.nih.gov/pubmed/32743767?tool=bestpractice.com
[79]Cuevas-Ramos D, Fleseriu M. Treatment of Cushing's disease: a mechanistic update. J Endocrinol. 2014 Nov;223(2):R19-39.
https://joe.bioscientifica.com/view/journals/joe/223/2/R19.xml
http://www.ncbi.nlm.nih.gov/pubmed/25134660?tool=bestpractice.com
Generalmente, se acepta la reoperación como el tratamiento de preferencia en caso de fracaso de la cirugía inicial. Se debe considerar en todos los pacientes con recurrencia o persistencia de la enfermedad. Es eficaz en aproximadamente dos tercios de los pacientes.[80]Friedman RB, Oldfield EH, Nieman LK, et al. Repeat transsphenoidal surgery for Cushing's disease. J Neurosurg. 1989 Oct;71(4):520-7.
http://www.ncbi.nlm.nih.gov/pubmed/2552045?tool=bestpractice.com
[81]Benveniste RJ, King WA, Walsh J, et al. Repeated transsphenoidal surgery to treat recurrent or residual pituitary adenoma. J Neurosurg. 2005 Jun;102(6):1004-12.
http://www.ncbi.nlm.nih.gov/pubmed/16028758?tool=bestpractice.com
[82]Hofmann BM, Hlavac M, Kreutzer J, et al. Surgical treatment of recurrent Cushing's disease. Neurosurgery. 2006 Jun;58(6):1108-18.
http://www.ncbi.nlm.nih.gov/pubmed/16723890?tool=bestpractice.com
Sin embargo, el riesgo de deficiencia hipofisaria después de la reoperación es del 50%. Esto es significativamente superior después del tratamiento quirúrgico inicial.[80]Friedman RB, Oldfield EH, Nieman LK, et al. Repeat transsphenoidal surgery for Cushing's disease. J Neurosurg. 1989 Oct;71(4):520-7.
http://www.ncbi.nlm.nih.gov/pubmed/2552045?tool=bestpractice.com
Si la reoperación no es eficaz o si el paciente no es un candidato para la reoperación, se debe considerar otra modalidad.
La radioterapia mediante radioterapia fraccionada estándar o radiocirugía estereotáctica se utiliza con mayor frecuencia en pacientes con hipercortisolismo persistente tras una resección incompleta del tumor corticotropo, especialmente si el tumor es agresivo o invasivo o se considera irresecable.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
La radioterapia permite controlar el hipercortisolismo en un plazo de 3 a 5 años en más de la mitad de los pacientes.[83]Sonino N, Zielezny M, Fava GA, et al. Risk factors and long-term outcome in pituitary-dependent Cushing's disease. J Clin Endocrinol Metab. 1996 Jul;81(7):2647-52.
https://academic.oup.com/jcem/article/81/7/2647/2875568
http://www.ncbi.nlm.nih.gov/pubmed/8675592?tool=bestpractice.com
[84]Castinetti F, Nagai M, Dufour H, et al. Gamma knife radiosurgery is a successful adjunctive treatment in Cushing's disease. Eur J Endocrinol. 2007 Jan;156(1):91-8.
https://eje.bioscientifica.com/view/journals/eje/156/1/1560091.xml
http://www.ncbi.nlm.nih.gov/pubmed/17218730?tool=bestpractice.com
[85]Devin JK, Allen GS, Cmelak AJ, et al. The efficacy of linear accelerator radiosurgery in the management of patients with Cushing's disease. Stereotact Funct Neurosurg. 2004;82(5-6):254-62.
http://www.ncbi.nlm.nih.gov/pubmed/15665560?tool=bestpractice.com
[86]Estrada J, Boronat M, Mielgo M, et al. The long-term outcome of pituitary irradiation after unsuccessful transsphenoidal surgery in Cushing's disease. N Engl J Med. 1997 Jan 16;336(3):172-7.
https://www.nejm.org/doi/full/10.1056/NEJM199701163360303
http://www.ncbi.nlm.nih.gov/pubmed/8988897?tool=bestpractice.com
[87]Starke RM, Williams BJ, Vance ML, et al. Radiation therapy and stereotactic radiosurgery for the treatment of Cushing's disease: an evidence-based review. Curr Opin Endocrinol Diabetes Obes. 2010 Aug;17(4):356-64.
http://www.ncbi.nlm.nih.gov/pubmed/20531182?tool=bestpractice.com
Esta modalidad es quizás mejor utilizada como parte del tratamiento para pacientes con hipercortisolismo residual leve, ya que los efectos totales del tratamiento pueden tardar varios años en obtenerse. La radiación de los tumores localizados cerca del quiasma óptico aumenta el riesgo de daño en el quiasma óptico y este riesgo debe considerarse antes del tratamiento. El hipopituitarismo también puede ocurrir después de la radioterapia y es otro riesgo que debe considerarse antes de iniciar el tratamiento. El riesgo exacto de hipopituitarismo después de la radioterapia fraccionada convencional en comparación con la radiocirugía estereotáctica no está claro, pero son similares.
Los pacientes con una reoperación no exitosa que manifiestan hipercortisolismo grave deben evaluarse para la terapia con tratamiento médico, adrenalectomía bilateral o una combinación de estos tratamientos. La ventaja de estos enfoques es el inicio rápido de la disminución de los niveles de cortisol o el bloqueo de la acción del cortisol.
El tratamiento médico con un análogo de la somatostatina (pasireotida), un agonista de la dopamina (cabergolina), un inhibidor de la esteroidogénesis (osilodrostat, ketoconazol, levoketoconazol, metirapona, mitotano y etomidato) o un antagonista de los receptores de glucocorticoides (mifepristona) se utiliza cada vez más en la práctica clínica. El tratamiento médico está indicado para controlar la secreción de cortisol en pacientes con hipercortisolismo leve, como adyuvante a corto plazo en caso de hipercortisolismo grave antes de iniciar otros tratamientos, en el preoperatorio como puente hasta que se logre el control del hipercortisolismo mediante radioterapia, en casos de hipercortisolismo persistente o recurrente tras una intervención quirúrgica, o cuando se rechaza la cirugía o no es factible (p. ej., alto riesgo quirúrgico, enfermedad metastásica).[88]Varlamov EV, McCartney S, Fleseriu M. Functioning pituitary adenomas - current treatment options and emerging medical therapies. Eur Endocrinol. 2019 Apr;15(1):30-40.
https://www.touchendocrinology.com/pituitary/journal-articles/functioning-pituitary-adenomas-current-treatment-options-and-emerging-medical-therapies
http://www.ncbi.nlm.nih.gov/pubmed/31244908?tool=bestpractice.com
[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
[91]Broersen LHA, Jha M, Biermasz NR, et al. Effectiveness of medical treatment for Cushing's syndrome: a systematic review and meta-analysis. Pituitary. 2018 Dec;21(6):631-41.
https://link.springer.com/article/10.1007%2Fs11102-018-0897-z
http://www.ncbi.nlm.nih.gov/pubmed/29855779?tool=bestpractice.com
Sin embargo, hay una escasez de estudios de alta calidad sobre la terapia médica en la enfermedad de Cushing y se debe tener cuidado al comparar las tasas de eficacia debido a la variabilidad en el diseño y la calidad de los estudios.[91]Broersen LHA, Jha M, Biermasz NR, et al. Effectiveness of medical treatment for Cushing's syndrome: a systematic review and meta-analysis. Pituitary. 2018 Dec;21(6):631-41.
https://link.springer.com/article/10.1007%2Fs11102-018-0897-z
http://www.ncbi.nlm.nih.gov/pubmed/29855779?tool=bestpractice.com
Es preciso individualizar el tratamiento médico de los pacientes con enfermedad de Cushing en función del cuadro clínico, incluyendo la gravedad del hipercortisolismo.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
En pacientes con enfermedad grave, realice un tratamiento agresivo para normalizar las concentraciones de cortisol (o la acción del cortisol). Utilice múltiples pruebas seriadas tanto de cortisol libre urinario como de cortisol salival nocturno para monitorizar los resultados del tratamiento.
La pasireotida es un análogo de la somatostatina que se dirige de manera selectiva a los receptores de somatostatina en los adenomas corticotropos y ahora se utiliza para tratar médicamente la enfermedad de Cushing.[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
La pasireotida se fija a una gran variedad de receptores de la somatostatina, pero con mayor afinidad con el receptor 5, que se expresa predominantemente en pacientes con adenomas corticotropos. Se ha demostrado que el uso de la formulación de liberación regular de pasireotida disminuye los niveles de cortisol en la mayoría de los pacientes con enfermedad de Cushing, pero solo normaliza los niveles de cortisol en el 25% de los pacientes.[92]Colao A, Petersenn S, Newell-Price J, et al. A 12-month phase 3 study of pasireotide in Cushing's disease. N Engl J Med. 2012 Mar 8;366(10):914-24.
https://www.nejm.org/doi/full/10.1056/NEJMoa1105743
http://www.ncbi.nlm.nih.gov/pubmed/22397653?tool=bestpractice.com
La formulación de acción prolongada del pasireótido mostró una normalización en aproximadamente el 40% de los pacientes, pero se observó hiperglucemia en hasta el 80% de los pacientes.[93]Lacroix A, Gu F, Gallardo W, et al. Efficacy and safety of once-monthly pasireotide in Cushing's disease: a 12 month clinical trial. Lancet Diabetes Endocrinol. 2018 Jan;6(1):17-26.
http://www.ncbi.nlm.nih.gov/pubmed/29032078?tool=bestpractice.com
En un estudio se observó una contracción tumoral en el 62.5% de los pacientes después de 6 meses de tratamiento con pasireotida.[94]Simeoli C, Auriemma RS, Tortora F, et al. The treatment with pasireotide in Cushing's disease: effects of long-term treatment on tumor mass in the experience of a single center. Endocrine. 2015 Dec;50(3):725-40.
http://www.ncbi.nlm.nih.gov/pubmed/25743263?tool=bestpractice.com
El cortisol salival también disminuyó después del tratamiento; por lo tanto, el cortisol salival puede ser un biomarcador más conveniente de seguimiento para evaluar la respuesta al tratamiento en pacientes con enfermedad de Cushing.[95]Findling JW, Fleseriu M, Newell-Price J, et al. Late-night salivary cortisol may be valuable for assessing treatment response in patients with Cushing's disease: 12-month, phase III pasireotide study. Endocrine. 2016 Nov;54(2):516-23.
https://link.springer.com/article/10.1007%2Fs12020-016-0978-6
http://www.ncbi.nlm.nih.gov/pubmed/27209465?tool=bestpractice.com
En una experiencia de 10 años con pasireotida en un solo centro se observó un beneficio bioquímico y clínico sostenido en aproximadamente el 60% de los pacientes con la enfermedad de Cushing.[96]Trementino L, Michetti G, Angeletti A, et al. A single-center 10-year experience with pasireotide in Cushing's disease: patients' characteristics and outcome. Horm Metab Res. 2016 May;48(5):290-8.
https://www.thieme-connect.com/products/ejournals/html/10.1055/s-0042-101347
http://www.ncbi.nlm.nih.gov/pubmed/27127913?tool=bestpractice.com
Este es un tratamiento dirigido a la hipófisis y solo debe utilizarse en pacientes con hipercortisolismo provocado por tumores hipofisarios secretores de ACTH.[97]Petersenn S, Fleseriu M. Pituitary-directed medical therapy in Cushing's disease. Pituitary. 2015 Apr;18(2):238-44.
http://www.ncbi.nlm.nih.gov/pubmed/25627118?tool=bestpractice.com
Existe un alto riesgo de hiperglucemia, que requiere una cuidadosa selección de los pacientes, y un riesgo de prolongación del QTc.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
La cabergolina, un agonista de la dopamina, se ha utilizado off-label en algunos países con resultados limitados para el tratamiento de la enfermedad de Cushing.[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
[98]Palui R, Sahoo J, Kamalanathan S, et al. Effect of cabergoline monotherapy in Cushing's disease: an individual participant data meta-analysis. J Endocrinol Invest. 2018 Dec;41(12):1445-55.
http://www.ncbi.nlm.nih.gov/pubmed/30097903?tool=bestpractice.com
Los inhibidores de la esteroidogénesis (fármacos que disminuyen la producción de corticosteroides suprarrenales, como el osilodrostat, el ketoconazol, el levoketoconazol, la metirapona, el mitotane y el etomidato) pueden utilizarse (aunque fuera de ficha técnica en algunos países, excepto el osilodrostat) en el tratamiento del síndrome de Cushing.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
El osilodrostat es un potente inhibidor oral de la esteroidogénesis (inhibe la 11-beta-hidroxilasa esteroidea) que está aprobado en EE.UU. para el tratamiento de la enfermedad de Cushing en pacientes en los que la cirugía hipofisaria no es una opción o no ha sido curativa, y en Europa y Japón para el tratamiento del síndrome de Cushing endógeno.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[99]Pivonello R, Fleseriu M, Newell-Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing's disease (LINC 3): a multicentre phase III study with a double-blind, randomised withdrawal phase. Lancet Diabetes Endocrinol. 2020 Sep;8(9):748-61.
http://www.ncbi.nlm.nih.gov/pubmed/32730798?tool=bestpractice.com
El osilodrostato reduce rápidamente el cortisol libre en la orina con mejoras asociadas en los signos clínicos de hipercortisolismo, y en general es bien tolerado.[99]Pivonello R, Fleseriu M, Newell-Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing's disease (LINC 3): a multicentre phase III study with a double-blind, randomised withdrawal phase. Lancet Diabetes Endocrinol. 2020 Sep;8(9):748-61.
http://www.ncbi.nlm.nih.gov/pubmed/32730798?tool=bestpractice.com
Existe riesgo de hipocortisolismo, hipopotasemia y prolongación del QTc; en las mujeres es necesario un control cuidadoso del hiperandrogenismo.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
El ketoconazol presenta un inicio relativamente rápido de inhibición de la esteroidogénesis. El ketoconazol puede causar lesión hepática grave e insuficiencia suprarrenal.[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
[100]Castinetti F, Guignat L, Giraud P, et al. Ketoconazole in Cushing's disease: is it worth a try? J Clin Endocrinol Metab. 2014 May;99(5):1623-30.
https://academic.oup.com/jcem/article/99/5/1623/2537349
http://www.ncbi.nlm.nih.gov/pubmed/24471573?tool=bestpractice.com
[101]US Food and Drug Administration. FDA drug safety communication: FDA warns that prescribing of Nizoral (ketoconazole) oral tablets for unapproved uses including skin and nail infections continues; linked to patient death. May 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-prescribing-nizoral-ketoconazole-oral-tablets-unapproved
Si se usa, debe monitorizarse la función hepática y suprarrenal antes y durante el tratamiento. Su uso requiere asesoría de expertos y está contraindicado en pacientes con hepatopatía.[101]US Food and Drug Administration. FDA drug safety communication: FDA warns that prescribing of Nizoral (ketoconazole) oral tablets for unapproved uses including skin and nail infections continues; linked to patient death. May 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-prescribing-nizoral-ketoconazole-oral-tablets-unapproved
El levoketoconazol es un inhibidor de la esteroidogénesis suprarrenal que está aprobado como tratamiento en EE.UU.[102]Fleseriu M, Castinetti F. Updates on the role of adrenal steroidogenesis inhibitors in Cushing's syndrome: a focus on novel therapies. Pituitary. 2016 Dec;19(6):643-53.
https://link.springer.com/article/10.1007/s11102-016-0742-1
http://www.ncbi.nlm.nih.gov/pubmed/27600150?tool=bestpractice.com
[103]Fleseriu M, Pivonello R, Elenkova A, et al. Efficacy and safety of levoketoconazole in the treatment of endogenous Cushing's syndrome (SONICS): a phase 3, multicentre, open-label, single-arm trial. Lancet Diabetes Endocrinol. 2019 Nov;7(11):855-65.
http://www.ncbi.nlm.nih.gov/pubmed/31542384?tool=bestpractice.com
[104]Zacharieva SZ, Pivonello R, Elenkova A, et al. MON-332 safety and efficacy of levoketoconazole in the treatment of endogenous Cushing’s syndrome (LOGICS): a double-blind, placebo-controlled, withdrawal study. J Endocr Soc. 2020 May 8;4(suppl 1):MON-332.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7208150
La metirapona proporciona un inicio rápido de la inhibición y puede obtenerse para uso compasivo en los EE. UU.
El mitotano presenta propiedades adrenostáticas y adrenolíticas, pero tiene eficacia retrasada debido al lento inicio de la acción y a una ventana terapéutica estrecha.[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
Se utiliza con poca frecuencia para el síndrome de Cushing provocado por otras causas que no sea un carcinoma suprarrenal.
El etomidato es un potente fármaco adrenostático de inicio rápido de acción. Se utiliza solo en casos de emergencia (p. ej., psicosis inducida por hipercortisol) y debe administrarse por vía intravenosa.[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
La mifepristona, un antagonista de los receptores de glucocorticoides, bloquea el efecto del cortisol a nivel de los receptores y debe considerarse en los pacientes que tienen trastornos clínicos y metabólicos de hipercortisolismo continuado con hiperglucemia y/o diabetes. La Administración de Medicamentos y Alimentos de los Estados Unidos ha aprobado la mifepristona para el tratamiento de la hiperglucemia asociada al síndrome de Cushing en pacientes con diabetes mellitus tipo 2. Los niveles de cortisol y de ACTH pueden aumentar con el uso de mifepristona debido a la inhibición por retroalimentación.[105]Fleseriu M, Findling JW, Koch CA, et al. Changes in plasma ACTH levels and corticotroph tumor size in patients with Cushing's disease during long-term treatment with the glucocorticoid receptor antagonist mifepristone. J Clin Endocrinol Metab. 2014 Oct;99(10):3718-27.
https://academic.oup.com/jcem/article/99/10/3718/2836437
http://www.ncbi.nlm.nih.gov/pubmed/25013998?tool=bestpractice.com
Por lo tanto, los niveles de cortisol no deben utilizarse para guiar la terapia en pacientes tratados con mifepristona.[106]Fleseriu M, Biller BM, Findling JW, et al; SEISMIC Study Investigators. Mifepristone, a glucocorticoid receptor antagonist, produces clinical and metabolic benefits in patients with Cushing's syndrome. J Clin Endocrinol Metab. 2012 Jun;97(6):2039-49.
https://academic.oup.com/jcem/article/97/6/2039/2536684
http://www.ncbi.nlm.nih.gov/pubmed/22466348?tool=bestpractice.com
La adrenalectomía bilateral proporciona una cura inmediata de cualquier causa de hipercortisolismo endógeno, pero a expensas de causar una insuficiencia suprarrenal permanente (que requiere el reemplazo de cortisol y de mineralocorticoides) y genera un riesgo de síndrome de Nelson (crecimiento de un tumor corticotropo después de la adrenalectomía). Esta progresión puede causar hiperpigmentación por el exceso de ACTH y síntomas de compresión intracraneal por el crecimiento del tumor fuera de la silla turca. Los métodos laparoscópicos de adrenalectomía más recientes permiten una recuperación más rápida y son mejor tolerados.[107]Neychev V, Steinberg SM, Yang L, et al. Long-term outcome of bilateral laparoscopic adrenalectomy measured by disease-specific questionnaire in a unique group of patients with Cushing's syndrome. Ann Surg Oncol. 2015 Dec;22 Suppl 3:S699-706.
http://www.ncbi.nlm.nih.gov/pubmed/25968622?tool=bestpractice.com
Un metaanálisis de 37 estudios (1320 pacientes, 82% con enfermedad de Cushing, 13% con síndrome de Cushing ectópico y 5% con hiperplasia suprarrenal primaria) demostró que la adrenalectomía bilateral es relativamente segura y proporciona un éxito adecuado.[108]Ritzel K, Beuschlein F, Mickisch A, et al. Clinical review: outcome of bilateral adrenalectomy in Cushing's syndrome: a systematic review. J Clin Endocrinol Metab. 2013 Oct;98(10):3939-48.
https://academic.oup.com/jcem/article/98/10/3939/2833849
http://www.ncbi.nlm.nih.gov/pubmed/23956347?tool=bestpractice.com
Aunque se encontró secreción residual de cortisol debido a tejido suprarrenal accesorio o restos suprarrenales en hasta el 34% de los pacientes, menos del 2% presentó una recidiva del síndrome de Cushing. Los síntomas de hipercortisolismo (p. ej., hipertensión, obesidad o depresión) mejoraron en la mayoría de los pacientes después de la adrenalectomía bilateral. El número de crisis suprarrenales por cada 100 años de paciente fue de 9.3, y el síndrome de Nelson se produjo en el 21% de los pacientes. El exceso de mortalidad dentro del primer año después de la cirugía sugiere que la atención clínica intensiva para los pacientes después de la adrenalectomía bilateral está justificada.
Para el reemplazo de las hormonas pituitarias no glucocorticoides después de la cirugía de la hipófisis (puede producirse cualquier combinación de deficiencias):[109]Fleseriu M, Hashim IA, Karavitaki N, et al. Hormonal replacement in hypopituitarism in adults: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 Nov;101(11):3888-921.
https://academic.oup.com/jcem/article/101/11/3888/2764912
http://www.ncbi.nlm.nih.gov/pubmed/27736313?tool=bestpractice.com
La levotiroxina se utiliza para lograr un nivel de T4 libre en la mitad superior del rango normal. No debería usarse una hormona estimulante de la tiroides para guiar el tratamiento.
La terapia con testosterona se utiliza para alcanzar un nivel de testosterona en el rango normal.
Las mujeres con un útero intacto que toman reemplazo de estrógenos también requieren 10 días de progestina cada mes además de la terapia de reemplazo de estrógenos.
La decisión de realizar el tratamiento con hormona del crecimiento debe individualizarse para cada paciente, teniendo en cuenta los síntomas, los beneficios y el riesgo del tratamiento. El ajuste de la dosis debe producirse cada mes para alcanzar la respuesta clínica (es decir, nivel de energía, sensación de bienestar y masa corporal magra) y un nivel de factor de crecimiento similar a la insulina tipo 1 (IGF-1) en el rango normal medio a superior ajustado según la edad.
La desmopresina se ajusta para controlar la diuresis excesiva sintomática. Esto se basa en las preferencias del paciente. El sodio sérico y los síntomas se monitorizan periódicamente para evaluar la idoneidad del tratamiento.
Síndrome de Cushing independiente de la ACTH
La causa más común de la sobreproducción de cortisol suprarrenal es un adenoma suprarrenal autónomo unilateral. El tratamiento de primera línea es casi siempre la adrenalectomía unilateral de la glándula suprarrenal afectada. La adrenalectomía laparoscópica es el método de preferencia en la mayoría de los casos. La extracción de la glándula suprarrenal afectada es curativa en todos los pacientes con enfermedad suprarrenal unilateral. La adrenalectomía tiene un efecto beneficioso sobre los factores de riesgo cardiovascular en pacientes con síndrome de Cushing subclínico, en general y en comparación con el tratamiento conservador.[110]Bancos I, Alahdab F, Crowley RK, et al. Therapy of endocrine disease: improvement of cardiovascular risk factors after adrenalectomy in patients with adrenal tumors and subclinical Cushing's syndrome: a systematic review and meta-analysis. Eur J Endocrinol. 2016 Dec;175(6):R283-95.
https://eje.bioscientifica.com/view/journals/eje/175/6/R283.xml
http://www.ncbi.nlm.nih.gov/pubmed/27450696?tool=bestpractice.com
Las causas menos frecuentes de la enfermedad independiente de la ACTH generalmente causan enfermedad suprarrenal bilateral provocada por la formación de nódulos autónomos o por hiperplasia bilateral.[19]Duan K, Gomez Hernandez K, Mete O. Clinicopathological correlates of adrenal Cushing's syndrome. J Clin Pathol. 2015 Mar;68(3):175-86.
https://jcp.bmj.com/content/68/3/175.long
http://www.ncbi.nlm.nih.gov/pubmed/25425660?tool=bestpractice.com
[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
En estos casos, el tratamiento de primera línea generalmente requiere la adrenalectomía bilateral. El tratamiento con inhibidores de la esteroidogénesis (osilodrostat, ketoconazol, levoketoconazol, metirapona, mitotane y etomidato), o un antagonista de los receptores de glucocorticoides (mifepristona) puede utilizarse en pacientes que deseen evitar la suprarrenalectomía bilateral.[19]Duan K, Gomez Hernandez K, Mete O. Clinicopathological correlates of adrenal Cushing's syndrome. J Clin Pathol. 2015 Mar;68(3):175-86.
https://jcp.bmj.com/content/68/3/175.long
http://www.ncbi.nlm.nih.gov/pubmed/25425660?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
[111]Cohan P, East HE, Galati SJ, et al. Mifepristone treatment in four cases of primary bilateral macronodular adrenal hyperplasia (BMAH). J Clin Endocrinol Metab. 2019 Dec 1;104(12):6279-90.
https://academic.oup.com/jcem/article/104/12/6279/5491614
http://www.ncbi.nlm.nih.gov/pubmed/31112270?tool=bestpractice.com
El osilodrostato reduce rápidamente el cortisol libre en la orina con mejoras asociadas en los signos clínicos de hipercortisolismo, y en general es bien tolerado.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[99]Pivonello R, Fleseriu M, Newell-Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing's disease (LINC 3): a multicentre phase III study with a double-blind, randomised withdrawal phase. Lancet Diabetes Endocrinol. 2020 Sep;8(9):748-61.
http://www.ncbi.nlm.nih.gov/pubmed/32730798?tool=bestpractice.com
El ketoconazol presenta un inicio relativamente rápido de inhibición de la esteroidogénesis. El ketoconazol puede causar lesión hepática grave e insuficiencia suprarrenal. Su uso requiere asesoría de expertos y está contraindicado en pacientes con hepatopatía. Si se usa, debe vigilarse la función hepática y suprarrenal antes y durante el tratamiento.[101]US Food and Drug Administration. FDA drug safety communication: FDA warns that prescribing of Nizoral (ketoconazole) oral tablets for unapproved uses including skin and nail infections continues; linked to patient death. May 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-prescribing-nizoral-ketoconazole-oral-tablets-unapproved
El levoketoconazol es un inhibidor de la esteroidogénesis suprarrenal que está aprobado como tratamiento en EE.UU.[102]Fleseriu M, Castinetti F. Updates on the role of adrenal steroidogenesis inhibitors in Cushing's syndrome: a focus on novel therapies. Pituitary. 2016 Dec;19(6):643-53.
https://link.springer.com/article/10.1007/s11102-016-0742-1
http://www.ncbi.nlm.nih.gov/pubmed/27600150?tool=bestpractice.com
[103]Fleseriu M, Pivonello R, Elenkova A, et al. Efficacy and safety of levoketoconazole in the treatment of endogenous Cushing's syndrome (SONICS): a phase 3, multicentre, open-label, single-arm trial. Lancet Diabetes Endocrinol. 2019 Nov;7(11):855-65.
http://www.ncbi.nlm.nih.gov/pubmed/31542384?tool=bestpractice.com
[104]Zacharieva SZ, Pivonello R, Elenkova A, et al. MON-332 safety and efficacy of levoketoconazole in the treatment of endogenous Cushing’s syndrome (LOGICS): a double-blind, placebo-controlled, withdrawal study. J Endocr Soc. 2020 May 8;4(suppl 1):MON-332.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7208150
La metirapona proporciona un inicio rápido de la inhibición. El mitotano tiene inicio de acción lento y una ventana terapéutica estrecha, por lo general, solo se utiliza en el carcinoma suprarrenal.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
El etomidato, utilizado solo en emergencias, tiene inicio rápido pero debe administrarse por vía intravenosa.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
La mifepristona bloquea la acción del cortisol, lo cual genera la atenuación de los efectos del cortisol.
El carcinoma suprarrenal es una causa muy poco frecuente de síndrome de Cushing independiente de la ACTH. El tratamiento de primera línea en muchos pacientes es la resección quirúrgica; sin embargo, en el momento del diagnóstico, la enfermedad generalmente ha avanzado y superado el punto en el que el tratamiento quirúrgico es eficaz. La eficacia de la quimioterapia y las terapias suplementarias tanto en la etapa inicial como en la tardía de la enfermedad ha mostrado resultados contradictorios en los ensayos clínicos; sin embargo, se debe considerar a los pacientes para el tratamiento con mitotano y la inscripción en los ensayos clínicos (si se dispone de ellos).[10]Fassnacht M, Dekkers OM, Else T, et al. European Society of Endocrinology clinical practice guidelines on the management of adrenocortical carcinoma in adults, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2018 Oct 1;179(4):G1-46.
https://eje.bioscientifica.com/view/journals/eje/179/4/EJE-18-0608.xml
http://www.ncbi.nlm.nih.gov/pubmed/30299884?tool=bestpractice.com
Síndrome de hormona adrenocorticotrópica (ACTH) ectópica
El tratamiento óptimo de primera línea implica localizar y extirpar quirúrgicamente el tumor productor de ACTH. No es infrecuente que la resección completa de estos tumores sea imposible. Cuando la resección quirúrgica no es posible, los tratamientos de segunda línea incluyen un antagonista de los receptores de glucocorticoides (mifepristona), terapia con inhibidores de la esteroidogénesis (osilodrostat, ketoconazol, levoketoconazol, metirapona, mitotane y etomidato) o suprarrenalectomía bilateral.[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
La adrenalectomía bilateral es un tratamiento definitivo, pero los pacientes con tumores productores de ACTH ectópica pueden presentar hipercortisolismo extremadamente grave y requieren la reducción del cortisol antes de someterse a la cirugía. En esos casos, se puede utilizar la mifepristona o el tratamiento con inhibidores de la esteroidogénesis para reducir los niveles de cortisol como preparación para una adrenalectomía bilateral. El osilodrostato reduce rápidamente el cortisol libre en la orina con mejoras asociadas en los signos clínicos de hipercortisolismo, y en general es bien tolerado.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[99]Pivonello R, Fleseriu M, Newell-Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing's disease (LINC 3): a multicentre phase III study with a double-blind, randomised withdrawal phase. Lancet Diabetes Endocrinol. 2020 Sep;8(9):748-61.
http://www.ncbi.nlm.nih.gov/pubmed/32730798?tool=bestpractice.com
El ketoconazol presenta un inicio relativamente rápido de inhibición de la esteroidogénesis. El ketoconazol puede causar lesión hepática grave e insuficiencia suprarrenal. Su uso requiere asesoría de expertos y está contraindicado en pacientes con hepatopatía. Si se usa, debe vigilarse la función hepática y suprarrenal antes y durante el tratamiento.[101]US Food and Drug Administration. FDA drug safety communication: FDA warns that prescribing of Nizoral (ketoconazole) oral tablets for unapproved uses including skin and nail infections continues; linked to patient death. May 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-prescribing-nizoral-ketoconazole-oral-tablets-unapproved
El levoketoconazol es un inhibidor de la esteroidogénesis suprarrenal que está aprobado como tratamiento en EE.UU.[102]Fleseriu M, Castinetti F. Updates on the role of adrenal steroidogenesis inhibitors in Cushing's syndrome: a focus on novel therapies. Pituitary. 2016 Dec;19(6):643-53.
https://link.springer.com/article/10.1007/s11102-016-0742-1
http://www.ncbi.nlm.nih.gov/pubmed/27600150?tool=bestpractice.com
[103]Fleseriu M, Pivonello R, Elenkova A, et al. Efficacy and safety of levoketoconazole in the treatment of endogenous Cushing's syndrome (SONICS): a phase 3, multicentre, open-label, single-arm trial. Lancet Diabetes Endocrinol. 2019 Nov;7(11):855-65.
http://www.ncbi.nlm.nih.gov/pubmed/31542384?tool=bestpractice.com
[104]Zacharieva SZ, Pivonello R, Elenkova A, et al. MON-332 safety and efficacy of levoketoconazole in the treatment of endogenous Cushing’s syndrome (LOGICS): a double-blind, placebo-controlled, withdrawal study. J Endocr Soc. 2020 May 8;4(suppl 1):MON-332.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7208150
La metirapona proporciona un inicio rápido de la inhibición. El mitotano tiene inicio de acción lento y una ventana terapéutica estrecha, por lo general, solo se utiliza en el carcinoma suprarrenal.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
El etomidato, utilizado solo en emergencias, tiene inicio rápido pero debe administrarse por vía intravenosa.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
La mifepristona bloquea la acción del cortisol, lo cual genera la atenuación de los efectos del cortisol.
