História e exame físico
Principais fatores diagnósticos
comuns
presença de fatores de risco
Os principais fatores de risco para o estado hipercoagulável incluem uma história de tromboembolismo venoso não provocado, idade avançada, gestação/pós-parto, neoplasia maligna, estado inflamatório agudo, anticorpos antifosfolipídeos, doenças mieloproliferativas, síndrome nefrótica, doença de Behçet, coagulação intravascular disseminada, hemoglobinúria paroxística noturna, trombocitopenia induzida por heparina, pílula contraceptiva oral contendo estrogênio/terapia de reposição hormonal/terapia com modulador seletivo do receptor estrogênicos, quimioterapia, cirurgia, deficiência de antitrombina, deficiência de proteínas C ou S, deficiência de plasminogênio.
inchaço da panturrilha
Sugere uma trombose venosa profunda.[Figure caption and citation for the preceding image starts]: Trombose venosa profunda agudaDo acervo do Dr. Roopen Arya; usado com permissão [Citation ends].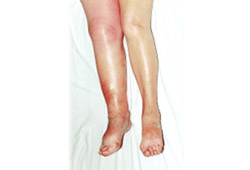
dor ou sensibilidade ao longo do sistema venoso profundo
Sugere uma trombose venosa profunda.
dor torácica
Sugere embolia pulmonar.
taquipneia
Sugere embolia pulmonar.
dispneia
Sugere embolia pulmonar.
hipotensão
Sugere embolia pulmonar.
taquicardia
Sugere embolia pulmonar.
Outros fatores diagnósticos
comuns
histórico familiar de tromboembolismo venoso
A história de tromboembolismo venoso em parentes de primeiro grau com o primeiro evento com pouca idade (<50 anos) pode sugerir trombofilia hereditária subjacente.[114]
Fatores de risco
Fortes
história de tromboembolismo venoso não provocado
Aproximadamente 25% dos primeiros tromboembolismos venosos não são provocados (idiopáticos) e indicam um estado hipercoagulável subjacente.[49]
A estratificação do risco usando o dímero D (marcador de fibrinólise), geração de trombina e níveis do fator VIII pode ajudar na identificação de pacientes com alto risco de tromboembolismo venoso adicional.[33][108][109][110][111]
avanço da idade
O risco de tromboembolismo venoso aumenta com a idade, de 1 em 100,000 crianças, para 1 em 1000 adultos acima de 40 anos de idade, para 1 em 100 adultos >80 anos de idade.[39][40][41] O envelhecimento está associado a níveis elevados de fatores VII, IX e X ativados e níveis elevados de fator VIII, fibrinogênio e dímero D (marcador da fibrinólise), que estão associados ao aumento do risco de trombose.[42]
A prevalência elevada de comorbidades associadas ao envelhecimento pode elevar ainda mais os níveis de fatores de coagulação.
gestação/pós-parto
A gestação resulta em uma queda fisiológica da proteína S e aumento do fibrinogênio, fator VIII e fator de von Willebrand. Isso resulta em resistência à proteína C ativada. Todas as alterações persistem pelo menos 2 meses pós-parto.[46]
Aumenta em quatro vezes o risco de tromboembolismo venoso em comparação com mulheres não gestantes.[43][44][45]
Embora o risco absoluto de tromboembolismo venoso na gravidez permaneça baixo, é uma das principais causas de morbidade e mortalidade materna.[47][48] O risco é maior com história familiar de tromboembolismo venoso e trombofilia hereditária.[7][17][26] O risco de tromboembolismo venoso relacionado à gravidez é maior em mulheres com deficiência de antitrombina tipo I, homozigosidade para fator V de Leiden ou heterozigosidade composta,[7][17][26] ou em mulheres que já apresentaram tromboembolismo venoso associado ao estrogênio sem fatores precipitantes.
neoplasia maligna
Fator de risco predisponente em 16% a 18% dos pacientes com trombofilia.[49][50]
O estado protrombótico resulta da ativação do sistema de coagulação decorrente da expressão do fator tecidual, atividade fibrinolítica e liberação de citocinas pelas células malignas e da sua interação com as células endoteliais e plaquetas.[51][52]
A prevalência de malignidade oculta no diagnóstico de tromboembolismo venoso não provocado (idiopático) é de 6.1% e 10% 12 meses após o diagnóstico de tromboembolismo venoso.[53]
Malignidade oculta é menos frequente em casos de tromboembolismo venoso provocado (1.6% e 2.4% no diagnóstico e 12 meses após o diagnóstico de tromboembolismo venoso, respectivamente).[53]
O diagnóstico subsequente de câncer geralmente é doença metastática avançada.[54]
Malignidade oculta e tromboembolismo venoso estão associados a uma alta incidência de recorrência precoce, sangramento e morte.[50]
estado inflamatório agudo
O risco de tromboembolismo venoso é aumentado em pacientes hospitalizados com infecção aguda, artrite, doença do tecido conjuntivo ou doença inflamatória intestinal.[44][55][56]
Pacientes na comunidade com doença infecciosa apresentam risco até duas vezes maior de tromboembolismo venoso.[57]
A doença inflamatória intestinal eleva o risco de tromboembolismo venoso em até três vezes.[58] O mecanismo subjacente ainda não foi esclarecido.
anticorpos antifosfolipídeos (AFLs)
Associados a doenças autoimunes (por exemplo, lúpus eritematoso sistêmico) ou neoplasia maligna (por exemplo, linfoma).[59]
A maioria dos pacientes com anticorpos antifosfolipídeos (AFLs) que desenvolvem tromboembolismo venoso apresentam fatores de risco adicionais de trombose.[59]
Foi observado que até 20% dos pacientes com tromboembolismo venoso apresentam níveis altos de anticorpos anticardiolipina antes do evento.[60]
A síndrome antifosfolipídica é caracterizada por AFLs persistentes (anticoagulante lúpico, anticorpos anticardiolipina, anticorpos anti-beta 2–glicoproteína 1 testados pelo menos duas vezes, com intervalo de 12 semanas) e por um evento trombótico objetivamente confirmado ou uma morbidade relacionada à gestação.[61][62][63]
A síndrome antifosfolipídica confirmada está associada a alto risco de tromboembolismo venoso recorrente após a supressão da anticoagulação.
doenças mieloproliferativas
Incluem policitemia vera, trombocitemia essencial, mielofibrose primária ou idiopática e leucemia mielogênica crônica.
Entre 12% e 39% dos casos apresentam trombose.[64]
São observados altos índices de trombose venosa abdominal.[65]
A mutação JAK2V617F pode ser responsável pelo fenótipo protrombótico.[65]
síndrome nefrótica
Alta incidência de estado hipercoagulável nos 6 primeiros meses após o diagnóstico.[67]
Alta prevalência de trombose venosa renal.[68]
A patogênese não está clara, mas provavelmente decorre de uma combinação de níveis alterados de proteínas de coagulação e fibrinolíticas, ativação plaquetária, hiperviscosidade, hiperlipidemia, hipoalbuminemia e terapia com corticosteroides ou diuréticos.[68]
Doença de Behçet
Uma doença multissistêmica rara caracterizada por ulceração oral e genital recorrente com envolvimento ocular.
O tromboembolismo venoso é uma complicação comum, afetando de 6% a 39% dos pacientes.[69][70]
A patogênese é pouco compreendida.
Foram observados marcadores elevados de geração de trombina e fibrinólise em todos os pacientes.[70]
coagulação intravascular disseminada
Complicação de uma doença subjacente, como sepse, malignidade, trauma ou doença hepática.
A patogênese complexa resulta em geração elevada de trombina decorrente da expressão elevada do fator tecidual, funcionamento prejudicado dos anticoagulantes naturais e fibrinólise acelerada.[71]
Pode se complicar com sangramento ou trombose.
hemoglobinúria paroxística noturna
trombocitopenia induzida por heparina
Causada pela formação de anticorpos contra o complexo formado entre a heparina e o fator plaquetário 4 (FP4).
A ligação de anticorpos ao complexo heparina/FP4 resulta na ativação plaquetária, formação de micropartículas, consumo de plaquetas, trombocitopenia e um aumento subsequente da geração de trombina.[74]
Deve-se suspeitar em pacientes que desenvolvem trombocitopenia ou nova trombose logo após o início da terapia com heparina.[75][76]
O risco de trombocitopenia induzida por heparina é menor em pacientes obstétricas/com afecções não cirúrgicas tratadas com heparina de baixo peso molecular (<0.1%) e é mais alto em pacientes cardíacos pós-operatórios e submetidos à cirurgia ortopédica tratados com heparina não fracionada (1% a 5%).[75][77]
terapia com pílula contraceptiva oral contendo estrogênio/terapia de reposição hormonal (TRH)/terapia com modulador seletivo dos receptores estrogênicos
Aumenta o risco de tromboembolismo venoso.[78][79]
[  ]
]
O risco absoluto de tromboembolismo venoso com uso de pílula contraceptiva oral em mulheres jovens sem história pessoal/familiar de trombose venosa permanece baixo.
A combinação de pílula contraceptiva oral e terapia de reposição hormonal (TRH) pode levar a níveis reduzidos de proteína S, níveis aumentados de fatores VII e VIII, fibrinólise aumentada e resistência à proteína C ativada.[80][81][82][83][84]
Preparações de TRH transdérmicas estão associadas a um risco menor que as formulações por via oral.[85][86][87][88]
A incidência de tromboembolismo venoso é maior nos 12 primeiros meses após o início da pílula contraceptiva oral ou TRH.[78] O uso de tamoxifeno está associado a aumento do risco de tromboembolismo venoso.[89] Entre as mulheres que tomam tamoxifeno adjuvante para câncer de mama em estádio inicial, a prevalência da mutação do fator V de Leiden pode ser aproximadamente cinco vezes maior naquelas que apresentam um evento tromboembólico que naquelas que não apresentam esse tipo de evento.[90]
quimioterapia
A taxa global de tromboembolismo venoso para os pacientes que recebem quimioterapia para câncer é de 6%.
Os esquemas que incorporam talidomida ou lenalidomida, além de dexametasona em alta dose, estão associados a uma maior incidência de tromboembolismo venoso (8% a 75% em pacientes com mieloma recém-diagnosticado) em comparação a 3%, quando a talidomida ou a lenalidomida são usadas como monoterapia.[91]
A terapia com asparaginase resulta em um aumento de quase cinco vezes na taxa de tromboembolismo venoso em pacientes com leucemia linfoblástica aguda.[92]
cirurgia
O risco de tromboembolismo venoso varia com o tipo de cirurgia e com outros fatores de risco subjacentes. Nos pacientes que não recebem profilaxia, estima-se que o risco basal de tromboembolismo venoso sintomático após uma cirurgia ortopédica de grande porte seja de 4.3%.[93]
Possivelmente devido ao estado protrombótico pós-operatório. O trauma cirúrgico pode resultar em exposição ao fator tecidual e subsequente ativação da coagulação.[94]
deficiência de antitrombina
A prevalência é de 1 em 5000 em pessoas brancas.[15]
As mutações genéticas podem provocar uma deficiência quantitativa ou defeito qualitativo na antitrombina (AT). Elas são relatadas em até 3% da população branca e em 6% dos indivíduos do Sudeste Asiático com tromboembolismo venoso.[10][11][16]
A deficiência grave de AT pode aumentar o risco de tromboembolismo venoso em até 50 vezes.[17]
A homozigosidade para um defeito na AT resulta em morte intrauterina.
deficiência de proteína C
Os pacientes com uma deficiência bem definida de proteína C têm um risco maior de evoluir para tromboembolismo venoso, comparados àqueles que não têm essa deficiência.
Prevalência de 1 em 500 em pessoas brancas; maior prevalência em indivíduos do Sudeste Asiático.[11][18]
Presente em até 5% da população branca e em até 8% dos indivíduos do Sudeste Asiático com tromboembolismo venoso.[10][16][19]
A deficiência homozigota pode resultar em fenótipo grave com púrpura fulminante neonatal.[20]
deficiência de proteína S
Prevalência de 1 em 1000 em pessoas brancas; maior prevalência em indivíduos do Sudeste Asiático.[10][12][19]
A proteína S é um cofator necessário para a inativação dos fatores Va e VIIIa pela proteína C ativada.[3]
A deficiência de proteína S foi associada a um alto risco de evoluir para tromboembolismo venoso, principalmente, em jovens.
deficiência de plasminogênio
Estudos sugerem que a frequência de deficiência de plasminogênio é maior que a esperada nos pacientes com trombose venosa.[3]
Pode ser uma deficiência quantitativa (hipoplasminogenemia) ou uma deficiência qualitativa (displasminogenemia).
Fracos
obesidade
A patogênese é multifatorial e inclui fatores de coagulação elevados e fibrinólise prejudicada.
Fator tecidual, fatores VII e VIII, e inibidor do ativador de plasminogênio 1 são todos elevados na obesidade, e podem contribuir para o estado protrombótico.[95][96] Adipocitocinas também podem estar envolvidas.[97]
A obesidade está associada ao aumento do risco do primeiro tromboembolismo venoso e de recorrência, com maior risco conferido pelo aumento do índice de massa corporal (IMC).[27][98][99]
tabagismo
Infecção pelo vírus da imunodeficiência humana (HIV)
A incidência de tromboembolismo venoso é maior em pacientes com infecção por HIV que em controles pareados por idade e sexo.[103]
O mecanismo que causa o estado protrombótico não é claro.
voos longos (>4 horas)
O risco de tromboembolismo venoso em uma coorte de pessoas saudáveis em um voo ≥4 horas é de 1 em 6000.[104]
A ativação da coagulação e fibrinólise com marcadores aumentados da geração de trombina foram observados em um subgrupo de voluntários saudáveis após um voo de 8 horas. Esses achados sugerem que a hipercoagulabilidade adquirida no voo (e não a imobilização) contribui para o risco de tromboembolismo venoso.[104][105]
O risco de tromboembolismo venoso aumenta com a presença de fatores de risco adicionais.[104][106][107]
fibrinogênio elevado
disfibrinogenemia
Uma doença hereditária rara associada a sangramento, mas complicada pela trombose em 21% dos pacientes.[21]
fator V de Leiden
Mutação genética no fator de coagulação V que confere hipercoagulabilidade.
Prevalência de até 6% em pessoas brancas; raro em outros grupos étnicos.[5][7]
Encontrado em 20% de pessoas brancas com tromboembolismo venoso.[22][23] Aproximadamente 90% dos pacientes com resistência à proteína C ativada apresentam fator V de Leiden.[3]
O risco de tromboembolismo venoso é até sete vezes maior em heterozigotos e 80 vezes maior em homozigotos.[7]
Mais de 75% dos portadores nunca evoluirão para tromboembolismo venoso.[24] No entanto, entre os portadores com história familiar de tromboembolismo venoso, aproximadamente 50% evoluirão para tromboembolismo venoso antes dos 65 anos de idade.[24]
Mutação no gene da protrombina (G-20210-A; também conhecido como variante F2 c.*97G>A).
As pessoas portadoras da mutação apresentam níveis maiores de protrombina que o normal.
Prevalência de até 2% em pessoas brancas, mas rara em outros grupos étnicos.[6][25]
Presente em até 6% dos pacientes que apresentam tromboembolismo venoso e em 18% daqueles com história familiar de tromboembolismo venoso.[6]
O risco de tromboembolismo venoso é de duas a três vezes maior em heterozigotos.
A heterozigosidade composta com o fator V de Leiden aumenta o risco de tromboembolismo venoso em 20 vezes.[26]
níveis elevados de fator VIII (>150 U/L)
Aumentam o risco de tromboembolismo venoso em até cinco vezes, mas o risco é mais de dez vezes maior nos indivíduos negros.[14][31]
A patogênese não está clara; pode ser decorrente de mutação genética.[3]
Encontrados em aproximadamente 25% dos pacientes com tromboembolismo venoso.[32]
O risco de tromboembolismo venoso aumenta em 10% para cada incremento de 10 U/litro no nível do fator VIII.[31][32][33]
Associados ao aumento do risco de tromboembolismo venoso recorrente.[33]
níveis elevados dos fatores IX ou XI
hiper-homocisteinemia
Sua função na hipercoagulabilidade é controversa; talvez não predisponha ao tromboembolismo venoso.[37][38]
Pode ser congênita ou adquirida. Formas adquiridas são encontradas em pacientes com deficiência alimentar de folato ou de vitaminas B6 ou B12. A forma congênita é decorrente de mutação, que resulta em ligação deficiente do folato e atividade reduzida da metilenotetraidrofolato redutase (NADPH2).
Possíveis mecanismos fisiopatológicos incluem ativação endotelial, proliferação de células musculares lisas, alterações na produção endotelial de óxido nítrico e alterações no metabolismo endotelial dos esteróis.[3]
doença falciforme
Seu papel na produção do estado hipercoagulável é controverso.
A doença falciforme causa níveis elevados de marcadores da geração da trombina, ativação anormal do sistema fibrinolítico, expressão elevada do fator tecidual e ativação plaquetária.[27]
Foi sugerido que a doença falciforme está associada a taxas elevadas de embolia pulmonar, mas as taxas de trombose venosa profunda (TVP) são equivalentes aos controles pareados por idade.[28]
níveis elevados do inibidor de fibrinólise ativável por trombina (TAFI)
Associados ao aumento de duas vezes no risco de tromboembolismo venoso inicial e recorrente.[36]
O uso deste conteúdo está sujeito ao nosso aviso legal