O diagnóstico de aldosteronismo primário (AP) deve ser considerado em todos os pacientes como hipertensão, independentemente da gravidade e do nível de potássio plasmático. Quando presentes, os sintomas indicativos de hipocalemia (como fraqueza muscular, parestesias, cãibras musculares, noctúria, poliúria e palpitações) são extremamente sugestivos de AP. No entanto, esses sintomas geralmente não estão presentes, pois a maioria dos pacientes é normocalêmica.[31]Mulatero P, Stowasser M, Loh KC, et al. Increased diagnosis of primary aldosteronism, including surgically correctable forms, in centers from five continents. J Clin Endocrinol Metab. 2004 Mar;89(3):1045-50.
https://academic.oup.com/jcem/article/89/3/1045/2844051
http://www.ncbi.nlm.nih.gov/pubmed/15001583?tool=bestpractice.com
Outros sintomas ou sinais que podem estar presentes geralmente são inespecíficos e não contribuem para o diagnóstico. Eles podem incluir letargia, dificuldade de concentração e distúrbios de humor como irritabilidade, ansiedade e depressão.
Um componente fundamental da investigação diagnóstica é a discussão cautelosa com o paciente. Cada fase do processo diagnóstico deve ser explicada em detalhes para o paciente antes que uma decisão seja tomada quanto ao prosseguimento do processo.
Rastreamento
Como apenas uma pequena parcela (aproximadamente 20%) dos pacientes com AP é hipocalêmica, a medição do potássio plasmático não tem sensibilidade como um teste de rastreamento. No entanto, quando está presente (especialmente quando não é provocada pelo uso de diuréticos), a hipocalemia serve como uma pista valiosa da presença dessa condição.
A relação aldosterona/renina é o teste de rastreamento disponível mais confiável, sendo mais específica que a medição de renina (cujos níveis quase sempre são suprimidos) e mais sensível que a medição de potássio plasmático ou aldosterona.[10]Reincke M, Bancos I, Mulatero P, et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol. 2021 Dec;9(12):876-92.
http://www.ncbi.nlm.nih.gov/pubmed/34798068?tool=bestpractice.com
[28]Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889-916.
https://academic.oup.com/jcem/article/101/5/1889/2804729
http://www.ncbi.nlm.nih.gov/pubmed/26934393?tool=bestpractice.com
[41]Mulatero P, Monticone S, Deinum J, et al. Genetics, prevalence, screening and confirmation of primary aldosteronism: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020 Oct;38(10):1919-28.
http://www.ncbi.nlm.nih.gov/pubmed/32890264?tool=bestpractice.com
[70]National Comprehensive Cancer Network. NCCN guidelines: neuroendocrine and adrenal tumors [internet publication].
https://www.nccn.org/guidelines/category_1
A relação aumenta antes que o potássio plasmático ou a aldosterona saiam de suas faixas normais.[6]Stowasser M, Gordon RD, Rutherford JC, et al. Diagnosis and management of primary aldosteronism. J Renin Angiotensin Aldosterone Syst. 2001 Sep;2(3):156-69.
http://journals.sagepub.com/doi/pdf/10.3317/jraas.2001.022
http://www.ncbi.nlm.nih.gov/pubmed/11881117?tool=bestpractice.com
[71]Gordon RD. Primary aldosteronism. J Endocrinol Invest. 1995 Jul-Aug;18(7):495-511.
http://www.ncbi.nlm.nih.gov/pubmed/9221268?tool=bestpractice.com
[72]Stowasser M, Gordon RD. The aldosterone-renin ratio for screening for primary aldosteronism. Endocrinologist. 2004 Sep-Oct;14(5):267-76.
http://journals.lww.com/theendocrinologist/Abstract/2004/09000/The_Aldosterone_Renin_Ratio_in_Screening_for.7.aspx
No entanto, resultados falso-positivos e falso-negativos são possíveis.[10]Reincke M, Bancos I, Mulatero P, et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol. 2021 Dec;9(12):876-92.
http://www.ncbi.nlm.nih.gov/pubmed/34798068?tool=bestpractice.com
[28]Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889-916.
https://academic.oup.com/jcem/article/101/5/1889/2804729
http://www.ncbi.nlm.nih.gov/pubmed/26934393?tool=bestpractice.com
[73]Stowasser M, Ahmed AH, Pimenta E, et al. Factors affecting the aldosterone/renin ratio. Horm Metab Res. 2012 Mar;44(3):170-6.
http://www.ncbi.nlm.nih.gov/pubmed/22147655?tool=bestpractice.com
A restrição alimentar de sal, a hipertensão maligna ou renovascular concomitante, a gestação (quando altos níveis de progesterona antagonizam a ação da aldosterona no receptor de mineralocorticoide) e o tratamento com diuréticos (inclusive espironolactona), antagonistas do canal de cálcio do grupo das di-hidropiridinas, inibidores da enzima conversora de angiotensina (ECA) ou antagonistas do receptor de angiotensina podem causar relações falso-negativas pela estimulação da secreção de renina.[6]Stowasser M, Gordon RD, Rutherford JC, et al. Diagnosis and management of primary aldosteronism. J Renin Angiotensin Aldosterone Syst. 2001 Sep;2(3):156-69.
http://journals.sagepub.com/doi/pdf/10.3317/jraas.2001.022
http://www.ncbi.nlm.nih.gov/pubmed/11881117?tool=bestpractice.com
[71]Gordon RD. Primary aldosteronism. J Endocrinol Invest. 1995 Jul-Aug;18(7):495-511.
http://www.ncbi.nlm.nih.gov/pubmed/9221268?tool=bestpractice.com
[72]Stowasser M, Gordon RD. The aldosterone-renin ratio for screening for primary aldosteronism. Endocrinologist. 2004 Sep-Oct;14(5):267-76.
http://journals.lww.com/theendocrinologist/Abstract/2004/09000/The_Aldosterone_Renin_Ratio_in_Screening_for.7.aspx
[74]Mulatero P, Rabbia F, Milan A, et al. Drug effects on aldosterone/plasma renin activity ratio in primary aldosteronism. Hypertension. 2002 Dec;40(6):897-902.
http://hyper.ahajournals.org/content/40/6/897.full
http://www.ncbi.nlm.nih.gov/pubmed/12468576?tool=bestpractice.com
[75]Seifarth C, Trenkel S, Schobel H, et al. Influence of antihypertensive medication on aldosterone and renin concentration in the differential diagnosis of essential hypertension and primary aldosteronism. Clin Endocrinol (Oxf). 2002 Oct;57(4):457-65.
http://www.ncbi.nlm.nih.gov/pubmed/12354127?tool=bestpractice.com
[76]Brown MJ, Hopper RV. Calcium-channel blockade can mask the diagnosis of Conn's syndrome. Postgrad Med J. 1999 Apr;75(882):235-6.
http://www.ncbi.nlm.nih.gov/pubmed/10715768?tool=bestpractice.com
[77]Gordon RD, Tunny TJ. Aldosterone-producing adenoma (A-P-A): effect of pregnancy. Clin Exp Hypertens A. 1982;4(9-10):1685-93.
http://www.ncbi.nlm.nih.gov/pubmed/6754149?tool=bestpractice.com
[78]Stowasser M, Gordon RD, Klemm SA, et al. Renin-aldosterone response to dexamethasone in glucocorticoid-suppressible hyperaldosteronism is altered by coexistent renal artery stenosis. J Clin Endocrinol Metab. 1993 Sep;77(3):800-4.
http://www.ncbi.nlm.nih.gov/pubmed/8396580?tool=bestpractice.com
Como o potássio é um poderoso regulador crônico da secreção de aldosterona, a hipocalemia também pode ser associada a relações falso-negativas.[73]Stowasser M, Ahmed AH, Pimenta E, et al. Factors affecting the aldosterone/renin ratio. Horm Metab Res. 2012 Mar;44(3):170-6.
http://www.ncbi.nlm.nih.gov/pubmed/22147655?tool=bestpractice.com
Betabloqueadores, alfametildopa, clonidina e medicamentos anti-inflamatórios não esteroidais (AINEs) podem suprimir os níveis de renina e produzir resultados falso-positivos.[6]Stowasser M, Gordon RD, Rutherford JC, et al. Diagnosis and management of primary aldosteronism. J Renin Angiotensin Aldosterone Syst. 2001 Sep;2(3):156-69.
http://journals.sagepub.com/doi/pdf/10.3317/jraas.2001.022
http://www.ncbi.nlm.nih.gov/pubmed/11881117?tool=bestpractice.com
[10]Reincke M, Bancos I, Mulatero P, et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol. 2021 Dec;9(12):876-92.
http://www.ncbi.nlm.nih.gov/pubmed/34798068?tool=bestpractice.com
[41]Mulatero P, Monticone S, Deinum J, et al. Genetics, prevalence, screening and confirmation of primary aldosteronism: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020 Oct;38(10):1919-28.
http://www.ncbi.nlm.nih.gov/pubmed/32890264?tool=bestpractice.com
[71]Gordon RD. Primary aldosteronism. J Endocrinol Invest. 1995 Jul-Aug;18(7):495-511.
http://www.ncbi.nlm.nih.gov/pubmed/9221268?tool=bestpractice.com
[74]Mulatero P, Rabbia F, Milan A, et al. Drug effects on aldosterone/plasma renin activity ratio in primary aldosteronism. Hypertension. 2002 Dec;40(6):897-902.
http://hyper.ahajournals.org/content/40/6/897.full
http://www.ncbi.nlm.nih.gov/pubmed/12468576?tool=bestpractice.com
[79]Ahmed AH, Gordon RD, Taylor P, et al. Effect of atenolol on aldosterone/renin ratio calculated by both plasma renin activity and direct renin concentration in healthy male volunteers. J Clin Endocrinol Metab. 2010 Jul;95(7):3201-6.
https://academic.oup.com/jcem/article/95/7/3201/2596261
http://www.ncbi.nlm.nih.gov/pubmed/20427490?tool=bestpractice.com
Resultados falso-positivos podem ocorrer em mulheres na pré-menopausa durante a fase lútea do ciclo menstrual e também nas mulheres que recebem agentes contraceptivos que contêm estrogênio ou terapia de reposição hormonal, mas somente quando a renina é medida como concentração de renina ativa direta, e não como atividade de renina plasmática.[80]Ahmed AH, Gordon RD, Taylor PJ, et al. Effect of contraceptives on aldosterone/renin ratio may vary according to the components of contraceptive, renin assay method, and possibly route of administration. J Clin Endocrinol Metab. 2011 Jun;96(6):1797-804.
https://academic.oup.com/jcem/article/96/6/1797/2834422
http://www.ncbi.nlm.nih.gov/pubmed/21411552?tool=bestpractice.com
[81]Ahmed AH, Gordon RD, Taylor PJ, et al. Are women more at risk of false-positive primary aldosteronism screening and unnecessary suppression testing than men? J Clin Endocrinol Metab. 2011 Feb;96(2):E340-6.
https://academic.oup.com/jcem/article/96/2/E340/2709561
http://www.ncbi.nlm.nih.gov/pubmed/20962019?tool=bestpractice.com
[82]Ahmed AH, Gordon RD, Ward G, et al. Effect of combined hormonal replacement therapy on the aldosterone/renin ratio in postmenopausal women. J Clin Endocrinol Metab. 2017 Jul 1;102(7):2329-34.
http://www.ncbi.nlm.nih.gov/pubmed/28379474?tool=bestpractice.com
Os resultados falso-positivos também podem ser observados em pacientes com insuficiência renal (a produção de renina é reduzida, enquanto qualquer hipercalemia associada tende a elevar a aldosterona), em idade avançada (quando a produção de renina cai mais rapidamente que a de aldosterona) e em hipertensão hipercalêmica familiar, também conhecida como pseudo-hipoaldosteronismo tipo II ou síndrome de Gordon.[10]Reincke M, Bancos I, Mulatero P, et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol. 2021 Dec;9(12):876-92.
http://www.ncbi.nlm.nih.gov/pubmed/34798068?tool=bestpractice.com
[72]Stowasser M, Gordon RD. The aldosterone-renin ratio for screening for primary aldosteronism. Endocrinologist. 2004 Sep-Oct;14(5):267-76.
http://journals.lww.com/theendocrinologist/Abstract/2004/09000/The_Aldosterone_Renin_Ratio_in_Screening_for.7.aspx
[83]McKenna TJ, Sequeira SJ, Heffernan A, et al. Diagnosis under random conditions of all disorders of the renin-angiotensin-aldosterone axis, including primary aldosteronism. J Clin Endocrinol Metab. 1991 Nov;73(5):952-7.
http://www.ncbi.nlm.nih.gov/pubmed/1939533?tool=bestpractice.com
O tratamento com antidepressivos da classe do inibidor seletivo de recaptação de serotonina (ISRS) diminui a relação aldosterona/renina, mas ainda não se sabe se pode provocar resultados falso-negativos em pacientes com AP.[84]Ahmed AH, Calvird M, Gordon RD, et al. Effects of two selective serotonin reuptake inhibitor antidepressants, sertraline and escitalopram, on aldosterone/renin ratio in normotensive depressed male patients. J Clin Endocrinol Metab. 2011 Apr;96(4):1039-45.
https://academic.oup.com/jcem/article/96/4/1039/2720852
http://www.ncbi.nlm.nih.gov/pubmed/21289246?tool=bestpractice.com
Os diuréticos devem ser descontinuados por, pelo menos, 6 semanas, e outros medicamentos interferentes por, pelo menos, 2 semanas (de preferência 4) antes de medir a relação, substituídos por outros medicamentos com menor efeito sobre os resultados, como verapamil de liberação lenta (com ou sem hidralazina), prazosina e moxonidina, para manter o controle da hipertensão.[71]Gordon RD. Primary aldosteronism. J Endocrinol Invest. 1995 Jul-Aug;18(7):495-511.
http://www.ncbi.nlm.nih.gov/pubmed/9221268?tool=bestpractice.com
[72]Stowasser M, Gordon RD. The aldosterone-renin ratio for screening for primary aldosteronism. Endocrinologist. 2004 Sep-Oct;14(5):267-76.
http://journals.lww.com/theendocrinologist/Abstract/2004/09000/The_Aldosterone_Renin_Ratio_in_Screening_for.7.aspx
[85]Ahmed A, Gordon RD, Ward G, et al. Effect of moxonidine on the aldosterone/renin ratio in healthy male volunteers. J Clin Endocrinol Metab. 2017 Jun 1;102(6):2039-43.
http://www.ncbi.nlm.nih.gov/pubmed/28324033?tool=bestpractice.com
Quando não for possível suspender um medicamento possivelmente interferente, informações úteis ainda poderão ser obtidas levando-se em conta seus efeitos conhecidos ao interpretar o resultado da relação. Por exemplo, uma relação elevada em pacientes que recebem um diurético, inibidor de ECA, bloqueador do receptor de angiotensina ou bloqueador de cálcio de di-hidropiridina aumentaria a probabilidade de AP, enquanto uma relação normal na presença do tratamento com betabloqueadores faria com que o diagnóstico fosse muito improvável.
A hipocalemia deve ser corrigida e o paciente deve ser incentivado a seguir uma dieta sem restrições de sal antes da medição da relação. Por causa dos efeitos da postura e da hora do dia, a sensibilidade do exame é maximizada coletando-se o sangue no meio da manhã em pacientes sentados que ficaram na posição ereta (sentados, em pé ou andando) por 2 a 4 horas.[71]Gordon RD. Primary aldosteronism. J Endocrinol Invest. 1995 Jul-Aug;18(7):495-511.
http://www.ncbi.nlm.nih.gov/pubmed/9221268?tool=bestpractice.com
[72]Stowasser M, Gordon RD. The aldosterone-renin ratio for screening for primary aldosteronism. Endocrinologist. 2004 Sep-Oct;14(5):267-76.
http://journals.lww.com/theendocrinologist/Abstract/2004/09000/The_Aldosterone_Renin_Ratio_in_Screening_for.7.aspx
A proporção deve ser considerada apenas como um teste de rastreamento e deve ser medida mais de uma vez (serialmente se as condições de amostragem, incluindo medicamentos, estiverem sendo alteradas) antes que se decida realizar um teste de supressão para confirmar ou excluir definitivamente o diagnóstico.
Confirmação de diagnóstico
Como a relação aldosterona/renina apresenta resultados falso-positivos ocasionais, mesmo sob as condições descritas acima, o teste confirmatório é necessário antes que o diagnóstico de AP possa ser definitivamente confirmado ou excluído.[10]Reincke M, Bancos I, Mulatero P, et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol. 2021 Dec;9(12):876-92.
http://www.ncbi.nlm.nih.gov/pubmed/34798068?tool=bestpractice.com
[41]Mulatero P, Monticone S, Deinum J, et al. Genetics, prevalence, screening and confirmation of primary aldosteronism: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020 Oct;38(10):1919-28.
http://www.ncbi.nlm.nih.gov/pubmed/32890264?tool=bestpractice.com
Embora o teste de supressão de fludrocortisona, no qual a resposta de aldosterona durante 4 dias de administração de fludrocortisona oral e carga oral de sal é determinada, seja amplamente considerado como o meio mais confiável de confirmar ou descartar o AP, a medição de aldosterona plasmática na conclusão de uma infusão intravenosa de soro fisiológico (geralmente 2 L durante 2 a 4 horas), ou taxas de excreção urinária de aldosterona em 24 horas após 3 dias de carga oral de sal também são empregadas em alguns centros.[6]Stowasser M, Gordon RD, Rutherford JC, et al. Diagnosis and management of primary aldosteronism. J Renin Angiotensin Aldosterone Syst. 2001 Sep;2(3):156-69.
http://journals.sagepub.com/doi/pdf/10.3317/jraas.2001.022
http://www.ncbi.nlm.nih.gov/pubmed/11881117?tool=bestpractice.com
[28]Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889-916.
https://academic.oup.com/jcem/article/101/5/1889/2804729
http://www.ncbi.nlm.nih.gov/pubmed/26934393?tool=bestpractice.com
[72]Stowasser M, Gordon RD. The aldosterone-renin ratio for screening for primary aldosteronism. Endocrinologist. 2004 Sep-Oct;14(5):267-76.
http://journals.lww.com/theendocrinologist/Abstract/2004/09000/The_Aldosterone_Renin_Ratio_in_Screening_for.7.aspx
[86]Litchfield WR, Dluhy RG. Primary aldosteronism. Endocrinol Metab Clin North Am. 1995 Sep;24(3):593-612.
http://www.ncbi.nlm.nih.gov/pubmed/8575411?tool=bestpractice.com
[87]Holland OB, Brown H, Kuhnert LV, et al. Further evaluation of saline infusion for the diagnosis of primary aldosteronism. Hypertension. 1984 Sep-Oct;6(5):717-23.
http://hyper.ahajournals.org/content/hypertensionaha/6/5/717.full.pdf
http://www.ncbi.nlm.nih.gov/pubmed/6389337?tool=bestpractice.com
[88]Kem DC, Weinberger MH, Mayes DM, et al. Saline suppression of plasma aldosterone in hypertension. Arch Intern Med. 1971 Sep;128(3):380-6.
http://www.ncbi.nlm.nih.gov/pubmed/5093210?tool=bestpractice.com
[89]Stowasser M, Ahmed AH, Cowley D, et al. Comparison of seated with recumbent saline suppression testing for the diagnosis of primary aldosteronism. J Clin Endocrinol Metab. 2018 Nov 1;103(11):4113-24.
https://academic.oup.com/jcem/article/103/11/4113/5098354
http://www.ncbi.nlm.nih.gov/pubmed/30239841?tool=bestpractice.com
Um estudo envolvendo 100 pacientes (77 com AP) constatou que o teste de supressão com soro fisiológico demonstrou melhor sensibilidade para AP quando realizado na posição ereta (sentado) comparado com a posição de decúbito tradicional.[89]Stowasser M, Ahmed AH, Cowley D, et al. Comparison of seated with recumbent saline suppression testing for the diagnosis of primary aldosteronism. J Clin Endocrinol Metab. 2018 Nov 1;103(11):4113-24.
https://academic.oup.com/jcem/article/103/11/4113/5098354
http://www.ncbi.nlm.nih.gov/pubmed/30239841?tool=bestpractice.com
Diferenciação de subtipos
Se o teste confirmatório for positivo, investigações adicionais são direcionadas para determinar o subtipo de AP (aldosteronismo unilateral, causado principalmente por adenoma produtor de aldosterona; ou hiperplasia adrenal bilateral), já que o tratamento de primeira escolha para cada subtipo é diferente.[28]Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889-916.
https://academic.oup.com/jcem/article/101/5/1889/2804729
http://www.ncbi.nlm.nih.gov/pubmed/26934393?tool=bestpractice.com
O hiperaldosteronismo familiar do tipo I (HF-I) é raro, mas é importante diagnosticar porque a hipertensão é prontamente controlada pelo tratamento com glicocorticoides.[11]Itcho K, Oki K, Ohno H, et al. Update on genetics of primary adosteronism. Biomedicines. 2021 Apr 10;9(4):409.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8069207
http://www.ncbi.nlm.nih.gov/pubmed/33920271?tool=bestpractice.com
Se houver suspeita de HF-I (por exemplo, com base no início precoce de AP ou uma história familiar de hipertensão, AP ou AVC precoce), o teste genético de sangue periférico para o gene híbrido deve ser realizado antes de passar para outros testes que visam a diferenciação de subtipos, já que um teste genético positivo os tornará supérfluos. Como a presença do gene híbrido é diagnóstica para o HF-I, o teste associado a ele tem praticamente substituído os monótonos e não tão confiáveis métodos bioquímicos de diagnóstico desse subtipo (por exemplo, demonstração de supressão persistente e significativa de aldosterona plasmática durante vários dias de administração de dexametasona).[90]Jonsson JR, Klemm SA, Tunny TJ, et al. A new genetic test for familial hyperaldosteronism type I aids in the detection of curable hypertension. Biochem Biophys Res Commun. 1995 Feb 15;207(2):565-71.
http://www.ncbi.nlm.nih.gov/pubmed/7864844?tool=bestpractice.com
[91]Stowasser M, Bachmann AW, Jonsson JR, et al. Clinical, biochemical and genetic approaches to the detection of familial hyperaldosteronism type I. J Hypertens. 1995 Dec;13(12 Pt 2):1610-3.
http://www.ncbi.nlm.nih.gov/pubmed/8903619?tool=bestpractice.com
[92]Mulatero P, Veglio F, Pilon C, et al. Diagnosis of glucocorticoid-remediable aldosteronism in primary aldosteronism: aldosterone response to dexamethasone and long polymerase chain reaction for chimeric gene. J Clin Endocrinol Metab. 1998 Jul;83(7):2573-5.
https://academic.oup.com/jcem/article/83/7/2573/2865742
http://www.ncbi.nlm.nih.gov/pubmed/9661646?tool=bestpractice.com
No entanto, a grande maioria de pacientes com AP terá um teste com resultado negativo para o gene híbrido, deixando a tarefa mais difícil de separar as formas tumorais unilaterais de variedades de hiperplasia adrenal bilateral (HAB). Em pacientes com PA de início precoce com teste negativo para o gene híbrido, deve-se considerar testes genéticos para mutações em CLCN2, KCNJ5 e CACNA1H para diagnóstico de HF-II, HF-III e HF-IV, respectivamente.[41]Mulatero P, Monticone S, Deinum J, et al. Genetics, prevalence, screening and confirmation of primary aldosteronism: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020 Oct;38(10):1919-28.
http://www.ncbi.nlm.nih.gov/pubmed/32890264?tool=bestpractice.com
A TC adrenal é recomendada em todos os pacientes para confirmar o subtipo e descartar o carcinoma adrenocortical.[10]Reincke M, Bancos I, Mulatero P, et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol. 2021 Dec;9(12):876-92.
http://www.ncbi.nlm.nih.gov/pubmed/34798068?tool=bestpractice.com
[28]Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889-916.
https://academic.oup.com/jcem/article/101/5/1889/2804729
http://www.ncbi.nlm.nih.gov/pubmed/26934393?tool=bestpractice.com
[41]Mulatero P, Monticone S, Deinum J, et al. Genetics, prevalence, screening and confirmation of primary aldosteronism: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020 Oct;38(10):1919-28.
http://www.ncbi.nlm.nih.gov/pubmed/32890264?tool=bestpractice.com
Geralmente, é capaz de detectar carcinomas produtores de aldosterona devido a seu tamanho relativamente grande (em geral, >3 cm), mas frequentemente não detecta adenomas produtores de aldosterona (que têm um tamanho médio de aproximadamente 1 cm).[9]Mulatero P, Sechi LA, Williams TA, et al. Subtype diagnosis, treatment, complications and outcomes of primary aldosteronism and future direction of research: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020 Oct;38(10):1929-36.
http://www.ncbi.nlm.nih.gov/pubmed/32890265?tool=bestpractice.com
A TC pode ser enganosa, pois não diferencia adenomas produtores de aldosterona de nódulos não funcionantes.[6]Stowasser M, Gordon RD, Rutherford JC, et al. Diagnosis and management of primary aldosteronism. J Renin Angiotensin Aldosterone Syst. 2001 Sep;2(3):156-69.
http://journals.sagepub.com/doi/pdf/10.3317/jraas.2001.022
http://www.ncbi.nlm.nih.gov/pubmed/11881117?tool=bestpractice.com
[27]Stowasser M, Gordon RD. Primary aldosteronism - careful investigation is essential and rewarding. Mol Cell Endocrinol. 2004 Mar 31;217(1-2):33-9.
http://www.ncbi.nlm.nih.gov/pubmed/15134798?tool=bestpractice.com
[71]Gordon RD. Primary aldosteronism. J Endocrinol Invest. 1995 Jul-Aug;18(7):495-511.
http://www.ncbi.nlm.nih.gov/pubmed/9221268?tool=bestpractice.com
[93]Doppman JL, Gill JR Jr, Miller DL, et al. Distinction between hyperaldosteronism due to bilateral hyperplasia and unilateral aldosteronoma: reliability of CT. Radiology. 1992 Sep;184(3):677-82.
http://www.ncbi.nlm.nih.gov/pubmed/1509049?tool=bestpractice.com
[94]Young WF, Stanson AW, Thompson GB, et al. Role for adrenal venous sampling in primary aldosteronism. Surgery. 2004 Dec;136(6):1227-35.
http://www.ncbi.nlm.nih.gov/pubmed/15657580?tool=bestpractice.com
Limitações semelhantes aplicam-se à RNM adrenal.[95]Tsushima Y, Ishizaka H, Matsumoto M. Adrenal masses: differentiation with chemical shift, fast low-angle shot MR imaging. Radiology. 1993 Mar;186(3):705-9.
http://www.ncbi.nlm.nih.gov/pubmed/8430178?tool=bestpractice.com
A responsividade da aldosterona plasmática (definida como um aumento de pelo menos 50% com relação ao valor basal) durante 2 ou 3 horas de posição ereta após ficar em decúbito à noite ou durante a infusão de angiotensina II já foi considerada específica para HAB entre os pacientes com AP.[96]Ganguly AG, Melada GA, Luetscher JA, et al. Control of plasma aldosterone in primary aldosteronism: distinction between adenoma and hyperplasia. J Clin Endocrinol Metab. 1973 Nov;37(5):765-75.
http://www.ncbi.nlm.nih.gov/pubmed/4356136?tool=bestpractice.com
[97]Wisgerhof M, Brown RD, Hogan MJ, et al. The plasma aldosterone response to angiotensin II infusion in aldosterone-producing adenoma and idiopathic hyperaldosteronism. J Clin Endocrinol Metab. 1981 Feb;52(2):195-8.
http://www.ncbi.nlm.nih.gov/pubmed/7462385?tool=bestpractice.com
No entanto, achados semelhantes também são observados na variedade responsiva à angiotensina II do adenoma produtor de aldosterona, que é responsável por mais de 50% dos adenomas produtores de aldosterona em algumas séries.[4]Gordon RD, Stowasser M, Klemm SA, et al. Primary aldosteronism - some genetic, morphological, and biochemical aspects of subtypes. Steroids. 1995 Jan;60(1):35-41.
http://www.ncbi.nlm.nih.gov/pubmed/7792813?tool=bestpractice.com
[98]Gordon RD, Hamlet SM, Tunny TJ, et al. Aldosterone-producing adenomas responsive to angiotensin pose problems in diagnosis. Clin Exp Pharmacol Physiol. 1987 Mar;14(3):175-9.
http://www.ncbi.nlm.nih.gov/pubmed/2822305?tool=bestpractice.com
[99]Gordon RD, Gomez-Sanchez CE, Hamlet SM, et al. Angiotensin-responsive aldosterone-producing adenoma masquerades as idiopathic hyperaldosteronism (IHA: adrenal hyperplasia) or low-renin essential hypertension. J Hypertens Suppl. 1987 Dec;5(5):S103-6.
http://www.ncbi.nlm.nih.gov/pubmed/2832571?tool=bestpractice.com
No entanto, o exame da resposta da aldosterona à postura em pacientes com AP é válido, pois sua ausência limita o diagnóstico a adenoma produtor de aldosterona não responsivo à angiotensina II ou HF-I na maioria dos casos. Os níveis de esteroide híbrido (18-hidroxi e 18-oxocortisol) são elevados em HF-I e adenoma produtor de aldosterona não responsivo à angiotensina II. Eles são uma evidência útil que sugere uma dessas duas condições. Entretanto, eles não estão amplamente disponíveis e, como são normais tanto no HAB quanto no adenoma produtor de aldosterona responsivo à angiotensina II, não diferenciam AP unilateral de bilateral.[91]Stowasser M, Bachmann AW, Jonsson JR, et al. Clinical, biochemical and genetic approaches to the detection of familial hyperaldosteronism type I. J Hypertens. 1995 Dec;13(12 Pt 2):1610-3.
http://www.ncbi.nlm.nih.gov/pubmed/8903619?tool=bestpractice.com
[98]Gordon RD, Hamlet SM, Tunny TJ, et al. Aldosterone-producing adenomas responsive to angiotensin pose problems in diagnosis. Clin Exp Pharmacol Physiol. 1987 Mar;14(3):175-9.
http://www.ncbi.nlm.nih.gov/pubmed/2822305?tool=bestpractice.com
[99]Gordon RD, Gomez-Sanchez CE, Hamlet SM, et al. Angiotensin-responsive aldosterone-producing adenoma masquerades as idiopathic hyperaldosteronism (IHA: adrenal hyperplasia) or low-renin essential hypertension. J Hypertens Suppl. 1987 Dec;5(5):S103-6.
http://www.ncbi.nlm.nih.gov/pubmed/2832571?tool=bestpractice.com
Devido aos motivos acima, a amostragem venosa adrenal (AVA) é a única maneira confiável de diferenciar o AP bilateral do unilateral.[28]Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889-916.
https://academic.oup.com/jcem/article/101/5/1889/2804729
http://www.ncbi.nlm.nih.gov/pubmed/26934393?tool=bestpractice.com
[71]Gordon RD. Primary aldosteronism. J Endocrinol Invest. 1995 Jul-Aug;18(7):495-511.
http://www.ncbi.nlm.nih.gov/pubmed/9221268?tool=bestpractice.com
[94]Young WF, Stanson AW, Thompson GB, et al. Role for adrenal venous sampling in primary aldosteronism. Surgery. 2004 Dec;136(6):1227-35.
http://www.ncbi.nlm.nih.gov/pubmed/15657580?tool=bestpractice.com
[100]Daunt N. Adrenal vein sampling: how to make it quick, easy, and successful. Radiographics. 2005 Oct;25 Suppl 1:S143-58.
http://pubs.rsna.org/doi/full/10.1148/rg.25si055514
http://www.ncbi.nlm.nih.gov/pubmed/16227488?tool=bestpractice.com
[101]Yeung A, Friedmann P, In H, et al. Evaluation of adrenal vein sampling use and outcomes in patients with primary aldosteronism. J Surg Res. 2020 Dec;256:673-9.
http://www.ncbi.nlm.nih.gov/pubmed/32827833?tool=bestpractice.com
Assim, alguns centros recomendam esse procedimento em todos os pacientes com AP (além daqueles com HF-I).[102]Sun F, Hong Y, Zhang H, et al. Determination of adrenal hypersecretion in primary aldosteronism without aldosterone-production adenomas. BMC Endocr Disord. 2021 May 31;21(1):114.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8167985
http://www.ncbi.nlm.nih.gov/pubmed/34059026?tool=bestpractice.com
Algumas diretrizes sugerem que a AVA pode ser contornada em pacientes com idade <35 anos com adenoma unilateral antes de proceder à adrenalectomia unilateral.[10]Reincke M, Bancos I, Mulatero P, et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol. 2021 Dec;9(12):876-92.
http://www.ncbi.nlm.nih.gov/pubmed/34798068?tool=bestpractice.com
[28]Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889-916.
https://academic.oup.com/jcem/article/101/5/1889/2804729
http://www.ncbi.nlm.nih.gov/pubmed/26934393?tool=bestpractice.com
[41]Mulatero P, Monticone S, Deinum J, et al. Genetics, prevalence, screening and confirmation of primary aldosteronism: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020 Oct;38(10):1919-28.
http://www.ncbi.nlm.nih.gov/pubmed/32890264?tool=bestpractice.com
[103]Yip L, Duh QY, Wachtel H, et al. American Association of Endocrine Surgeons guidelines for adrenalectomy: executive summary. JAMA Surg. 2022 Oct 1;157(10):870-7.
https://jamanetwork.com/journals/jamasurgery/fullarticle/2795363
http://www.ncbi.nlm.nih.gov/pubmed/35976622?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: TC mostrando lesão na glândula adrenal direita em paciente com adenoma produtor de aldosterona no lado direitoDo acervo pessoal do Dr. Michael Stowasser; usado com permissão [Citation ends].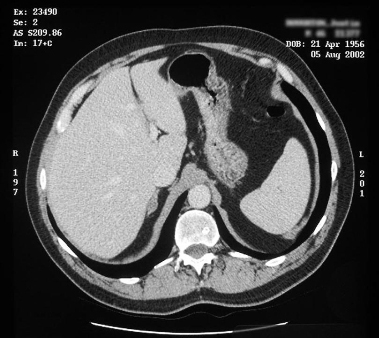 [Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando lesão na glândula adrenal direita em paciente com hiperplasia adrenal bilateralDo acervo pessoal do Dr. Michael Stowasser; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando lesão na glândula adrenal direita em paciente com hiperplasia adrenal bilateralDo acervo pessoal do Dr. Michael Stowasser; usado com permissão [Citation ends].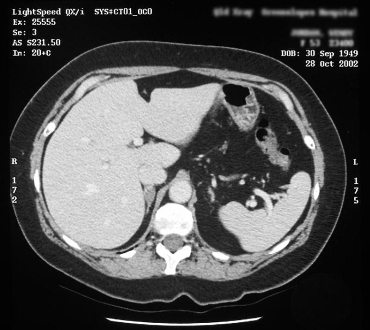
A imagem nuclear usando tomografia por emissão de pósitrons (PET-CT) com metomidato marcado como ligante de CYP11B1 e CYP11B2 foi proposta como uma alternativa viável à AVA, ou como adjuvante à AVA em casos difíceis.[104]Powlson AS, Gurnell M, Brown MJ. Nuclear imaging in the diagnosis of primary aldosteronism. Curr Opin Endocrinol Diabetes Obes. 2015 Jun;22(3):150-6.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4405075
http://www.ncbi.nlm.nih.gov/pubmed/25871964?tool=bestpractice.com
[105]O'Shea PM, O'Donoghue D, Bashari W, et al. ¹¹ C-Metomidate PET/CT is a useful adjunct for lateralization of primary aldosteronism in routine clinical practice. Clin Endocrinol (Oxf). 2019 May;90(5):670-9.
http://www.ncbi.nlm.nih.gov/pubmed/30721535?tool=bestpractice.com
Neste protocolo, o pré-tratamento com dexametasona é usado para suprimir o hormônio adrenocorticotrófico e a expressão de CYP11B1. A meia-vida curta e a falta de especificidade para CYP11B2 do isótopo usado atualmente limita a aplicação disseminado e a confiabilidade desta técnica, no entanto, o trabalho está em andamento para encontrar alternativas.
 [Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando lesão na glândula adrenal direita em paciente com hiperplasia adrenal bilateralDo acervo pessoal do Dr. Michael Stowasser; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando lesão na glândula adrenal direita em paciente com hiperplasia adrenal bilateralDo acervo pessoal do Dr. Michael Stowasser; usado com permissão [Citation ends].