O diagnóstico baseia-se na presença de critérios bem-definidos que ajudam a distinguir o MM de outras neoplasias plasmocitárias e neoplasias malignas que envolvem células B associadas à produção de paraproteína (proteína M).[3]Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov;15(12):e538-48.
https://orbi.uliege.be/handle/2268/174646
http://www.ncbi.nlm.nih.gov/pubmed/25439696?tool=bestpractice.com
[4]Rajkumar SV. Updated diagnostic criteria and staging system for multiple myeloma. Am Soc Clin Oncol Educ Book. 2016;35:e418-23.
https://ascopubs.org/doi/10.1200/EDBK_159009
http://www.ncbi.nlm.nih.gov/pubmed/27249749?tool=bestpractice.com
Consulte Classificação.
A investigação diagnóstica inicial inclui história completa e exame físico, com os testes diagnósticos mais importantes decisivos fornecendo o diagnóstico definitivo.[44]Dimopoulos MA, Moreau P, Terpos E, et al. Multiple myeloma: EHA-ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. Ann Oncol. 2021 Mar;32(3):309-22.
https://www.annalsofoncology.org/article/S0923-7534(20)43169-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/33549387?tool=bestpractice.com
[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: multiple myeloma [internet publication].
https://www.nccn.org/guidelines/category_1
História e características clínicas
História familiar de câncer linfo-hematopoiético (particularmente MM), sexo masculino, etnia negra e exposição à radiação ionizante ou produtos derivados do petróleo estão associados a um risco maior de MM.[9]National Cancer Institute: Surveillance, Epidemiology, and End Results Program. Cancer stat facts: myeloma. 2023 [internet publication].
https://seer.cancer.gov/statfacts/html/mulmy.html
[11]Schinasi LH, Brown EE, Camp NJ, et al. Multiple myeloma and family history of lymphohaematopoietic cancers: results from the International Multiple Myeloma Consortium. Br J Haematol. 2016 Oct;175(1):87-101.
https://onlinelibrary.wiley.com/doi/10.1111/bjh.14199
http://www.ncbi.nlm.nih.gov/pubmed/27330041?tool=bestpractice.com
[12]Bourguet CC, Grufferman S, Delzell E, et al. Multiple myeloma and family history of cancer: a case-control study. Cancer. 1985 Oct 15;56(8):2133-9.
http://www.ncbi.nlm.nih.gov/pubmed/4027940?tool=bestpractice.com
[14]Cardis E, Vrijheid M, Blettner M, et al. The 15-country collaborative study of cancer risk among radiation workers in the nuclear industry: estimates of radiation-related cancer risks. Radiat Res. 2007 Apr;167(4):396-416.
http://www.ncbi.nlm.nih.gov/pubmed/17388693?tool=bestpractice.com
[15]Torres A, Giralt M, Raichs A. Coexistence of chronic benzol contacts and multiple plasmacytoma: presentation of 2 cases [in Spanish]. Sangre (Barc). 1970;15(2):275-9.
http://www.ncbi.nlm.nih.gov/pubmed/5431825?tool=bestpractice.com
[16]Aksoy M, Erdem S, Dincol G, et al. Clinical observations showing the role of some factors in the etiology of multiple myeloma: a study in 7 patients. Acta Haematol. 1984;71(2):116-20.
http://www.ncbi.nlm.nih.gov/pubmed/6421049?tool=bestpractice.com
[17]Bergsagel DE, Wong O, Bergsagel PL, et al. Benzene and multiple myeloma: appraisal of the scientific evidence. Blood. 1999 Aug 15;94(4):1174-82.
https://ashpublications.org/blood/article/94/4/1174/249672/Benzene-and-Multiple-Myeloma-Appraisal-of-the
http://www.ncbi.nlm.nih.gov/pubmed/10438704?tool=bestpractice.com
[18]Stenehjem JS, Kjærheim K, Bråtveit M, et al. Benzene exposure and risk of lymphohaematopoietic cancers in 25,000 offshore oil industry workers. Br J Cancer. 2015 Apr 28;112(9):1603-12.
https://www.nature.com/articles/bjc2015108
http://www.ncbi.nlm.nih.gov/pubmed/25867262?tool=bestpractice.com
O MM é precedido pela doença pré-maligna assintomática gamopatia monoclonal de significado indeterminado (MGUS).
Os sintomas iniciais do MM geralmente são inespecíficos (por exemplo, fadiga, dor óssea) e são resultado de danos aos órgãos-alvo causados pela infiltração de células do mieloma e/ou pela paraproteinemia associada. A dor óssea (normalmente localizada nas costas) e a anemia são as características mais comuns, afetando 60% a 70% dos pacientes.[5]Kyle RA. Multiple myeloma: review of 869 cases. Mayo Clin Proc. 1975 Jan;50(1):29-40.
http://www.ncbi.nlm.nih.gov/pubmed/1110582?tool=bestpractice.com
[6]Kyle RA, Gertz MA, Witzig TE, et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc. 2003 Jan;78(1):21-33.
http://www.ncbi.nlm.nih.gov/pubmed/12528874?tool=bestpractice.com
As outras características incluem insuficiência renal, hipercalcemia e sintomas associados a infecções.[5]Kyle RA. Multiple myeloma: review of 869 cases. Mayo Clin Proc. 1975 Jan;50(1):29-40.
http://www.ncbi.nlm.nih.gov/pubmed/1110582?tool=bestpractice.com
[6]Kyle RA, Gertz MA, Witzig TE, et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc. 2003 Jan;78(1):21-33.
http://www.ncbi.nlm.nih.gov/pubmed/12528874?tool=bestpractice.com
[7]Blimark C, Holmberg E, Mellqvist UH, et al. Multiple myeloma and infections: a population-based study on 9253 multiple myeloma patients. Haematologica. 2015 Jan;100(1):107-13.
https://haematologica.org/article/view/7239
http://www.ncbi.nlm.nih.gov/pubmed/25344526?tool=bestpractice.com
Investigação laboratorial inicial
Os exames iniciais a serem solicitados incluem hemograma completo com diferencial e contagem plaquetária, esfregaço de sangue periférico, ureia sérica, creatinina sérica, eletrólitos séricos (incluindo cálcio), ácido úrico sérico, testes da função hepática (TFHs), albumina sérica, proteína C-reativa, lactato desidrogenase (LDH) sérica, beta2-microglobulina sérica e fragmento N-terminal do pró-hormônio do PNB (NT-proPNB) ou peptídeo natriurético do tipo B (se o NT-proPNB não estiver disponível).[44]Dimopoulos MA, Moreau P, Terpos E, et al. Multiple myeloma: EHA-ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. Ann Oncol. 2021 Mar;32(3):309-22.
https://www.annalsofoncology.org/article/S0923-7534(20)43169-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/33549387?tool=bestpractice.com
[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: multiple myeloma [internet publication].
https://www.nccn.org/guidelines/category_1
Esses exames laboratoriais básicos podem ajudar a orientar o diagnóstico (por exemplo, avaliando danos em órgãos-alvo) e informar o prognóstico e a estratificação de risco.
Testes diagnósticos
Exames usados para estabelecer o diagnóstico incluem:[3]Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov;15(12):e538-48.
https://orbi.uliege.be/handle/2268/174646
http://www.ncbi.nlm.nih.gov/pubmed/25439696?tool=bestpractice.com
[4]Rajkumar SV. Updated diagnostic criteria and staging system for multiple myeloma. Am Soc Clin Oncol Educ Book. 2016;35:e418-23.
https://ascopubs.org/doi/10.1200/EDBK_159009
http://www.ncbi.nlm.nih.gov/pubmed/27249749?tool=bestpractice.com
[44]Dimopoulos MA, Moreau P, Terpos E, et al. Multiple myeloma: EHA-ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. Ann Oncol. 2021 Mar;32(3):309-22.
https://www.annalsofoncology.org/article/S0923-7534(20)43169-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/33549387?tool=bestpractice.com
[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: multiple myeloma [internet publication].
https://www.nccn.org/guidelines/category_1
[46]National Institute for Health and Care Excellence. Myeloma: diagnosis and management. Oct 2018 [internet publication].
https://www.nice.org.uk/guidance/ng35
[47]Hillengass J, Usmani S, Rajkumar SV, et al. International Myeloma Working Group consensus recommendations on imaging in monoclonal plasma cell disorders. Lancet Oncol. 2019 Jun;20(6):e302-12.
http://www.ncbi.nlm.nih.gov/pubmed/31162104?tool=bestpractice.com
Imunoglobulinas quantitativas séricas
eletroforese de proteínas séricas e urinárias
Imunofixação no soro e na urina
técnica de detecção de cadeias leves livres no soro
Estudos de imagem (por exemplo, imagem de corpo inteiro com tomografia computadorizada [TC] de baixa dose, tomografia por emissão de pósitrons com 18F-fluordesoxiglucose/TC [FDG-PET-CT] ou, em alguns casos, ressonância nuclear magnética [RNM])
Avaliação da medula óssea
A grande maioria dos pacientes com MM apresenta uma proteína M no soro e/ou urina (na eletroforese ou imunofixação). Entretanto, uma proteína M não é detectável em 1% a 5% dos pacientes. Esses pacientes são definidos como tendo MM não-secretor.[6]Kyle RA, Gertz MA, Witzig TE, et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc. 2003 Jan;78(1):21-33.
http://www.ncbi.nlm.nih.gov/pubmed/12528874?tool=bestpractice.com
[48]Drayson M, Tang LX, Drew R, et al. Serum free light-chain measurements for identifying and monitoring patients with nonsecretory multiple myeloma. Blood. 2001 May 1;97(9):2900-2.
https://ashpublications.org/blood/article/97/9/2900/130347/Serum-free-light-chain-measurements-for
http://www.ncbi.nlm.nih.gov/pubmed/11313287?tool=bestpractice.com
[49]Kumar SK, Mikhael JR, Buadi FK, et al. Management of newly diagnosed symptomatic multiple myeloma: updated Mayo Stratification of Myeloma and Risk-Adapted Therapy (mSMART) consensus guidelines. Mayo Clin Proc. 2009 Dec;84(12):1095-110.
https://www.mayoclinicproceedings.org/article/S0025-6196(11)60296-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/19955246?tool=bestpractice.com
Com a disponibilidade da técnica de detecção de cadeias leves livres no soro, o MM não-secretor e também o oligossecretor podem ser facilmente diagnosticados.[48]Drayson M, Tang LX, Drew R, et al. Serum free light-chain measurements for identifying and monitoring patients with nonsecretory multiple myeloma. Blood. 2001 May 1;97(9):2900-2.
https://ashpublications.org/blood/article/97/9/2900/130347/Serum-free-light-chain-measurements-for
http://www.ncbi.nlm.nih.gov/pubmed/11313287?tool=bestpractice.com
[50]Dispenzieri A, Kyle R, Merlini G, et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia. 2009 Feb;23(2):215-24.
http://www.ncbi.nlm.nih.gov/pubmed/19020545?tool=bestpractice.com
Às vezes, uma proteína M é observada na eletroforese de proteínas séricas em pacientes assintomáticos devido ao aumento das frações de globulina.
A espectrometria de massa pode ser usada como uma alternativa à imunofixação para a detecção de proteínas M.[51]Murray DL, Puig N, Kristinsson S, et al. Mass spectrometry for the evaluation of monoclonal proteins in multiple myeloma and related disorders: an International Myeloma Working Group Mass Spectrometry Committee Report. Blood Cancer J. 2021 Feb 1;11(2):24.
https://www.nature.com/articles/s41408-021-00408-4
http://www.ncbi.nlm.nih.gov/pubmed/33563895?tool=bestpractice.com
A espectrometria de massa é mais sensível que a imunofixação e também pode auxiliar na distinção entre anticorpos monoclonais terapêuticos (administrados a um paciente) e proteínas M endógenas.[52]Zajec M, Jacobs JFM, Groenen PJTA, et al. Development of a targeted mass-spectrometry serum assay to quantify M-protein in the presence of therapeutic monoclonal antibodies. J Proteome Res. 2018 Mar 2;17(3):1326-33.
http://www.ncbi.nlm.nih.gov/pubmed/29424538?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: A: eletroforese de proteínas séricas (EFPS) de soro normal. B: EFPS do soro do mieloma múltiplo mostrando uma imunoglobulina monoclonal (proteína M) na região gama. C: traçado densitométrico de soro normal (A) mostrando as 5 zonas da eletroforese em agarose de alta resolução. D: traçado densitométrico do soro do mieloma múltiplo (B) mostrando um pico monoclonal (pico M)Cortesia do Dr. M Murali e do Clinical Immunology Laboratory, Massachusetts General Hospital; usado com permissão [Citation ends].
Exames por imagem
Exames de imagem para avaliar doenças ósseas são essenciais para o diagnóstico e orientação do tratamento, e devem ser realizados em todos os pacientes com suspeita de MM.[3]Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov;15(12):e538-48.
https://orbi.uliege.be/handle/2268/174646
http://www.ncbi.nlm.nih.gov/pubmed/25439696?tool=bestpractice.com
[4]Rajkumar SV. Updated diagnostic criteria and staging system for multiple myeloma. Am Soc Clin Oncol Educ Book. 2016;35:e418-23.
https://ascopubs.org/doi/10.1200/EDBK_159009
http://www.ncbi.nlm.nih.gov/pubmed/27249749?tool=bestpractice.com
[46]National Institute for Health and Care Excellence. Myeloma: diagnosis and management. Oct 2018 [internet publication].
https://www.nice.org.uk/guidance/ng35
[47]Hillengass J, Usmani S, Rajkumar SV, et al. International Myeloma Working Group consensus recommendations on imaging in monoclonal plasma cell disorders. Lancet Oncol. 2019 Jun;20(6):e302-12.
http://www.ncbi.nlm.nih.gov/pubmed/31162104?tool=bestpractice.com
TC de baixa dose corpo inteiro ou FDG-PET-CT é recomendada para a investigação diagnóstica inicial de MM.[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: multiple myeloma [internet publication].
https://www.nccn.org/guidelines/category_1
[46]National Institute for Health and Care Excellence. Myeloma: diagnosis and management. Oct 2018 [internet publication].
https://www.nice.org.uk/guidance/ng35
[47]Hillengass J, Usmani S, Rajkumar SV, et al. International Myeloma Working Group consensus recommendations on imaging in monoclonal plasma cell disorders. Lancet Oncol. 2019 Jun;20(6):e302-12.
http://www.ncbi.nlm.nih.gov/pubmed/31162104?tool=bestpractice.com
A RNM de corpo inteiro deve ser considerada se a TC ou FDG-PET-CT for negativa ou inconclusiva e a suspeita permanecer alta para MM.[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: multiple myeloma [internet publication].
https://www.nccn.org/guidelines/category_1
[46]National Institute for Health and Care Excellence. Myeloma: diagnosis and management. Oct 2018 [internet publication].
https://www.nice.org.uk/guidance/ng35
[47]Hillengass J, Usmani S, Rajkumar SV, et al. International Myeloma Working Group consensus recommendations on imaging in monoclonal plasma cell disorders. Lancet Oncol. 2019 Jun;20(6):e302-12.
http://www.ncbi.nlm.nih.gov/pubmed/31162104?tool=bestpractice.com
A radiografia de esqueleto convencional é menos sensível na detecção de lesões osteolíticas em comparação com a TC, a FDG-PET/TC e a RNM, mas pode ser considerada se essas modalidades de imagem avançadas não estiverem disponíveis.[47]Hillengass J, Usmani S, Rajkumar SV, et al. International Myeloma Working Group consensus recommendations on imaging in monoclonal plasma cell disorders. Lancet Oncol. 2019 Jun;20(6):e302-12.
http://www.ncbi.nlm.nih.gov/pubmed/31162104?tool=bestpractice.com
[53]Terpos E, Kleber M, Engelhardt M, et al; European Myeloma Network. European Myeloma Network guidelines for the management of multiple myeloma-related complications. Haematologica. 2015 Oct;100(10):1254-66.
https://haematologica.org/article/view/7519
http://www.ncbi.nlm.nih.gov/pubmed/26432383?tool=bestpractice.com
[54]Hillengass J, Moulopoulos LA, Delorme S, et al. Whole-body computed tomography versus conventional skeletal survey in patients with multiple myeloma: a study of the International Myeloma Working Group. Blood Cancer J. 2017 Aug 25;7(8):e599.
https://www.nature.com/articles/bcj201778
http://www.ncbi.nlm.nih.gov/pubmed/28841211?tool=bestpractice.com
[55]Walker R, Barlogie B, Haessler J, et al. Magnetic resonance imaging in multiple myeloma: diagnostic and clinical implications. J Clin Oncol. 2007 Mar 20;25(9):1121-8.
https://ascopubs.org/doi/10.1200/JCO.2006.08.5803
http://www.ncbi.nlm.nih.gov/pubmed/17296972?tool=bestpractice.com
A RNM consegue detectar lesões focais e infiltrações da medula óssea. Ela tem valor prognóstico nos pacientes assintomáticos porque a presença de pequenas lesões focais (ou seja, <5 mm) nesses pacientes é um forte preditor de progressão para MM sintomático.[56]Hillengass J, Fechtner K, Weber MA, et al. Prognostic significance of focal lesions in whole-body magnetic resonance imaging in patients with asymptomatic multiple myeloma. J Clin Oncol. 2010 Mar 20;28(9):1606-10.
https://ascopubs.org/doi/10.1200/JCO.2009.25.5356
http://www.ncbi.nlm.nih.gov/pubmed/20177023?tool=bestpractice.com
A FDG-PET/TC e a RNM são particularmente úteis durante o acompanhamento do tratamento, pois podem detectar lesões focais residuais e informar o prognóstico.[57]Regelink JC, Minnema MC, Terpos E, et al. Comparison of modern and conventional imaging techniques in establishing multiple myeloma-related bone disease: a systematic review. Br J Haematol. 2013 Jul;162(1):50-61.
https://onlinelibrary.wiley.com/doi/10.1111/bjh.12346
http://www.ncbi.nlm.nih.gov/pubmed/23617231?tool=bestpractice.com
[58]Cavo M, Terpos E, Nanni C, et al. Role of 18F-FDG PET/CT in the diagnosis and management of multiple myeloma and other plasma cell disorders: a consensus statement by the International Myeloma Working Group. Lancet Oncol. 2017 Apr;18(4):e206-17.
http://www.ncbi.nlm.nih.gov/pubmed/28368259?tool=bestpractice.com
[59]Zamagni E, Nanni C, Mancuso K, et al. PET/CT improves the definition of complete response and allows to detect otherwise unidentifiable skeletal progression in multiple myeloma. Clin Cancer Res. 2015 Oct 1;21(19):4384-90.
https://aacrjournals.org/clincancerres/article/21/19/4384/125050/PET-CT-Improves-the-Definition-of-Complete
http://www.ncbi.nlm.nih.gov/pubmed/26078390?tool=bestpractice.com
[60]Pawlyn C, Fowkes L, Otero S, et al. Whole-body diffusion-weighted MRI: a new gold standard for assessing disease burden in patients with multiple myeloma? Leukemia. 2016 Jun;30(6):1446-8.
https://www.nature.com/articles/leu2015338
http://www.ncbi.nlm.nih.gov/pubmed/26648535?tool=bestpractice.com
Avaliação da medula óssea
A biópsia e o aspirado da medula óssea são necessários para verificar a presença de plasmócitos monoclonais na medula óssea e para confirmar o diagnóstico de MM.[3]Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov;15(12):e538-48.
https://orbi.uliege.be/handle/2268/174646
http://www.ncbi.nlm.nih.gov/pubmed/25439696?tool=bestpractice.com
[4]Rajkumar SV. Updated diagnostic criteria and staging system for multiple myeloma. Am Soc Clin Oncol Educ Book. 2016;35:e418-23.
https://ascopubs.org/doi/10.1200/EDBK_159009
http://www.ncbi.nlm.nih.gov/pubmed/27249749?tool=bestpractice.com
A proporção de plasmócitos clonais da medula óssea pode ajudar a diferenciar MM de MGUS. Consulte Classificação.
O plasmocitoma solitário, que pode progredir para MM, é confirmado pela presença de uma lesão solitária de osso (ou tecido mole) na biópsia, com evidência de plasmócitos clonais.[3]Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov;15(12):e538-48.
https://orbi.uliege.be/handle/2268/174646
http://www.ncbi.nlm.nih.gov/pubmed/25439696?tool=bestpractice.com
A medula óssea é normal e não há evidências de plasmócitos clonais na medula óssea. Os exames de imagem são normais (exceto pela lesão solitária); não há danos em órgãos-alvo.[3]Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov;15(12):e538-48.
https://orbi.uliege.be/handle/2268/174646
http://www.ncbi.nlm.nih.gov/pubmed/25439696?tool=bestpractice.com
A imuno-histoquímica e a citometria de fluxo podem ser realizadas em amostras de medula óssea para confirmar a presença de plasmócitos monoclonais e quantificar com precisão o envolvimento dos plasmócitos.[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: multiple myeloma [internet publication].
https://www.nccn.org/guidelines/category_1
[Figure caption and citation for the preceding image starts]: Biópsia da medula ósseaCortesia do Dr. Robert Hasserjian, Hematopatologia, Massachusetts General Hospital; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Biópsia da medula óssea após análise histoquímica de cadeia leve kappaCortesia do Dr. Robert Hasserjian, Hematopatologia, Massachusetts General Hospital; usado com permissão [Citation ends].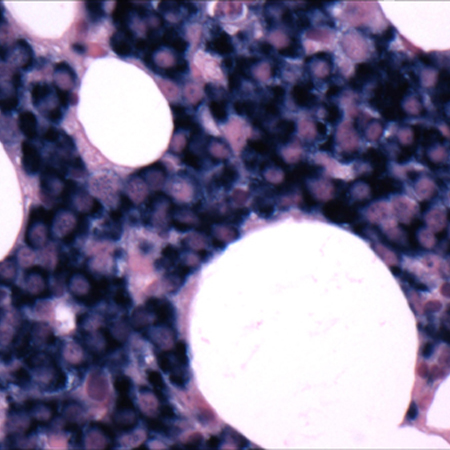
[Figure caption and citation for the preceding image starts]: Biópsia da medula óssea após análise histoquímica de cadeia leve lambdaCortesia do Dr. Robert Hasserjian, Hematopatologia, Massachusetts General Hospital; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Aspirado mostrando infiltrado plasmocitárioCortesia do Dr. Robert Hasserjian, Hematopatologia, Massachusetts General Hospital; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Aspirado mostrando infiltrado plasmocitárioCortesia do Dr. Robert Hasserjian, Hematopatologia, Massachusetts General Hospital; usado com permissão [Citation ends].
Testes citogenéticos
A análise citogenética (por exemplo, hibridização in situ fluorescente [FISH]) deve ser realizada em amostras de medula óssea para identificar anormalidades cromossômicas consideradas como de aumento do risco de progressão/recidiva, por exemplo: del(13q), del(17p), t(4;14), t(11;14), t(14;16), t(14:20), ganho/amplificação de 1q21, deleção de 1p, translocação MYC.[44]Dimopoulos MA, Moreau P, Terpos E, et al. Multiple myeloma: EHA-ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. Ann Oncol. 2021 Mar;32(3):309-22.
https://www.annalsofoncology.org/article/S0923-7534(20)43169-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/33549387?tool=bestpractice.com
[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: multiple myeloma [internet publication].
https://www.nccn.org/guidelines/category_1
Prognóstico e estratificação de risco
Marcadores prognósticos importantes incluem beta2-microglobulina sérica, albumina sérica, anormalidades citogenéticas, creatinina, ureia, proteína C-reativa, LDH sérica e NT-proPNB/peptídeo natriurético do tipo B.
A beta2-microglobulina sérica se correlaciona com estágios clínicos no sistema de estadiamento de Durie Salmon, sendo considerado o fator mais importante para a estimativa da sobrevida.[61]Durie BG, Salmon SE. A clinical staging system for multiple myeloma: correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. Cancer. 1975 Sep;36(3):842-54.
http://www.ncbi.nlm.nih.gov/pubmed/1182674?tool=bestpractice.com
Foi demonstrado que os níveis de albumina sérica combinados com os níveis séricos de beta2-microglobulina melhoram a significância prognóstica, e isso forma a base do sistema de classificação do Sistema Internacional de Estadiamento (ISS) usado para estratificar o risco de pacientes com MM.[62]Greipp PR, San Miguel J, Durie BG, et al. International staging system for multiple myeloma. J Clin Oncol. 2005 May 20;23(15):3412-20.
https://ascopubs.org/doi/10.1200/JCO.2005.04.242
http://www.ncbi.nlm.nih.gov/pubmed/15809451?tool=bestpractice.com
Consulte Critérios.
A LDH sérica e as anormalidades citogenéticas de alto risco, como del(17p), t(4;14), t(14;16) e ganho/amplificação de 1q, foram incorporadas em versões revisadas do sistema de classificação ISS (RISS e R2-ISS) para melhorar a estratificação de risco e o prognóstico.[63]Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised International Staging System for multiple myeloma: a report from International Myeloma Working Group. J Clin Oncol. 2015 Sep 10;33(26):2863-9.
https://ascopubs.org/doi/10.1200/JCO.2015.61.2267
http://www.ncbi.nlm.nih.gov/pubmed/26240224?tool=bestpractice.com
[64]D'Agostino M, Cairns DA, Lahuerta JJ, et al. Second revision of the International Staging System (R2-ISS) for overall survival in multiple myeloma: a European Myeloma Network (EMN) report within the HARMONY project. J Clin Oncol. 2022 Oct 10;40(29):3406-18.
https://ascopubs.org/doi/10.1200/JCO.21.02614?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/35605179?tool=bestpractice.com
Consulte Critérios.
O prognóstico desfavorável está associado a:[5]Kyle RA. Multiple myeloma: review of 869 cases. Mayo Clin Proc. 1975 Jan;50(1):29-40.
http://www.ncbi.nlm.nih.gov/pubmed/1110582?tool=bestpractice.com
[65]Dimopoulos MA, Terpos E, Chanan-Khan A, et al. Renal impairment in patients with multiple myeloma: a consensus statement on behalf of the International Myeloma Working Group. J Clin Oncol. 2010 Nov 20;28(33):4976-84.
http://www.ncbi.nlm.nih.gov/pubmed/20956629?tool=bestpractice.com
[66]Pavo N, Cho A, Wurm R, et al. N-terminal B-type natriuretic peptide (NT-proBNP) is associated with disease severity in multiple myeloma. Eur J Clin Invest. 2018 Apr;48(4).
http://www.ncbi.nlm.nih.gov/pubmed/29417568?tool=bestpractice.com
Aumento da creatinina e da ureia, que indica comprometimento renal e é relatado em até 50% dos pacientes
Elevação de proteína C-reativa, LDH sérica e NT-proPNB/peptídeo natriurético do tipo B, indicativos de doença mais extensa
Exames adicionais a serem considerados
Os seguintes exames devem ser considerados:[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: multiple myeloma [internet publication].
https://www.nccn.org/guidelines/category_1
O teste de polimorfismo de nucleotídeo único (SNP) e/ou sequenciamento de última geração (NGS) em amostras de medula óssea; fornece detalhes adicionais sobre a genética dos plasmócitos clonais que podem informar o prognóstico e auxiliar no teste/monitoramento da doença residual mínima (DRM) durante o tratamento.[67]Kumar SK, Rajkumar SV. The multiple myelomas - current concepts in cytogenetic classification and therapy. Nat Rev Clin Oncol. 2018 Jul;15(7):409-21.
http://www.ncbi.nlm.nih.gov/pubmed/29686421?tool=bestpractice.com
Viscosidade sérica, se houver suspeita de hiperviscosidade (particularmente aqueles com altos níveis de proteína M).
Rastreamento para hepatite B e C, HIV, vírus do herpes simples e vírus da varicela-zóster, conforme indicação clínica.



 [Figure caption and citation for the preceding image starts]: Aspirado mostrando infiltrado plasmocitárioCortesia do Dr. Robert Hasserjian, Hematopatologia, Massachusetts General Hospital; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Aspirado mostrando infiltrado plasmocitárioCortesia do Dr. Robert Hasserjian, Hematopatologia, Massachusetts General Hospital; usado com permissão [Citation ends].