Abordagem
A maioria dos adenomas hipofisários clinicamente não funcionantes (ACNF hipofisários) apresenta-se tardiamente por não secretar hormônios ou por secretar hormônios funcionais de forma ineficiente.[1] A idade média de apresentação é de 40 a 58 anos para mulheres versus 58 a 62 anos para homens.[34]
História
Os adenomas hipofisários podem ser encontrados incidentalmente em exames de imagem, ou apresentarem-se com sintomas e sinais de efeito de massa ou alterações neuroendócrinas. As cefaleias são comuns (35% a 70%), mas a fisiopatologia subjacente ainda é incerta.[35] Os mecanismos possíveis incluem causas estruturais, como alongamento dural, ou invasão do seio cavernoso.[8] O crescimento do tumor no terceiro ventrículo pode causar hidrocefalia e sintomas associados, como cefaleia, perda do equilíbrio e incontinência urinária.[8] O crescimento lateral do tumor no seio cavernoso pode causar visão dupla decorrente de paralisia nos terceiro, quarto e sexto nervos cranianos, além de dor facial e parestesia decorrente de paralisia nos ramos V1 e V2 do quinto nervo craniano.[9] Podem ocorrer convulsões em decorrência de envolvimento do lobo temporal.[10] Sinusite recorrente e rinorreia do líquido cefalorraquidiano podem resultar de um crescimento para o interior do seio esfenoide.
Os pacientes com ACNF hipofisários podem apresentar características de hipopituitarismo.[8][36] Os gonadotrofos e somatotrofos se mostram extremamente suscetíveis ao dano por pressão local de um adenoma hipofisário. O hipogonadismo em homens se manifesta com a perda de características sexuais secundárias, humor instável, perda da libido, disfunção erétil, infertilidade, anemia, perda de massa muscular e osteopenia. Nas mulheres, estão presentes amenorreia, diminuição da libido, infertilidade, fogachos, osteopenia e atrofia de mamas. A deficiência da produção do hormônio do crescimento causa obesidade troncular, fadiga associada a tolerância reduzida a esforços, massa muscular reduzida e aumento da massa adiposa, osteopenia, depressão e perfil lipídico anormal. O hipotireoidismo causa fadiga, constipação, aumento de peso, intolerância a frio, pele seca, queda de cabelos, bradicardia, perda de memória e depressão. A insuficiência adrenal causa fadiga, náuseas, anorexia, perda de peso, hiponatremia, fraqueza e tremores. Tipicamente não há hipercalemia, pois a via dos mineralocorticoides permanece intacta e não há hiperpigmentação.
Geralmente, os adenomas gonadotrofos não são funcionais, mas em casos raros apresentam achados clínicos secundários à hipersecreção de gonadotrofinas, inclusive puberdade precoce em crianças, macro-orquidismo em homens, hiperestimulação ovariana em mulheres na pré-menopausa com tumores secretores de hormônio folículo-estimulante ou níveis de testosterona anormalmente altos e tumores secretores de hormônio luteinizante.[1][14]
O diabetes insípido é um achado raro no diagnóstico de ACNF hipofisários, embora possa resultar de cirurgia do adenoma hipofisário.[37]
Apoplexia hipofisária
Pode ser a manifestação inicial, cursando com cefaleia intensa de início súbito, febre, náuseas e vômitos, meningismo, nível de consciência alterado, distúrbios visuais e hipopituitarismo.[11] A apoplexia hipofisária clinicamente significativa é um evento raro em pacientes com microadenomas hipofisários. O risco de apoplexia é estimado em 2% a 12% dos pacientes com adenomas hipofisários.[11] Ocorre devido a um rápido aumento da hipófise, resultante de hemorragia e/ou infarto do tumor.[12] Embora a maioria dos casos de apoplexia hipofisária seja espontânea, os fatores precipitantes podem incluir traumatismo cranioencefálico, terapia anticoagulante, agonistas dopaminérgicos, radioterapia ou testes dinâmicos em endocrinologia. Em uma metanálise de pacientes com incidentalomas hipofisários e ACNF hipofisários, a apoplexia hipofisária ocorreu a uma taxa de 0.2 por 100 pessoas-anos, com uma tendência estatisticamente não significativa de uma maior taxa de apoplexia com macroadenomas em comparação com os microadenomas.[38]
Se a hemorragia ou infarto do tumor tiver ocorrido anteriormente, o paciente poderá não se lembrar de seus sintomas; e pode-se considerar que o paciente apresentou uma apoplexia hipofisária assintomática.
Achados dos exames
À apresentação, 80% apresentam deficit no campo visual como resultado de compressão da via óptica, manifestando-se mais comumente como hemianopsia bitemporal com compressão do quiasma.[37] Os pacientes podem apresentar acuidade visual reduzida. A perda de campo visual tipicamente se inicia com quadrantanopsia superior bitemporal.[39] As paralisias de nervos cranianos envolvendo o terceiro, quarto, quinto (V1 e V2) e sexto nervos e midríase associada à paralisia do terceiro nervo podem estar presentes. Os pacientes com apoplexia hipofisária podem ter graus variados de alteração no estado mental.
Achados relacionados à endocrinologia em pacientes com adenomas hipofisários incluem: sinais de hipogonadismo (redução dos pelos faciais e corporais, ginecomastia, massa muscular reduzida, testículos moles em homens e atrofia da mama em mulheres); hipotireoidismo (pele e cabelos secos, face inchada, perda ou diminuição do volume das sobrancelhas); e deficiência do hormônio do crescimento (perda de massa muscular, aumento da obesidade abdominal). Palidez e aumento das rugas na pele são achados característicos em pacientes com pan-hipopituitarismo.
Exames por imagem
Uma ressonância nuclear magnética (RNM) dedicada da hipófise, pré-contraste e pós-contraste com gadolínio, é preferencial em contraposição a uma tomografia computadorizada (TC).[39][40] A RNM delineará as características do tumor, a presença de invasão tumoral nos seios cavernosos e no seio esfenoidal, além de efeitos de massa sobre o quiasma óptico.[Figure caption and citation for the preceding image starts]: Ressonância magnética (RM) pré-contraste coronal (A) e sagital (B) de um paciente com macroadenoma hipofisário (seta, A). A massa hipofisária se estende em direção ao quiasma óptico com certo efeito de pressãoDo acervo de Dr. Amir Hamrahian [Citation ends].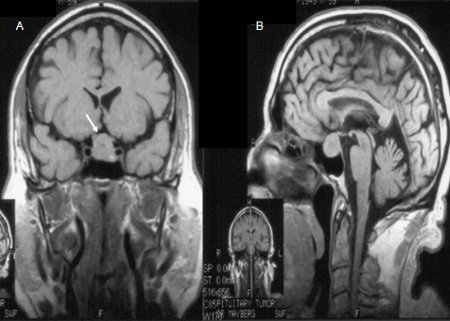 [Figure caption and citation for the preceding image starts]: Ressonância magnética (RM) coronal antes (A) e após (B) injeção de contraste em um paciente com um microadenoma hipofisário pequeno. A lesão hipofisária é realçada menos que a hipófise normal após o contraste por gadolínio; aparenta ser hipodensa quando comparada à hipófise normal (seta, B)Do acervo de Dr. Amir Hamrahian [Citation ends].
[Figure caption and citation for the preceding image starts]: Ressonância magnética (RM) coronal antes (A) e após (B) injeção de contraste em um paciente com um microadenoma hipofisário pequeno. A lesão hipofisária é realçada menos que a hipófise normal após o contraste por gadolínio; aparenta ser hipodensa quando comparada à hipófise normal (seta, B)Do acervo de Dr. Amir Hamrahian [Citation ends].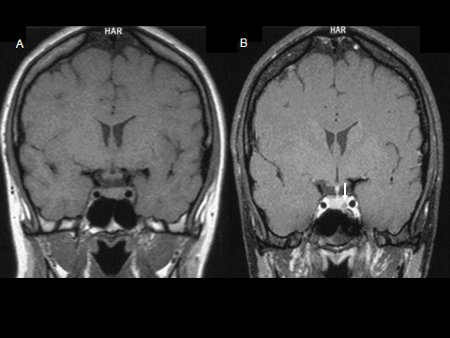
Avaliação oftálmica
Exames oftalmológicos e testes formais de campo visual (testes de Humphrey ou Goldmann) são indicados se o diagnóstico por imagem indicar que o adenoma estiver causando pressão sobre o quiasma óptico ou estiver em contato com ele, a fim de documentar a acuidade visual e a ocorrência de deficits do campo visual.
Exames de sangue de rotina
Além da avaliação hormonal, um perfil metabólico básico e um hemograma completo devem ser feitos inicialmente. Hiponatremia pode ser observada na insuficiência adrenal e no hipotireoidismo e também está associada a sintomas como náuseas, vômitos, cefaleia e mal-estar. Anemia pode ser uma característica de pacientes com hipogonadismo, hipotireoidismo ou insuficiência adrenal de longa data e também está associada a fadiga e mal-estar. Um perfil lipídico pode ser realizado subsequentemente para determinar hiperlipidemia e risco de aterosclerose prematura combinados à deficiência do hormônio do crescimento e hipogonadismo.
Prolactina
Os níveis de prolactina associados a prolactinomas correspondem ao tamanho do tumor. Uma hiperprolactinemia leve a moderada pode estar presente (<2000 mUI/L [<100 microgramas/L]) com um microprolactinoma ou, na presença de um macroadenoma hipofisário, geralmente devido a compressão do pedúnculo hipofisário.[41] À exceção de pacientes sendo tratados com medicamentos como metoclopramida e antipsicóticos, um nível de prolactina >4000 mUI/L (>200 microgramas/L) quase sempre é diagnóstico de prolactinoma. Outras causas fisiológicas de hiperprolactinemia incluem gravidez, estimulação da parede torácica ou do mamilo, insuficiência renal, hipotireoidismo e insuficiência adrenal.
Hormônio do crescimento e fator de crescimento semelhante à insulina-1
A deficiência de hormônio do crescimento (GH) é uma das deficiências hormonais mais comuns associadas aos ACNF hipofisários. Os níveis aleatórios de GH não são úteis para se fazer um diagnóstico, e o fator de crescimento semelhante à insulina-1 (IGF-1) pode estar normal em até 65% dos pacientes com deficiência de GH; além disso esse não é considerado um exame de rastreamento adequado. A presença de 3 ou mais deficiências hormonais da adeno-hipófise, na presença de IGF-1 baixo, quase sempre indicará a presença de deficiência de GH. Portanto, podem ser dispensados testes adicionais.[42] No entanto, um nível de GH estimulado com um teste de tolerância à insulina (TTI), teste de estímulo por glucagon, teste de estímulo por arginina/hormônio de liberação do hormônio do crescimento (GHRH) ou teste de macimorelin costuma ser necessário para o diagnóstico. Embora o TTI seja um teste padrão ouro para o diagnóstico, deve ser realizado por um endocrinologista experiente, por conta dos riscos associados à hipoglicemia iatrogênica e da necessidade de administração de glicose para a recuperação, quando necessário. O TTI é contraindicado em pacientes com história de transtorno convulsivo, doença arterial coronariana e doença cerebrovascular, com idade superior a 65 anos. O teste de estimulação com glucagon foi proposto como uma alternativa ao TTI para a avaliação de pacientes com suspeita de deficiência de GH.[43]O macimorelin é um agonista do receptor de secretagogo do GH oral que foi aprovado para o diagnóstico de deficiência de GH em adultos.[44]
Hormônio folículo-estimulante, hormônio luteinizante, subunidades alfa de hormônios glicoproteicos hipofisários humanos, estradiol e testosterona
Baixo nível de testosterona sérica nos homens, ou estradiol nas mulheres, acompanhado por níveis normais/baixos de hormônio folículo-estimulante (FSH) e hormônio luteinizante (LH), é um quadro consistente com deficiência de gonadotrofina em homens e em mulheres amenorreicas na pré-menopausa. A não elevação de FSH e LH em mulheres menopausadas também é um quadro consistente com deficiência de gonadotrofina. A presença de um ciclo menstrual regular quase sempre indica um eixo gonadotrófico normal. Em mulheres com menstruação irregular, a interpretação da elevação hormonal no eixo gonadotrófico pode ser desafiadora e não é geralmente indicada.
Embora mais de 45% dos ACNF hipofisários sejam de fato adenomas de células gonadotrópicas, eles raramente produzem uma síndrome de hipersecreção hormonal.[37] Eles podem produzir FSH e LH intactos, e, mais comumente, produzem uma variedade de combinações da subunidade beta do FSH e/ou da subunidade beta da LH, juntamente com a subunidade mais comum, alfa.[37] Em pacientes com adenomas de células gonadotróficas, o FSH, LH e/ou a subunidade alfa podem estar elevados. A testosterona pode raramente estar elevada nos pacientes com adenomas hipofisários produtores de LH.
hormônio estimulante da tireoide e tiroxina livre ou total
Se houver suspeita clínica de hipotireoidismo secundário, o hormônio estimulante da tireoide (TSH) e o T4 livre (ou o índice de T4 livre) devem ser medidos em conjunto. Os pacientes costumam apresentar TSH baixo ou, mais comumente, normal em conjunto com um nível baixo de T4 livre, em contraposição aos pacientes com hipotireoidismo primário, nos quais o TSH está elevado.
Hormônio adrenocorticotrófico e cortisol
O teste de estímulo com o hormônio adrenocorticotrófico (cosintropina) e de nível de cortisol no plasma pela manhã (por exemplo, 8h) são exames iniciais razoáveis para a avaliação do eixo corticotrófico.
Um nível de cortisol pela manhã inferior a 83 nanomoles/L (3 microgramas/dL) sugere fortemente uma insuficiência adrenal; um valor superior a 414 nanomoles/L (15 microgramas/dL) torna esse diagnóstico altamente improvável.
Níveis de cortisol entre 83-414 nanomoles/L (3-15 microgramas/dL) não são considerados conclusivos e devem ser adicionalmente avaliados pelo teste de estímulo com o hormônio adrenocorticotrófico (ACTH), que pode ser realizado em qualquer momento do dia.
Os valores ideais de cortisol usados no teste de estímulo com o hormônio adrenocorticotrófico devem ser individualizados, dependendo do ensaio usado, pois ensaios mais novos (por exemplo, imunoensaios de anticorpos monoclonais ou espectrometria de massa) podem ter um limiar mais baixo e resultar em um teste falso-positivo.[45] O valor de <500 nanomoles/L (<18 microgramas/dL) para indicar insuficiência adrenal é derivado de ensaios de anticorpos policlonais; um corte de cortisol sérico inferior a 386-414 nanomoles/L (14-15 microgramas/dL) é sugerido para os novos imunoensaios de anticorpos monoclonais específicos.[45]
Os valores de corte também precisam ser individualizados de acordo com o uso de cosintropina em alta ou baixa doses para o teste de estímulo com o hormônio adrenocorticotrófico.[46] A dose padrão do teste de estímulo com o hormônio adrenocorticotrófico utiliza uma injeção intravenosa ou intramuscular de 250 microgramas de cosintropina, com determinação dos níveis plasmáticos de cortisol antes e 30 minutos após a injeção. Uma resposta normal seria uma concentração plasmática de cortisol superior a 497 nanomoles/L (18 microgramas/dL) a 30 minutos. Pacientes com deficiência leve, parcial ou de início recente do ACTH hipofisário ou do hormônio liberador de corticotrofina hipotalâmico (por exemplo, em 2 a 4 semanas após cirurgia hipofisária) podem ter uma resposta normal a 250 microgramas de cosintropina, pelo fato de as glândulas adrenais não estarem suficientemente atrofiadas e ainda responderem a altíssimas concentrações de estimulação com ACTH. A sensibilidade do teste de estímulo com o hormônio adrenocorticotrófico para identificar insuficiência adrenal leve ou parcial aumenta com uma dose baixa de cosintropina (1 micrograma).[46]
Os níveis de ACTH não são confiáveis para o diagnóstico, mas podem ser usados para diferenciar uma insuficiência adrenal primária de uma secundária em pacientes com níveis de cortisol baixos.
Teste de estimulação por hormônio liberador de gonadotrofina
Este teste pode ser útil na avaliação do eixo gonadotrófico em determinados pacientes pediátricos, mas geralmente é desnecessário. Há relatos de indução de apoplexia hipofisária decorrente do teste.
Coloração imuno-histoquímica
Realizada após a ressecção do tumor, podendo auxiliar na formação do diagnóstico e do tratamento com base na secreção hormonal subclínica.
O uso deste conteúdo está sujeito ao nosso aviso legal