Подход
Лечение обструкции дыхательных путей (ОДП) является сложным и требует назначения консилиума с привлечением пульмонолога, химиотерапевта и онколога-радиолога, анестезиолога, отоларинголога, торакального хирурга, а также специалиста по интервенционной бронхоскопии.
Лечение ОНДП, главным образом, зависит от начального проявления. Больше половины вмешательств, выполняемых при обструкции дыхательных путей, проводятся в кратчайшие сроки или неотложно.[28]
Значительная обструкция дыхательных путей, сопровождающаяся надвигающимся удушьем, требует принятия срочных мер для незамедлительного и эффективного восстановления и обеспечения проходимости дыхательных путей, а также купирования обструкции.[18] Этого часто достигают при помощи жесткой бронхоскопии и методики термальной терапии (например, эндобронхиальный лазер). В связи с острым характером проявлений у таких пациентов предварительные исследования (например, компьютерную томографию с высоким разрешением, исследования функции легких) и диагностическую гибкую бронхоскопию первоначально не выполняют.
Большинство пациентов, у которых проявления ОНДП являются доброкачественными или не острыми, проходят однодневное лечение в амбулаторных условиях. Этих пациентов наблюдают в течение нескольких часов в палате послеоперационного наблюдения и выписывают в тот же день, если они клинически стабильны после вмешательства.[9]
Эксперты обычно описывают двухэтапный подход к лечению ОНДП путем первичной стабилизации, за которой следуют различные вмешательства в дыхательные пути, которые можно разделить на эндоскопические и хирургические виды операционной терапии.
Начальная стабилизация
Первым этапом и приоритетной задачей лечения ОНДП является поддержание достаточной оксигенации и вентиляции.
Пациентов с подострым проявлением ОНДП можно лечить дополнительным кислородом через носовые канюли или респираторную маску. У таких стабильных пациентов дополнительная диагностическая информация может быть получена при помощи диагностической гибкой бронхоскопии.
У пациентов с тяжелой трахеальной или бронхиальной обструкцией, которые нестабильны, с проявлением приближающейся дыхательной недостаточности, первичная стабилизация направлена на создание безопасного дыхательного пути. Этих пациентов нужно исследовать и оказать помощь в отделении интенсивной терапии. Для создания безопасного дыхательного пути может потребоваться эндотрахеальная интубация или жесткая бронхоскопия. Для пациентов с тяжелой проксимальной обструкцией верхних дыхательных путей ургентная крикотиреоидотомия или трахеотомия являются методами выбора.[1][64]
Эндотрахеальную интубацию следует выполнять во время анестезии слизистых оболочек у пациента, находящегося в сознании, или пациента, находящегося под легким наркозом, который активно дышит. Рекомендуется избегать применения паралитиков, поскольку интубация может быть сложной или невозможной.[1][64] Хотя пациенты с ОНДП очень волнуются, седативные средства следует использовать с осторожностью, поскольку гиповентиляция может еще больше нарушить дыхательные пути.[57][76] Эндотрахеальную трубку (ЭТТ) следует аккуратно перемещать вдоль трахеи, поскольку повреждение хрупких тканей может усугубить внутрипросветную обструкцию и вызвать кровотечение.[57] Для проксимальных обструкций трахеи следует рассматривать интубацию при помощи оптического волокна с размещением ЭТТ под прямой визуализацией.[57] Ларингеальная маска или подвесная ларингоскопия являются альтернативными вариантами для того, чтобы избежать этих осложнений.[76]
Если есть какие-либо сомнения относительно стабильности дыхательных путей при тяжелой обструкции, жесткая бронхоскопия является методом выбора, поскольку она предоставляет безопасные дыхательные пути, обеспечивающие оксигенацию и вентиляцию.[1][66] Она также выступает в качестве терапевтического инструмента для быстрой дилатации стеноза.[1][64]
Гелиокс, смесь 60-80 % гелия и 20-40 % кислорода, может использоваться для неотложных пациентов в качестве переходной терапии, чтобы избежать интубации или выполнить более безопасную или стабильную интубацию. Он уменьшает работу дыхания за счет уменьшения турбулентного потока газов в крупных дыхательных путях и делает возможным более быстрое восстановление ламинарного потока после изменения диаметра дыхательных путей.[15][76] Этот эффект снижает рабочее давление, которое требуется для получения предусмотренного потока, либо улучшает поток с тем же рабочим давлением. Возникшая в результате сокращенная работа дыхания делает возможной более стабильную интубацию при помощи ЭТТ или жесткой бронхоскопии. Основным ограничением использования гелиокса является неспособность доставлять газ с долей вдыхаемого кислорода (FiO2) >40%. Несмотря на физиологические признаки и клинические отчеты, есть недостаток в проспективных рандомизированных исследованиях, которые демонстрируют улучшенные результаты использования гелиокса.
Если профильная команда по вопросам дыхательных путей отсутствует, после первичной стабилизации следует рассмотреть вопрос перевода пациента в специализированный центр. Если у пациента присутствуют симптомы приближающейся дыхательной недостаточности из-за внешней компрессии дыхательных путей, немедленная интубация с использованием гибкого бронхоскопа, который проходит дистально по отношению к стенозу, и очистка дистальных дыхательных путей для удаления гноя и слизи до направления к врачу-специалисту может спасти ему жизнь. Раздувание трахеальной манжеты облегчает компрессию опухолевидного участка, и пациента можно безопасно доставить в специализированный центр для дальнейшего лечения.[18]
Как только пациентам, которым не была проведена жесткая бронхоскопия, или пациентам, которые не требуют срочного вмешательства, выполняют первичную стабилизацию, может быть проведена подробная и тщательная гибкая бронхоскопия, а также другие дополнительные исследования, необходимые для диагностики и планирования лечения.
Злокачественная обструкция дыхательных путей
Операбельные опухоли
Радикальная хирургическая резекция с системным узелковым иссечением является стандартным терапевтическим подходом к операбельным опухолям.[18]
Неоперабельные опухоли
Злокачественная ОНДП обычно представляет собой прогрессирующее заболевание без каких-либо шансов на излечение при помощи хирургической резекции.
У пациентов с неоперабельными опухолями нижних дыхательных путей восстановление проходимости дыхательных путей обеспечивает временное облегчение и может продлить жизнь, особенно в случаях, когда ОНДП сопровождается приближающейся дыхательной недостаточностью.[21]
Интервенционная бронхоскопия может быть показана до начала химиотерапии или лучевой терапии (или когда такое лечение не действует) при лечении неоперабельных опухолей и, как было показано, улучшает частоту одышки и экстубации, тем самым повышая качество жизни.[29]
Бронхоскопическая терапия является альтернативой оперативному вмешательству в случаях, когда во всех других отношениях операбельная опухоль считается неоперабельной из-за высокого функционального или риска анестезии для пациента.[29]
Хотя существует очень мало случаев, когда неоперабельный рак легких стал операбельным после интервенционного бронхоскопического лечения,[29][77] последнее исследование показало, что терапевтическая бронхоскопия может использоваться в качестве дополнительного средства при комбинированном бронхоскопическом и хирургическом лечении злокачественной ОНДП перед излечивающей хирургией легкого.[30]
Пациентам с неоперабельным раком легких и симптоматической обструкцией дыхательных путей следует предложить терапевтическую бронхоскопию с механической или термоабляцией, близкофокусную лучевую терапию или стентирование с целью улучшения одышки, кашля, кровохарканья и повышения качества жизни.[78]
Большое ретроспективное исследование более 800 пациентов показало, что интервенционные бронхоскопические процедуры для тяжелой неопластической обструкции дыхательных путей имеют показатель эффективности 85 %.[79]
Не злокачественная обструкция дыхательных путей
Лечение незлокачественной обструкции дыхательных путей требует тесного сотрудничества с торакальным хирургом, имеющим опыт восстановления комплексных изменений дыхательных путей.
Лечение коллапса нижних экспираторных дыхательных путей зависит от тяжести функционального нарушения, его этиологии, степени сужения дыхательных путей и степени коллапса. Трахеобронхомаляцию или симптоматический тяжелый динамический коллапс задних дыхательных путей можно лечить при помощи консервативной терапии, такой как бронходилататоры в стандартных дозах или непрерывная вентиляция с положительным давлением.[13]
У пациентов с низким риском с очаговым стенозом трахеи хирургическая резекция с первичным реанастомозом является терапией первой линии.[21] Пациентам с коллапсом нижних экспираторных дыхательных путей из-за трахеобронхомаляции или чрезмерного динамического коллапса дыхательных путей может быть рекомендовано временное стентирование дыхательных путей, если пациент является кандидатом на проведение трахеопластики, поскольку существует вероятность того, что симптомы улучшатся после стентирования. Инородное тело, блокирующее нижние дыхательные пути, может быть удалено при помощи различных инструментов, включая щипцы, захватные крючки или щипцы типа "корзина", баллон Фогарти или зонд для криотерапии.[68]
Гибкая и жесткая бронхоскопия
Бронхоскопическая терапия, которая может быть выполнена посредством гибкой или жесткой бронхоскопии, приводит к уменьшению проявления симптомов, улучшению качества жизни и повышению выживаемости. Выбор надлежащего подхода среди возможных эндоскопических вмешательств (тепловое, нетепловое и лучевое) зависит от ряда факторов, в том числе от остроты проявления симптомов, первопричины и типа поражения, стабильности пациента, общего, сердечного и легочного статуса пациента, качества жизни, общего прогноза, опыта врача и доступных технологий.[1][59]
Обычно используется комбинированное лечение с сочетанием различных эндоскопических методов, поскольку некоторые методы, такие как лазерная терапия или электрохирургия со стентированием дыхательных путей дополняют друг друга.[16] В целом, эндоскопическое лечение, по сравнению с хирургическим вмешательством, предусматривает меньший риск, дискомфорт и заболеваемость.[Figure caption and citation for the preceding image starts]: Сужение анастомоза бронха после трансплантации легкогоИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].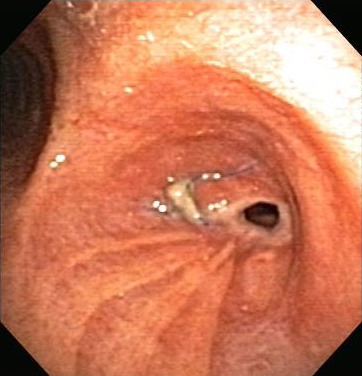 [Figure caption and citation for the preceding image starts]: Анастомозный стеноз бронха после трансплантации легкого: анастомоз правого главного бронха после комбинированной эндоскопической терапииИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
[Figure caption and citation for the preceding image starts]: Анастомозный стеноз бронха после трансплантации легкого: анастомоз правого главного бронха после комбинированной эндоскопической терапииИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].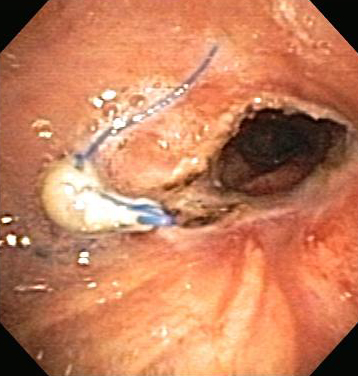
Гибкая бронхоскопия
Некоторые эксперты выступают за то, чтобы она использовалась всегда, когда это возможно.
Может проводиться под местной анестезией с внутривенной седацией или под общей анестезией.
Во время процедур гибкой бронхоскопии без эндотрахеальной трубки (ЭTT) вентиляция является спонтанной, в то время как во время процедур, которые проводятся через ЭTT или ларингеальную маску, требуется вентиляция с положительным перемежающимся давлением.[57]
Жесткая бронхоскопия
Безопасный и эффективный способ защиты дыхательных путей, который обеспечивает способность вентилировать и насыщать кислородом пациента при проведении диагностических и терапевтических вмешательств в дыхательные пути.[16][64][66][67][68][80]
Бронхоскопический метод является предпочтительным для пациента с приближающейся дыхательной недостаточностью.
Позволяет использовать большие катетеры для отсасывания, чтобы удалить кровь или остатки, в то время как цилиндр может быть использован для расширения стенозов и в качестве инструмента для удаления опухоли, вызывающей обструкцию.
Требует общей анестезии и операционной.
Вентиляция может быть достигнута посредством спонтанной вентиляции, спонтанной вспомогательной вентиляции, контролируемой эжекционной искусственной вентиляции, высокочастотной искусственной вентиляции или приточно-вытяжной вентиляции с закрытым контуром через жесткий бронхоскоп.[16][57][67][76] Эжекционная искусственная вентиляция используется открытой системой, где адаптер эжекционной искусственной вентиляции подключен непосредственно к жесткому бронхоскопу. Обычно 100 % кислород вводят при 50 ф/дм2 на скорости 8-15 вдохов в минуту. Поскольку это открытая система, также вводится комнатный воздух, а переменная концентрация кислорода во вдыхаемом воздухе передается в дистальные дыхательные пути. К возможным осложнениям относится ятрогенный пневмоторакс.[81]
Противопоказаниями являются те, которые связаны с анестезией и анатомией шеи и челюсти (например, неустойчивый шейный отдел позвоночника, челюстно-лицевая травма, шейный анкилоз или тяжелый кифосколиоз).[16][67]
Осложнения встречаются редко. Данных о частоте возникновения осложнений недостаточно, но тяжелые осложнения возникают редко, если вы находитесь в руках опытного специалиста. Наиболее распространенным осложнением является боль в горле после процедуры. Другие осложнения включают повреждение зубов или десен, разрывы трахеи или бронхов и сильное кровотечение. Вызванная гипоксемией сердечная ишемия и аритмии являются наиболее опасными осложнениями. Общая смертность, связанная с жесткой бронхоскопией, составляет всего 0,4%.[16][67][80][82]
Ретроспективное исследование показало, что жесткая бронхоскопия и механическая циторедукция в качестве монотерапии безопасна и успешна в 83 % случаев опухолей нижних дыхательных путей.[83]
В конструкцию жесткого бронхоскопа были внесены различные улучшения для создания более универсального инструмента.[84] Широко используемыми жесткими бронхоскопами являются жесткий бронхоскоп «Bryan-Dumon II» и «Karl Storz». Жесткий бронхоскоп «Hemer» имеет измерительную трубку, соединенную с бронхоскопом, которая позволяет измерять давление вдоха и выдоха, а также концентрации кислорода и углекислого газа.[85]
Проведение жесткой бронхоскопии требует специальной подготовки. В Соединенных Штатах она используется недостаточно, поскольку подготовка к проведению жесткой бронхоскопии предлагается только в 4,4 % всех программ легочной медицины и 31,3 % легочных программ, которые оказывают услугу интервенционной пульмонологии.[82]
Термические эндоскопические вмешательства в дыхательные пути
Все термические эндоскопические вмешательства в дыхательные пути могут происходить как при помощи жесткого, так и при помощи гибкого бронхоскопа.
Лазерная терапия[1][2][16][17][18][21][59][60][64][68][80][86][87]
Лазерное резекция является примером применения лазерной энергии для создания термических, фотодинамических и электромагнитных изменений в живых тканях. Есть несколько типов лазера, в том числе Nd:YAG (неодим:иттрий-алюминиевый гранат), CO2 (двуокись углерода) и Nd:YAP (неодим:иттрий-алюминий-перовскит). Лазер Nd:YAG, вероятно, является наиболее широко используемым типом лазера при эндобронхиальном заболевании.
Nd:YAG – бесконтактный или контактный метод, при котором энергия от лазера Nd:YAG направляется на ткань дыхательных путей для облегчения проходимости при злокачественной и незлокачественной ОДП.[Figure caption and citation for the preceding image starts]: Обструкция нижних дыхательных путей: злокачественная обструкция правого бронхаИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
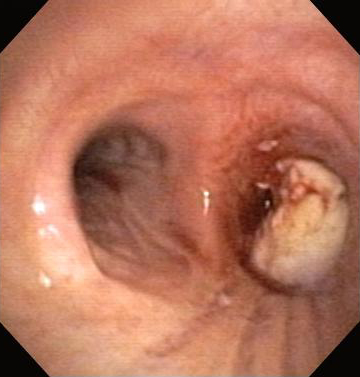 [Figure caption and citation for the preceding image starts]: Бронхоскопическая терапия для обструкции нижних дыхательных путей правого главного бронха: лазерное фоторазделениеИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
[Figure caption and citation for the preceding image starts]: Бронхоскопическая терапия для обструкции нижних дыхательных путей правого главного бронха: лазерное фоторазделениеИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
Может использоваться в чрезвычайных ситуациях и является отличным инструментом для быстрой эндобронхиальной циторедукции с зарегистрированной скоростью восстановления просвета 83-93 %, а также ослаблением симптомов до 63-94 %.[60]
«Правило четырех» лазерной резекции может быть использовано для увеличения шансов на успех и минимизации риска:[17]
Длительность течения коллапса: меньше 4 недель
Длина поражения: меньше 4 см
Расстояние от эндотрахеальной трубки до поражения: больше 4 см
Расстояние от кончика волокна до поражения (бесконтактное): 4 мм
Расстояние от бронхоскопа до кончика волокна: 4 мм
Концентрация кислорода во вдыхаемом воздухе: меньше 40 %
Мощность (ватт) - бесконтактная: 40 Вт
Мощность (ватт) - контактная: 4 Вт
Продолжительность импульса: 0,4 секунды
Количество пульсов между очистками: 40
Время в операционной: менее 4 часов
Лазерный метод: 4.
При лазерной резекции вапоризация ткани происходит немедленно, а глубина разрушения ткани обычно составляет 3-4 мм. Отличные знания в области анатомии необходимы для предотвращения осложнений, таких как перфорация крупных сосудов.
Поскольку глубину разрушения ткани нельзя точно оценить по внешнему виду поверхности ткани, следует проявлять особую осторожность, направляя лазерный луч параллельно бронхиальной стенке, чтобы избежать повреждения. Чтобы получить неподвижный участок для точной локализации лазерного луча, предпочтительнее использовать общую анестезию с нервно-мышечными релаксантами, чтобы избежать перемещений (например, при кашле).[57][67]
Единственным абсолютным противопоказанием является изолированное экстрабронхиальное заболевание.
В целом, лазерная резекция имеет вероятность возникновения осложнений менее 3 %.
К осложнениям относятся перфорация (дыхательных путей, пищевода или легочной артерии), сердечные аритмии, пневмоторакс (напряжение и отсутствие напряжения), кровотечение, гипоксемия, инфаркт миокарда, инсульт, воздушная эмболия (на фоне выходящего из наконечника зонда под давлением газа и пересекающего слизистые оболочки в кровеносные сосуды через бронхолегочные фистулы, которые образуются путем коагуляции ткани)[58] и эндобронхиальная вспышка. Поэтому рекомендуется, чтобы концентрация кислорода во вдыхаемом воздухе не превышала 40 % во время процедуры.
Несмотря на отсутствие рандомизированных исследований для сравнения лазерной терапии Nd:YAG с другими формами лечения ОНДП, несколько ретроспективных исследований показали успешные результаты.[1][16][88][89][90]
Электрохирургия (электрокаутеризация)[1][2][16][17][18][21][59][60][80][84][86][91][92][93]
Использование электрического тока для нагрева и разрушения ткани.
Бесконтактный или контактный метод, при котором высокочастотный переменный электрический ток применяется к ткани дыхательных путей для облегчения злокачественной и незлокачественной ОНДП.[Figure caption and citation for the preceding image starts]: Сужение анастомоза бронха после трансплантации легкогоИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
 [Figure caption and citation for the preceding image starts]: Сужение анастомоза бронха после трансплантации легкого: лучевое рассечение электрическим токомИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
[Figure caption and citation for the preceding image starts]: Сужение анастомоза бронха после трансплантации легкого: лучевое рассечение электрическим токомИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].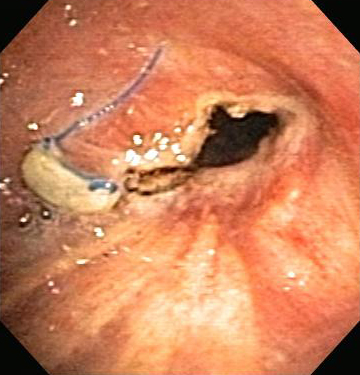
Влияние на ткань дыхательных путей зависит от использованной мощности, времени применения, площади контактной поверхности и типа ткани. Тепло, генерируемое электрическим током, пропорционально связано с резистентностью ткани и обратно пропорционально васкуляризации ткани и содержанию влаги.
Может использоваться в чрезвычайных ситуациях и является отличным инструментом для быстрой эндобронхиальной циторедукции с зарегистрированной скоростью восстановления просвета около 90 %, а также ослаблением симптомов на 70-97 %.
Есть несколько инструментов для применения электрокоагуляции в дыхательных путях: например, жесткие зонды для электрокоагуляции и щипцы. Для гибкой бронхоскопии доступны петли для электрокоагуляции, нож, тупые зонды и горячие щипцы.
Обычно установка мощности от 10 Вт до 40 Вт используется с тупыми зондами, и от 10 Вт до 40 Вт при использовании ловушки или ножа для электрокаутеризации.[94]
Противопоказаны при внешней компрессии дыхательных путей. У пациентов с кардиостимуляторами или автоматическими имплантированными кардиовертерами/дефибрилляторами из-за возможности развития аритмий или неисправности устройства, рекомендуется действовать с осторожностью, устройство должно быть по мере возможности отключено и должны быть клинические показания.
Риск кровотечения составляет 2-5 %. Другие осложнения включают в себя эндобронхиальную инициацию, электрошок для оператора, если нет соответствующего заземления, и перфорацию дыхательных путей. Потеря эффективности может возникать при кровотечении из-за диффузии тока по большей площади поверхности.
Как и в случае с лазерной кислорода во вдыхаемом воздухе должна быть ниже 40 %, чтобы избежать воспламенения дыхательных путей.
Аргоноплазменная коагуляция (АПК)[1][2][16][17][18][21][59][60][64][68][80][84][86]
Бесконтактный режим электрокоагуляции ткани, при котором ионизированный газообразный аргон используется для проведения электрического тока в ткани дыхательных путей при временном облегчении злокачественной ОНДП в рамках комбинированного лечения и для облегчения незлокачественных эндобронхиальный заболеваний, таких как грануляционная ткань и папилломатоз дыхательных путей.[Figure caption and citation for the preceding image starts]: Обструкция нижних дыхательных путей: злокачественная обструкция правого бронхаИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
 [Figure caption and citation for the preceding image starts]: Бронхоскопическая терапия для обструкции нижних дыхательных путей правого главного бронха: аргоноплазменная коагуляцияИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
[Figure caption and citation for the preceding image starts]: Бронхоскопическая терапия для обструкции нижних дыхательных путей правого главного бронха: аргоноплазменная коагуляцияИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].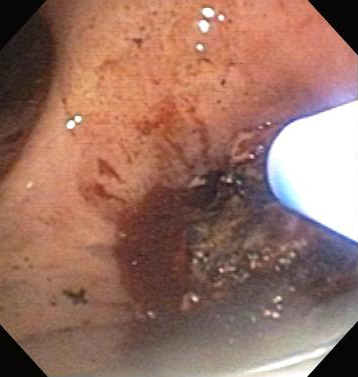
Все чаще используясь в качестве альтернативы лазерной терапии и электрохирургии, АПК является отличным инструментом для фотокоагуляции (гемостаза) со скоростью восстановления просвета 91 %.[95]
Прямые, радиальные и боковые воспламенительные зонды доступны для различных применений.
Обычно в вынужденном режиме используется мощность 30 Вт или 10 Вт в импульсном режиме. Рекомендуемый поток газа составляет от 0,3 литра в минуту до 0,8 литра в минуту.[94]
Несмотря на то, что ее преимуществом является способность достигать поражений, которые удалены от зонда, находятся «за углом» и под острым углом к зонду, АПК не вызывает вапоризацию опухоли, поэтому для циторедукции больших опухолевых новообразований необходимы другие методы. После применения АПК к эндобронхиальной опухоли оператор может удалить получающийся в результате ожоговый струп и продукты распада с помощью аспирации, форцепта или криоадгезии с помощью криозонда.
Противопоказаны при внешней компрессии дыхательных путей. У пациентов с кардиостимуляторами или автоматическими имплантированными кардиовертерами/дефибрилляторами из-за возможности развития аритмий или неисправности устройства, рекомендуется действовать с осторожностью, устройство должно быть по мере возможности отключено и должны быть клинические показания.
Вероятность возникновения осложнений менее 1 %. Осложнения включают кровотечение, перфорацию дыхательных путей и стеноз, эндобронхиальную инициацию и воздушную эмболию с газообразным аргоном. Концентрация кислорода во вдыхаемом воздухе должна быть ниже 40 % при использовании АПК, чтобы избежать воспламенения дыхательных путей.
Криотерапия[1][16][17][21][60][80][91][96]
Контактный метод, при котором криогенное вещество (чаще всего оксид азота) применяется к ткани дыхательных путей при лечении злокачественной и незлокачественной ОНДП без приближающейся дыхательной недостаточности.
Особенно эффективна при удалении посторонних предметов и сгустков крови (через криоадгезию), слизистых пробок, грануляционной ткани и полиповидных поражений с частотой восстановления просвета примерно на уровне 80 % и облегчением симптомов на уровне 70-93 %.
Большинство проявлений действия криохирургии не возникает в течение нескольких часов после лечения, а исторически использование криотерапии в дыхательных путях ограничено хронической или тяжелой обструкцией дыхательных путей. Большинство применений криотерапии было описано для слабо выраженного стеноза или в качестве дополнительной терапии. Максимальное разрушение ткани происходит через 1–2 недели, а для достижения желаемого эффекта рекомендовано повторное лечение.[97]
Истории болезни[98] и ретроспективные исследования показали, что использование криотерапии для криореканализации имеет немедленный эффект лечения. Большое ретроспективное исследование 225 случаев показало, что показатель эффективности составляет 91 % с гибким криозондом для криореканализации злокачественного стеноза с безопасным профилем.[99]
Влияние на ткань дыхательных путей зависит от количества циклов замораживания-размораживания, достигнутой температуры (обычно ниже -40 °C) и содержания воды в ткани, при этом максимальный эффект достигается при быстром замораживании и медленном размораживании. К криочувствительным тканям относят кожу, нервы, эндотелий, грануляционную ткань и слизистые оболочки. Соединительная и фиброзная ткань, оболочка нерва, хрящ и жир являются криорезистентными.
Безопасная процедура с немногими и относительно незначительными осложнениями, наиболее распространенными из которых являются послеоперационная лихорадка, а также шелушение дыхательных путей, которые требуют проведения повторных последующих бронхоскопий. Криотерапия вызывает ограниченное повреждение стенки бронха без остаточного стеноза и значительно снижает риск перфорации дыхательных путей.
Нетермические эндоскопические вмешательства в дыхательные пути
Фотодинамическая терапия (ФДТ)[1][16][17][21][59][60][80]
Свет с определенной длиной волны (из калий-титанил-фосфат [КТФ] лазера) применяется к поражению через гибкий бронхоскоп через 24-72 часа после локального или системного введения фотосенсибилизирующего средства, такого как эфир дигематопорфирина (DHE). Это приводит к фототоксической реакции и разрушению опухоли, поскольку фотосенсибилизирующее средство поглощается преимущественно злокачественными клетками.
Сразу же и через 48 часов после процедуры выполняется обработка бронхоскопической раны (очистка и циторедукция области для удаления опухолевого мусора, оставшихся секреций и слизистой оболочки) для определения проходимости дыхательных путей и оценки необходимости дальнейшего лечения.
Показана при паллиативном лечении ОНДП без острой одышки и особенно эффективна при дистальных обструкциях из-за злокачественных полиповидных эндобронхиальных новообразований с минимальной внешней компрессией дыхательных путей. Может также назначаться пациентам, которые уже перенесли операцию, лучевую терапию или химиотерапию.
В связи с замедленной реакцией на лечение ФДТ не следует использовать при срочном лечении острой, тяжелой ОНДП.
Наиболее распространенным осложнением является светочувствительность кожи, которая длится в течение 4-6 недель; пациентам нужно посоветовать избегать воздействия солнца в течение этого времени. К другим осложнениям относят местный отек дыхательных путей, стриктуры, кровотечение и образование фистул, хотя ФДТ имеет более низкий риск перфорации дыхательных путей.
Проявления действия относительно длительные, а ФДТ, как было показано, уменьшает обструкцию дыхательных путей у 80 % пациентов.
Дилатация дыхательных путей
Дилатация стенозов дыхательных путей может быть достигнута путем вставки цилиндра жесткого бронхоскопа или дилатации баллона.
Жесткая бронхоскопическая дилатация дыхательных путей может использоваться в чрезвычайных ситуациях, поскольку может быть достигнута быстрая реканализация.[21][60][67] Дистальный конец жесткого бронхоскопа действует как штопор, расширяющий стеноз, или как машина для удаления сердцевины, проникающая через крупные обструктивные опухоли. Цилиндр бронхоскопа может использоваться для тампонирования кровоточивых поражений во время удаления опухоли. Через бронхоскоп можно вводить большие щипцы, чтобы облегчить механическую очистку массивных опухолей, удалить инородные тела или сгустки. Гибкий бронхоскоп можно использовать во время жесткой бронхоскопии для облегчения очистки ткани в угловатых или дистальных дыхательных путях. Эти методы, хотя они все еще широко используются, следует приберечь для наиболее тяжелых случаев.[28]
Баллонная бронхопластика (ББП) может быть выполнена во время жесткой или гибкой бронхоскопии с выполнением рентгеноскопии или без нее, и подразумевает использование баллонов с гораздо большим диаметром, которые заполнены солевым раствором и удерживаются в положении в течение 15-60 секунд для мягкого расширения дыхательных путей.[1][17][21][100][101] Она вызывает меньшую, по сравнению с жестким расширением, травму слизистой оболочки и последующее образование грануляционной ткани. Балонная трахопластика и бронхопластика могут использоваться при злокачественных и незлокачественных ОНДП, стенозах после хирургических резекций и трансплантации легких, а также при стенозе трахеи после интубации. ББП приводит к немедленному улучшению внешней и внутренней злокачественной ОНДП у 79 % пациентов и эффективна при расширении дыхательных путей перед стентированием. Поскольку проявления действия являются недлительными, за ББП дилатацией обычно следуют другие виды терапии, такие как лазерная резекция, лучевая терапия или стентирование. Осложнения включают рецидив стеноза, боль, медиастинит и кровотечение, а также изнашивание или разрывы дыхательных путей с последующим пневмотораксом или эмфиземой средостения.[Figure caption and citation for the preceding image starts]: Сужение анастомоза бронха после трансплантации легкогоИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
 [Figure caption and citation for the preceding image starts]: Стеноз анастомоза бронха после трансплантации легкого: балонная бронхопластикаИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
[Figure caption and citation for the preceding image starts]: Стеноз анастомоза бронха после трансплантации легкого: балонная бронхопластикаИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].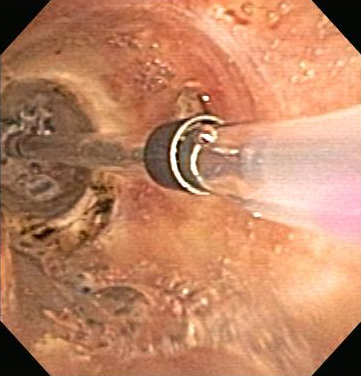
Стенты дыхательных путей[2][102][103]
Эндобронхиальные протезы из различных материалов могут использоваться для поддержки и сохранения проходимости дыхательных путей. В настоящее время в дыхательных путях широко используются два типа стентов (силиконовые и металлические или гибридные), при этом чаще используется силиконовый стент, который вставляется при жесткой бронхоскопии.
Силиконовые стенты (например, стент Дюмона, Т-образный стент Монтгомери, стент Hood, тайгоновый стент Reynders-Noppen) осложняются высокой скоростью миграции и обструкцией путем образования грануляционной ткани на концах стента или слизистыми выделениями из-за нарушенного мукоцилиарного клиренса.[1][64][68][104][Figure caption and citation for the preceding image starts]: Рентгенография грудной клетки, показывающая окклюзию эндобронхиального стента правого главного бронха из-за слизиИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
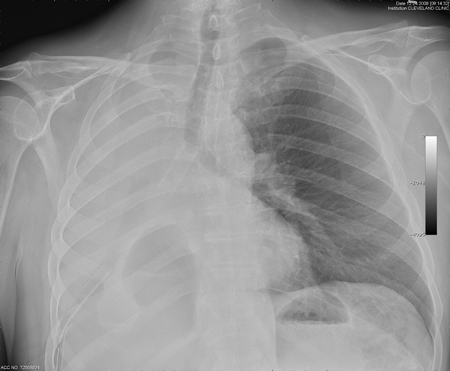
Силиконовые стенты могут использоваться при доброкачественных и злокачественных заболеваниях и являются предпочтительным типом стента для доброкачественных заболеваний дыхательных путей.[4]
Силиконовый Y-образный стент Дюмона особенно эффективен при злокачественных заболеваниях с участием киля и главных бронхов. Один ретроспективный анализ показал безопасность и эффективность нового типа саморасширяющегося металлического Y-образного стента.[105]
Теоретически гибридные стенты сочетают в себе свойства силиконовых и металлических стентов (например, стент Wallstent, стент Ultraflex, стент Polyflex, стент Alveolus). Они доступны в открытых (металлические стенты) и закрытых (гибридные металлические стенты) вариантах. Преимущество закрытых гибридных стентов заключается в обеспечении механического барьера для прорастания опухоли внутрь.
Показаны при лечении наружной злокачественной обструкции и сохранения проходимости дыхательных путей после удаления внутренней или смешанной злокачественной эндоскопической опухоли. Несмотря на то, что используется при резистентном стенозе после трансплантации легкого, стентирование применяется только при других формах злокачественной ОНДП, если другие методы лечения не подходят, поскольку вероятность возникновения осложнений стентирования в таких условиях составляет 75 %.[106][107][Figure caption and citation for the preceding image starts]: Обструкция нижних дыхательных путей: злокачественная обструкция правого бронхаИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
 [Figure caption and citation for the preceding image starts]: Бронхоскопическая терапия для обструкции нижних дыхательных путей правого главного бронха: размещение стентаИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
[Figure caption and citation for the preceding image starts]: Бронхоскопическая терапия для обструкции нижних дыхательных путей правого главного бронха: размещение стентаИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].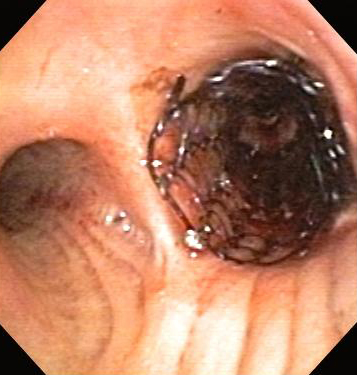
Хотя саморасширяющиеся металлические стенты относительно легко разворачиваются без необходимости проведения жесткой бронхоскопии, их осложнения могут быть тяжелыми, а их использование при доброкачественных заболеваниях должно быть осторожным. На самом деле, в 2005 году Управление по контролю за продуктами и лекарствами выпустило предупреждение о том, что при доброкачественных заболеваниях следует избегать использование металлических стентов.
Обеспечивают оперативное и длительное облегчение, при этом облегчение симптомов достигается у 84 % пациентов.[108] Трахеобронхиальные стенты, как было показано, улучшают качество жизни и повышают уровень выживания у пациентов с запущенной злокачественной обструкцией.[104][109][110][111]
Связаны с высокой вероятностью возникновения осложнений, особенно при длительном использовании металлических или гибридных стентов.[19] В дополнение к вышеупомянутым осложнениям, стенты также могут быть связаны с галитозом, переломом стента, усталостью металла, перфорацией дыхательных путей и сосудов, разрывами слизистой оболочки и обструкцией лобарных отверстий.[18][64][68][112]
Каждому пациенту со стентов дыхательных путей следует выдать карточку "уведомлений о стентировании". В ней следует указать тип и размер стента, расположение и соответствующий размер эндотрахеальной трубки, которая должна использоваться, если потребуется экстренная интубация в случае трахеальных стентов.[113]
Управляемое вращающееся лезвие приводит к тщательному удалению поврежденных частей при обструкции. Одновременное всасывание позволяет быстро удалять кровь и некротические ткани с минимальным повреждением дыхательных путей, хотя удаляемая ткань может не подходить для патологического обследования.
Лезвие микродебридера может быть гладким или зубчатым и имеет 2 длины: 37 см для доступа к повреждениям трахеи и наиболее проксимальным главных бронхам и 45 см для более удаленных поражений. Обычная скорость лезвия составляет 1000-2000 об/мин.
Может использоваться для терапии подсвязочного стеноза, а также грануляционной ткани и злокачественных заболеваний в трахее, главных бронхах и нижнедолевых бронхах.[Figure caption and citation for the preceding image starts]: Обструкция нижних дыхательных путей: злокачественная обструкция правого бронхаИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
 [Figure caption and citation for the preceding image starts]: Бронхоскопическая терапия для обструкции нижних дыхательных путей правого главного бронха: постмеханическая циторедукцияИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].
[Figure caption and citation for the preceding image starts]: Бронхоскопическая терапия для обструкции нижних дыхательных путей правого главного бронха: постмеханическая циторедукцияИз коллекций Хосе Фернандо Сантакруза, дипломированного врача, члена Американской коллегии специалистов в области торакальной медицины, DAABIP, и Эрика Фолка, дипломированного врача, магистра наук; используется с разрешения [Citation ends].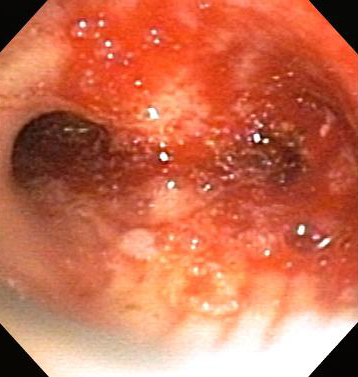
Может быть хорошим решением для пациентов с недостаточным резервным объёмом легких, поскольку нет необходимости уменьшать долю кислорода во вдыхаемом воздухе во время циторедукции опухоли.
Для достижения гемостаза у 35 % пациентов может потребоваться добавление электрокаутеризации.
Одно ретроспективное исследование показало, что микродебридер безопасен и эффективен в лечении доброкачественной и злокачественной обструкции нижних дыхательных путей.[116]
Лучевые (близкофокусная лучевая терапия) эндоскопические вмешательства в дыхательные пути
Эндобронхиальная доставка излучения достигается путем размещения радиоактивного вещества (чаще всего иридия-192) непосредственно в опухоль дыхательных путей или в непосредственной близости от нее при помощи гибкого бронхоскопа. Это приводит к разрушению ткани посредством мутаций ДНК, которые приводят к апоптозу клеток.[1][16][17][21][59][60][80][91]
Близкофокусная лучевая терапия показана при облегчении симптомов (в частности одышки, кашля и кровохарканья), связанных с обструкцией дыхательных путей. Высокодозовая эндобронхиальная близкофокусная лучевая терапия также эффективна в лечении образования чрезмерной грануляционной ткани после трансплантации легких на месте анастомоза или в качестве осложнения стентирования дыхательных путей.[14][117][118]
Поскольку близкофокусная лучевая терапия может быть эффективной при использовании в течении 3 недель, ее не следует использовать при срочном лечении острой, тяжелой ОНДП. Проявления действия близкофокусной лучевой терапии являются продолжительными и имеют зарегистрированную скорость восстановления просвета 78-85 %, а также ослабление симптомов на уровне 69-93 %.[7]
Преимущество близкофокусной лучевой терапии заключается в том, что она может использоваться для опухолей в областях (например, бронхи верхней доли и бронхи третьего порядка), которые недоступны для других методов лечения. Доставка близкофокусной лучевой терапии осуществляется с помощью эндобронхиальных методов с низкой мощностью дозы (LDR) или с высокой мощностью дозы (HDR). Эндобронхиальная близкофокусная лучевая терапия высокой дозы может доставлять более высокие дозы лучевой терапии за меньшее время на каждую фракцию, что позволяет использовать ее в амбулаторных условиях.
Близкофокусная лучевая терапия может использоваться в комбинации с другими методами, такими как лазерная терапия или дистанционная лучевая терапия, с которыми она создает синергетический эффект воздействия.
К осложнениям этого метода относят кровотечение (в частности, в правую и левую верхние доли и часто с массивным кровохарканьем), образование свищей в средостении, аритмии, гипотензию, бронхоспазм, стеноз или некроз бронхов и лучевой бронхит. Смертельная кровопотеря была описана в 32 % случаев; тем не менее, трудно отличить кровотечение, вызванное лучевой терапией, и кровотечение, вызванное самой опухолью.
Внешняя лучевая терапия (ВЛТ)
Хотя традиционное лечение рака легких и считается предпочтительным для пациентов с неоперабельным не мелкоклеточным раком легкого, ВЛТ непостоянно эффективна только для злокачественной ОНДП, а ее проявления замедленные и ненадежные.
Учитывая последние достижения в области интервенционной бронхоскопии, лечение пациентов со злокачественной ОНДП переключается с ВЛТ на бронхоскопию, поэтому в центрах с возможностями интервенционной пульмонологии последнюю следует рассматривать как терапию первой линии.[1][59][60] Иногда ВЛТ можно проводить у стабильного пациента с улучшенным функциональным статусом после бронхоскопического вмешательства для подтверждения воздействия этого лечения.
Основным ограничивающим фактором ВЛТ является нежелательная лучевая нагрузка нормальной ткани, включая паренхиму легких, сердца, позвоночника и пищевода. Примерно у 50 % пациентов, которых лечили при помощи ВЛТ для местного контроля, развивается прогрессирование заболевания в поле облучения.
Показатель эффективности лечения при помощи ВЛТ при кровохарканье составляет 84 %, хотя она эффективна только для лечения обструкции дыхательных путей и ателектаза примерно у 20 % пациентов.
Хирургическое лечение
Хотя хирургическое вмешательство является наилучшим методом лечения как злокачественных, так и незлокачественных ОНДП, оно возможно только в нескольких случаях из-за степени злокачественного заболевания при первичном обследовании, характера доброкачественного заболевания и наличия сопутствующих медицинский показаний, которые делают многих пациентов несоответствующими для проведения хирургического вмешательства.[66][119]
Хирургическое лечение доброкачественной ОНДП является узкоспециализированным полем и должно выполняться торакальным хирургом со значительным опытом в проведении сложных операций на дыхательных путях.[120] Целью операции является либо увеличение размера доступных дыхательных путей, либо удаление характеризующегося сужением участка. Таким образом, наиболее распространенными операциями являются анастомоз по типу "конец в конец" или циркулярная резекция трахеи.
Злокачественная обструкция дыхательных путей
Хирургия - это предпочтительный метод лечения для немелкоклеточного рака легкого (НМКРЛ) на ранней стадии с уровнем выживания в течение 5 лет более 70 %, который наблюдается на стадии IA заболевания.[59][30][121] Поскольку 80 % пациентов имеют III или IV стадию, общий уровень выживания в течение 5 лет составляет всего 4 %.[59][121][122] Таким образом, для большинства пациентов с прогрессирующим раком легких лечение сосредоточено на временном облегчении симптомов и улучшении качества жизни.
Не злокачественная обструкция дыхательных путей
Хотя хирургическая резекция и анастомоз являются предпочтительными методами лечения при доброкачественных стриктурах трахеи, резекция трахеи возможна только у примерно 50 % пациентов, которые при прочих равных условиях пригодны для хирургического вмешательства, и пока еще не разработаны соответствующие требованиям протезы, позволяющее провести более обширную резекцию трахеи.[119]
Использование этого контента попадает под действие нашего заявления об отказе от ответственности