Abordagem
A tríade patológica consiste em eosinofilia dos tecidos, inflamação granulomatosa e vasculite. A granulomatose eosinofílica com poliangiite (GEPA) deve ser considerada em pacientes com asma refratária quando estiver associada a uma eosinofilia >10% da contagem leucocitária, ou quando estiver associada a outros sinais ou sintomas de inflamação sistêmica. Ela também deve ser considerada em qualquer investigação de hipereosinofilia e em pacientes que apresentem uma forma não especificada de vasculite. As metas de qualquer investigação diagnóstica são:
Estabelecer o diagnóstico de modo definitivo
Estabelecer a extensão e a gravidade do envolvimento dos órgãos para orientar o tratamento
Definir a linha basal e estabelecer os marcadores para avaliar a resposta ao tratamento.
A EGPA Consensus Task Force, um grupo comissionado pela European Respiratory Society e Foundation for the Development of Internal Medicine na Europa, publicou uma declaração de consenso sobre o manejo e tratamento da GEPA, incluindo uma investigação de diagnóstico diferencial detalhada.[28] Para pacientes que têm asma, eosinofilia e evidências de inflamação eosinofílica (por exemplo, miocardite), mas sem evidências de vasculite bem definida, a força-tarefa da European Respiratory Society para granulomatose eosinofílica com poliangiite (Churg-Strauss) sugeriu que o termo "asma hipereosinofílica" com (quaisquer) manifestações sistêmicas seja usado em vez de GEPA.[29]
História
Geralmente, os pacientes apresentam uma história de asma, rinite alérgica ou sinusite, com sintomas como dispneia, tosse e sibilância. Esses sintomas pulmonares podem ser uma manifestação da asma. No entanto, eles podem refletir uma hemorragia alveolar subjacente, a qual pode estar acompanhada de hemoptise ou de doença tromboembólica. Os pacientes podem apresentar um novo episódio de deficit sensorial ou motor, o que sugere uma mononeurite múltipla, com um novo episódio de fraqueza, como pé caído, ou um novo episódio de dormência de um membro. Uma erupção cutânea purpúrea dos membros é comumente observada em decorrência da vasculite. Frequentemente, esse envolvimento cutâneo permite que o diagnóstico da vasculite seja feito com uma biópsia da pele. Esses achados clínicos podem se sobrepor e podem variar conforme os pacientes e os sintomas. Outros sintomas incluem fadiga, artralgias e mialgias, ou obstrução ou secreção nasal. Cerca de um terço dos pacientes pode ter dor abdominal em razão de esofagite, gastrite, colite, colecistite ou vasculite do trato biliar.
Diversos medicamentos foram associados à GEPA. Entre eles, estão os antibióticos macrolídeos e a quinidina. A possibilidade de os antagonistas do receptor do leucotrieno apresentarem qualquer risco de GEPA é controversa. As evidências sugerem que esses agentes revelam uma GEPA subjacente não reconhecida anteriormente, seja facilitando a supressão glicocorticoide sistêmica, permitindo desse modo que a síndrome se desenvolva por completo, ou impedindo o controle da doença conforme os sintomas do paciente evoluem.[18][19][20]
Exame físico
Uma avaliação clínica dos pacientes com dispneia pode demonstrar uma taquipneia com sibilância associada à asma, estertores associados à insuficiência cardíaca e à hemorragia alveolar pulmonar, ou murmúrios vesiculares distintos associados a doença tromboembólica. Outros achados físicos de insuficiência cardíaca incluem ortopneia, edema periférico e refluxo hepatojugular, e podem ocorrer em uma circunstância incomum de cardiomiopatia vasculítica, o que causa insuficiência cardíaca. Uma erupção cutânea purpúrea palpável com petéquias pode ser observada, bem como nódulos cutâneos devidos a granulomas. Os deficits motores ou sensoriais isolados, como pé caído, sugerem uma mononeurite múltipla. Esses achados clínicos podem se sobrepor e podem variar conforme os pacientes e os sintomas. Uma secreção nasal hemorrágica e purulenta ou uma dor facial podem ser a manifestação de uma doença do trato sinusal. Pólipos nasais, obstrução nasal e episódios recorrentes de sinusite podem ser observados.
Exames laboratoriais
Nenhum exame de sangue é específico para o diagnóstico da GEPA. Os exames devem incluir:
Um hemograma completo com diferencial para avaliar a contagem de eosinófilos, a qual tipicamente é >10% da contagem leucocitária.
Anticorpos anticitoplasma de neutrófilo (ANCA): aumentam em 30% a 40% dos pacientes com GEPA. Geralmente, um padrão positivo para mieloperoxidase de ANCA perinuclear.[4][5][16]
Velocidade de hemossedimentação e proteína C-reativa como marcadores gerais de inflamação. No contexto de uma vasculite, eles geralmente estão elevados e podem ser acompanhados para avaliar a resposta ao tratamento.
Bioquímica sérica, com foco na ureia e na creatinina, e urinálise, as quais são úteis para avaliar o envolvimento renal.
Geralmente, a imunoglobulina E (IgE) sérica está elevada na GEPA. Se estiver elevada, testes adicionais específicos da IgE e IgG para Aspergillus devem ser realizados para descartar a possibilidade de aspergilose broncopulmonar alérgica.[28]
Teste de vírus da imunodeficiência humana (HIV), já que o HIV pode causar eosinofilia leve.[28]
Os exames para obter o diagnóstico diferencial de síndrome hipereosinofílica idiopática incluem os testes moleculares para a mutação FIP1L1/PDGFR alfa (causando a formação de uma tirosina quinase nova, que pode ser terapeuticamente alvejada por imatinibe) e citometria de fluxo. Esses exames são realizados rotineiramente em alguns centros de cuidados de nível terciário e devem ser considerados em pacientes com achados vasculíticos mais sutis. Ocasionalmente, é necessário realizar uma biópsia da medula óssea.[30][31] Esse procedimento também não é realizado rotineiramente, exceto em centros de cuidados de nível terciário, e deve ser considerado em pacientes com achados vasculíticos mais sutis.
Em um contexto clínico apropriado, pode ser necessário realizar coproculturas para excluir uma infecção parasitária. A sorologia para Toxocara também deve ser considerada.[28]
A eotaxina-3 é um marcador sérico emergente que está elevado na GEPA ativa, mas ainda não é medido na prática clínica de rotina.[32][33]
Antes de iniciar o uso de azatioprina, geralmente deve-se verificar os níveis de tiopurina metiltransferase nos pacientes, quando disponíveis, para garantir que eles tenham níveis de enzima suficientes para metabolizar o medicamento.
Exames fisiológicos e de imagem
Geralmente, o teste de função pulmonar mostrará uma obstrução reversível das vias aéreas compatível com asma, que coexiste em muitos casos.
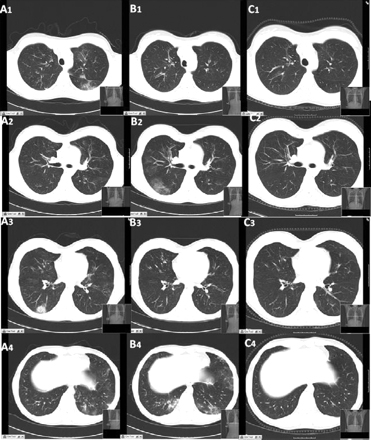
Deve-se realizar uma radiografia torácica em todos os pacientes com o objetivo de encontrar qualquer evidência que seja compatível com pneumonia eosinofílica ou com hemorragia alveolar. Se forem observadas anormalidades, o paciente deverá realizar uma TC do tórax.[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) do tórax obtida (A) durante a exacerbação dos sintomas, revelando infiltrados pulmonares no lobo inferior direito (A3) e no lobo inferior esquerdo (A4). Uma reavaliação feita 15 dias depois (B) revelou a natureza migratória das lesões, com o desaparecimento completo dos infiltrados descritos anteriormente e a presença de novas áreas com opacidade em vidro fosco dentro do lobo inferior direito (B2) e do segmento lingular esquerdo e do lobo inferior esquerdo (B4). (C) Seis meses após o tratamento, todas as lesões pulmonares descritas estavam completamente curadasBMJ Case Reports 2009; doi:10.1136/bcr.04.2009.1731. Copyright © 2011 by the BMJ Publishing Group Ltd [Citation ends].
Nos casos em que houver uma alta suspeita de GEPA, ou uma GEPA conhecida com dispneia, os pacientes deverão se submeter a um eletrocardiograma (ECG) para rastrear um possível envolvimento cardíaco.[24][34]
O papel da ressonância nuclear magnética (RNM) cardíaca ainda está sendo investigado.
Pacientes com GEPA ativa apresentam aumento do risco de doença tromboembólica. Deve-se realizar uma ultrassonografia dos membros inferiores ou uma angiotomografia dos pulmões, se clinicamente indicado.[35][36]
Pode-se estabelecer um diagnóstico presuntivo de mononeurite múltipla com base em uma eletromiografia, que pode ser um marcador alternativo da vasculite.
Patologia
Quando possível, deve-se obter uma biópsia tecidual para verificar se há alguma evidência de vasculite. Geralmente, esse procedimento deve ser realizado a partir do órgão mais acessível. Uma biópsia de lesão cutânea purpúrea é o procedimento mais frequente. Geralmente, ela mostra uma vasculite leucocitoclástica. O comprometimento grave dos rins ou pulmões indicaria a necessidade de terapia agressiva e as amostras devem ser provenientes destes órgãos, se houver dúvidas quanto ao seu comprometimento. Uma hemorragia alveolar pode ser diagnosticada com uma broncoscopia com lavagem broncoalveolar (LBA) no contexto clínico correto. O achado característico seria de alíquotas sanguíneas do líquido do lavado, com ou sem macrófagos com depósito de hemossiderina elevados. Um diagnóstico de vasculite é raramente feito com uma biópsia transbrônquica.
A pneumonia eosinofílica pode ser diagnosticada na broncoscopia com base em uma alta contagem de eosinófilos na LBA, ou inflamação eosinofílica na biópsia transbrônquica.[Figure caption and citation for the preceding image starts]: Avaliação histológica de uma amostra de biópsia pulmonar, revelando a presença de um infiltrado inflamatório, composto predominantemente por eosinófilos encontrados dentro do lúmen vascular e da parede vascularBMJ Case Reports 2009; doi:10.1136/bcr.04.2009.1731. Copyright © 2011 by the BMJ Publishing Group Ltd [Citation ends]. [Figure caption and citation for the preceding image starts]: Exame citológico do líquido da lavagem broncoalveolar, revelando a presença de uma grande predominância de eosinófilos (A), representando 27% dos elementos celulares. Os outros elementos celulares encontrados foram macrófagos (C) e linfócitos (B)BMJ Case Reports 2009; doi:10.1136/bcr.04.2009.1731. Copyright © 2011 by the BMJ Publishing Group Ltd [Citation ends].
[Figure caption and citation for the preceding image starts]: Exame citológico do líquido da lavagem broncoalveolar, revelando a presença de uma grande predominância de eosinófilos (A), representando 27% dos elementos celulares. Os outros elementos celulares encontrados foram macrófagos (C) e linfócitos (B)BMJ Case Reports 2009; doi:10.1136/bcr.04.2009.1731. Copyright © 2011 by the BMJ Publishing Group Ltd [Citation ends].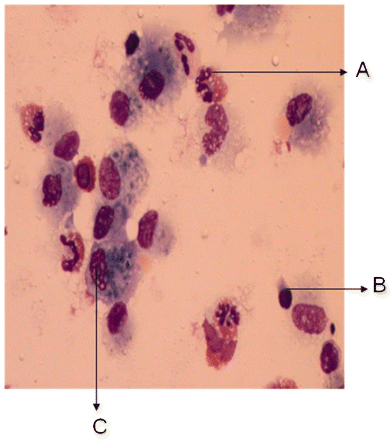
O uso deste conteúdo está sujeito ao nosso aviso legal