Abordagem
Os pacientes podem apresentar deficits neurológicos focais de acordo com a localização do tumor, ou sinais de hipertensão intracraniana (por exemplo, cefaleia, diminuição da consciência ou náuseas e vômitos). No entanto, pode ser difícil distinguir clinicamente entre os diferentes gliomas, entre estes e outros tipos de tumor cerebral, ou entre tumores e afecções neurológicas benignas mais comuns que apresentam sinais e sihotomas semelhantes.[20] Sintomas neurológicos rapidamente progressivos podem, no entanto, refletir uma evolução mais agressiva.
Quando se suspeita de tumor cerebral, devem ser realizados exames de imagem confirmatórios com ressonância magnética com contraste. Em última análise, o tecido obtido de uma biópsia ou ressecção cirúrgica é necessário para o diagnóstico, com base tanto em informações histopatológicas quanto moleculares.[20][21][22][23][24]
Deficits neurológicos de acordo com a localização
Frontal:
Alteração de personalidade
Declínio cognitivo
Instabilidade emocional
Afasia não fluente (se o giro frontal inferior dominante estiver envolvido)
Deficit motor (giro pré-central)
Temporal:
Deficit do campo visual
Afasia fluente (se o lobo dominante estiver envolvido)
Parietal:
Deficits sensoriais
Lobo parietal inferior do lado dominante: afasia expressiva
Superior: síndrome de Gerstmann (acalculia, agnosia digital, confusão esquerda-direita, alexia sem agrafia)
Lado não dominante: negligência, anosognosia
Deficit do campo visual
Occipital:
Hemianopsia homônima contralateral
Cerebelo:
Vermis: ataxia de tronco
Hemisfério: dismetria ipsilateral, nistagmo
Tronco encefálico:
Paralisias do nervo craniano (NC)
NC III, IV, VI: diplopia
NC V: distúrbios sensitivos faciais
NC VII: paralisia facial
NC VIII: problemas de audição ou equilíbrio
NC IX: problemas sensoriais na garganta, problemas de deglutição
NC X: alteração da voz (isto é, rouquidão), problemas de deglutição
NC XI: fraqueza dos músculos esternocleidomastoideo e trapézio
NC XII: desvio da língua
Nistagmo
Sinais cerebelares
Sinais de trato longo
Lesões óptico-hipotalâmicas:
Deficit do campo visual
Excesso ou deficiência de hormônios hipofisários
Síndrome hipotalâmica
Medula espinhal (achados abaixo do nível da lesão)
Motor (perda de força ipsilateral, hiper-reflexia, clônus, espasticidade)
Sensorial (sensibilidade tátil ipsilateral, propriocepção, deficits de vibração/dor contralateral e deficits de temperatura)
Alterações autonômicas
Síndromes medulares (central, de Brown-Sequard, posterior, anterior)
Dor dorsal
Dor radicular
Distúrbios esfincterianos
Convulsão
Uma revisão relatou que 75% a 80% dos pacientes com gliomas de baixo grau têm convulsões, em comparação com 29% a 60% dos pacientes com glioblastomas.[25]
Hipertensão intracraniana e edema vasogênico
Os pacientes podem apresentar cefaleia, náuseas, vômitos, diplopia e/ou diminuição do nível de excitação. Eles também podem apresentar sinais de hipertensão intracraniana (paralisia do sexto [VI] nervo e papiledema).
Avaliação laboratorial
Um exame dos hormônios do eixo hipotálamo-hipofisário deve ser solicitado se houver uma lesão na região hipotalâmica ou hipofisária conhecida ou se o paciente apresentar sintomas ou sinais sugestivos de hipopituitarismo.
Ressonância nuclear magnética
A ressonância nuclear magnética (RNM) com gadolínio é a modalidade de exame de imagem de escolha para a avaliação de gliomas, antes e depois da biópsia ou ressecção cirúrgica, e como método de vigilância para detectar a progressão de tumores previamente tratados.[21][22][24][26][27][28][29]
Nos gliomas de alto grau, as áreas de realce com gadolínio correspondem a regiões de aumento da vascularização ou proliferação endotelial e aumento da permeabilidade da barreira hematoencefálica. Áreas de aumento do sinal de recuperação de inversão atenuada por fluidos (FLAIR) em T2 geralmente correspondem a áreas infiltradas não necróticas do tumor, embora possam também estar associadas a edema peritumoral ou alterações da substância branca induzidas por radiação. Os gliomas com mutação na isocitrato desidrogenase (IDH) de baixo grau (grau 2) são mais comumente sem realce e detectados por áreas de aumento do sinal T2-FLAIR.[21][22]
Os gliomas são lesões intra-axiais frequentemente centradas ou que se estendem ao longo dos tratos da substância branca.[Figure caption and citation for the preceding image starts]: Ressonância nuclear magnética (RNM) ponderada em T2 sem (A) e com (B) contraste demonstrando um glioma pontinoDo acervo de Karine Michaud, University of California, São Francisco [Citation ends]. [Figure caption and citation for the preceding image starts]: RNM: T2 e T1 pós-contraste, demonstrando glioma tectal (grau 2)Do acervo de Karine Michaud, University of California, São Francisco [Citation ends].
[Figure caption and citation for the preceding image starts]: RNM: T2 e T1 pós-contraste, demonstrando glioma tectal (grau 2)Do acervo de Karine Michaud, University of California, São Francisco [Citation ends].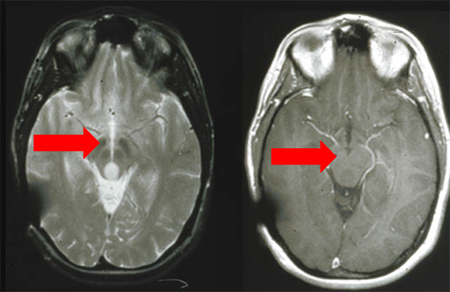 [Figure caption and citation for the preceding image starts]: RNM demonstrando um glioblastoma temporal direito (grau 4)Do acervo de Karine Michaud, University of California, São Francisco [Citation ends].
[Figure caption and citation for the preceding image starts]: RNM demonstrando um glioblastoma temporal direito (grau 4)Do acervo de Karine Michaud, University of California, São Francisco [Citation ends].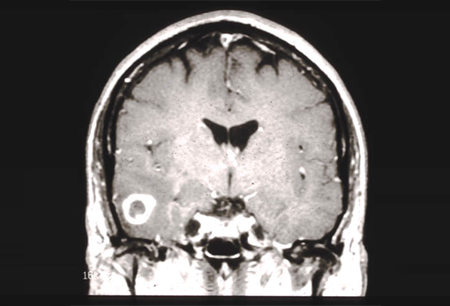 [Figure caption and citation for the preceding image starts]: RNM demonstrando um astrocitoma difuso frontal direito de grau 2Do acervo de Karine Michaud, University of California, São Francisco [Citation ends].
[Figure caption and citation for the preceding image starts]: RNM demonstrando um astrocitoma difuso frontal direito de grau 2Do acervo de Karine Michaud, University of California, São Francisco [Citation ends].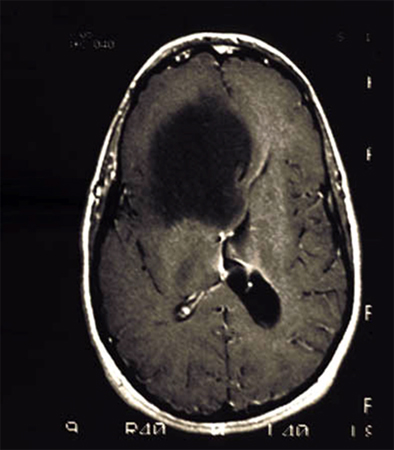 [Figure caption and citation for the preceding image starts]: RNM demonstrando um astrocitoma pilocítico cerebelar (grau 1)Do acervo de Karine Michaud, University of California, São Francisco [Citation ends].
[Figure caption and citation for the preceding image starts]: RNM demonstrando um astrocitoma pilocítico cerebelar (grau 1)Do acervo de Karine Michaud, University of California, São Francisco [Citation ends].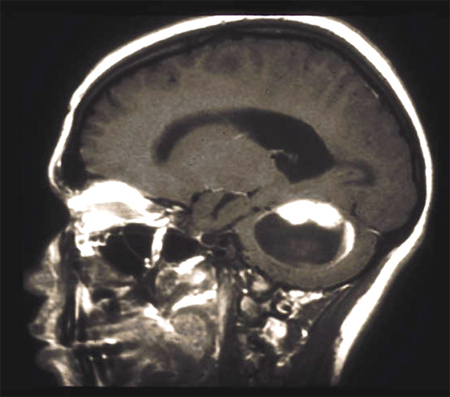
A espectroscopia por ressonância magnética (ERM) é frequentemente empregada para pesquisar determinadas áreas de aumento do sinal T2-FLAIR para metabólitos específicos.[21][22][27] Ela é utilizada para diferenciar entre tecido normal e neoplásico e auxiliar no diagnóstico, como ocorre quando é detectado o pico correspondente ao 2-hidroxiglutarato, metabólito resultante da atividade da mutação em IDH. A ERM pode também ser usada para diferenciar entre a verdadeira progressão do tumor e alterações de imagem relacionadas ao tratamento ou pseudoprogressão em pacientes com suspeita de glioblastoma progressivo.[26][27]
N-acetil-aspartato: pico mais alto no cérebro normal, marcador neuronal.
Colina: marcador de renovação da membrana celular; aumentos deste pico estão associados a malignidade.
Lactato: marcador de hipóxia; aumentos neste pico estão associados a malignidade.
A RNM com tensor de difusão produz mapas com codificação direcional dos tratos da substância branca cerebral.[21] A tractografia é comumente usada no planejamento pré-operatório para identificar estruturas subcorticais importantes, como o trato corticoespinhal (função motora) e fascículo arqueado (função da linguagem).
A RNM de perfusão fornece uma avaliação quantitativa do fluxo sanguíneo cerebral regional e do volume sanguíneo cerebral, refletindo a magnitude da angiogênese em um tumor, ajudando assim a diferenciar entre a progressão do tumor e alterações induzidas por radiação nas áreas de realce de tumores previamente tratados.[21]
A RNM funcional é o estudo de alterações regionais no fluxo sanguíneo relacionado à função e é usada no planejamento pré-operatório de tumores em locais eloquentes (áreas do cérebro que controlam a fala, a função motora e os sentidos).[21]
Tomografia computadorizada (TC)
A tomografia computadorizada (TC) pode ser uma modalidade de imagem útil para avaliar alterações macroscópicas no tamanho do tumor ou a presença de hemorragia intratumoral.
A TC não deve ser usada rotineiramente no diagnóstico e na vigilância de tumores cerebrais por causa da resolução e da qualidade de imagem superiores da RNM.[21] Ela poderá ser usada se a RNM não estiver disponível ou for contraindicada. A TC poderá ser solicitada se a apresentação for aguda e houver necessidade de descartar outros processos, como hérnia, AVC e hemorragia.
Avaliação oftalmológica
Uma avaliação oftalmológica, incluindo um teste do campo visual, poderá ser solicitada se houver sintomas ou sinais de perda da visão ou evidências de compressão do quiasma óptico à RNM.
Investigações histopatológicas
A ressecção ou biópsia para obtenção de tecido para análises histopatológicas deve ser realizada em todos os pacientes.
Se o tumor for considerado acessível, tenta-se uma ressecção máxima segura, salvo se os resultados da patologia por congelação revelarem linfoma primário do sistema nervoso central ou lesões com etiologias não neoplásicas. Para tumores inacessíveis à ressecção, ou se o paciente não for considerado clinicamente apto para uma operação demorada, deve-se realizar uma biópsia aberta ou estereotáxica.[21][22] As amostras de tecido são enviadas para análises histológicas e moleculares antes de se iniciar qualquer tratamento adicional.
Análises moleculares
A caracterização molecular do tecido obtido na ressecção ou biópsia é essencial para uma classificação precisa e para orientar as decisões de tratamento subsequentes. Os marcadores moleculares que devem ser investigados (dependendo do contexto clínico, dos resultados da histologia por congelação e achados de imagem) incluem mutação em IDH1 e IDH2, codeleção de 1p/19q, deleção de CDKN2A/B, mutação de ATRX, mutação de TP53, estado de metilação do promotor MGMT, amplificação de EGFR , ganho do cromossomo 7, perda do cromossomo 10, mutação do promotor TERT e mutação da histona H3.[1][21][22][23][24][27][30]
[Figure caption and citation for the preceding image starts]: Exames moleculares importantes para estabelecer o diagnóstico e o prognóstico do glioblastomaGritsch e cols. Cancer. 2022 Jan 1;128(1):47-58; usado com permissão [Citation ends].
O uso deste conteúdo está sujeito ao nosso aviso legal