Etiologia
A causa mais comum da acloridria é a gastrite atrófica crônica. A atrofia gástrica pode ser definida como a perda de glândulas (glândulas oxínticas) e/ou células parietais no fundo e corpo do estômago. As glândulas são normalmente substituídas por tecido conjuntivo (atrofia não metaplásica) ou estruturas glandulares inadequadas para a localização (atrofia metaplásica).[32]
As causas da atrofia gástrica são infecção por Helicobacter pylori, gastrite autoimune primária e uma combinação de H pylori com gastrite autoimune.[33] Diferentes perfis de microbioma gástrico foram relatados em pacientes com gastrite induzida por H pylori e aqueles com gastrite autoimune.[34]
Considera-se que a atrofia gástrica, com ou sem gastrite autoimune, seja iniciada na maioria das vezes por infecção por H pylori.[35][36][37][38] Propõe-se que a inflamação induzida por H pylori resulte na quebra da tolerância para autoantígenos (por exemplo, adenosina trifosfatase estimulada por hidrogênio-potássio [H+/K+ ATPase]) em indivíduos geneticamente suscetíveis ou que anticorpos sejam adquiridos devido ao mimetismo molecular entre o lipopolissacarídeo de H pylori e H+/K+ ATPase, ambos contendo epítopos de Lewis. A patologia mostra um infiltrado linfocítico inflamatório crônico da mucosa oxíntica inicialmente, acompanhado pela perda de células parietais e principais. Posteriormente, a atrofia acentuada das glândulas oxínticas desenvolve-se mostrando apenas agregados linfoides dispersos.
Outras causas da acloridria incluem antrectomia com vagotomia para úlcera péptica e gastrectomia subtotal para câncer. É importante observar que inibidores da bomba de prótons não inibem completamente a secreção de ácido ao longo de 24 horas devido à meia-vida plasmática relativamente curta (1 a 2 horas), ao tempo de residência limitado na circulação sistêmica e à regeneração de aproximadamente 25% das bombas todos os dias.[39][40][41]
Metaplasia intestinal gástrica
A atrofia gástrica está invariavelmente associada a algum grau de metaplasia intestinal (MI) gástrica e hipergastrinemia. A MI gástrica é uma condição pré-maligna com um pequeno aumento do risco anual de adenocarcinoma (0.1% a 0.2%), que se caracteriza por uma mudança na mucosa gástrica para um fenótipo de intestino delgado.[23][42] A infecção por H pylori é o fator de risco mais forte e consistente para MI gástrica (aumento do risco de três a oito vezes).[43][44]
Os dados observacionais sugerem uma associação entre sexo masculino, idade avançada, etnia não branca, tabagismo atual e maior presença de MI gástrica.[45] Entre os pacientes com MI gástrica, os pacientes do sexo masculino e aqueles com MI gástrica incompleta podem ter maior risco de desenvolver displasia ou câncer gástrico precoce.[46]
[Figure caption and citation for the preceding image starts]: Modelo ilustrativo da regulação fisiológica da secreção de ácido gástrico pela gastrina, histamina, somatostatina e ácido luminal. A gastrina, liberada pelas células G antrais, é o principal estimulante hormonal da secreção de ácido durante a ingestão de refeições. A gastrina age diretamente nas células parietais secretoras de ácido e, sobretudo, indiretamente estimulando a secreção de histamina pelas células ECL. A histamina se difunde para as células parietais adjacentes, onde se liga a receptores H2 de histamina reforçando a estimulação da secreção de ácido. Na fase interdigestiva, a somatostatina, liberada pelas células D antrais em resposta ao ácido luminal, promove a inibição tônica da secreção de gastrina pelas células G, mantendo, assim, a secreção de ácido em um nível economicamente baixo.Do acervo do Professor Mitchell L. Schubert, com o agradecimento de Mary Beatty-Brooks (ilustradora médica) [Citation ends]. [Figure caption and citation for the preceding image starts]: Modelo ilustrativo da fisiopatologia da acloridria e do desenvolvimento de tumores carcinoides gástricos. Com a acloridria, o efeito do ácido luminal de estimulação da somatostatina é perdido. Consequentemente, a secreção da somatostatina é diminuída e sua restrição inibitória na secreção de gastrina é atenuada (desinibição), resultando em hipergastrinemia. A gastrina não é apenas um secretagogo, mas é também um hormônio trófico que induz o crescimento da mucosa oxíntica. Se a hipergastrinemia for sustentada por dias, as células ECL apresentarão hipertrofia; se for sustentada por semanas a meses, as células ECL ficam hiperplásicas, displásicas e, em alguns pacientes, formarão tumores carcinoides.Do acervo do Professor Mitchell L. Schubert, com o agradecimento de Mary Beatty-Brooks (ilustradora médica) [Citation ends].
[Figure caption and citation for the preceding image starts]: Modelo ilustrativo da fisiopatologia da acloridria e do desenvolvimento de tumores carcinoides gástricos. Com a acloridria, o efeito do ácido luminal de estimulação da somatostatina é perdido. Consequentemente, a secreção da somatostatina é diminuída e sua restrição inibitória na secreção de gastrina é atenuada (desinibição), resultando em hipergastrinemia. A gastrina não é apenas um secretagogo, mas é também um hormônio trófico que induz o crescimento da mucosa oxíntica. Se a hipergastrinemia for sustentada por dias, as células ECL apresentarão hipertrofia; se for sustentada por semanas a meses, as células ECL ficam hiperplásicas, displásicas e, em alguns pacientes, formarão tumores carcinoides.Do acervo do Professor Mitchell L. Schubert, com o agradecimento de Mary Beatty-Brooks (ilustradora médica) [Citation ends].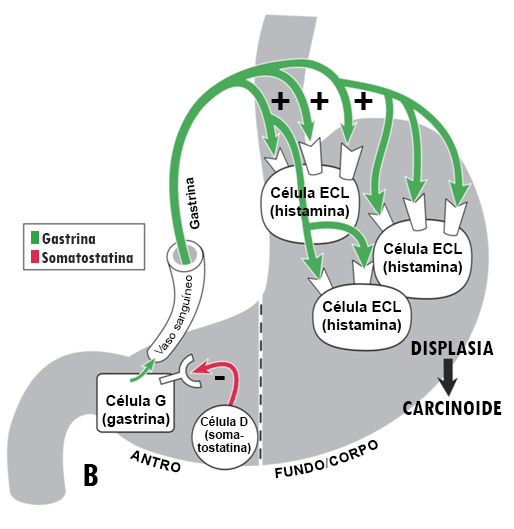 [Figure caption and citation for the preceding image starts]: Classificação dos tumores carcinoides gástricosHou W, Schubert, ML. Treatment of gastric carcinoids. Curr Treat Options Gastroenterol. 2007;10:123-133. Usado com permissão do Current Medicine Group LLC [Citation ends].
[Figure caption and citation for the preceding image starts]: Classificação dos tumores carcinoides gástricosHou W, Schubert, ML. Treatment of gastric carcinoids. Curr Treat Options Gastroenterol. 2007;10:123-133. Usado com permissão do Current Medicine Group LLC [Citation ends].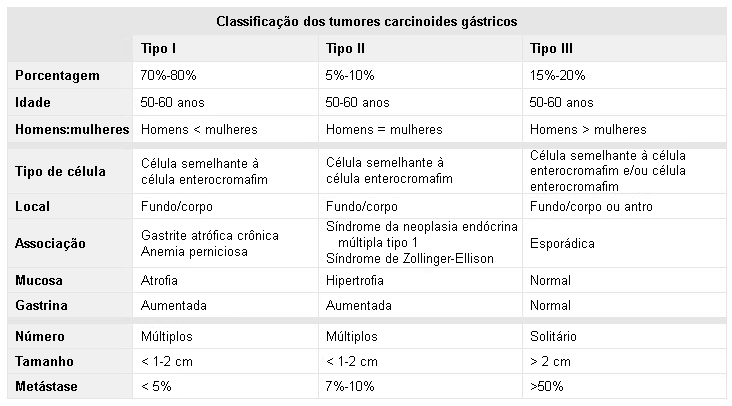
Fisiopatologia
O Helicobacter pylori coloniza metade da população mundial, e a maioria dos pacientes cronicamente infectados manifesta pangastrite e produz quantidade de ácido abaixo do normal.[47]
A secreção de ácido reduzida, inicialmente, pode ser atribuída ao H pylori (por exemplo, inibição funcional da bomba de prótons gástrica [H+/K+ATPase]) ou a citocinas liberadas do infiltrado inflamatório (por exemplo, inibição direta da secreção de células parietais pela interleucina-1beta e fator de necrose tumoral alfa).[1][48][49][50][51]
Com o tempo, pode ocorrer atrofia das glândulas oxínticas com perda das células parietais, resultando em acloridria irreversível. Há evidências crescentes de que o H pylori pode desempenhar um papel no desenvolvimento de gastrite autoimune e sua gastrite atrófica resultante em indivíduos suscetíveis. Postula-se que anticorpos direcionados contra H+/K+ ATPase ocorram em um subconjunto de pacientes infectados por H pylori como resultado do mimetismo molecular entre o lipopolissacarídeo do microrganismo e a bomba de prótons, ambos expressando antígenos sanguíneos de Lewis x e y.[1][37][38]
A gastrite autoimune também está associada a outras doenças consideradas de origem imunológica, como: doença tireoidiana autoimune (doença de Graves e tireoidite de Hashimoto [também denominada tireoidite autoimune e tireoidite linfocítica crônica]); diabetes mellitus do tipo 1; insuficiência adrenocortical idiopática; vitiligo; hipoparatireoidismo; e colangite biliar primária.[52][53][54][55][56][57] Na doença tireoidiana autoimune, a atrofia oxíntica sorológica está presente em cerca de 25% dos casos.[58] Na colangite biliar primária, anticorpos anticélulas parietais e anticorpos antifator intrínseco estão presentes em 32% e 12% dos casos, respectivamente.[52]
Intervenções cirúrgicas, como antrectomia com vagotomia, podem induzir a acloridria. Os principais estimulantes da secreção de ácido são gastrina (liberada das células G do antro gástrico), histamina (liberada das células semelhantes à enterocromafina [ECL] do corpo/fundo gástrico) e acetilcolina ([ACh] liberada dos neurônios pós-ganglionares localizados dentro da parede do estômago).[1] A gastrina também funciona como o principal hormônio responsável pelo crescimento da mucosa oxíntica. A antrectomia remove a gastrina, o principal estimulante hormonal da secreção de ácido durante a ingestão de uma refeição. A vagotomia remove o efeito de estimulantes centrais da secreção de ácido, como pensamento, visão, olfato e sabor do alimento. A bile que reflui para o restante do estômago após a cirurgia pode induzir inflamação crônica e atrofia.[Figure caption and citation for the preceding image starts]: Modelo ilustrativo da regulação fisiológica da secreção de ácido gástrico pela gastrina, histamina, somatostatina e ácido luminal. A gastrina, liberada pelas células G antrais, é o principal estimulante hormonal da secreção de ácido durante a ingestão de refeições. A gastrina age diretamente nas células parietais secretoras de ácido e, sobretudo, indiretamente estimulando a secreção de histamina pelas células ECL. A histamina se difunde para as células parietais adjacentes, onde se liga a receptores H2 de histamina reforçando a estimulação da secreção de ácido. Na fase interdigestiva, a somatostatina, liberada pelas células D antrais em resposta ao ácido luminal, promove a inibição tônica da secreção de gastrina pelas células G, mantendo, assim, a secreção de ácido em um nível economicamente baixo.Do acervo do Professor Mitchell L. Schubert, com o agradecimento de Mary Beatty-Brooks (ilustradora médica) [Citation ends]. [Figure caption and citation for the preceding image starts]: Modelo ilustrativo da fisiopatologia da acloridria e do desenvolvimento de tumores carcinoides gástricos. Com a acloridria, o efeito do ácido luminal de estimulação da somatostatina é perdido. Consequentemente, a secreção da somatostatina é diminuída e sua restrição inibitória na secreção de gastrina é atenuada (desinibição), resultando em hipergastrinemia. A gastrina não é apenas um secretagogo, mas é também um hormônio trófico que induz o crescimento da mucosa oxíntica. Se a hipergastrinemia for sustentada por dias, as células ECL apresentarão hipertrofia; se for sustentada por semanas a meses, as células ECL ficam hiperplásicas, displásicas e, em alguns pacientes, formarão tumores carcinoides.Do acervo do Professor Mitchell L. Schubert, com o agradecimento de Mary Beatty-Brooks (ilustradora médica) [Citation ends].
[Figure caption and citation for the preceding image starts]: Modelo ilustrativo da fisiopatologia da acloridria e do desenvolvimento de tumores carcinoides gástricos. Com a acloridria, o efeito do ácido luminal de estimulação da somatostatina é perdido. Consequentemente, a secreção da somatostatina é diminuída e sua restrição inibitória na secreção de gastrina é atenuada (desinibição), resultando em hipergastrinemia. A gastrina não é apenas um secretagogo, mas é também um hormônio trófico que induz o crescimento da mucosa oxíntica. Se a hipergastrinemia for sustentada por dias, as células ECL apresentarão hipertrofia; se for sustentada por semanas a meses, as células ECL ficam hiperplásicas, displásicas e, em alguns pacientes, formarão tumores carcinoides.Do acervo do Professor Mitchell L. Schubert, com o agradecimento de Mary Beatty-Brooks (ilustradora médica) [Citation ends].
Classificação
Classificação da atrofia gástrica
Não existe classificação padrão para acloridria, mas há sistemas de classificação para a gastrite, incluindo a gastrite crônica ativa.
A atrofia do corpo gástrico é definida como a perda de células glandulares gástricas, com e sem sua substituição por fibrose, metaplasia intestinal (MI) ou metaplasia pseudopilórica/pilórica. Na MI, o epitélio normal é substituído por epitélio intestinal que contém células caliciformes e/ou de Paneth. Na metaplasia pseudopilórica, também denominada metaplasia que expressa polipeptídeos espasmolíticos (SPEM), as glândulas oxínticas são substituídas por glândulas semelhantes às antrais.
Quatro sistemas de estadiamento são usados de forma intercambiável para classificar a atrofia gástrica, com base na extensão e gravidade das alterações histológicas: sistema Sydney atualizado, operative link on gastritis assessment (OLGA), sistema Baylor e operative link on intestinal metaplasia assessment (OLGIM).
Sistema de Sydney atualizado[8]
Destina-se a identificar e resolver problemas com o sistema de Sydney (que enfatizou a importância de combinar informações topográficas, morfológicas e etiológicas para gerar diagnósticos reproduzíveis e clinicamente úteis). A classificação final foi aprimorada para destacar a distinção entre o estômago atrófico e não atrófico.
Sistema OLGA (Operative Link on Gastritis Assessment)[5][9][10]
O sistema OLGA integra o escore de atrofia e topografia de atrofia em um sistema. O sistema de classificação foi validado em um estudo de acompanhamento de longo prazo de 7436 pacientes; estágios mais elevados no momento da inclusão acarretavam um risco maior de displasia gástrica no acompanhamento.[11]
Sistema Baylor[12]
Exames não invasivos com concentrações séricas de pepsinogênio e gastrina são usados como medidas indiretas da integridade funcional da mucosa oxíntica gástrica.
Sistema OLGIM (Operative link on intestinal metaplasia assessment)[10][13]
Reconhece a MI na mucosa gástrica de uma maneira mais fácil e consistente do que o sistema OLGA.
O uso deste conteúdo está sujeito ao nosso aviso legal