Abordagem
A chave para o diagnóstico da supressão adrenal iatrogênica é constatar a exposição a glicocorticoides exógenos ou outros agentes desencadeantes.
Os pacientes que recebem doses suprafisiológicas de glicocorticoides orais para doença responsiva a corticosteroide e que apresentam uma aparência com características cushingoides (obesidade centrípeta com uma face redonda ou fácies de lua cheia, adiposidades dorsocervicais e estrias) devem ter um reconhecimento imediato de uma possível supressão no eixo hipotálamo-hipófise-adrenal (HHA). Entretanto, a supressão do eixo HHA foi descrita após somente 4 a 5 dias de corticoterapia e como uma consequência da administração local de glicocorticoides.[24][25] Em pacientes que recebem injeções intra-articulares de glicocorticoides, a recuperação do eixo HHA pode levar de 1 a 4 semanas, dependendo da dose e da frequência das injeções.[9] Embora alguns pacientes apresentem características cushingoides e alguns apresentem sintomas óbvios de insuficiência adrenal quando o agente corticosteroide desencadeador é rapidamente desmamado ou interrompido, a supressão do eixo HHA pode ser sutil. Nem todos os pacientes apresentam características cushingoides, sendo necessário um alto índice de suspeita.
Os pacientes com supressão adrenal correm risco de crise adrenal se o tratamento com glicocorticoide for suspenso subitamente ou se não for aumentado em períodos de estresse elevado (por exemplo, doença febril, trauma ou cirurgia). Os pacientes com uma história compatível com supressão adrenal e que apresentam características de crise adrenal (ou seja, hipotensão, insuficiência circulatória) devem ser tratados com urgência. Devem ser realizados exames como linha basal, mas os exames diagnósticos não devem protelar o tratamento.[32]
História e sintomas
Os pacientes que recebem doses suprafisiológicas de glicocorticoides têm o risco de apresentar supressão adrenal, especialmente se forem potentes e/ou se foram administrados por um período prolongado.[1][7][33] No entanto, os corticosteroides não sistêmicos também podem causar supressão adrenal.[1] Os pacientes podem precisar ser questionados: por exemplo, sobre colírios, pulverizadores nasais, inaladores para problemas respiratórios ou injeções para a dor.
A história deve ser direcionada para detectar o padrão do uso de glicocorticoides. É importante perguntar sobre doenças para as quais os corticosteroides são comumente prescritos e sobre vias de administração oral ou alternativas como:
Corticosteroides inalatórios para asma ou doença pulmonar obstrutiva crônica[11][12]
Corticosteroides intranasais para rinite alérgica[13]
Corticosteroides tópicos para o tratamento de quadros clínicos dermatológicos[14][15]
Corticosteroides intra-articulares e epidurais para doenças reumatológicas ou distúrbios relacionados à dor.[9][10]
As doses equivalentes de hidrocortisona, prednisolona, prednisona e dexametasona são:[Figure caption and citation for the preceding image starts]: Equivalência de dose para glicocorticoidesCriada por MC Lansang e SL Quinn [Citation ends].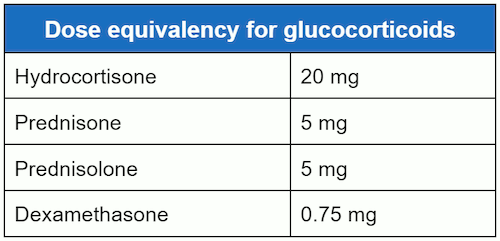
Fontes de corticosteroides não prescritos como tratamentos de venda livre para eczema, cremes para clareamento da pele e medicamentos fitoterápicos podem conter corticosteroides. Outras fontes de corticosteroides prescritos, como enemas ou espumas retais para doença inflamatória intestinal, também devem ser buscadas. Também devem ser obtidas informações adicionais como o tipo, a dose, a via de administração e a duração do tratamento com corticosteroide. De forma menos comum, os pacientes fornecem uma história de tomar medicamentos que atuam no receptor de glicocorticoide, como o acetato de megestrol ou medroxiprogesterona.[1][16][17] Os pacientes também devem ser questionados sobre medicamentos concomitantes que podem interferir no metabolismo de glicocorticoides.[1] O CYP3A4 é a via primária para o metabolismo da maioria dos glicocorticoides prescritos e, portanto, os inibidores do CYP3A4 aumentarão a exposição aos glicocorticoides.[1] Por exemplo, o medicamento antirretroviral ritonavir é um inibidor do CYP3A4 e é conhecido por aumentar as concentrações plasmáticas dos metabólitos da prednisona (prednisolona).[1] Outros inibidores fortes do CYP3A4 incluem antifúngicos, como itraconazol e cetoconazol, e tratamentos contra o câncer, como ceritinibe e idelalisibe.[1] Esta lista não é exaustiva e você deve consultar o formulário de medicamentos local. Raramente, os pacientes apresentam uma história de remoção de carcinoma ou adenoma hipofisário que causou a síndrome de Cushing.[19][20]
Sintomas de insuficiência adrenal podem estar presentes, especialmente quando o agente desencadeante é rapidamente reduzido ou interrompido. Em pacientes com supressão adrenal induzida por glicocorticoides, a interação com medicamentos que induzem o CYP3A4 diminuirá os níveis de glicocorticoides sintéticos e também pode causar sintomas de insuficiência adrenal. Exemplos de agentes que induzem o CYP3A4 incluem carbamazepina, fenobarbital, fenitoína, primidona, rifampicina e nafcilina.[1] Esta lista não é exaustiva e você deve consultar o formulário de medicamentos local. Os sintomas de insuficiência adrenal geralmente são vagos. Eles incluem fadiga, anorexia, náuseas e/ou vômitos e perda de peso.[32] Tontura, sintomas ortostáticos, mialgias e artralgias também podem estar presentes. A dor abdominal pode ser leve ou intensa o suficiente para levar ao diagnóstico equivocado de abdome agudo.
Os pacientes podem relatar sintomas consistentes com a síndrome de Cushing, incluindo sintomas do sistema nervoso central como depressão, agitação ou distúrbios do sono.[34] Pode haver uma história prévia de ganho de peso e aumento no apetite, face redonda, adiposidades dorsocervicais e facilidade de formação de hematomas. Outras afecções médicas como hipertensão e diabetes podem se tornar mais difíceis de controlar e menos responsivas aos medicamentos.
A supressão adrenal na população pediátrica pode se manifestar como uma crise adrenal em momentos de estresse, mas tem maior probabilidade de ser sutil. Os sintomas inespecíficos de supressão adrenal em crianças são semelhantes aos observados em adultos; no entanto, as crianças também podem apresentar deficit de crescimento e hipoglicemia.[2]
Exame físico
Pacientes com risco de supressão adrenal que interromperam repentinamente medicamentos glicocorticoides ou não aumentaram a dose durante períodos de estresse aumentado podem apresentar uma crise adrenal aguda com colapso devido a choque hipovolêmico, hipotensão, tontura postural e taquicardia.[32]
Em casos menos agudos, os pacientes podem ou não ter aparência cushingoide, e a hipertensão pode estar presente. Também pode haver fraqueza muscular. A cor da pele pode ser pletórica com estrias pigmentadas; pele fina com fácil formação de hematomas; e acne. Características associadas a elevações do hormônio adrenocorticotrópico (ACTH) como hiperpigmentação mucosal e cutânea não estarão presentes. Também estão provavelmente ausentes outros estigmas de doenças autoimunes associadas à insuficiência adrenal autoimune, como o vitiligo. Essas características ajudam a distinguir a supressão adrenal induzida endogenamente da supressão adrenal iatrogênica.
Exames diagnósticos
Em casos de crise adrenal aguda, os exames diagnósticos não devem protelar o tratamento.[32] As investigações incluirão o monitoramento rigoroso da pressão arterial, equilíbrio hídrico e sangue em linha basal (hemograma completo, eletrólitos, ureia, creatinina, função tireoidiana [o hipertireoidismo pode desencadear crise adrenal], cortisol e nível de ACTH). Se o paciente estiver estável hemodinamicamente, considere um rápido teste de estímulo com o hormônio adrenocorticotrófico.[32]
Apesar de não serem diagnósticos, achados de exames laboratoriais incidentais como hipoglicemia, hiperglicemia, hipocalemia, hipomagnesemia e alcalose de contração podem levantar suspeita de uso de glicocorticoides. Anormalidades eletrolíticas consistentes com a deficiência de mineralocorticoides como hipercalemia estão ausentes porque o sistema renina-angiotensina-aldosterona permanece intacto.
Enquanto os corticosteroides suprafisiológicos continuarem, a avaliação da função adrenal não é útil. Os pacientes com uma história de uso de glicocorticoide que passaram por uma descontinuação ou uma redução recente na dose de corticosteroide para níveis fisiológicos ou subfisiológicos, juntamente com sintomas de insuficiência adrenal, devem ser testados quanto a supressão adrenal.
Se os corticosteroides foram descontinuados, um cortisol aleatório no início da manhã é o teste diagnóstico mais simples, mas os resultados geralmente são inconclusivos, sendo necessária a realização de um dos mais incômodos, embora mais confiáveis, testes de estimulação para a confirmação. Devido ao fato de o ACTH ter sido suprimido por corticosteroide exógeno, espera-se que o cortisol sérico esteja baixo. Valores abaixo de 110 nanomoles/L (4 microgramas/dL) são consistentes com a supressão do eixo HHA. Valores entre 110 e 469 nanomoles/L (4 e 17 microgramas/dL) são inconclusivos.[35] Os valores indeterminados exigem confirmação com um dos testes de estimulação para a descontinuação segura da corticoterapia. Os níveis de cortisol sérico aleatório ou níveis de ACTH não são recomendados como indicadores confiáveis do estado adrenal. Em vez de realizar um dos exames de estimulação, muitos médicos preferem prosseguir com um programa de redução gradual de corticosteroide. Quando o valor do cortisol sérico matinal for >497 nanomoles/L (18 microgramas/dL), os corticosteroides podem ser descontinuados com segurança.
O cortisol salivar da meia noite foi reconhecido como uma excelente ferramenta diagnóstica para a identificação da síndrome de Cushing, mas tem havido um crescente interesse no cortisol salivar da manhã como meio para rastrear a insuficiência adrenal. Estudos constataram que os níveis de cortisol sérico de manhã são equivalentes aos níveis de cortisol salivar para diferenciar a insuficiência adrenal da função adrenal normal.[36][37] O cortisol salivar pode ser especialmente útil em pacientes com doença hepática que apresentam hipoalbuminemia e cirrose, nas quais os níveis de cortisol salivar se correlacionam melhor com a função adrenal e com o cortisol livre no plasma que o cortisol total no plasma.[38][39] O cortisol salivar também pode ser útil como um substituto para o cortisol livre no plasma durante o teste de estímulo com o hormônio adrenocorticotrópico em pacientes com outras formas de níveis de proteína de ligação plasmática aumentados ou diminuídos.[40] Em pacientes na unidade de terapia intensiva (UTI), o cortisol salivar e sérico livres têm uma correlação próxima, quando são obtidas amostras salivares adequadas. No entanto, a coleta inadequada de amostras e a contaminação são problemas frequentes.[41][42] Embora seja provável que o cortisol salivar será usado mais amplamente no futuro, é preferível usar um aumento no cortisol sérico total <9 microgramas/dL após 250 microgramas de ACTH ou um cortisol total aleatório <10 microgramas/dL para confirmar insuficiência adrenal em pacientes na UTI.[43]
Os testes de estímulo com o hormônio adrenocorticotrópico são os métodos preferenciais para detectar a supressão adrenal. Os testes convencionais com ACTH e os testes de estímulo com o hormônio adrenocorticotrópico de baixa dose usam o ACTH (ACTH sintético, como injeções ou infusões de cosintropina) para medir o débito de cortisol adrenal e são geralmente confiáveis. A dose de 250 microgramas é a mais usada e o teste pode ser realizado até mesmo no ambiente de consultório.[44] Sugeriu-se que o uso de 1 a 10 microgramas de ACTH comparado a 250 microgramas é mais sensível na identificação da hipofunção adrenal, mas essas preparações exigem diluições e infusões intravenosas em vez de injeções intramusculares e intravenosas mais simples, por meio das quais a dose de 250 microgramas é administrada.[45][46][47][48][49] Historicamente, os valores de corte de 30 minutos para o teste com 1 micrograma foram reconhecidos como <18 a 20 microgramas/dL em pacientes não estressados e <25 microgramas/dL ou um aumento de <9 microgramas/dL a partir da linha basal em pacientes criticamente enfermos.[50] No entanto, ensaios monoclonais mais recentes ou métodos de espectrometria de massa por cromatografia líquida para medir as concentrações de cortisol sérico estão associados a uma reatividade cruzada reduzida com outros glicocorticoides e, portanto, foi proposto um corte mais baixo de cortisol sérico em picos de 30 ou 60 de <15 microgramas/dL.[1][51] Uma metanálise comparando o teste de estímulo com o hormônio adrenocorticotrófico de 1 mcg versus a dose de 250 mcg mostrou baixa sensibilidade e alta especificidade de cada para diagnóstico de insuficiência adrenal secundária, com precisão diagnóstica semelhante das duas doses.[52] O teste de estímulo com o hormônio adrenocorticotrópico pode não ser confiável em pacientes com início recente de supressão do eixo HHA, em que as glândulas adrenais ainda não tiveram tempo suficiente para atrofiar. Se os pacientes estão tomando hidrocortisona ou prednisolona, é recomendável manter o tratamento durante 24 horas antes do teste para evitar falso-positivos. Outras preparações com corticosteroides, como a dexametasona, não apresentam reação cruzada com o ensaio de cortisol usado pelo teste de estímulo com o hormônio adrenocorticotrópico.
O teste de tolerância à insulina (TTI) e o teste de metirapona noturna, apesar de um pouco incômodos, avaliam todo o eixo HHA e são capazes de avaliar a supressão adrenal parcial.[44] O teste de tolerância à insulina (TTI) pode ser usado se houver a necessidade concomitante de determinar se o paciente também tem deficiência do hormônio do crescimento, para a qual o TTI também é um teste diagnóstico. Tanto o TTI quanto os testes de metirapona podem ser usados se for pertinente saber se o paciente apresenta insuficiência adrenal secundária devido a uma lesão recente da hipófise (por exemplo, cirurgia da hipófise). Nessa situação, as glândulas adrenais ainda podem produzir uma resposta normal ao teste de estímulo com o hormônio adrenocorticotrópico por até 2 a 3 semanas após a lesão hipofisária em decorrência da reserva adrenal. Entretanto, o TTI pode revelar que a hipófise não é capaz de responder ao estresse. Devido ao fato de o TTI se basear na produção de hipoglicemia sintomática para estimular a liberação de cortisol, ele avalia todo o eixo HHA, mas tem o risco associado de convulsões hipoglicêmicas e, portanto, deve ser realizado sob observação estrita. Não é recomendado para pacientes frágeis ou idosos com doença cardiovascular ou convulsões. O teste de metirapona também avalia todo o eixo HHA, mas está associado ao potencial teórico, embora improvável, de precipitar insuficiência adrenal aguda.
Em pacientes que apresentam uma vaga lembrança de ter recebido preparações de glicocorticoides locais (como a administração epidural ou intra-articular) suspeitas de provocarem a supressão adrenal, o rastreamento da urina para corticosteroides sintéticos irá confirmar a absorção sistêmica de glicocorticoides exógenos, mas não é diagnóstico de supressão adrenal.[Figure caption and citation for the preceding image starts]: Tabela de testes para a supressão adrenalCriada por MC Lansang e SL Quinn [Citation ends].
O uso deste conteúdo está sujeito ao nosso aviso legal