O tratamento da polipose adenomatosa familiar (PAF) é orientado pela vigilância colonoscópica e pela presença de adenomas.
A proctocolectomia profilática é a principal maneira de prevenir o câncer colorretal na PAF.
Colonoscopia de vigilância
Pacientes com história familiar de PAF/PAF atenuada (PAFA) positivos para polipose adenomatosa do cólon (APC) devem ser submetidos à colonoscopia de vigilância para identificar e/ou monitorar adenomas colônicos.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
[24]Hyer W, Cohen S, Attard T, et al. Management of familial adenomatous polyposis in children and adolescents: Position paper from the ESPGHAN polyposis working group. J Pediatr Gastroenterol Nutr. 2019 Mar;68(3):428-41.
https://journals.lww.com/jpgn/Fulltext/2019/03000/Management_of_Familial_Adenomatous_Polyposis_in.30.aspx
http://www.ncbi.nlm.nih.gov/pubmed/30585891?tool=bestpractice.com
[30]Monahan KJ, Bradshaw N, Dolwani S, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut. 2020 Mar;69(3):411-44.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7034349
http://www.ncbi.nlm.nih.gov/pubmed/31780574?tool=bestpractice.com
[37]Zaffaroni G, Mannucci A, Koskenvuo L, et al. Updated European guidelines for clinical management of familial adenomatous polyposis (FAP), MUTYH-associated polyposis (MAP), gastric adenocarcinoma, proximal polyposis of the stomach (GAPPS) and other rare adenomatous polyposis syndromes: a joint EHTG-ESCP revision. Br J Surg. 2024 May 3;111(5):znae070.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11081080
http://www.ncbi.nlm.nih.gov/pubmed/38722804?tool=bestpractice.com
[38]Issaka RB, Chan AT, Gupta S. AGA clinical practice update on risk stratification for colorectal cancer screening and post-polypectomy surveillance: expert review. Gastroenterology. 2023 Nov;165(5):1280-91.
https://www.gastrojournal.org/article/S0016-5085(23)04771-6/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
http://www.ncbi.nlm.nih.gov/pubmed/37737817?tool=bestpractice.com
Para pacientes com PAF, a National Comprehensive Cancer Network (NCCN) orienta que a colonoscopia deve ser oferecida a partir dos 10 a 15 anos de idade. Outras orientações, inclusive da European Society for Paediatric Gastroenterology, Hepatology and Nutrition, recomendam que essa vigilância pode começar um pouco depois, a partir dos 12 anos de idade.[24]Hyer W, Cohen S, Attard T, et al. Management of familial adenomatous polyposis in children and adolescents: Position paper from the ESPGHAN polyposis working group. J Pediatr Gastroenterol Nutr. 2019 Mar;68(3):428-41.
https://journals.lww.com/jpgn/Fulltext/2019/03000/Management_of_Familial_Adenomatous_Polyposis_in.30.aspx
http://www.ncbi.nlm.nih.gov/pubmed/30585891?tool=bestpractice.com
[30]Monahan KJ, Bradshaw N, Dolwani S, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut. 2020 Mar;69(3):411-44.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7034349
http://www.ncbi.nlm.nih.gov/pubmed/31780574?tool=bestpractice.com
[37]Zaffaroni G, Mannucci A, Koskenvuo L, et al. Updated European guidelines for clinical management of familial adenomatous polyposis (FAP), MUTYH-associated polyposis (MAP), gastric adenocarcinoma, proximal polyposis of the stomach (GAPPS) and other rare adenomatous polyposis syndromes: a joint EHTG-ESCP revision. Br J Surg. 2024 May 3;111(5):znae070.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11081080
http://www.ncbi.nlm.nih.gov/pubmed/38722804?tool=bestpractice.com
Para pacientes com PAFA, a vigilância colonoscópica deve começar no fim da adolescência, geralmente até os 20 anos de idade.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
[37]Zaffaroni G, Mannucci A, Koskenvuo L, et al. Updated European guidelines for clinical management of familial adenomatous polyposis (FAP), MUTYH-associated polyposis (MAP), gastric adenocarcinoma, proximal polyposis of the stomach (GAPPS) and other rare adenomatous polyposis syndromes: a joint EHTG-ESCP revision. Br J Surg. 2024 May 3;111(5):znae070.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11081080
http://www.ncbi.nlm.nih.gov/pubmed/38722804?tool=bestpractice.com
A frequência da vigilância colônica é individualizada, dependendo do fenótipo colônico, e, normalmente, é realizada entre cada 1 e 3 anos.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
[24]Hyer W, Cohen S, Attard T, et al. Management of familial adenomatous polyposis in children and adolescents: Position paper from the ESPGHAN polyposis working group. J Pediatr Gastroenterol Nutr. 2019 Mar;68(3):428-41.
https://journals.lww.com/jpgn/Fulltext/2019/03000/Management_of_Familial_Adenomatous_Polyposis_in.30.aspx
http://www.ncbi.nlm.nih.gov/pubmed/30585891?tool=bestpractice.com
[37]Zaffaroni G, Mannucci A, Koskenvuo L, et al. Updated European guidelines for clinical management of familial adenomatous polyposis (FAP), MUTYH-associated polyposis (MAP), gastric adenocarcinoma, proximal polyposis of the stomach (GAPPS) and other rare adenomatous polyposis syndromes: a joint EHTG-ESCP revision. Br J Surg. 2024 May 3;111(5):znae070.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11081080
http://www.ncbi.nlm.nih.gov/pubmed/38722804?tool=bestpractice.com
A presença de sintomas de alerta, como anemia, sangramento retal, aumento dos movimentos intestinais e secreção de muco, deve justificar a colonoscopia de urgência para qualquer paciente, independente da idade ou do fenótipo colônico.[24]Hyer W, Cohen S, Attard T, et al. Management of familial adenomatous polyposis in children and adolescents: Position paper from the ESPGHAN polyposis working group. J Pediatr Gastroenterol Nutr. 2019 Mar;68(3):428-41.
https://journals.lww.com/jpgn/Fulltext/2019/03000/Management_of_Familial_Adenomatous_Polyposis_in.30.aspx
http://www.ncbi.nlm.nih.gov/pubmed/30585891?tool=bestpractice.com
[37]Zaffaroni G, Mannucci A, Koskenvuo L, et al. Updated European guidelines for clinical management of familial adenomatous polyposis (FAP), MUTYH-associated polyposis (MAP), gastric adenocarcinoma, proximal polyposis of the stomach (GAPPS) and other rare adenomatous polyposis syndromes: a joint EHTG-ESCP revision. Br J Surg. 2024 May 3;111(5):znae070.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11081080
http://www.ncbi.nlm.nih.gov/pubmed/38722804?tool=bestpractice.com
Não há um consenso unificado em relação às indicações absolutas ou relativas para cirurgia. Em pacientes com PAF, a cirurgia geralmente é recomendada após a detecção de adenomas colônicos, mas o momento deve ser individualizado e depende da distribuição, do tamanho e da histologia dos pólipos colorretais.[24]Hyer W, Cohen S, Attard T, et al. Management of familial adenomatous polyposis in children and adolescents: Position paper from the ESPGHAN polyposis working group. J Pediatr Gastroenterol Nutr. 2019 Mar;68(3):428-41.
https://journals.lww.com/jpgn/Fulltext/2019/03000/Management_of_Familial_Adenomatous_Polyposis_in.30.aspx
http://www.ncbi.nlm.nih.gov/pubmed/30585891?tool=bestpractice.com
[28]Poylin VY, Shaffer VO, Felder SI, et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the management of inherited adenomatous polyposis syndromes. Dis Colon Rectum. 2024 Feb 1;67(2):213-27.
https://journals.lww.com/dcrjournal/fulltext/2024/02000/the_american_society_of_colon_and_rectal_surgeons.6.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37682806?tool=bestpractice.com
Em caso de PAFA, a cirurgia é amplamente guiada pela carga do adenoma, e não pela presença de adenoma.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
O American College of Gastroenterologists orienta que as indicações absolutas para cirurgia colorretal imediata em pacientes com PAF, ou PAF atenuada, incluem:[29]Syngal S, Brand RE, Church JM, et al.; American College of Gastroenterology. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015 Feb;110(2):223-62.
http://www.ncbi.nlm.nih.gov/pubmed/25645574?tool=bestpractice.com
Câncer colorretal documental ou suspeito
Sintomas significativos relacionados à neoplasia colônica (por exemplo, hemorragia digestiva)
Essas indicações também têm o suporte da British Association of Gastroenterology e da Association of Coloproctology of Great Britain and Ireland.[30]Monahan KJ, Bradshaw N, Dolwani S, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut. 2020 Mar;69(3):411-44.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7034349
http://www.ncbi.nlm.nih.gov/pubmed/31780574?tool=bestpractice.com
As indicações relativas de cirurgia incluem:[29]Syngal S, Brand RE, Church JM, et al.; American College of Gastroenterology. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015 Feb;110(2):223-62.
http://www.ncbi.nlm.nih.gov/pubmed/25645574?tool=bestpractice.com
Presença de múltiplos adenomas >6 mm
Aumento significativo no número de adenomas
Presença de adenoma com displasia de alto grau
Incapacidade de examinar adequadamente o cólon devido a múltiplos pólipos diminutos
O European Hereditary Tumor Group (EHTG) e a European Society of Coloproctology (ESCP) recomendam que, para pacientes com PAF, as indicações de cirurgia colorretal imediata incluem:[37]Zaffaroni G, Mannucci A, Koskenvuo L, et al. Updated European guidelines for clinical management of familial adenomatous polyposis (FAP), MUTYH-associated polyposis (MAP), gastric adenocarcinoma, proximal polyposis of the stomach (GAPPS) and other rare adenomatous polyposis syndromes: a joint EHTG-ESCP revision. Br J Surg. 2024 May 3;111(5):znae070.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11081080
http://www.ncbi.nlm.nih.gov/pubmed/38722804?tool=bestpractice.com
Determinados tipos de câncer ou suspeita de câncer
Sintomas graves de polipose
Doença grave (>1000 pólipos identificados na colonoscopia)
Características histológicas desfavoráveis (por exemplo, adenoma viloso)
As indicações para a cirurgia planejada incluem:[37]Zaffaroni G, Mannucci A, Koskenvuo L, et al. Updated European guidelines for clinical management of familial adenomatous polyposis (FAP), MUTYH-associated polyposis (MAP), gastric adenocarcinoma, proximal polyposis of the stomach (GAPPS) and other rare adenomatous polyposis syndromes: a joint EHTG-ESCP revision. Br J Surg. 2024 May 3;111(5):znae070.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11081080
http://www.ncbi.nlm.nih.gov/pubmed/38722804?tool=bestpractice.com
Pólipo >10 mm de diâmetro
Características histológicas favoráveis
Aumento considerável do número de pólipos entre os exames
Doença esparsa (100-1000 pólipos)
Cirurgia para PAF
A proctocolectomia total com anastomose íleo-anal com bolsa (AIAB) é a cirurgia preferencial para a maioria dos pacientes com PAF, pois previne o câncer retal.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
Entretanto, alguns pacientes podem precisar (ou escolher) a colectomia abdominal total com anastomose ileorretal ou a proctocolectomia total com ileostomia terminal permanente.
Proctocolectomia total com anastomose íleo-anal com bolsa (AIAB)
Esse procedimento é oferecido aos pacientes com PAF clássica, pacientes com PAF atenuada com muitos pólipos, que resultam em um tapete no reto, aqueles com câncer retal curável que complica a polipose, e aqueles que foram submetidos a anastomose ileorretal e agora têm reto instável em termos de número, tamanho ou histologia dos pólipos. Geralmente, o procedimento não é oferecido aos pacientes com câncer incurável, aqueles com desmoide intra-abdominal que pode interferir na conclusão da cirurgia, aqueles com contraindicações anatômicas, fisiológicas ou patológicas a uma AIAB, ou quando há preocupação relativa à capacidade dos pacientes de participarem da vigilância endoscópica rigorosa após a cirurgia.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
As vantagens da proctocolectomia total com anastomose íleo-anal com bolsa (AIAB) são: o risco de desenvolver câncer retal é insignificante e não é necessário estoma permanente. As desvantagens são: é uma operação complexa, geralmente é necessário estoma permanente e há um pequeno risco de disfunção vesical ou sexual e de lesão no esfíncter anal. A função intestinal, embora geralmente razoável, também é um pouco imprevisível. A bolsa ileal requer vigilância, e a área da AIAB ainda deve ser examinada devido ao fato de que ainda pode haver mucosa da zona transicional anal residual.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
A mucosectomia para maximizar a remoção da mucosa retal pode ser considerada na AIAB.[39]Chambers WM, McC Mortensen NJ. Should ileal pouch-anal anastomosis include mucosectomy? Colorectal Dis. 2007;9:384-392.
http://www.ncbi.nlm.nih.gov/pubmed/17504334?tool=bestpractice.com
Podem ser usadas técnicas de AIAB suturada à mão ou grampeada. A AIAB suturada à mão envolve a remoção de toda a mucosa colorretal e, portanto, está associada com a redução do risco de pólipos pós-operatórios na zona transicional anal, em comparação com a anastomose grampeada. Ela pode ser a técnica de primeira escolha para AIAB para pacientes selecionados com PAF.[40]Bjork JA, Akerbrant HI, Iselius LE, et al. Risk factors for rectal cancer morbidity and mortality in patients with familial adenomatous polyposis after colectomy and ileorectal anastomosis. Dis Colon Rectum. 2000;43:1719-1725.
http://www.ncbi.nlm.nih.gov/pubmed/11156457?tool=bestpractice.com
Isto incluiria pacientes com pólipos na zona transicional que podem ser difíceis de remover sem mucosectomia. Dados retrospectivos de um registro grande, prospectivo, genético institucional de pacientes com PAF demonstraram que, apesar da AIAB grampeada ter uma incidência maior de pólipos na zona transicional anal que necessitam de tratamento, comparada à AIAB suturada à mão, a incidência de adenocarcinoma na zona transicional anal foi similar entre os dois grupos.[41]Ozdemir Y, Kalady MF, Aytac E, et al. Anal transitional zone neoplasia in patients with familial adenomatous polyposis after restorative proctocolectomy and IPAA: incidence, management, and oncologic and functional outcomes. Dis Colon Rectum. 2013;56:808-814.
http://www.ncbi.nlm.nih.gov/pubmed/23739186?tool=bestpractice.com
A anastomose grampeada está associada com melhor função intestinal em longo prazo que a anastomose suturada à mão. Portanto, ela é a técnica de preferência para o manejo cirúrgico de pacientes com PAF em alguns centros.[41]Ozdemir Y, Kalady MF, Aytac E, et al. Anal transitional zone neoplasia in patients with familial adenomatous polyposis after restorative proctocolectomy and IPAA: incidence, management, and oncologic and functional outcomes. Dis Colon Rectum. 2013;56:808-814.
http://www.ncbi.nlm.nih.gov/pubmed/23739186?tool=bestpractice.com
Há evidência de que a AIAB laparoscópica é um procedimento seguro e praticável, embora sejam necessários estudos amplos e de boa qualidade que examinam as diferenças entre abordagens laparoscópicas e abertas em termos de complicações pós-operatórias, aspeto, qualidade de vida e custos.[42]Xie YQ, Yuan X. Meta analysis of surgical treatment of 231 cases of familial adenomatous polyposis in China. Chin J Cancer Prev Treat. 2008;15:537-540.[43]Ahmed AU, Keus F, Heikens JT, et al. Open versus laparoscopic (assisted) ileo pouch anal anastomosis for ulcerative colitis and familial adenomatous polyposis. Cochrane Database Syst Rev. 2009;(1):CD006267.
http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD006267.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/19160273?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Ileostomia de Brooke na polipose adenomatosa familiar: risco de adenomaDo acervo pessoal de Lisa A. Boardman, MD; usado com permissão [Citation ends].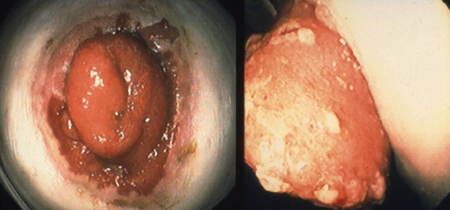
Pacientes do sexo feminino devem ser informadas que a AIAB está associada a um aumento da infertilidade.[44]Rajaratnam SG, Eglinton TW, Hider P, et al. Impact of ileal pouch-anal anastomosis on female fertility: meta-analysis and systematic review. Int J Colorectal Dis. 2011;26:1365-1374.
http://www.ncbi.nlm.nih.gov/pubmed/21766164?tool=bestpractice.com
Para pacientes submetidos a IPPA, uma endoscopia da bolsa ileal anual é necessária para a vigilância de pólipos na bolsa.[45]Tudyka VN, Clark SK. Surgical treatment in familial adenomatous polyposis. Ann Gastroenterol. 2012;25(3):201-6.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3959379
http://www.ncbi.nlm.nih.gov/pubmed/24714154?tool=bestpractice.com
Colectomia abdominal total com anastomose ileorretal (AIR)
É uma opção para pacientes com PAF com poucos ou nenhum adenoma retal.[12]Yang J, Gurudu SR, Koptiuch C, et al. American Society for Gastrointestinal Endoscopy guideline on the role of endoscopy in familial adenomatous polyposis syndromes. Gastrointest Endosc. 2020 May;91(5):963-82.e2.
https://linkinghub.elsevier.com/retrieve/pii/S0016-5107(20)30054-7
http://www.ncbi.nlm.nih.gov/pubmed/32169282?tool=bestpractice.com
[28]Poylin VY, Shaffer VO, Felder SI, et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the management of inherited adenomatous polyposis syndromes. Dis Colon Rectum. 2024 Feb 1;67(2):213-27.
https://journals.lww.com/dcrjournal/fulltext/2024/02000/the_american_society_of_colon_and_rectal_surgeons.6.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37682806?tool=bestpractice.com
Como quase um quarto dos pacientes com PAF tratados com AIR desenvolve câncer retal na mucosa retal retida sem acompanhamento, os pacientes que passam por esse procedimento precisam de retoscopia anual.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
Em um estudo, 13% dos pacientes com PAF tratados com AIR desenvolveram câncer retal, em média 10 anos após a cirurgia.[46]Jenner DC, Levitt S. Rectal cancer following colectomy and ileorectal anastomosis for familial adenomatous polyposis. Aust N Z J Surg. 1998;68:136-138.
http://www.ncbi.nlm.nih.gov/pubmed/9494007?tool=bestpractice.com
O risco de desenvolver câncer no coto retal aumenta consideravelmente após os 50 anos de idade. Se o reto se tornar instável, a proctectomia com AIAB ou ileostomia terminal é recomendada.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
Os benefícios da AIAB versus AIR devem ser discutidos de maneira detalhada com o paciente.[44]Rajaratnam SG, Eglinton TW, Hider P, et al. Impact of ileal pouch-anal anastomosis on female fertility: meta-analysis and systematic review. Int J Colorectal Dis. 2011;26:1365-1374.
http://www.ncbi.nlm.nih.gov/pubmed/21766164?tool=bestpractice.com
[47]De Cosse JJ, Bulow S, Neale K, et al. Rectal cancer risk in patients treated for familial adenomatous polyposis. Br J Surg. 1992;79:1372-1375.
http://www.ncbi.nlm.nih.gov/pubmed/1336702?tool=bestpractice.com
[48]van Leerdam ME, Roos VH, van Hooft JE, et al. Endoscopic management of polyposis syndromes: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2019 Sep;51(9):877-895.
https://www.doi.org/10.1055/a-0965-0605
http://www.ncbi.nlm.nih.gov/pubmed/31342472?tool=bestpractice.com
Pacientes com anastomose ileorretal (AIR) apresentam melhor continência e função intestinal após a cirurgia, em comparação com pacientes com AIAB.[49]Günther K, Braunrieder G, Bittorf BR, et al. Patients with familial adenomatous polyposis experience better bowel function and quality of life after ileorectal anastomosis than after ileoanal pouch. Colorectal Dis. 2003 Jan;5(1):38-44.
http://www.ncbi.nlm.nih.gov/pubmed/12780925?tool=bestpractice.com
Mulheres em idade fértil podem escolher a anastomose ileorretal (AIR) até depois da maternidade, quando elas podem passar para a AIAB.
Conversão da AIR em AIAB
Em alguns casos, a AIR pode ser convertida em AIAB. Esse foi o caso em 8% dos pacientes em uma revisão retrospectiva de pacientes com PAF. Além do aumento do risco de infecção da ferida em 9% dos que foram convertidos para AIAB em comparação a <1% com AIAB como primeira operação, nenhuma outra complicação significativa foi associada à AIAB após uma anastomose ileorretal (IRA).[50]Parc Y, Piquard A, Dozois RR, et al. Long-term outcome of familial adenomatous polyposis patients after restorative proctocolectomy. Ann Surg. 2004 Mar;239(3):378-82.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1356236
http://www.ncbi.nlm.nih.gov/pubmed/15075655?tool=bestpractice.com
Proctocolectomia com ileostomia terminal
Ela é raramente indicada como procedimento profilático porque há abordagens alternativas disponíveis que não envolvem um estoma permanente. A proctocolectomia com ileostomia terminal remove todo o risco de câncer retal, mas está associada a risco de disfunção vesical ou sexual. Ela pode ser oferecida a pacientes com câncer retal baixo, localmente avançado, pacientes que não puderem ter bolsa ileal devido a um tumor desmoide, pacientes com bolsa ileal com mau funcionamento, pacientes com contraindicação à AIAB (por exemplo, doença de Crohn concomitante, função esfincteriana comprometida), e pacientes nos quais houver relativa preocupação quanto à participação em uma vigilância endoscópica rigorosa após a cirurgia. A proctocolectomia com ileostomia continente é oferecida aos pacientes motivados a evitarem uma ileostomia terminal por não poderem realizar proctocolectomia com AIAB (por exemplo, pacientes que já tiverem passado por cirurgia pélvica prévia ou tido encurtamento mesentérico) ou que apresentarem mau funcionamento da AIAB. Trata-se de uma operação complexa com risco significativo de reoperação.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
Manejo de tumores desmoides
Os tumores desmoides intra-abdominais são uma das principais causas de morte em pacientes com PAF.[51]DE Marchis ML, Tonelli F, Quaresmini D, et al. Desmoid tumors in familial adenomatous polyposis. Anticancer Res. 2017 Jul;37(7):3357-3366.
https://www.doi.org/10.21873/anticanres.11702
http://www.ncbi.nlm.nih.gov/pubmed/28668823?tool=bestpractice.com
Os tumores desmoides têm comportamento imprevisível com biologia mal compreendida, resultando na falta de terapias médicas e cirúrgicas padronizadas. O manejo de desmoides é difícil e geralmente há recorrência, apesar do tratamento. Pacientes com PAF e tumores desmoides devem ser encaminhados a centros especializados no manejo de tumores desmoides.
A terapia farmacológica geralmente é a abordagem inicial de primeira escolha.[28]Poylin VY, Shaffer VO, Felder SI, et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the management of inherited adenomatous polyposis syndromes. Dis Colon Rectum. 2024 Feb 1;67(2):213-27.
https://journals.lww.com/dcrjournal/fulltext/2024/02000/the_american_society_of_colon_and_rectal_surgeons.6.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37682806?tool=bestpractice.com
A cirurgia pode estimular o crescimento do tumor desmoide intra-abdominal em pacientes com PAF e, normalmente, só é oferecida para pacientes sintomáticos que não apresentam resposta à terapia medicamentosa inicial.[28]Poylin VY, Shaffer VO, Felder SI, et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the management of inherited adenomatous polyposis syndromes. Dis Colon Rectum. 2024 Feb 1;67(2):213-27.
https://journals.lww.com/dcrjournal/fulltext/2024/02000/the_american_society_of_colon_and_rectal_surgeons.6.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37682806?tool=bestpractice.com
Sistemas de estadiamento de desmoide intra-abdominal foram desenvolvidos para ajudar a predizer a mortalidade associada. A sobrevida de cinco anos de pacientes com tumor desmoide intra-abdominal em estádio I, II, III e IV foi de 95%, 100%, 89% e 76%, respectivamente (P <0.001). Dor intensa, dependência de opioides, tamanho de tumor maior que 10 cm e a necessidade de nutrição parenteral total são fatores que ajudaram a definir mais detalhadamente a sobrevida em cada estádio. A taxa de sobrevida de 5 anos de um paciente em estádio IV com todos os fatores de risco mencionados acima foi de apenas 53%.[52]Quintini C, Ward G, Shatnawei A, et al. Mortality of intra-abdominal desmoid tumors in patients with familial adenomatous polyposis: a single center review of 154 patients. Ann Surg. 2012;255:511-516.
http://www.ncbi.nlm.nih.gov/pubmed/22323009?tool=bestpractice.com
Os tratamentos disponíveis incluem inibidores de ciclo-oxigenase (COX)-2 (por exemplo, celecoxibe) ou inibidores de COX-1 e COX-2 combinados (por exemplo, sulindaco), antiestrogênios (por exemplo, tamoxifeno), quimioterapia e radioterapia, e cirurgia. Imatinibe foi associado com a resposta parcial e a estabilização do crescimento, mesmo em tumores desmoides que não apresentam mutações aparentes no oncogene KIT-tirosina quinase.[53]Duffaud F, Le Cesne A. Imatinib in the treatment of solid tumors. Targ Oncol. 2009;4:45-56.
http://www.ncbi.nlm.nih.gov/pubmed/19343301?tool=bestpractice.com
Não há ensaios controlados comparando essas várias modalidades de tratamento. Complicando nosso entendimento do impacto desses tratamentos está o fenômeno de regressão espontânea de desmoides, que pode ocorrer em até 10% dos casos.[54]Clark SK, Phillips RK. Desmoids in familial adenomatous polyposis. Br J Surg. 1996;83:1494-1504.
http://www.ncbi.nlm.nih.gov/pubmed/9014661?tool=bestpractice.com
[55]Knudsen AL, Bulow S. Desmoid tumour in familial adenomatous polyposis: a review of literature. Fam Cancer. 2001;1:111-119.
http://www.ncbi.nlm.nih.gov/pubmed/14574007?tool=bestpractice.com
Manejo de pólipos duodenais
Em mais de 90% dos pacientes com PAF, há desenvolvimento de polipose adenomatosa duodenal. A vigilância do trato gastrointestinal superior com endoscopia é um aspecto importante do manejo, pois o câncer duodenal pode se desenvolver em até 10% dos pacientes.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
Os critérios de Spigelman são usados para avaliar a gravidade dos pólipos:[36]Spigelman AD, Williams CB, Talbot IC, et al. Upper gastrointestinal cancer in patients with familial adenomatous polyposis. Lancet. 1989 Sep 30;2(8666):783-5.
http://www.ncbi.nlm.nih.gov/pubmed/2571019?tool=bestpractice.com
Número de pólipo duodenal/periampular (1-4 = 1 ponto; 5-20 = 2 pontos; >20 = 3 pontos)
Tamanho (1-4 mm = 1 ponto; 5-10 mm = 2 pontos; >10 mm = 3 pontos)
Histologia (tubular = 1 ponto; tubulovilosa = 2 pontos; vilosa = 3 pontos)
Grau de displasia (baixo grau = 1 ponto; alto grau = 3 pontos).
Um escore de 0 ponto é classificado como doença em estágio 0; 1 a 4 pontos é classificado como doença em estágio 1; 5 a 6 pontos é classificado como doença em estágio 2; 7 a 8 pontos é classificado como doença em estágio 3, e 9 a 12 pontos é classificado como doença em estágio 4.
Pacientes em risco com adenomas colorretais, bem como portadores do gene da APC, devem realizar endoscopias digestivas altas com visão lateral e frontal pelo menos a cada 5 anos.
A American Society of Colon and Rectal Surgeons e a National Comprehensive Cancer Network recomendam que o rastreamento para adenomas duodenais comece aos 20-25 anos de idade, embora possa ser oferecido a pacientes mais novos se houver história familiar de câncer duodenal ou carga significativa de pólipos duodenais.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
[28]Poylin VY, Shaffer VO, Felder SI, et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the management of inherited adenomatous polyposis syndromes. Dis Colon Rectum. 2024 Feb 1;67(2):213-27.
https://journals.lww.com/dcrjournal/fulltext/2024/02000/the_american_society_of_colon_and_rectal_surgeons.6.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37682806?tool=bestpractice.com
[30]Monahan KJ, Bradshaw N, Dolwani S, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut. 2020 Mar;69(3):411-44.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7034349
http://www.ncbi.nlm.nih.gov/pubmed/31780574?tool=bestpractice.com
O American College of Gastroenterologists e a European Society of Medical Oncology recomendam começar mais tarde, entre 25-30 anos de idade.[29]Syngal S, Brand RE, Church JM, et al.; American College of Gastroenterology. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015 Feb;110(2):223-62.
http://www.ncbi.nlm.nih.gov/pubmed/25645574?tool=bestpractice.com
[30]Monahan KJ, Bradshaw N, Dolwani S, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut. 2020 Mar;69(3):411-44.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7034349
http://www.ncbi.nlm.nih.gov/pubmed/31780574?tool=bestpractice.com
[56]Stjepanovic N, Moreira L, Carneiro F, et al. Hereditary gastrointestinal cancers: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019 Oct 1;30(10):1558-71.
https://www.sciencedirect.com/science/article/pii/S0923753419609774
http://www.ncbi.nlm.nih.gov/pubmed/31378807?tool=bestpractice.com
A endoscopia deve ser repetida a cada 4-5 anos, até que sejam encontrados pólipos.[29]Syngal S, Brand RE, Church JM, et al.; American College of Gastroenterology. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015 Feb;110(2):223-62.
http://www.ncbi.nlm.nih.gov/pubmed/25645574?tool=bestpractice.com
[56]Stjepanovic N, Moreira L, Carneiro F, et al. Hereditary gastrointestinal cancers: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019 Oct 1;30(10):1558-71.
https://www.sciencedirect.com/science/article/pii/S0923753419609774
http://www.ncbi.nlm.nih.gov/pubmed/31378807?tool=bestpractice.com
Assim que os pólipos se desenvolverem, os critérios de Spigelman devem ser usados para determinar os intervalos de vigilância adequados:[36]Spigelman AD, Williams CB, Talbot IC, et al. Upper gastrointestinal cancer in patients with familial adenomatous polyposis. Lancet. 1989 Sep 30;2(8666):783-5.
http://www.ncbi.nlm.nih.gov/pubmed/2571019?tool=bestpractice.com
Estádio 0: 3-5 anos
Estádio 1: 2-3 anos
Estádio 2: 1-2 anos
Estádio 3: 6-12 meses
Estádio 4: a vigilância deve ocorrer a cada 3-6 meses, juntamente com apoio cirúrgico para a consideração de duodenectomia.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
Pacientes com polipose avançada devem ser encaminhados a centros especializados para serem atendidos por endoscopistas com experiência em PAF.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
O tratamento endoscópico é usado para a redução do estágio, com o objetivo de protelar a evolução para o estágio 4 da doença. As terapias endoscópicas para adenomas duodenais incluem polipectomia, ressecção endoscópica de mucosa e ablação.[12]Yang J, Gurudu SR, Koptiuch C, et al. American Society for Gastrointestinal Endoscopy guideline on the role of endoscopy in familial adenomatous polyposis syndromes. Gastrointest Endosc. 2020 May;91(5):963-82.e2.
https://linkinghub.elsevier.com/retrieve/pii/S0016-5107(20)30054-7
http://www.ncbi.nlm.nih.gov/pubmed/32169282?tool=bestpractice.com
Não há evidências suficientes para o benefício da quimioprevenção no tratamento de pólipos duodenais. Os pacientes devem ser encaminhados para centros especializados para que sua inscrição em um ensaio clínico seja considerada, caso tenham interesse na quimioprevenção. Atualmente, não há medicamentos aprovados para a prevenção ou a regressão de adenomas duodenais.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
Manejo da PAF atenuada
A eliminação frequente do adenoma colonoscópico pode ser adequada para pacientes com baixa carga de pólipos.[40]Bjork JA, Akerbrant HI, Iselius LE, et al. Risk factors for rectal cancer morbidity and mortality in patients with familial adenomatous polyposis after colectomy and ileorectal anastomosis. Dis Colon Rectum. 2000;43:1719-1725.
http://www.ncbi.nlm.nih.gov/pubmed/11156457?tool=bestpractice.com
[48]van Leerdam ME, Roos VH, van Hooft JE, et al. Endoscopic management of polyposis syndromes: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2019 Sep;51(9):877-895.
https://www.doi.org/10.1055/a-0965-0605
http://www.ncbi.nlm.nih.gov/pubmed/31342472?tool=bestpractice.com
[57]Nugent KP, Phillips RK. Rectal cancer risk in older patients with familial adenomatous polyposis and an ileorectal anastomosis: a cause for concern. Br J Surg. 1992;79:1204-1206.
http://www.ncbi.nlm.nih.gov/pubmed/1334761?tool=bestpractice.com
[58]Parc YR, Olschwang S, Desaint B, et al. Familial adenomatous polyposis: prevalence of adenomas in the ileal pouch after restorative proctocolectomy. Ann Surg. 2001 Mar;233(3):360-4.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1421251
http://www.ncbi.nlm.nih.gov/pubmed/11224623?tool=bestpractice.com
[59]van Duijvendijk P, Vasen HF, Bertario L, et al. Cumulative risk of developing polyps or malignancy at the ileal pouch-anal anastomosis in patients with familial adenomatous polyposis. J Gastrointest Surg. 1999;3:325-330.
http://www.ncbi.nlm.nih.gov/pubmed/10481126?tool=bestpractice.com
Isso geralmente é definido como a presença de >20 adenomas (todos com <1 cm de diâmetro) sem histologia avançada.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
Quando a carga de adenomas não puder ser tratada endoscopicamente, deve-se oferecer a cirurgia. Isso normalmente ocorre quando a carga do pólipo é >20 (em qualquer exame físico individual), os pólipos foram previamente ablados, alguns pólipos têm >1 cm de tamanho, ou é observada histologia avançada em qualquer pólipo.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
A escolha da cirurgia na PAF atenuada é individualizada com base na idade do paciente, história de cirúrgica prévia, localização dos pólipos e preferências do paciente.[48]van Leerdam ME, Roos VH, van Hooft JE, et al. Endoscopic management of polyposis syndromes: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2019 Sep;51(9):877-895.
https://www.doi.org/10.1055/a-0965-0605
http://www.ncbi.nlm.nih.gov/pubmed/31342472?tool=bestpractice.com
Na maioria dos casos, os adenomas retais são poucos, por isso a colectomia com uma anastomose ileorretal (AIR) e vigilância vitalícia e contínua do reto é o manejo de escolha.
Quimioprevenção
A quimioprevenção pode ser considerada como adjuvante no manejo do reto retido ou bolsa ileal em pacientes selecionados com PAF/PAFA após a cirurgia profilática.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
[28]Poylin VY, Shaffer VO, Felder SI, et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the management of inherited adenomatous polyposis syndromes. Dis Colon Rectum. 2024 Feb 1;67(2):213-27.
https://journals.lww.com/dcrjournal/fulltext/2024/02000/the_american_society_of_colon_and_rectal_surgeons.6.aspx
http://www.ncbi.nlm.nih.gov/pubmed/37682806?tool=bestpractice.com
Os dados disponíveis sugerem que sulindaco é o medicamento mais potente para a regressão de pólipos; no entanto, ainda não se sabe se a diminuição da carga de pólipos reduz o risco de câncer colorretal.[9]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal, endometrial, and gastric [internet publication].
https://www.nccn.org/guidelines/category_2
[60]Cruz-Correa M, Hylind LM, Romans KE, et al. Long-term treatment with sulindac in familial adenomatous polyposis: a prospective cohort study. Gastroenterology. 2002 Mar;122(3):641-5.
https://www.doi.org/10.1053/gast.2002.31890
http://www.ncbi.nlm.nih.gov/pubmed/11874996?tool=bestpractice.com
Os pacientes devem ser encaminhados para centros especializados para que sua inscrição em um ensaio clínico seja considerada, caso tenham interesse na quimioprevenção. Atualmente, não há medicamentos aprovados para essa indicação.
