Abordagem
Um forte índice de suspeita deve estar subjacente à investigação da síndrome antifosfolipídica (SAF). Não há critérios de diagnóstico para a SAF. Entretanto, os critérios de classificação (originalmente formulados para fins de pesquisa em Sapporo, Japão, e posteriormente atualizados pelo ACR/EULAR) são frequentemente usados como um guia para o diagnóstico da SAF.[1][2][3] Esses critérios de classificação baseiam-se em critérios clínicos, incluindo trombose e/ou morbidade gestacional, e fatores laboratoriais que incluem exames persistentemente positivos para anticorpos de SAF.[1][2] Os critérios do ACR/EULAR são considerados mais específicos para SAF, o que significa que um paciente tem alta probabilidade de ter SAF se os critérios forem atendidos. Os critérios de Sapporo são mais sensíveis, o que significa que é menos provável que não detectem pacientes com SAF. Pacientes que atendem aos critérios de Sapporo, mas não aos critérios do ACR/EULAR, ainda podem ter SAF e o julgamento clínico deve ser usado para determinar a melhor estratégia de tratamento.[29]
Aqueles com pelo menos um teste de anticorpos antifosfolipídeos (aFL) positivo dentro de 3 anos de um critério clínico associado a aFL podem ser classificados com os critérios do ACR/EULAR.[2]
Existem seis domínios clínicos (tromboembolismo venoso macrovascular, trombose arterial macrovascular, microvascular, obstétrica, valvar cardíaca e hematológica) e dois domínios laboratoriais (testes de aFL por ensaio de coagulação e ensaio de fase sólida) na classificação do ACR/EULAR.[2]
Os itens em cada um dos oito domínios recebem um escore entre 1 e 7. As pessoas que pontuam pelo menos 3 pontos nos domínios clínico e laboratorial são classificadas como portadoras de SAF.[2]
Nos critérios do ACR/EULAR, a trombose venosa ou arterial que ocorre como resultado de riscos conhecidos e fatores desencadeantes recebe um escore mais baixo. Se houver fatores de risco fortes ou múltiplos, o teste para SAF não é recomendado.
Os pacientes com anticorpos IgM recebem pontuações mais baixas e, isoladamente, não atingiriam o limite de pontuação laboratorial para o diagnóstico de SAF nos novos critérios do ACR/EULAR. Existe controvérsia sobre o risco trombótico desses pacientes, com a necessidade reconhecida de pesquisas adicionais para determinar o tratamento apropriado.
História e exame físico
Os aspectos principais da história que sustentam o diagnóstico incluem o seguinte.[1][2]
Um evento trombótico documentado (venoso, arterial ou microvascular).[Figure caption and citation for the preceding image starts]: Imagem por ressonância magnética direta do trombo em uma trombose venosa profunda (TVP) bilateral proximalDo acervo pessoal de ensino do Professor Hunt; usado com permissão [Citation ends].

História de perda gestacional recorrente <10 semanas de gestação ou perda gestacional entre a 10ª e a 34ª semana de gestação ou complicações relacionadas à gravidez (eclâmpsia, pré-eclâmpsia grave, restrição do crescimento intrauterino ou insuficiência placentária) resultando em nascimento prematuro de um neonato morfologicamente normal antes da 34ª semana de gestação.
Eventos tromboembólicos venosos aparentemente espontâneos e pacientes jovens (<50 anos) que apresentem acidente vascular cerebral (AVC), trombo na artéria coronária ou eventos arteriais periféricos requerem o teste para anticorpos SAF.
Infarto do miocárdio trombótico: em casos com essa apresentação, deve-se assumir a presença de SAF até que o contrário seja confirmado.
Anormalidades na valva cardíaca, como espessamento valvar inexplicável ou presença de vegetações.
Uma história de anormalidades hematológicas, como trombocitopenia inexplicável ou anemia hemolítica.
A SAF que ocorre junto com um distúrbio subjacente reumático ou doença do tecido conjuntivo era conhecida como SAF secundária. Uma história de lúpus ou de síndrome semelhante ao lúpus é um fator de risco para SAF, mas não é um critério de diagnóstico clínico. Outras manifestações da doença incluem distúrbios reumatológicos ou autoimunes, como síndrome de Sjögren e artrite reumatoide. Várias manifestações clínicas associadas à SAF não estão incluídas nos critérios de classificação específicos e incluem livedo reticular, erupção cutânea (que geralmente é inespecífica), vasculite, nefropatia, edema, proteinúria e hemorragia pulmonar.[4][30][Figure caption and citation for the preceding image starts]: Livedo reticularDo acervo pessoal de ensino do Professor Hunt; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Livedo reticularDo acervo pessoal de ensino do Professor Hunt; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Livedo reticularDo acervo pessoal de ensino do Professor Hunt; usado com permissão [Citation ends].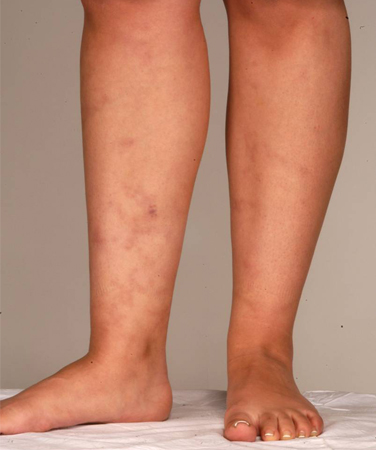
Em casos raros, nefropatia (manifestando-se como edema e proteinúria) pode ser decorrente de trombose microangiopática secundária à SAF.[31] As manifestações neurológicas incluem convulsão, cefaleia, perda de memória e mielopatia transversa.[32][33] Pacientes também podem apresentar artralgia ou artrite. Deve-se prestar atenção aos sinais de síndrome pós-flebítica, como edema dos membros inferiores, veia varicosa, descoloração da pele e ulceração.[34]
Investigação laboratorial
O rastreamento de anticorpos antifosfolipídeos deve ser realizada se houver suspeita clínica de SAF. Confirmação laboratorial da presença de anticorpos antifosfolipídeos em 2 ocasiões com um intervalo de pelo menos 12 semanas é necessária para o diagnóstico.[35] Os anticorpos aFL incluem: anticoagulante lúpico, anticorpo anticardiolipina e anticorpo anti-beta 2-glicoproteína I (anticorpo anti-B2GP I).[2] A presença de anticorpos antifosfolipídeos pode ser transitória devido a infecções, distúrbios linfoproliferativos e exposições a medicamentos. Em uma proporção significativa de pacientes, a detecção de anticorpos antifosfolipídeos é um achado incidental em pacientes aparentemente saudáveis, e o risco de trombose nesses pacientes é relativamente baixo. Por esse motivo, a SAF é confirmada após 2 testes, com intervalo de 12 semanas.
O diagnóstico de anticoagulantes lúpicos baseia-se em ensaios de coagulação e envolve um estágio inicial de detecção, seguido por um estágio de confirmação.[36][37] O princípio do ensaio é o prolongamento, pelo anticorpo, do teste de coagulação dependente de fosfolipídeo. No estágio confirmatório, a adição de fosfolipídeos carregados negativamente se liga ao anticorpo, reduzindo, assim, o tempo de coagulação. Sempre que possível, o teste de anticoagulante lúpico deve ser realizado antes do início da anticoagulação, pois os anticoagulantes podem levar a resultados falso-positivos. Quando não for possível, o teste pode ser realizado com heparina não fracionada ou heparina de baixo peso molecular, desde que o ensaio contenha um neutralizante de heparina e os níveis do medicamento não sejam supraterapêuticos.[38] O teste para anticoagulante lúpico em pacientes que tomam anticoagulante oral direto não é recomendado, a menos que sejam removidos ou neutralizados. Anticorpos anticardiolipina e anticorpos anti-B2GP-I são detectados pelo imunoensaio de fase sólida (ensaio de imunoadsorção enzimática [ELISA] padronizado) e não são afetados pela anticoagulação. Os anticorpos anticardiolipina devem ser do isotipo imunoglobulina (Ig) G e/ou IgM no soro ou plasma, presentes em título médio ou alto (ou seja, >40 unidades de fosfolipídeos IgG [GPL] ou unidades de fosfolipídeos IgM [MPL] ou >percentil 99).[1][2][39] O anticorpo anti-B2GP-I deve ser do isotipo IgG e/ou IgM no soro ou plasma (no título >99º percentil).[2]
Deve-se enfatizar que apenas cerca de um terço dos pacientes com SAF apresentam anticoagulante lúpico, anticorpos anticardiolipina e anti-beta 2-glicoproteína I (ou seja, são triplo-positivos). Muitos pacientes podem ser positivos somente para o anticoagulante lúpico ou para o anticorpo anticardiolipina isolado. Assim, uma investigação inicial adequada para SAF deve incluir todos os exames laboratoriais.
Outras investigações laboratoriais devem incluir: hemograma completo para descartar trombocitopenia e anemia, creatinina e ureia para a função renal, e rastreamento de distúrbios autoimunes, se houver suspeita clínica. Em pacientes jovens que apresentam tromboembolismo venoso e história familiar de trombose, um exame de trombofilia hereditária medindo os níveis de proteína C, proteína S, antitrombina e fator V de Leiden e/ou reação em cadeia da polimerase para mutação do gene da protrombina (G-20210-A) deve ser considerado para descartar trombofilia hereditária subjacente.
Em pacientes com anticorpos antifosfolipídeos, ou com história de morbidade relacionada à gestação (SAF obstétrica), testes para identificar distúrbios trombofílicos adicionais devem ser feitos somente se houver um alto índice de suspeita de trombofilia hereditária, como história familiar de tromboembolismo venoso.
Exames por imagem
Em pacientes que apresentam características clínicas que sugerem evento tromboembólico venoso ou arterial, investigações radiológicas apropriadas devem ser realizadas. Doppler venoso ou venografia por tomografia computadorizada ou ressonância nuclear magnética (RNM) devem ser realizados para confirmar trombose venosa profunda.[Figure caption and citation for the preceding image starts]: Imagem por ressonância magnética direta do trombo em uma trombose venosa profunda (TVP) bilateral proximalDo acervo pessoal de ensino do Professor Hunt; usado com permissão [Citation ends]. Angiotomografia do tórax e cintilografia de ventilação/perfusão (V/Q) são necessárias para confirmação em pacientes com suspeita de embolia pulmonar. Imagem do crânio com RNM é necessária para pacientes com AVC. A ecocardiografia é indicada para pacientes com características clínicas indicativas de lesões ou vegetações na valva cardíaca (isto é, tromboembolismo arterial inexplicado ou sopro cardíaco). A ecocardiografia transesofágica é o estudo mais sensível para identificar essas lesões e deve ser realizada se houver alto índice de suspeita.
Angiotomografia do tórax e cintilografia de ventilação/perfusão (V/Q) são necessárias para confirmação em pacientes com suspeita de embolia pulmonar. Imagem do crânio com RNM é necessária para pacientes com AVC. A ecocardiografia é indicada para pacientes com características clínicas indicativas de lesões ou vegetações na valva cardíaca (isto é, tromboembolismo arterial inexplicado ou sopro cardíaco). A ecocardiografia transesofágica é o estudo mais sensível para identificar essas lesões e deve ser realizada se houver alto índice de suspeita.
O uso deste conteúdo está sujeito ao nosso aviso legal