Doença de Cushing (adenoma hipofisário)
A doença de Cushing é causada por tumores hipofisários secretores de hormônio adrenocorticotrófico (ACTH). O objetivo final da terapia é remover o adenoma hipofisário causador e normalizar os níveis de cortisol, ao mesmo tempo preservando a função da hipófise.
A terapia de primeira linha é a ressecção transfenoidal (TSS) do adenoma hipofisário causador por um cirurgião experiente.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[66]Nieman LK, Biller BM, Findling JW, et al. Treatment of Cushing’s syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2015 Aug;100(8):2807-31.
https://academic.oup.com/jcem/article/100/8/2807/2836065
http://www.ncbi.nlm.nih.gov/pubmed/26222757?tool=bestpractice.com
[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
A cirurgia pode ser feita usando-se uma abordagem endoscópica ou microscópica. Os resultados são comparáveis entre ambas as técnicas para microadenomas.[70]Broersen LHA, Biermasz NR, van Furth WR, et al. Endoscopic vs. microscopic transsphenoidal surgery for Cushing's disease: a systematic review and meta-analysis. Pituitary. 2018 Oct;21(5):524-34.
https://link.springer.com/article/10.1007%2Fs11102-018-0893-3
http://www.ncbi.nlm.nih.gov/pubmed/29767319?tool=bestpractice.com
Ainda não está claro se existe potencial benefício incremental com uma abordagem endoscópica para os macroadenomas.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[70]Broersen LHA, Biermasz NR, van Furth WR, et al. Endoscopic vs. microscopic transsphenoidal surgery for Cushing's disease: a systematic review and meta-analysis. Pituitary. 2018 Oct;21(5):524-34.
https://link.springer.com/article/10.1007%2Fs11102-018-0893-3
http://www.ncbi.nlm.nih.gov/pubmed/29767319?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Algoritmo para o tratamento da doença de Cushing (teste de supressão com dexametasona. IPSS = amostra de sangue dos seios petrosos inferiores. ACTH = hormônio adrenocorticotrófico. *A cirurgia da hipófise deve ser realizada por um cirurgião experiente. †Ausência de adenoma corado com ACTH. §Requer monitoramento vitalício para hipopituitarismo e neoplasias secundárias no campo de radiação. ¶Na dose máxima tolerada do medicamento)Fleseriu M et al. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75; usado com permissão [Citation ends].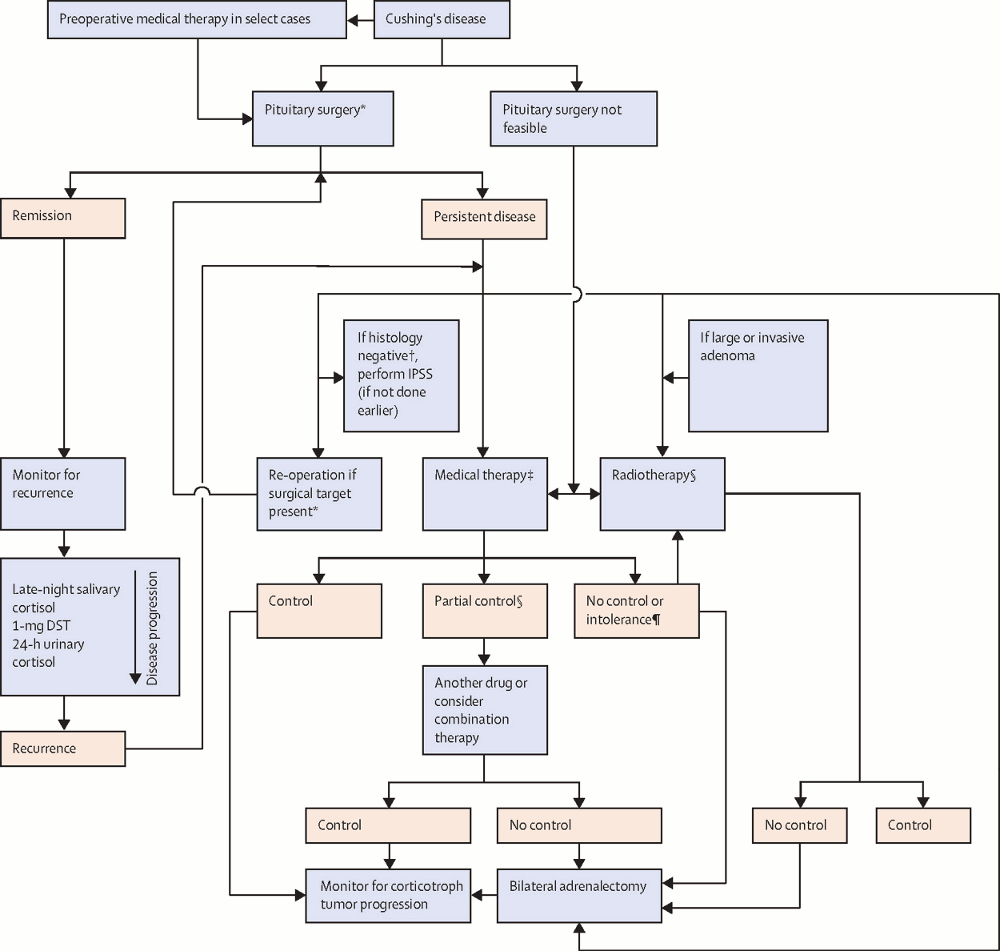
Muitos pacientes são medicados com corticosteroides após a cirurgia da hipófise, mas devem ter a remissão avaliada durante a primeira semana do pós-operatório.[68]Hammer GD, Tyrrell JB, Lamborn KR, et al. Transsphenoidal microsurgery for Cushing's disease: initial outcome and long-term results. J Clin Endocrinol Metab. 2004 Dec;89(12):6348-57.
https://academic.oup.com/jcem/article/89/12/6348/2844760
http://www.ncbi.nlm.nih.gov/pubmed/15579802?tool=bestpractice.com
Isso é feito medindo-se o cortisol matinal pelo menos 24 horas após a última dose de corticoterapia. Os pacientes com cortisol matinal pós-operatório de <55 nanomoles/L (<2 microgramas/dL) são considerados em remissão e podem passar para um acompanhamento em longo prazo. Os pacientes com cortisol matinal pós-operatório de >138 nanomoles/L (>5 microgramas/dL) exigem avaliação mais cuidadosa e, possivelmente, tratamento adicional. Os pacientes com cortisol matinal entre 55 e 138 nanomoles/L (2 e 5 microgramas/dL) devem ser acompanhados com medições adicionais para a detecção de redução dos níveis matinais de cortisol subsequentes. Os indivíduos com cortisol matinal >55 nanomoles/L (>2 microgramas/dL) após a cirurgia têm 2.5 vezes mais probabilidade de recorrência que aqueles com níveis de cortisol <55 nanomoles/L (<2 microgramas/dL).[71]Abu Dabrh AM, Singh Ospina NM, Al Nofal A, et al. Predictors of biochemical remission and recurrence after surgical and radiation treatments of Cushing disease: a systematic disease: a systematic review and meta-analysis. Endocr Pract. 2016 Apr;22(4):466-75.
http://www.ncbi.nlm.nih.gov/pubmed/26789343?tool=bestpractice.com
[72]Patil CG, Prevedello DM, Lad SP, et al. Late recurrences of Cushing's disease after initial successful transsphenoidal surgery. J Clin Endocrinol Metab. 2008 Feb;93(2):358-62.
https://academic.oup.com/jcem/article/93/2/358/2597991
http://www.ncbi.nlm.nih.gov/pubmed/18056770?tool=bestpractice.com
[73]Fleseriu M, Hamrahian AH, Hoffman AR, et al; AACE Neuroendocrine and Pituitary Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology Disease State Clinical Review: diagnosis of recurrence in Cushing disease. Endocr Pract. 2016 Dec;22(12):1436-48.
http://www.ncbi.nlm.nih.gov/pubmed/27643842?tool=bestpractice.com
O hipocortisolismo pós-operatório é preditivo da remissão, e por isso alguns centros defendem a suspensão da corticoterapia de rotina após a cirurgia da hipófise e a monitorização dos níveis de cortisol a cada 8 horas, ou se ocorrerem sintomas de insuficiência adrenal.[74]Sughrue ME, Shah JK, Devin JK, et al. Utility of the immediate postoperative cortisol concentrations in patients with Cushing's disease. Neurosurgery. 2010 Sep;67(3):688-95.
http://www.ncbi.nlm.nih.gov/pubmed/20651632?tool=bestpractice.com
Se ocorrer insuficiência adrenal, ou se forem documentados baixos níveis de cortisol, a corticoterapia é iniciada. Outros centros iniciam a corticoterapia de rotina imediatamente após a cirurgia e avaliam a remissão do hipercortisolismo posteriormente, durante a fase pós-operatória.[75]Hameed N, Yedinak CG, Brzana J, et al. Remission rate after transsphenoidal surgery in patients with pathologically confirmed Cushing's disease, the role of cortisol, ACTH assessment and immediate reoperation: a large single center experience. Pituitary. 2013 Dec;16(4):452-8.
http://www.ncbi.nlm.nih.gov/pubmed/23242860?tool=bestpractice.com
Os corticosteroides costumam ser rapidamente reduzidos a doses fisiológicas em 1 semana ou menos (em geral com alta hospitalar). O teste para verificar se o eixo hipotálamo-hipófise-adrenal (HHA) se recuperou poderá ser feito por meio de acompanhamento em 3 meses após a cirurgia. O teste é geralmente um cortisol matinal antes de o paciente tomar a dose matinal de hidrocortisona, se a terapia com hidrocortisona tiver sido mantida. Níveis de cortisol >552 nanomoles/L (>20 microgramas/dL) indicam recuperação do eixo. Níveis <83 nanomoles/L (<3 microgramas/dL) indicam uma necessidade de corticosteroides continuada. Níveis entre 83 nanomoles/L (3 microgramas/dL) e 552 nanomoles/L (20 microgramas/dL) exigem novos testes (teste de estimulação com cosintropina, teste de tolerância à insulina ou teste de metirapona). Uma vez que a recuperação do eixo HHA tiver sido estabelecida, os pacientes precisam ser submetidos a testes para possíveis recorrências. O teste de cortisol salivar parece ser o melhor preditor de recorrência precoce.[73]Fleseriu M, Hamrahian AH, Hoffman AR, et al; AACE Neuroendocrine and Pituitary Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology Disease State Clinical Review: diagnosis of recurrence in Cushing disease. Endocr Pract. 2016 Dec;22(12):1436-48.
http://www.ncbi.nlm.nih.gov/pubmed/27643842?tool=bestpractice.com
[76]Danet-Lamasou M, Asselineau J, Perez P, et al. Accuracy of repeated measurements of late-night salivary cortisol to screen for early-stage recurrence of Cushing's disease following pituitary surgery. Clin Endocrinol (Oxf). 2015 Feb;82(2):260-6.
http://www.ncbi.nlm.nih.gov/pubmed/24975391?tool=bestpractice.com
Deve-se considerar a utilização de terapia adicional nos pacientes com falha da cirurgia hipofisária inicial ou com recorrência da doença. A incidência de recorrência na doença de Cushing é alta, com 50% das recorrências ocorrendo durante os primeiros 50 meses após a primeira cirurgia.[77]Braun LT, Rubinstein G, Zopp S, et al. Recurrence after pituitary surgery in adult Cushing's disease: a systematic review on diagnosis and treatment. Endocrine. 2020 Nov;70(2):218-31.
https://www.doi.org/10.1007/s12020-020-02432-z
http://www.ncbi.nlm.nih.gov/pubmed/32743767?tool=bestpractice.com
As terapias padrão incluem repetição da cirurgia da hipófise, radioterapia, adrenalectomia bilateral ou terapia medicamentosa.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
[78]Reincke M, Ritzel K, Osswald A, et al. A critical re-appraisal of bilateral adrenalectomy for ACTH-dependent Cushing's syndrome. Eur J Endocrinol. 2015 Oct;173(4):M23-32.
https://eje.bioscientifica.com/view/journals/eje/173/4/M23.xml
http://www.ncbi.nlm.nih.gov/pubmed/25994948?tool=bestpractice.com
As taxas de sucesso dessas opções de tratamento variam entre 25% (para algumas das terapias medicamentosas) e 100% (adrenalectomia bilateral). As opções de tratamento têm vantagens, limitações e efeitos colaterais específicos, portanto, as decisões de tratamento devem ser individualizadas de acordo com as necessidades específicas do paciente e o risco de complicações.[77]Braun LT, Rubinstein G, Zopp S, et al. Recurrence after pituitary surgery in adult Cushing's disease: a systematic review on diagnosis and treatment. Endocrine. 2020 Nov;70(2):218-31.
https://www.doi.org/10.1007/s12020-020-02432-z
http://www.ncbi.nlm.nih.gov/pubmed/32743767?tool=bestpractice.com
[79]Cuevas-Ramos D, Fleseriu M. Treatment of Cushing's disease: a mechanistic update. J Endocrinol. 2014 Nov;223(2):R19-39.
https://joe.bioscientifica.com/view/journals/joe/223/2/R19.xml
http://www.ncbi.nlm.nih.gov/pubmed/25134660?tool=bestpractice.com
A reoperação é frequentemente a terapia preferencial se a cirurgia inicial falhar. Ela deve ser considerada em todos os pacientes com a doença recorrente ou persistente. A cirurgia é efetiva em aproximadamente dois terços dos pacientes.[80]Friedman RB, Oldfield EH, Nieman LK, et al. Repeat transsphenoidal surgery for Cushing's disease. J Neurosurg. 1989 Oct;71(4):520-7.
http://www.ncbi.nlm.nih.gov/pubmed/2552045?tool=bestpractice.com
[81]Benveniste RJ, King WA, Walsh J, et al. Repeated transsphenoidal surgery to treat recurrent or residual pituitary adenoma. J Neurosurg. 2005 Jun;102(6):1004-12.
http://www.ncbi.nlm.nih.gov/pubmed/16028758?tool=bestpractice.com
[82]Hofmann BM, Hlavac M, Kreutzer J, et al. Surgical treatment of recurrent Cushing's disease. Neurosurgery. 2006 Jun;58(6):1108-18.
http://www.ncbi.nlm.nih.gov/pubmed/16723890?tool=bestpractice.com
No entanto, o risco de deficiência hipofisária após a reoperação é de 50%. Ela é significativamente maior que após a terapia cirúrgica inicial.[80]Friedman RB, Oldfield EH, Nieman LK, et al. Repeat transsphenoidal surgery for Cushing's disease. J Neurosurg. 1989 Oct;71(4):520-7.
http://www.ncbi.nlm.nih.gov/pubmed/2552045?tool=bestpractice.com
Se a reoperação for ineficaz, ou se um paciente não for candidato à reoperação, outra modalidade deve ser considerada.
A radioterapia por radioterapia fracionada convencional ou radiocirurgia estereotáxica é mais comumente usada nos pacientes com hipercortisolismo persistente após ressecção incompleta de tumor corticotrófico, particularmente se o tumor for agressivo ou invasivo, ou considerado irressecável.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
A radioterapia permite o controle do hipercortisolismo dentro de 3 a 5 anos em mais da metade dos pacientes.[83]Sonino N, Zielezny M, Fava GA, et al. Risk factors and long-term outcome in pituitary-dependent Cushing's disease. J Clin Endocrinol Metab. 1996 Jul;81(7):2647-52.
https://academic.oup.com/jcem/article/81/7/2647/2875568
http://www.ncbi.nlm.nih.gov/pubmed/8675592?tool=bestpractice.com
[84]Castinetti F, Nagai M, Dufour H, et al. Gamma knife radiosurgery is a successful adjunctive treatment in Cushing's disease. Eur J Endocrinol. 2007 Jan;156(1):91-8.
https://eje.bioscientifica.com/view/journals/eje/156/1/1560091.xml
http://www.ncbi.nlm.nih.gov/pubmed/17218730?tool=bestpractice.com
[85]Devin JK, Allen GS, Cmelak AJ, et al. The efficacy of linear accelerator radiosurgery in the management of patients with Cushing's disease. Stereotact Funct Neurosurg. 2004;82(5-6):254-62.
http://www.ncbi.nlm.nih.gov/pubmed/15665560?tool=bestpractice.com
[86]Estrada J, Boronat M, Mielgo M, et al. The long-term outcome of pituitary irradiation after unsuccessful transsphenoidal surgery in Cushing's disease. N Engl J Med. 1997 Jan 16;336(3):172-7.
https://www.nejm.org/doi/full/10.1056/NEJM199701163360303
http://www.ncbi.nlm.nih.gov/pubmed/8988897?tool=bestpractice.com
[87]Starke RM, Williams BJ, Vance ML, et al. Radiation therapy and stereotactic radiosurgery for the treatment of Cushing's disease: an evidence-based review. Curr Opin Endocrinol Diabetes Obes. 2010 Aug;17(4):356-64.
http://www.ncbi.nlm.nih.gov/pubmed/20531182?tool=bestpractice.com
Esta modalidade é, talvez, melhor usada como parte da terapêutica para pacientes com hipercortisolismo residual leve, já que os efeitos completos da terapêutica podem levar vários anos para serem percebidos. A radiação de tumores localizados próximo ao quiasma óptico faz aumentar o risco de dano ao quiasma óptico, e esse risco deve ser considerado antes da terapêutica. Também pode ocorrer hipopituitarismo após radioterapia, que é outro risco a ser considerado antes do início da terapêutica. O risco exato do hipopituitarismo após a radioterapia fracionada convencional versus radiocirurgia estereotáxica é incerto, mas parece similar.
Pacientes sem sucesso na re-operação que manifestam hipercortisolismo grave devem ser avaliados para tratamento com terapia médica, adrenalectomia bilateral ou uma combinação destas terapias. A vantagem dessas abordagens é o rápido início de redução nos níveis de cortisol ou bloqueio da ação do cortisol.
O tratamento clínico com um análogo da somatostatina (pasireotida), um agonista dopaminérgico (cabergolina), um inibidor da esteroidogênese (osilodrostat, cetoconazol, levocetoconazol, metirapona, mitotano e etomidato) ou um antagonista do receptor de glicocorticoide (mifepristona) tem sido cada vez mais utilizado na prática clínica. A terapia medicamentosa é indicada para controlar a secreção de cortisol nos pacientes com hipercortisolismo leve, como adjuvante de curto prazo para o hipercortisolismo grave antes que outras terapias sejam realizadas, no pré-operatório para diminuir o período de tempo até que o controle do hipercortisolismo seja alcançado por radioterapia, nos casos com hipercortisolismo persistente ou recorrente após a cirurgia, ou quando a cirurgia é recusada ou inviável (por exemplo, alto risco cirúrgico, doença metastática).[88]Varlamov EV, McCartney S, Fleseriu M. Functioning pituitary adenomas - current treatment options and emerging medical therapies. Eur Endocrinol. 2019 Apr;15(1):30-40.
https://www.touchendocrinology.com/pituitary/journal-articles/functioning-pituitary-adenomas-current-treatment-options-and-emerging-medical-therapies
http://www.ncbi.nlm.nih.gov/pubmed/31244908?tool=bestpractice.com
[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
[91]Broersen LHA, Jha M, Biermasz NR, et al. Effectiveness of medical treatment for Cushing's syndrome: a systematic review and meta-analysis. Pituitary. 2018 Dec;21(6):631-41.
https://link.springer.com/article/10.1007%2Fs11102-018-0897-z
http://www.ncbi.nlm.nih.gov/pubmed/29855779?tool=bestpractice.com
No entanto, há escassez de estudos de alta qualidade sobre a terapia medicamentosa na doença de Cushing, e deve-se ter cuidado ao comparar taxas de eficácia em razão da variabilidade no projeto e na qualidade do estudo.[91]Broersen LHA, Jha M, Biermasz NR, et al. Effectiveness of medical treatment for Cushing's syndrome: a systematic review and meta-analysis. Pituitary. 2018 Dec;21(6):631-41.
https://link.springer.com/article/10.1007%2Fs11102-018-0897-z
http://www.ncbi.nlm.nih.gov/pubmed/29855779?tool=bestpractice.com
Individualize a terapia medicamentosa para pacientes com doença de Cushing com base no quadro clínico, incluindo a gravidade do hipercortisolismo.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
Em pacientes com doença grave, trate agressivamente para normalizar as concentrações de cortisol (ou a ação do cortisol). Use vários testes seriados do cortisol urinário livre e do cortisol salivar noturno para monitorar os desfechos do tratamento.
A pasireotida é um análogo da somatostatina que atinge seletivamente os receptores da somatostatina em adenomas corticotróficos e está sendo usada para tratar clinicamente a doença de Cushing.[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
Ela é vinculada a uma grande variedade de receptores da somatostatina, mas com maior afinidade com o receptor 5, que é predominantemente expressado em pacientes com adenomas corticotróficos. O uso da formulação de liberação regular da pasireotida demonstrou reduzir os níveis de cortisol na maioria dos pacientes com doença de Cushing, mas normaliza os níveis de cortisol em somente 25% dos pacientes.[92]Colao A, Petersenn S, Newell-Price J, et al. A 12-month phase 3 study of pasireotide in Cushing's disease. N Engl J Med. 2012 Mar 8;366(10):914-24.
https://www.nejm.org/doi/full/10.1056/NEJMoa1105743
http://www.ncbi.nlm.nih.gov/pubmed/22397653?tool=bestpractice.com
A formulação de ação prolongada da pasireotida mostrou normalização em aproximadamente 40% dos pacientes, mas observou-se hiperglicemia em até 80% dos pacientes.[93]Lacroix A, Gu F, Gallardo W, et al. Efficacy and safety of once-monthly pasireotide in Cushing's disease: a 12 month clinical trial. Lancet Diabetes Endocrinol. 2018 Jan;6(1):17-26.
http://www.ncbi.nlm.nih.gov/pubmed/29032078?tool=bestpractice.com
Em um estudo foi observado o encolhimento do tumor em 62.5% dos pacientes após 6 meses de tratamento com pasireotide.[94]Simeoli C, Auriemma RS, Tortora F, et al. The treatment with pasireotide in Cushing's disease: effects of long-term treatment on tumor mass in the experience of a single center. Endocrine. 2015 Dec;50(3):725-40.
http://www.ncbi.nlm.nih.gov/pubmed/25743263?tool=bestpractice.com
Cortisol salivar também diminuiu após o tratamento; assim, o cortisol salivar pode ser um biomarcador mais conveniente para seguir na avaliação da resposta ao tratamento em pacientes com doença de Cushing.[95]Findling JW, Fleseriu M, Newell-Price J, et al. Late-night salivary cortisol may be valuable for assessing treatment response in patients with Cushing's disease: 12-month, phase III pasireotide study. Endocrine. 2016 Nov;54(2):516-23.
https://link.springer.com/article/10.1007%2Fs12020-016-0978-6
http://www.ncbi.nlm.nih.gov/pubmed/27209465?tool=bestpractice.com
Uma experiência de 10 anos de duração realizada em um único centro com o pasireotide relatou benefícios bioquímicos e clínicos persistentes em aproximadamente 60% dos pacientes com doença de Cushing.[96]Trementino L, Michetti G, Angeletti A, et al. A single-center 10-year experience with pasireotide in Cushing's disease: patients' characteristics and outcome. Horm Metab Res. 2016 May;48(5):290-8.
https://www.thieme-connect.com/products/ejournals/html/10.1055/s-0042-101347
http://www.ncbi.nlm.nih.gov/pubmed/27127913?tool=bestpractice.com
Essa terapêutica é direcionada à hipófise e só deve ser usada em pacientes com hipercortisolismo causado por tumores da hipófise secretores do ACTH.[97]Petersenn S, Fleseriu M. Pituitary-directed medical therapy in Cushing's disease. Pituitary. 2015 Apr;18(2):238-44.
http://www.ncbi.nlm.nih.gov/pubmed/25627118?tool=bestpractice.com
Existe um alto risco de hiperglicemia, o que requer uma seleção cuidadosa dos pacientes, e um risco de prolongamento do intervalo QTc.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
A cabergolina, um agonista dopaminérgico, foi usada off-label no tratamento da doença de Cushing em alguns países, com resultados limitados.[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
[98]Palui R, Sahoo J, Kamalanathan S, et al. Effect of cabergoline monotherapy in Cushing's disease: an individual participant data meta-analysis. J Endocrinol Invest. 2018 Dec;41(12):1445-55.
http://www.ncbi.nlm.nih.gov/pubmed/30097903?tool=bestpractice.com
Os inibidores da esteroidogênese (agentes que diminuem a produção de corticosteroides adrenais, como osilodrostat, cetoconazol, levoketoconazol, metirapona, mitotano e etomidato) podem ser usados (embora off-label em alguns países, exceto o osilodrostat) no tratamento da síndrome de Cushing.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
O osilodrostat é um potente inibidor oral da esteroidogênese (inibe o esteroide 11-beta-hidroxilase) aprovado nos EUA para o tratamento da doença de Cushing em pacientes nos quais a cirurgia hipofisária não é uma opção ou não foi curativa, e na Europa e no Japão para tratamento da síndrome de Cushing endógena.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[99]Pivonello R, Fleseriu M, Newell-Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing's disease (LINC 3): a multicentre phase III study with a double-blind, randomised withdrawal phase. Lancet Diabetes Endocrinol. 2020 Sep;8(9):748-61.
http://www.ncbi.nlm.nih.gov/pubmed/32730798?tool=bestpractice.com
O osilodrostat reduz rapidamente o cortisol livre urinário com melhoras associadas nos sinais clínicos de hipercortisolismo e, geralmente, é bem tolerado.[99]Pivonello R, Fleseriu M, Newell-Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing's disease (LINC 3): a multicentre phase III study with a double-blind, randomised withdrawal phase. Lancet Diabetes Endocrinol. 2020 Sep;8(9):748-61.
http://www.ncbi.nlm.nih.gov/pubmed/32730798?tool=bestpractice.com
Existe o risco de hipocortisolismo, hipocalemia e prolongamento do intervalo QTc; um monitoramento cuidadoso para hiperandrogenismo é necessário nas mulheres.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
O cetoconazol tem início relativamente rápido de inibição da esteroidogênese. Cetoconazol pode causar lesão hepática grave de natureza idiopática e insuficiência adrenal.[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
[100]Castinetti F, Guignat L, Giraud P, et al. Ketoconazole in Cushing's disease: is it worth a try? J Clin Endocrinol Metab. 2014 May;99(5):1623-30.
https://academic.oup.com/jcem/article/99/5/1623/2537349
http://www.ncbi.nlm.nih.gov/pubmed/24471573?tool=bestpractice.com
[101]US Food and Drug Administration. FDA drug safety communication: FDA warns that prescribing of Nizoral (ketoconazole) oral tablets for unapproved uses including skin and nail infections continues; linked to patient death. May 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-prescribing-nizoral-ketoconazole-oral-tablets-unapproved
Se usado, o fígado e a função adrenal devem ser monitorados antes e durante o tratamento. Seu uso requer orientação especializada e é contraindicado em pacientes com doença hepática.[101]US Food and Drug Administration. FDA drug safety communication: FDA warns that prescribing of Nizoral (ketoconazole) oral tablets for unapproved uses including skin and nail infections continues; linked to patient death. May 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-prescribing-nizoral-ketoconazole-oral-tablets-unapproved
O levocetoconazol é um inibidor da esteroidogênese adrenal aprovado para tratamento nos EUA.[102]Fleseriu M, Castinetti F. Updates on the role of adrenal steroidogenesis inhibitors in Cushing's syndrome: a focus on novel therapies. Pituitary. 2016 Dec;19(6):643-53.
https://link.springer.com/article/10.1007/s11102-016-0742-1
http://www.ncbi.nlm.nih.gov/pubmed/27600150?tool=bestpractice.com
[103]Fleseriu M, Pivonello R, Elenkova A, et al. Efficacy and safety of levoketoconazole in the treatment of endogenous Cushing's syndrome (SONICS): a phase 3, multicentre, open-label, single-arm trial. Lancet Diabetes Endocrinol. 2019 Nov;7(11):855-65.
http://www.ncbi.nlm.nih.gov/pubmed/31542384?tool=bestpractice.com
[104]Zacharieva SZ, Pivonello R, Elenkova A, et al. MON-332 safety and efficacy of levoketoconazole in the treatment of endogenous Cushing’s syndrome (LOGICS): a double-blind, placebo-controlled, withdrawal study. J Endocr Soc. 2020 May 8;4(suppl 1):MON-332.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7208150
A metirapona oferece rápido início de inibição e pode ser obtida para uso compassivo nos EUA.
O mitotano tem propriedades adrenostáticas e adrenolíticas, mas tem eficácia protelada devido ao início de ação lento e uma janela terapêutica estreita.[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
Raramente é usado para a síndrome de Cushing devido a causas que não sejam o carcinoma de adrenal.
O etomidato é um agente adrenostático potente com início de ação rápido. É usado apenas em emergências (por exemplo, psicose induzida por hipercortisol) e deve ser administrado por via intravenosa.[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
A mifepristona, um antagonista do receptor de glicocorticoide, bloqueia o efeito do cortisol no nível do receptor e deve ser considerada em pacientes com distúrbios clínicos e metabólicos de hipercortisolismo contínuo com hiperglicemia e/ou diabetes. A Food and Drug Administration aprovou a mifepristona para o tratamento da hiperglicemia associada com a síndrome de Cushing em pacientes com diabetes mellitus do tipo 2. Os níveis de cortisol e ACTH podem aumentar com o uso de mifepristona devido à inibição do feedback.[105]Fleseriu M, Findling JW, Koch CA, et al. Changes in plasma ACTH levels and corticotroph tumor size in patients with Cushing's disease during long-term treatment with the glucocorticoid receptor antagonist mifepristone. J Clin Endocrinol Metab. 2014 Oct;99(10):3718-27.
https://academic.oup.com/jcem/article/99/10/3718/2836437
http://www.ncbi.nlm.nih.gov/pubmed/25013998?tool=bestpractice.com
Dessa forma, os níveis de cortisol não devem ser usados para guiar a terapia nos pacientes tratados com mifepristona.[106]Fleseriu M, Biller BM, Findling JW, et al; SEISMIC Study Investigators. Mifepristone, a glucocorticoid receptor antagonist, produces clinical and metabolic benefits in patients with Cushing's syndrome. J Clin Endocrinol Metab. 2012 Jun;97(6):2039-49.
https://academic.oup.com/jcem/article/97/6/2039/2536684
http://www.ncbi.nlm.nih.gov/pubmed/22466348?tool=bestpractice.com
A adrenalectomia bilateral fornece a cura imediata para qualquer causa de hipercortisolismo endógeno, à custa de causar insuficiência adrenal permanente (exigindo reposição de cortisol e mineralocorticoides) e criando um risco de síndrome de Nelson (crescimento do tumor corticotrófico após adrenalectomia). Esta progressão pode causar hiperpigmentação por excesso de ACTH e sintomas de compressão intracraniana por crescimento do tumor fora da sela. Novos métodos laparoscópicos de adrenalectomia permitem recuperação e tolerabilidade mais rápidas.[107]Neychev V, Steinberg SM, Yang L, et al. Long-term outcome of bilateral laparoscopic adrenalectomy measured by disease-specific questionnaire in a unique group of patients with Cushing's syndrome. Ann Surg Oncol. 2015 Dec;22 Suppl 3:S699-706.
http://www.ncbi.nlm.nih.gov/pubmed/25968622?tool=bestpractice.com
Uma metanálise de 37 estudos (1320 pacientes, 82% com doença de Cushing, 13% com síndrome de Cushing ectópica e 5% com hiperplasia adrenal primária) mostrou que a adrenalectomia bilateral é relativamente segura e proporciona o sucesso adequado.[108]Ritzel K, Beuschlein F, Mickisch A, et al. Clinical review: outcome of bilateral adrenalectomy in Cushing's syndrome: a systematic review. J Clin Endocrinol Metab. 2013 Oct;98(10):3939-48.
https://academic.oup.com/jcem/article/98/10/3939/2833849
http://www.ncbi.nlm.nih.gov/pubmed/23956347?tool=bestpractice.com
Embora a secreção de cortisol residual devido ao tecido adrenal acessório ou aos remanescentes adrenais tenha sido encontrada em até 34% dos pacientes, menos de 2% tiveram uma recidiva da síndrome de Cushing. A maioria dos pacientes apresentou melhora quanto aos sintomas de hipercortisolismo (por exemplo, hipertensão, obesidade ou depressão) após a adrenalectomia bilateral. O número de crises adrenais por 100 pacientes-anos foi de 9.3, e síndrome de Nelson ocorreu em 21% dos pacientes. O excesso de mortalidade no primeiro ano depois da cirurgia sugere que são necessários cuidados clínicos intensivos para os pacientes após a adrenalectomia bilateral.
Para reposição de hormônios hipofisários não glicocorticoide após a cirurgia hipofisária (qualquer combinação de deficiências pode ocorrer):[109]Fleseriu M, Hashim IA, Karavitaki N, et al. Hormonal replacement in hypopituitarism in adults: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 Nov;101(11):3888-921.
https://academic.oup.com/jcem/article/101/11/3888/2764912
http://www.ncbi.nlm.nih.gov/pubmed/27736313?tool=bestpractice.com
A levotiroxina é usada para obter T4 livre na metade superior da faixa normal. Um hormônio estimulante da tireoide não deve ser usado para orientar a terapia.
A terapêutica com testosterona é usada para obter um nível de testosterona na faixa normal.
Mulheres com útero intacto que recebem reposição de estrogênio também precisam de 10 dias de progesterona todos os meses em associação com a terapêutica de reposição de estrogênio.
A decisão de tratamento com hormônio do crescimento deve ser individualizada para cada paciente com base nos sintomas, nos benefícios e no risco da terapêutica. A titulação da dose deve ocorrer a cada mês para a obtenção de uma resposta clínica (isto é, nível de energia, sensação de bem-estar e massa corporal magra) e de um nível de IGF-1 na faixa normal intermediária para superior de acordo com a faixa etária.
A desmopressina é ajustada para controlar o débito urinário excessivo sintomático. Isso se baseia na preferência do paciente. O sódio sérico e os sintomas são monitorizados periodicamente para avaliar a adequação do tratamento.
Síndrome de Cushing independente do ACTH
A causa mais comum de superprodução de cortisol adrenal é o adenoma adrenal autônomo unilateral. A terapia de primeira linha consiste quase sempre na adrenalectomia unilateral da glândula adrenal afetada. A adrenalectomia laparoscópica é o método preferido na maioria dos casos. A remoção da glândula adrenal afetada é curativa em todos os pacientes com doença adrenal unilateral. Adrenalectomia tem um efeito benéfico nos fatores de risco cardiovascular em pacientes com síndrome de Cushing subclínica global e comparada com o tratamento conservador.[110]Bancos I, Alahdab F, Crowley RK, et al. Therapy of endocrine disease: improvement of cardiovascular risk factors after adrenalectomy in patients with adrenal tumors and subclinical Cushing's syndrome: a systematic review and meta-analysis. Eur J Endocrinol. 2016 Dec;175(6):R283-95.
https://eje.bioscientifica.com/view/journals/eje/175/6/R283.xml
http://www.ncbi.nlm.nih.gov/pubmed/27450696?tool=bestpractice.com
Causas raras da doença independente de ACTH geralmente causam doença adrenal bilateral pela formação de nódulos autônomos ou hiperplasia bilateral.[19]Duan K, Gomez Hernandez K, Mete O. Clinicopathological correlates of adrenal Cushing's syndrome. J Clin Pathol. 2015 Mar;68(3):175-86.
https://jcp.bmj.com/content/68/3/175.long
http://www.ncbi.nlm.nih.gov/pubmed/25425660?tool=bestpractice.com
[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
Nesses casos, a terapia de primeira linha geralmente exige a adrenalectomia bilateral. A terapia com inibidores da esteroidogênese (osilodrostat, cetoconazol, levocetoconazol, metirapona, mitotano e etomidato) ou um antagonista do receptor de glicocorticoide (mifepristona) pode ser usada para os pacientes que desejarem evitar a adrenalectomia bilateral.[19]Duan K, Gomez Hernandez K, Mete O. Clinicopathological correlates of adrenal Cushing's syndrome. J Clin Pathol. 2015 Mar;68(3):175-86.
https://jcp.bmj.com/content/68/3/175.long
http://www.ncbi.nlm.nih.gov/pubmed/25425660?tool=bestpractice.com
[90]Hinojosa-Amaya JM, Cuevas-Ramos D, Fleseriu M. Medical management of Cushing's syndrome: current and emerging treatments. Drugs. 2019 Jun;79(9):935-56.
http://www.ncbi.nlm.nih.gov/pubmed/31098899?tool=bestpractice.com
[111]Cohan P, East HE, Galati SJ, et al. Mifepristone treatment in four cases of primary bilateral macronodular adrenal hyperplasia (BMAH). J Clin Endocrinol Metab. 2019 Dec 1;104(12):6279-90.
https://academic.oup.com/jcem/article/104/12/6279/5491614
http://www.ncbi.nlm.nih.gov/pubmed/31112270?tool=bestpractice.com
O osilodrostat reduz rapidamente o cortisol livre urinário com melhoras associadas nos sinais clínicos de hipercortisolismo e, geralmente, é bem tolerado.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[99]Pivonello R, Fleseriu M, Newell-Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing's disease (LINC 3): a multicentre phase III study with a double-blind, randomised withdrawal phase. Lancet Diabetes Endocrinol. 2020 Sep;8(9):748-61.
http://www.ncbi.nlm.nih.gov/pubmed/32730798?tool=bestpractice.com
O cetoconazol tem início relativamente rápido de inibição da esteroidogênese. O cetoconazol pode causar lesão hepática grave e insuficiência adrenal. Seu uso requer orientação especializada e é contraindicado em pacientes com doença hepática. Se usado, o fígado e a função adrenal devem ser monitorados antes e durante o tratamento.[101]US Food and Drug Administration. FDA drug safety communication: FDA warns that prescribing of Nizoral (ketoconazole) oral tablets for unapproved uses including skin and nail infections continues; linked to patient death. May 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-prescribing-nizoral-ketoconazole-oral-tablets-unapproved
O levocetoconazol é um inibidor da esteroidogênese adrenal aprovado para tratamento nos EUA.[102]Fleseriu M, Castinetti F. Updates on the role of adrenal steroidogenesis inhibitors in Cushing's syndrome: a focus on novel therapies. Pituitary. 2016 Dec;19(6):643-53.
https://link.springer.com/article/10.1007/s11102-016-0742-1
http://www.ncbi.nlm.nih.gov/pubmed/27600150?tool=bestpractice.com
[103]Fleseriu M, Pivonello R, Elenkova A, et al. Efficacy and safety of levoketoconazole in the treatment of endogenous Cushing's syndrome (SONICS): a phase 3, multicentre, open-label, single-arm trial. Lancet Diabetes Endocrinol. 2019 Nov;7(11):855-65.
http://www.ncbi.nlm.nih.gov/pubmed/31542384?tool=bestpractice.com
[104]Zacharieva SZ, Pivonello R, Elenkova A, et al. MON-332 safety and efficacy of levoketoconazole in the treatment of endogenous Cushing’s syndrome (LOGICS): a double-blind, placebo-controlled, withdrawal study. J Endocr Soc. 2020 May 8;4(suppl 1):MON-332.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7208150
A metirapona oferece rápido início de inibição. O mitotano tem início de ação lento, janela terapêutica estreita e, em geral, só é usado em carcinoma adrenal.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
O etomidato, usado somente em emergências, tem início rápido mas deve ser administrado por via intravenosa.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
A mifepristona bloqueia a ação do cortisol, resultando em atenuação dos efeitos do cortisol.
O carcinoma adrenal é uma causa extremamente rara de síndrome de Cushing independente de ACTH. A terapia de primeira linha em muitos pacientes é a ressecção cirúrgica; no entanto, no momento do diagnóstico a doença geralmente progrediu além do ponto de eficácia da terapêutica cirúrgica. A eficácia da quimioterapia e das terapêuticas adjuvantes em doenças de estádio inicial ou avançado mostrou resultados mistos em ensaios clínicos; no entanto, os pacientes devem ser considerados para o tratamento com mitotano e a inclusão em ensaios clínicos (se disponíveis).[10]Fassnacht M, Dekkers OM, Else T, et al. European Society of Endocrinology clinical practice guidelines on the management of adrenocortical carcinoma in adults, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2018 Oct 1;179(4):G1-46.
https://eje.bioscientifica.com/view/journals/eje/179/4/EJE-18-0608.xml
http://www.ncbi.nlm.nih.gov/pubmed/30299884?tool=bestpractice.com
Síndrome do ACTH ectópico
A terapia de primeira linha ideal envolve a localização e a ressecção cirúrgica do tumor produtor de ACTH. Não é incomum que a ressecção total desses tumores não seja possível. Quando a ressecção cirúrgica não é possível, as terapias de segunda linha incluem um antagonista do receptor de glicocorticoide (mifepristona), terapia com inibidor da esteroidogênese (osilodrostat, cetoconazol, levocetoconazol, metirapona, mitotano e etomidato) ou adrenalectomia bilateral.[89]Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12.
http://www.ncbi.nlm.nih.gov/pubmed/30033041?tool=bestpractice.com
A adrenalectomia bilateral é uma terapêutica definitiva, mas os pacientes com tumores produtores de ACTH ectópico podem ter hipercortisolismo extremamente grave e exigirem redução no cortisol antes de serem submetidos à cirurgia. Nesses casos, a mifepristona ou a terapêutica do inibidor da esteroidogênese podem ser usadas para reduzir os níveis de cortisol para adrenalectomia bilateral. O osilodrostat reduz rapidamente o cortisol livre urinário com melhoras associadas nos sinais clínicos de hipercortisolismo e, geralmente, é bem tolerado.[26]Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743006
http://www.ncbi.nlm.nih.gov/pubmed/34687601?tool=bestpractice.com
[99]Pivonello R, Fleseriu M, Newell-Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing's disease (LINC 3): a multicentre phase III study with a double-blind, randomised withdrawal phase. Lancet Diabetes Endocrinol. 2020 Sep;8(9):748-61.
http://www.ncbi.nlm.nih.gov/pubmed/32730798?tool=bestpractice.com
O cetoconazol tem início relativamente rápido de inibição da esteroidogênese. O cetoconazol pode causar lesão hepática grave e insuficiência adrenal. Seu uso requer orientação especializada e é contraindicado em pacientes com doença hepática. Se usado, o fígado e a função adrenal devem ser monitorados antes e durante o tratamento.[101]US Food and Drug Administration. FDA drug safety communication: FDA warns that prescribing of Nizoral (ketoconazole) oral tablets for unapproved uses including skin and nail infections continues; linked to patient death. May 2016 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-prescribing-nizoral-ketoconazole-oral-tablets-unapproved
O levocetoconazol é um inibidor da esteroidogênese adrenal aprovado para tratamento nos EUA.[102]Fleseriu M, Castinetti F. Updates on the role of adrenal steroidogenesis inhibitors in Cushing's syndrome: a focus on novel therapies. Pituitary. 2016 Dec;19(6):643-53.
https://link.springer.com/article/10.1007/s11102-016-0742-1
http://www.ncbi.nlm.nih.gov/pubmed/27600150?tool=bestpractice.com
[103]Fleseriu M, Pivonello R, Elenkova A, et al. Efficacy and safety of levoketoconazole in the treatment of endogenous Cushing's syndrome (SONICS): a phase 3, multicentre, open-label, single-arm trial. Lancet Diabetes Endocrinol. 2019 Nov;7(11):855-65.
http://www.ncbi.nlm.nih.gov/pubmed/31542384?tool=bestpractice.com
[104]Zacharieva SZ, Pivonello R, Elenkova A, et al. MON-332 safety and efficacy of levoketoconazole in the treatment of endogenous Cushing’s syndrome (LOGICS): a double-blind, placebo-controlled, withdrawal study. J Endocr Soc. 2020 May 8;4(suppl 1):MON-332.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7208150
A metirapona oferece rápido início de inibição. O mitotano tem início de ação lento, janela terapêutica estreita e, em geral, só é usado em carcinoma adrenal.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
O etomidato, usado somente em emergências, tem início rápido mas deve ser administrado por via intravenosa.[69]Pivonello R, De Leo M, Cozzolino A, et al. The treatment of Cushing's disease. Endocr Rev. 2015 Aug;36(4):385-486.
https://academic.oup.com/edrv/article/36/4/385/2354703
http://www.ncbi.nlm.nih.gov/pubmed/26067718?tool=bestpractice.com
A mifepristona bloqueia a ação do cortisol, resultando em atenuação dos efeitos do cortisol.
