Íleo paralítico
- Visão geral
- Teoria
- Diagnóstico
- Tratamento
- ACOMPANHAMENTO
- Recursos
Algoritmo de tratamento
Observe que as formulações/vias e doses podem diferir entre nomes e marcas de medicamentos, formulários de medicamentos ou localidades. As recomendações de tratamento são específicas para os grupos de pacientes:ver aviso legal
íleo paralítico pós-operatório
jejum e hidratação intravenosa
Todos os pacientes com íleo paralítico devem permanecer em jejum e requerem hidratação intravenosa.
A escolha inicial da solução intravenosa dependerá do estado de hidratação inicial do paciente e da presença de comorbidades.
Um paciente significativamente hipovolêmico pode se beneficiar de uma dose em bolus de vários litros de soro fisiológico.
Após essa hidratação inicial, a solução intravenosa de manutenção deverá ser fisiológica e fornecer alguma quantidade de glicose.
Essa taxa deve ser adaptada ao débito urinário e à hemodinâmica do paciente.
Durante esse período, os eletrólitos devem ser monitorados e repostos, se necessário.
redução da analgesia por opioides ± substituição com analgesia não opioide
Tratamento recomendado para TODOS os pacientes no grupo de pacientes selecionado
Foi mostrado que os analgésicos opioides retardam a motilidade intestinal.[3]Wattchow D, Heitmann P, Smolilo D, et al. Postoperative ileus-an ongoing conundrum. Neurogastroenterol Motil. 2021 May;33(5):e14046. http://www.ncbi.nlm.nih.gov/pubmed/33252179?tool=bestpractice.com
Foi mostrado que a diminuição do uso de analgésicos opioides administrados sistemicamente ajuda a prevenir o surgimento de íleo paralítico pós-operatório.[26]Gustafsson UO, Scott MJ, Hubner M, et al. Guidelines for perioperative care in elective colorectal surgery: enhanced recovery after surgery (ERAS(®)) society recommendations: 2018. World J Surg. 2019 Mar;43(3):659-95. https://link.springer.com/article/10.1007/s00268-018-4844-y http://www.ncbi.nlm.nih.gov/pubmed/30426190?tool=bestpractice.com A analgesia por opioides controlada pelo paciente reduz a quantidade total de opioides administrados em comparação com a administração de analgésicos de forma intermitente ao longo do dia por um enfermeiro.[31]Chan KC, Cheng YJ, Huang GT, et al. The effect of IVPCA morphine on post-hysterectomy bowel function. Acta Anaesthesiol Sin. 2002 Jun;40(2):61-4. http://www.ncbi.nlm.nih.gov/pubmed/12194392?tool=bestpractice.com
Os anti-inflamatórios não esteroidais (AINEs) como o cetorolaco são adjuvantes úteis para o controle da dor.[36]Schlachta CM, Burpee SE, Fernandez C, et al. Optimizing recovery after laparoscopic colon surgery (ORAL-CS): effect of intravenous ketorolac on length of hospital stay. Surg Endosc. 2007 Dec;21(12):2212-9. http://www.ncbi.nlm.nih.gov/pubmed/17440782?tool=bestpractice.com [37]Chen JY, Wu GJ, Mok MS, et al. Effect of adding ketorolac to intravenous morphine patient-controlled analgesia on bowel function in colorectal surgery patients: a prospective, randomized, double-blind study. Acta Anaesthesiol Scand. 2005 Apr;49(4):546-51. http://www.ncbi.nlm.nih.gov/pubmed/15777304?tool=bestpractice.com [38]McNicol ED, Ferguson MC, Schumann R. Single-dose intravenous ketorolac for acute postoperative pain in adults. Cochrane Database Syst Rev. 2021 May 17;5(5):CD013263. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013263.pub2/full http://www.ncbi.nlm.nih.gov/pubmed/33998669?tool=bestpractice.com [39]Bell S, Rennie T, Marwick CA, et al. Effects of peri-operative nonsteroidal anti-inflammatory drugs on post-operative kidney function for adults with normal kidney function. Cochrane Database Syst Rev. 2018 Nov 29;11(11):CD011274. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011274.pub2/full http://www.ncbi.nlm.nih.gov/pubmed/30488949?tool=bestpractice.com [40]Chen JY, Ko TL, Wen YR, et al. Opioid-sparing effects of ketorolac and its correlation with the recovery of postoperative bowel function in colorectal surgery patients: a prospective randomized double-blinded study. Clin J Pain. 2009 Jul-Aug;25(6):485-9. http://www.ncbi.nlm.nih.gov/pubmed/19542795?tool=bestpractice.com
A administração de um anestésico local por via epidural constitui outra alternativa à analgesia por opioides.[3]Wattchow D, Heitmann P, Smolilo D, et al. Postoperative ileus-an ongoing conundrum. Neurogastroenterol Motil. 2021 May;33(5):e14046. http://www.ncbi.nlm.nih.gov/pubmed/33252179?tool=bestpractice.com [32]Senagore AJ, Delaney CP, Mekhail N, et al. Randomized clinical trial comparing epidural anaesthesia and patient-controlled analgesia after laparoscopic segmental colectomy. Br J Surg. 2003 Oct;90(10):1195-9. http://www.ncbi.nlm.nih.gov/pubmed/14515286?tool=bestpractice.com [33]Marret E, Remy C, Bonnet F. Meta-analysis of epidural analgesia versus parenteral opioid analgesia after colorectal surgery. Br J Surg. 2007 Jun;94(6):665-73. https://onlinelibrary.wiley.com/doi/full/10.1002/bjs.5825 http://www.ncbi.nlm.nih.gov/pubmed/17514701?tool=bestpractice.com [34]Gendall KA, Kennedy RR, Watson AJ, et al. The effect of epidural analgesia on postoperative outcome after colorectal surgery. Colorectal Dis. 2007 Sep;9(7):584-98;discussion 598-600. http://www.ncbi.nlm.nih.gov/pubmed/17506795?tool=bestpractice.com [35]Carli F, Trudel JL, Belliveau P. The effect of intraoperative thoracic epidural anesthesia and postoperative analgesia on bowel function after colorectal surgery: a prospective, randomized trial. Dis Colon Rectum. 2001 Aug;44(8):1083-9. http://www.ncbi.nlm.nih.gov/pubmed/11535845?tool=bestpractice.com [51]Guay J, Nishimori M, Kopp SL. Epidural local anesthetics versus opioid-based analgesic regimens for postoperative gastrointestinal paralysis, vomiting, and pain after abdominal surgery: a Cochrane review. Anesth Analg. 2016 Dec;123(6):1591-602. https://journals.lww.com/anesthesia-analgesia/fulltext/2016/12000/epidural_local_anesthetics_versus_opioid_based.33.aspx http://www.ncbi.nlm.nih.gov/pubmed/27870743?tool=bestpractice.com
Opções primárias
cetorolaco: adultos <65 anos de idade e/ou ≥50 kg: 30 mg por via intramuscular/intravenosa a cada 6 horas quando necessário, máximo de 120 mg/dia; adultos ≥65 anos de idade e/ou <50 kg: 15 mg por via intramuscular/intravenosa a cada 6 horas quando necessário, máximo de 60 mg/dia
descompressão nasogástrica
Tratamento recomendado para TODOS os pacientes no grupo de pacientes selecionado
A sonda nasogástrica deve ser colocada de forma que a sua extremidade fique no estômago, fixada e conectada à sucção.
Deve-se medir o débito gástrico, e o volume perdido deve ser reposto com solução salina fisiológica intravenosa.
A decisão de remover a sonda nasogástrica é baseada no débito medido ao longo do tempo e na remissão do íleo paralítico. O paciente é avaliado quanto à ausência de cólica e distensão abdominal, diminuição do débito através da sonda nasogástrica e eliminação de fezes e flatos com o objetivo de remover a sonda nasogástrica. Pode ser necessário reinserir a sonda nasogástrica, caso o paciente apresente novamente evidências de íleo paralítico em andamento com distensão abdominal e vômitos.
No entanto, estudos recentes mostraram que a descompressão nasogástrica rotineira é desnecessária e pode ser prejudicial. Portanto, o uso rotineiro deixou de ser recomendado, e a descompressão nasogástrica é reservada para uso seletivo.[82]Nelson R, Edwards S, Tse B. Prophylactic nasogastric decompression after abdominal surgery. Cochrane Database Syst Rev. 2007 Jul 18;2007(3):CD004929. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6669251 http://www.ncbi.nlm.nih.gov/pubmed/17636780?tool=bestpractice.com
Frequentemente é realizada descompressão orogástrica no período intraoperatório, mas a sonda é removida ao se concluir a cirurgia.[26]Gustafsson UO, Scott MJ, Hubner M, et al. Guidelines for perioperative care in elective colorectal surgery: enhanced recovery after surgery (ERAS(®)) society recommendations: 2018. World J Surg. 2019 Mar;43(3):659-95. https://link.springer.com/article/10.1007/s00268-018-4844-y http://www.ncbi.nlm.nih.gov/pubmed/30426190?tool=bestpractice.com
causa não cirúrgica
jejum e hidratação intravenosa
Todos os pacientes com íleo paralítico devem permanecer em jejum e requerem hidratação intravenosa.
A escolha inicial da solução intravenosa dependerá do estado de hidratação inicial do paciente e da presença de comorbidades.
Um paciente significativamente hipovolêmico pode se beneficiar de uma dose em bolus de vários litros de soro fisiológico.
Após essa hidratação inicial, a solução intravenosa de manutenção deverá ser fisiológica e fornecer alguma quantidade de glicose.
Os fluidos devem ser inicialmente administrados a uma taxa de manutenção que depende do peso corporal. Essa taxa deve ser adaptada ao débito urinário e à hemodinâmica do paciente.
Em pacientes que recebem tratamento farmacológico que pode exacerbar o íleo paralítico (por exemplo, opiáceos, anticolinérgicos), a descontinuação ou a redução desses medicamentos ajuda a remitir o íleo paralítico.
Anormalidades eletrolíticas (hipocalemia, hipocloremia, alcalose e hipermagnesemia) podem ser uma consequência do íleo paralítico ou um fator de exacerbação. Durante esse período, os eletrólitos devem ser monitorados e repostos, se necessário.
tratamento das afecções subjacentes
Tratamento recomendado para TODOS os pacientes no grupo de pacientes selecionado
As afecções subjacentes, como sepse, infecções intra-abdominais ou outras doenças sistêmicas, devem ser tratadas.
As doenças sistêmicas associadas à hipomotilidade intestinal incluem diabetes mellitus, doença de Chagas, esclerodermia e doenças neurológicas.
O uso crônico de opioides também contribui para essa condição.
descompressão nasogástrica
Tratamento adicional recomendado para ALGUNS pacientes no grupo de pacientes selecionado
A sonda nasogástrica deve ser colocada de forma que a sua extremidade fique no estômago e permaneça fixada e conectada à sucção.
Deve-se medir o débito gástrico, e o volume perdido deve ser reposto com solução salina fisiológica intravenosa.
A decisão de remover a sonda nasogástrica é baseada no débito medido ao longo do tempo e na remissão do íleo paralítico. O paciente é avaliado quanto à ausência de cólica e distensão abdominal, diminuição do débito através da sonda nasogástrica e eliminação de fezes e flatos com o objetivo de remover a sonda nasogástrica. Pode ser necessário reinserir a sonda nasogástrica, caso o paciente apresente novamente evidências de íleo paralítico em andamento com distensão abdominal e vômitos.
No entanto, estudos recentes mostraram que a descompressão nasogástrica rotineira é desnecessária e pode ser prejudicial. Portanto, o uso rotineiro deixou de ser recomendado, e a descompressão nasogástrica é reservada para uso seletivo.[82]Nelson R, Edwards S, Tse B. Prophylactic nasogastric decompression after abdominal surgery. Cochrane Database Syst Rev. 2007 Jul 18;2007(3):CD004929. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6669251 http://www.ncbi.nlm.nih.gov/pubmed/17636780?tool=bestpractice.com
íleo paralítico que dure mais de 3 dias ou que prolongue a recuperação pós-operatória
nutrição parenteral
Esses pacientes poderão ser mantidos em jejum durante várias semanas.
A nutrição parenteral é recomendada para pacientes que não fazem ingestão oral por mais de 7 dias.[3]Wattchow D, Heitmann P, Smolilo D, et al. Postoperative ileus-an ongoing conundrum. Neurogastroenterol Motil. 2021 May;33(5):e14046. http://www.ncbi.nlm.nih.gov/pubmed/33252179?tool=bestpractice.com [76]Gero D, Gié O, Hübner M, et al. Postoperative ileus: in search of an international consensus on definition, diagnosis, and treatment. Langenbecks Arch Surg. 2017 Feb;402(1):149-58. http://www.ncbi.nlm.nih.gov/pubmed/27488952?tool=bestpractice.com No entanto, a nutrição parenteral é benéfica nos pacientes que permanecem em repouso intestinal durante mais de 14 dias ou que apresentam desnutrição subjacente.[83]Sandstrom R, Drott C, Hyltander A, et al. The effect of postoperative intravenous feeding (TPN) on outcome following major surgery evaluated in a randomized study. Ann Surg. 1993 Feb;217(2):185-95. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1242758 http://www.ncbi.nlm.nih.gov/pubmed/8439216?tool=bestpractice.com Deve-se verificar os eletrólitos diariamente para se identificar eventuais anormalidades eletrolíticas associadas a alimentação intravenosa pós-operatória e ao estado de jejum.
Os benefícios de se iniciar a nutrição parenteral antes de transcorridos 7 dias são menores que os riscos associados à nutrição parenteral e ao acesso venoso central.
Na maioria dos pacientes, o estado de "inanição" pós-operatório não está associado a um aumento da morbidade ou da mortalidade.
A inserção de uma linha venosa central está associada a um risco elevado de lesão iatrogênica nos vasos próximos, pneumotórax, trombose venosa profunda (TVP) e bacteremia associada a linha central.[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando estômago significativamente dilatadoDo acervo pessoal da Dra. Paula I. Denoya [Citation ends].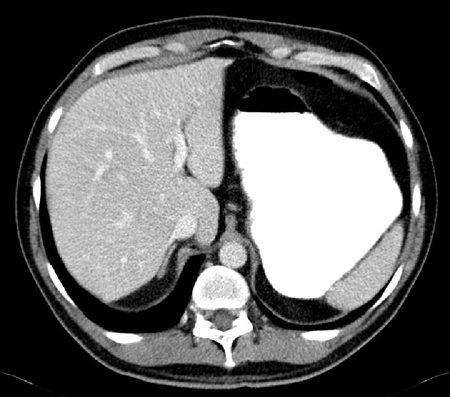 [Figure caption and citation for the preceding image starts]: Sonda nasogástricaDo acervo pessoal da Dra. Paula I. Denoya [Citation ends].
[Figure caption and citation for the preceding image starts]: Sonda nasogástricaDo acervo pessoal da Dra. Paula I. Denoya [Citation ends].

Escolha um grupo de pacientes para ver nossas recomendações
Observe que as formulações/vias e doses podem diferir entre nomes e marcas de medicamentos, formulários de medicamentos ou localidades. As recomendações de tratamento são específicas para os grupos de pacientes. Ver aviso legal
O uso deste conteúdo está sujeito ao nosso aviso legal