Abordagem
O tratamento é orientado principalmente pelo grau e pelo estádio do tumor determinados na ressecção inicial, junto com o achado de investigações laboratoriais e imagiológicas adicionais. O estadiamento preciso, que requer ressecção no músculo detrusor, é fundamental.
Tumores não invasivos do músculo
Baixo risco
As diretrizes de câncer de bexiga da American Urological Association (AUA) definem o câncer de bexiga de baixo risco como: doença solitária, de pequeno volume (≤3 cm), de baixo grau e em estádio Ta (Ta = carcinoma papilar não invasivo); qualquer neoplasia urotelial papilar de potencial maligno.[41]
A ressecção transuretral de um tumor de bexiga (RTTB) é a terapia de primeira linha. As diretrizes recomendam repetir a ressecção transuretral dentro de 6 semanas para diminuir a recorrência se a ressecção inicial estiver incompleta.[41][48]
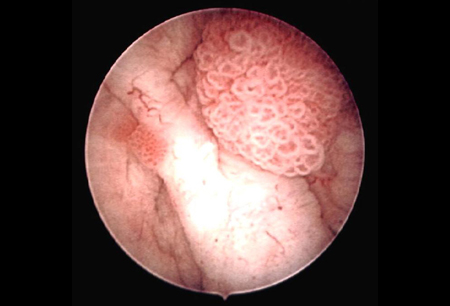
Recomenda-se uma única instilação imediata de quimioterapia intravesical (administrada em até 24 horas após a ressecção transuretral) para reduzir o risco de recorrência.[41] A instilação não deverá ser feita se houver suspeita de perfuração da bexiga ou se a ressecção for extensa. A gencitabina e a mitomicina são comumente usadas.[44] A gencitabina é preferível; ela tem tolerabilidade favorável e pode reduzir o risco de recorrência e progressão ao longo do tempo em comparação com a mitomicina.[44][81] A epirrubicina é uma opção alternativa.[41][44][82][Figure caption and citation for the preceding image starts]: Carcinoma urotelial papilar não invasivo (Ta) de baixo grau; observe o tumor satélite adjacente, ilustrando o efeito de campoDo acervo de Donald Lamm, MD, FACS [Citation ends].
Médio risco
Os pacientes de risco intermediário da AUA são aqueles com doença de grande volume (>3 cm) ou doença multifocal de baixo grau e em estádio Ta; doença de alto grau em estádio Ta ≤3 cm; doença T1 de baixo grau; ou recorrência de um tumor em estádio Ta em até 1 ano (T1 = o tumor invade o tecido conjuntivo subepitelial, ou seja, a lâmina própria).[41] Esses pacientes têm um alto risco de recorrência, mas um baixo risco de progressão da doença.
A RTTB é a terapia de primeira linha. As diretrizes recomendam repetir a ressecção transuretral dentro de 6 semanas para diminuir a recorrência se a ressecção inicial tiver sido incompleta, se não houver músculo detrusor no espécime de ressecção inicial ou se forem encontrados tumores T1.[41][48]
Recomenda-se uma única instilação imediata de quimioterapia intravesical (administrada em até 24 horas após a ressecção transuretral) para reduzir o risco de recorrência.[41][82][83] A instilação não deverá ser feita se houver suspeita de perfuração da bexiga ou se a ressecção for extensa. A gencitabina e a mitomicina são comumente usadas.[44] A gencitabina é preferível; ela tem tolerabilidade favorável e pode reduzir o risco de recorrência e progressão ao longo do tempo em comparação com a mitomicina.[44][81][83] A epirrubicina é uma opção alternativa.[41][44][82] A BCG nunca é apropriada para instilação no pós-operatório imediato devido ao risco de sepse.[84]
A imunoterapia intravesical com BCG tardia ou a quimioterapia intravesical podem ser consideradas para os pacientes com doença de risco intermediário, iniciando 3-4 semanas após a RTTB e administradas uma vez por semana por 6 semanas.[41][44] As decisões sobre terapia intravesical adicional se baseiam na avaliação do risco de recorrência, na história e nos sintomas do paciente, no risco de desfechos adversos de uma repetição da ressecção e na toxicidade da terapia.[41]
A terapia de manutenção é uma opção se houver resposta completa ao tratamento postergado.[41][44] A duração ideal da terapia de manutenção é desconhecida. As diretrizes especificam o uso da manutenção com BCG por 1 ano na doença de risco intermediário.[41][44][85] Um esquema de 3 semanas de BCG administrado a 3, 6 e 12 meses é comumente usado.[44][86]
Os pacientes com doença persistente ou recorrente, ou citologia positiva após a imunoterapia com BCG intravesical, podem receber um segundo ciclo de BCG.[41]
Mitomicina e gencitabina são alternativas para quimioterapia intravesical tardia. Outras opções incluem gencitabina sequencial associada a docetaxel, epirrubicina, valrubicina, docetaxel ou gencitabina sequencial associada a mitomicina.[44] Docetaxel é bem tolerado por via intravesical e é uma opção eficaz para câncer de bexiga sem invasão muscular refratário a BCG isolada e em combinação com gencitabina.[87][88] A quimioterapia de manutenção normalmente é administrada em intervalos mensais, por 6-12 meses.[41]
Alto risco
Definido como: carcinoma in situ; Ta de alto grau >3 cm ou multifocal; T1 de alto grau; qualquer tumor Ta de alto grau recorrente; qualquer falha da BCG em um paciente de alto grau; histologia de qualquer variante ou invasão linfovascular ou uretral prostática.[41]
A ressecção transuretral, seguida por imunoterapia com BCG de indução e manutenção, é a terapia de primeira linha.[41]
Embora não tenha sido confirmado se é benéfica na doença de alto risco, uma instilação pós-operatória imediata (até 24 horas depois) e única de quimioterapia intravesical (por exemplo, gencitabina, mitomicina, epirrubicina) às vezes é usada em associação com a imunoterapia intravesical tardia.[41][89][90] O BCG nunca é apropriado para instilação no pós-operatório imediato devido ao risco de sepse.[84]
A conclusão da ressecção do tumor, a recorrência em 3 meses e a presença de doença residual na nova ressecção têm importância prognóstica significativa.[91][92]
As diretrizes recomendam repetir a ressecção transuretral dentro de 6 semanas para diminuir a recorrência se a ressecção inicial for incompleta, se não houver músculo detrusor na amostra de ressecção inicial, se forem encontrados tumores T1, ou se os tumores tiverem histologia variante (e o paciente não for submetido à cistectomia).[41][48]
A repetição da ressecção também deve ser considerada para tumores Ta de alto risco e alto grau.[41][93][94] A ressecção repetida revelará tumor residual em cerca de 50% a 70% dos pacientes com tumores T1.[41] A ressecção repetida que demonstra doença T1 residual foi associada a uma maior incidência de invasão muscular, em comparação com a ausência de tumor ou tumor não T1 detectado à ressecção transuretral de reestadiamento.[95]
A imunoterapia intravesical com BCG costuma ser administrada 3-4 semanas após a ressecção transuretral e mantida por 2 horas. A indução é com BCG semanal por 6 semanas.[41][44] A manutenção com BCG é recomendada se houver uma resposta completa à indução. A duração ideal da terapia de manutenção é desconhecida. As diretrizes especificam o uso da manutenção com BCG por 3 anos, se tolerada, para a doença de alto risco.[41][85] A terapia de manutenção geralmente é administrada em instilações semanais por 3 semanas em 3, 6, 12, 18, 24, 30 e 36 meses. Podem ser usadas doses reduzidas se houver sintomas locais, ou para prevenir a intensificação dos efeitos adversos da BCG.[86] Nos pacientes de alto risco, a BCG por 3 anos em dose máxima reduz as recorrências em comparação com a BCG em dose máxima por 1 ano.[85] Pacientes com doença persistente ou recorrente após um único ciclo de BCG intravesical de indução devem receber um segundo ciclo de BCG.[41]
A cistectomia é um tratamento excessivo na maioria dos pacientes de alto risco que não têm invasão muscular. As diretrizes da National Comprehensive Cancer Network sugerem que a cistectomia é preferível para os pacientes com características de risco muito alto, definidas como ausência de resposta à BCG, histologias variantes (por exemplo, micropapilar, plasmocitoide, sarcomatoide), invasão linfovascular e invasão uretral prostática.[44] A BCG é a opção de tratamento de escolha para pacientes de alto risco (isto é, sem características de risco muito alto).[44] É necessária cautela ao se selecionarem pacientes para cistectomia, principalmente na ausência de invasão muscular; a mortalidade geral em 90 dias para a cistectomia chega a 9%, e o avanço da idade, um escore da American Society of Anesthesiology maior, e a presença de linfonodo ou metástase distante aumentam a mortalidade.[96]
Alto risco: sem resposta clínica ou intolerante ao BCG
A cistectomia é o tratamento de escolha para os pacientes intolerantes à BCG ou que têm doença sem resposta clínica à BCG (recorrência ou progressão durante ou após uma terapia adequada com BCG).[44] As outras opções podem incluir quimioterapia intravesical, pembrolizumabe ou nadofaragene firadenovec. As diretrizes da National Comprehensive Cancer Network (NCCN) incluem o nogapendekin alfa inbakicept (um superagonista da interleucina-15 ativador de células imunológicas) associado a BCG como opção adicional para pacientes selecionados.[44]
O tratamento ideal dos pacientes que rejeitarem ou não puderem ser submetidos à cistectomia não foi estabelecido. Deve-se oferecer aos pacientes a inscrição em um ensaio clínico ou uma terapia intravesical alternativa, como mitomicina, gencitabina ou gencitabina associada a docetaxel.[41][48]
O pembrolizumabe, o nadofaragene firadenovec e o nogapendekin alfa inbakicept associado a BCG estão aprovados pela Food and Drug Administration (FDA) dos EUA para pacientes com carcinoma in situ não músculo-invasivo de alto risco e sem resposta clínica à BCG.[44][97][98][99] A aprovação do pembrolizumabe estipula que os pacientes são inelegíveis para ou optaram por não se submeter à cistectomia. A imunoterapia sistêmica com pembrolizumabe é administrada ao paciente com carcinoma in situ até 12 meses após a conclusão de uma terapia com BCG adequada.[41]
Pacientes com hiperplasia prostática benigna (HPB) obstrutiva coexistente
Os pacientes com tumores de bexiga não invasivos do músculo e HPB obstrutiva coexistente podem fazer ressecção transuretral da próstata no mesmo momento da RTTB. Uma metanálise demonstra que a realização dos procedimentos simultaneamente melhora a qualidade de vida do paciente, sem risco de aumentar as taxas tumorais de recorrência ou metástase.[100] Essa abordagem é apropriada para tumores de bexiga não músculo invasivos, de baixo, médio e alto risco.
Tumores localmente invasivos
Doença músculo invasiva localizada: T2a-T4a N0M0 ou N1
As diretrizes recomendam a quimioterapia neoadjuvante seguida por cistectomia para pacientes elegíveis com doença T2-T4a sem envolvimento de linfonodos (N0) ou com envolvimento em um único linfonodo pélvico (N1).[44][54][101] A quimioterapia neoadjuvante combinada baseada em platina reduz o risco de mortalidade sem aumentar as complicações perioperatórias ou a mortalidade.[102][103] O metotrexato denso em doses associado a vimblastina, doxorrubicina e cisplatina (ddMVAC) é o esquema de primeira escolha; a toxicidade e a eficácia são maiores, em comparação com o MVAC tradicional. A gencitabina associada a cisplatina pode ser uma opção alternativa.[44][104][105][106][107][108]
A cistoprostatectomia radical (nos homens) ou cistectomia radical frequentemente acompanhada por histerectomia (nas mulheres) geralmente é necessária, e acredita-se que proporcione a melhor chance de cura. A dissecção dos linfonodos pélvicos (DLP) bilateral é uma parte fundamental do procedimento. A dissecção estendida dos linfonodos é controversa; as evidências de maior sobrevida são duvidosas, enquanto o risco de efeitos adversos é maior.[44][54][109][110] Uma cicatrização grave secundária a uma cirurgia ou tratamentos prévios, idade avançada ou comorbidades graves podem impedir a DLP. A cistectomia é seguida pela formação de uma derivação urinária por meio de um canal ileal na pele ou pela criação de um reservatório interno que pode ser drenado por um cateter ou pela uretra. As contraindicações relativas à drenagem uretral incluem Tis (carcinoma in situ) nos dutos prostáticos ou uma margem uretral positiva.[44] Uma neobexiga ortóptica fornece alguma função semelhante a uma bexiga nativa, mas apresenta um aumento do risco de incontinência noturna e retenção que requer autocateterismo intermitente.
Em pacientes selecionados com doença T2, uma cistectomia parcial pode ser viável.[44] Isso requer que um tumor solitário, localizado em uma área da bexiga onde haja uma margem livre mínima de 2 cm do urotélio não envolvido, possa ser alcançado e a presença de tecidos moles suficientes para permitir a remoção do tumor sem reduzir significativamente a capacidade da bexiga ou causar incontinência. Esse procedimento costuma ser reservado para tumores no topo da bexiga que não têm Tis (carcinoma in situ) associado em outras áreas da bexiga. As contraindicações relativas são lesões no trígono ou colo vesical.
Para pacientes que recusam ou não são candidatos à cistectomia, a terapia trimodal (TMT) de preservação de órgãos com a combinação de RTTB máxima, quimioterapia e radioterapia pode ser uma opção alternativa.[54][111][112] Os candidatos preferidos para a terapia de preservação de órgãos incluem aqueles com tumores menores solitários, sem envolvimento de linfonodos, sem carcinoma in situ extenso ou multifocal, sem hidronefrose e com boa função vesical pré-tratamento.[54] O aconselhamento adequado do paciente sobre os riscos e a vigilância regular pós-tratamento são essenciais. Embora uma metanálise tenha descoberto que a TMT não foi inferior à cistectomia radical em <10 anos, no geral a TMT foi associada a um aumento dos riscos da mortalidade por todas as causas e da específica para câncer de bexiga.[113] Cerca de 30% dos pacientes tratados com terapia multimodal de preservação de órgãos terão doença invasiva recorrente e necessitarão de cistectomia radical subsequente.[111]
A quimioterapia ou quimiorradioterapia pós-cistectomia pode ser considerada em pacientes de alto risco selecionados (por exemplo, T3-4 patológico, linfonodos positivos, margens positivas).[44][114][115] Pode ser usada uma combinação baseada em cisplatina, como ddMVAC, ou gencitabina associada a cisplatina.[44] Os dados relacionados ao uso da radioterapia e da quimiorradioterapia pós-cistectomia são limitados.[44][54][111] Uma revisão sistemática não relatou benefícios claros atribuíveis à radioterapia adjuvante após a cistectomia.[116] Em um ensaio clínico de fase 2 randomizado com pacientes após a cistectomia que com câncer de bexiga localmente avançado (carcinoma urotelial ou carcinoma de células escamosas), a quimioterapia sequencial adjuvante e a radioterapia melhoraram significativamente o controle local, em comparação com a quimioterapia adjuvante isolada (96% vs. 69%, respectivamente, em 2 anos).[117] As sobrevidas global e livre de doença não tiveram uma diferença significativa entre os grupos de tratamento.
O nivolumabe pós-cistectomia pode ser considerado para determinados pacientes de alto risco com doença residual que não forem elegíveis ou que rejeitarem a terapia adjuvante baseada em cisplatina.[44][54] Em um ensaio clínico randomizado e controlado, o nivolumabe pós-operatório melhorou significativamente a sobrevida livre de doença a 6 meses em comparação com o placebo (RR de 0.70); o aumento na sobrevida foi maior entre os pacientes com expressão de PD-L1 ≥1% (RR de 0.55). Os pacientes do ensaio clínico apresentaram evidências patológicas de carcinoma urotelial com alto risco de recorrência.[118]
Irressecável localmente avançado: T4b ou N2-3
A doença T4b e N2-3 é normalmente considerada irressecável (definida por massa vesical fixa ou linfonodos positivos evidentes antes da laparotomia) e geralmente é tratada com quimioterapia isolada ou com quimiorradioterapia.[44] Para os pacientes que não mostram doença nodal nas TCs, recomendam-se 2 ou 3 ciclos de quimioterapia com ou sem radioterapia, seguidos por cistoscopia e uma nova TC.[44] Se o tumor responder ao tratamento, as opções subsequentes incluirão cistectomia ou quimioterapia de consolidação com ou sem radioterapia. As contraindicações à radiação incluem radiação pélvica prévia, bexiga contraída ou sintomas irritativos vesicais.
A manutenção com avelumabe é recomendada após o término da quimioterapia para pacientes com boa resposta e sem progressão da doença.[44][119] Em um ensaio de fase 3, a manutenção com avelumabe aumentou a sobrevida global em 7.1 meses em comparação com a terapia de suporte.[120]
Há várias imunoterapias aprovadas para os pacientes com doença localmente avançada ou metastática como
tratamento de primeira linha alternativo, ou
tratamento de segunda linha para os pacientes com evolução durante ou após a quimioterapia baseada em platina.
Na prática, essas opções não são comumente usadas para doenças não metastáticas. Consulte a seção sobre doença metastática abaixo para uma discussão mais aprofundada sobre imunoterapia.
Doença metastática
Os pacientes que apresentam doença metastática ou desenvolvem doença metastática posteriormente geralmente são tratados com terapia sistêmica.[44][54] A radioterapia paliativa, geralmente combinada com a terapia sistêmica, pode ser usada para reduzir os sintomas ou melhorar o controle local. O esquema de terapia usado pode variar de acordo com fatores como presença e gravidade das comorbidades (por exemplo, doença cardíaca, neuropatia, perda auditiva, disfunção renal), junto com uma avaliação do risco baseada na extensão da doença.
A análise molecular/genômica, incluindo testes para alterações genéticas de FGFR3 e superexpressão de HER2, pode ajudar a orientar as opções de tratamento subsequentes e/ou a elegibilidade para ensaios clínicos.[44]
Terapia sistêmica de primeira linha
As diretrizes recomendam o pembrolizumabe associado ao conjugado anticorpo-medicamento enfortumabe vedotina como o tratamento de primeira linha de escolha para os pacientes com doença metastática que puderem receber terapia combinada.[44][54][121] Foram relatados melhores desfechos de sobrevida com o pembrolizumabe associado a enfortumabe vedotina, em comparação com a quimioterapia baseada em cisplatina.[122][123]
Para os pacientes com doença metastática que não puderem receber pembrolizumabe associado a enfortumabe vedotina (por exemplo, devido a contraindicações ou disponibilidade), os esquemas recomendados para os pacientes elegíveis para cisplatina incluem o ddMVAC, ou gencitabina associada a cisplatina, ou gencitabina associada a cisplatina e nivolumabe.[44][54][121][124] Gencitabina associada a carboplatina é o esquema quimioterápico preferido para os pacientes inelegíveis para cisplatina (ou seja, aqueles com: clearance da creatinina <60 mL/min; escore 2 de capacidade funcional do Eastern Cooperative Oncology Group; neuropatia de grau ≥2 ou perda auditiva; insuficiência cardíaca de classe III da New York Heart Association).[44][54][121][125][126] Após 2 ou 3 ciclos de quimioterapia, os pacientes são reavaliados e o tratamento é mantido por até 6 ciclos no total se a doença tiver respondido ou se mantido estável.[44]
Tratamento adicional após a terapia sistêmica
A cirurgia ou radioterapia pode ser considerada em pacientes altamente selecionados que mostram uma resposta parcial importante em um tumor primário irressecável ou têm um local solitário de doença residual que é ressecável após a quimioterapia.[44][54][127] Se a doença for completamente removida, dois ciclos adicionais de quimioterapia podem ser administrados se tolerados pelo paciente.
A manutenção com avelumabe é recomendada após o término da quimioterapia (sem nivolumabe) para os pacientes com boa resposta e sem progressão da doença.[44][54][119][120] Para os pacientes que recebem gencitabina associada a cisplatina e nivolumabe, a manutenção com nivolumabe é recomendada.[44][54][124]
A inscrição em um ensaio clínico, se elegível, é fortemente recomendada para as terapias de segunda linha e de linhas subsequentes para doença metastática e avançada; não há evidências para a seleção do tratamento ideal. A escolha do tratamento deve se basear nas terapias prévias e na elegibilidade para cisplatina.
Para os pacientes que evoluírem após o tratamento de primeira linha com pembrolizumabe associado a enfortumabe vedotina, as diretrizes recomendam quimioterapia baseada em platina ou monoterapia com enfortumabe vedotina (se não forem elegíveis para quimioterapia à base de cisplatina).[44][54][121]
O pembrolizumabe (preferencial), o nivolumabe, o avelumabe ou o enfortumabe vedotina podem ser usados como tratamentos de segunda linha nos pacientes com carcinoma urotelial localmente avançado ou metastático que tiverem progressão da doença durante ou após a quimioterapia à base de platina.[44][128][129] No Reino Unido, o NICE não recomenda o uso de segunda linha de pembrolizumabe e nivolumabe devido à relação custo-efetividade incerta do pembrolizumabe e à falta de dados comparativos diretos para o nivolumabe.[130][131]
O inibidor do receptor do fator de crescimento de fibroblastos (FGFR) erdafitinibe é uma opção alternativa para certos pacientes com alterações genéticas de FGFR3 que tiverem recebido pelo menos uma linha de terapia sistêmica prévia.[44][54][121] O erdafitinibe está aprovado nos EUA e na Europa para os carcinomas uroteliais localmente avançados ou metastáticos que expressarem alterações do gene FGFR3 e tiverem evoluído durante ou após pelo menos uma linha de terapia sistêmica prévia (a qual deve incluir imunoterapia para os pacientes elegíveis). Nos pacientes com doença progressiva e pelo menos uma alteração pré-especificada do FGFR, o erdafitinibe produziu uma taxa de resposta objetiva de 40% em um ensaio de fase 2 e uma melhora na sobrevida global em comparação com a quimioterapia em um ensaio de fase 3.[132][133]
As linhas de terapia subsequentes dependem das terapias prévias e podem incluir enfortumabe vedotina, erdafitinibe (se positivo para alterações genéticas de FGFR3) ou quimioterapia. A FDA o aprovou trastuzumabe deruxtecan (um conjugado anticorpo-medicamento direcionado ao HER2) para o tratamento de tumores de bexiga irressecáveis ou metastáticos positivos para HER2 em pacientes que tiverem recebido tratamento prévio (ou que não tiverem outras opções de tratamentos alternativos). Em um ensaio aberto de fase 2, o tratamento com trastuzumabe deruxtecan resultou em uma taxa de resposta objetiva de 39% (16/41) e em uma sobrevida livre de progressão mediana de 7 meses em pacientes com câncer de bexiga com superexpressão de HER2 (imuno-histoquímica 3+/2+).[134]
O uso deste conteúdo está sujeito ao nosso aviso legal