Os princípios da assistência para os pacientes com DMD também se aplicam a pacientes com outras distrofias musculares. Algumas variações no tratamento são descritas nesta seção, e há diretrizes para o tratamento de pacientes com distrofias musculares congênitas, distrofia miotônica e atrofia muscular espinhal (AME).[3]Mercuri E, Finkel RS, Muntoni F, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 1: recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018 Feb;28(2):103-15.
https://www.nmd-journal.com/article/S0960-8966(17)31284-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29290580?tool=bestpractice.com
[12]Ashizawa T, Gagnon C, Groh WJ, et al. Consensus-based care recommendations for adults with myotonic dystrophy type 1. Neurol Clin Pract. 2018 Dec;8(6):507-20.
https://cp.neurology.org/content/8/6/507
http://www.ncbi.nlm.nih.gov/pubmed/30588381?tool=bestpractice.com
[13]Tawil R, Kissel JT, Heatwole C, et al. Evidence-based guideline summary: evaluation, diagnosis, and management of facioscapulohumeral muscular dystrophy: report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology and the Practice Issues Review Panel of the American Association of Neuromuscular & Electrodiagnostic Medicine. Neurology. 2015 Jul 28;85(4):357-64.
https://n.neurology.org/content/85/4/357
http://www.ncbi.nlm.nih.gov/pubmed/26215877?tool=bestpractice.com
[14]Narayanaswami P, Weiss M, Selcen D, et al. Evidence-based guideline summary: diagnosis and treatment of limb-girdle and distal dystrophies: report of the guideline development subcommittee of the American Academy of Neurology and the practice issues review panel of the American Association of Neuromuscular & Electrodiagnostic Medicine. Neurology. 2014 Oct 14;83(16):1453-63.
https://n.neurology.org/content/83/16/1453
http://www.ncbi.nlm.nih.gov/pubmed/25313375?tool=bestpractice.com
[15]Kang PB, Morrison L, Iannaccone ST, et al. Evidence-based guideline summary: evaluation, diagnosis, and management of congenital muscular dystrophy: report of the Guideline Development Subcommittee of the American Academy of Neurology and the Practice Issues Review Panel of the American Association of Neuromuscular & Electrodiagnostic Medicine. Neurology. 2015 Mar 31;84(13):1369-78.
https://n.neurology.org/content/84/13/1369
http://www.ncbi.nlm.nih.gov/pubmed/25825463?tool=bestpractice.com
[28]Finkel RS, Mercuri E, Meyer OH, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 2: pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018 Mar;28(3):197-207.
https://www.nmd-journal.com/article/S0960-8966(17)31290-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29305137?tool=bestpractice.com
Cuidados multidisciplinares
Não há cura para a DMD. A assistência multidisciplinar para os pacientes com DMD é focada em prolongar a funcionalidade, controlar os sintomas e manter uma boa qualidade de vida pelo maior tempo possível. A equipe multidisciplinar compreende uma equipe central de especialistas clínicos em medicina neuromuscular, ortopédica, cardíaca e respiratória. Ela incluirá também fisioterapeutas, fonoaudiólogos e nutricionistas para controle dos sintomas, bem como terapeutas ocupacionais, psicólogos e assistentes sociais para apoio psicossocial e para ajudar a maximizar a qualidade de vida e a participação social. A coordenação dos cuidados (inclusive com os profissionais da atenção primária) e o planejamento antecipado da transição dos cuidados da adolescência para a idade adulta são vitais.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[11]Duan D, Goemans N, Takeda S, et al. Duchenne muscular dystrophy. Nat Rev Dis Primers. 2021 Feb 18;7(1):13.
https://www.nature.com/articles/s41572-021-00248-3
http://www.ncbi.nlm.nih.gov/pubmed/33602943?tool=bestpractice.com
[22]Fox H, Millington L, Mahabeer I, et al. Duchenne muscular dystrophy. BMJ. 2020 Jan 23;368:l7012.
http://www.ncbi.nlm.nih.gov/pubmed/31974125?tool=bestpractice.com
[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
É melhor considerar que o tratamento físico da DMD e das outras doenças neuromusculares compreende 3 estágios.
Estágio deambulante: os objetivos incluem diagnóstico precoce, preservação da força muscular com o uso de corticosteroides (glicocorticoides), redução das contraturas musculotendinosas dos membros e realização de exercícios adequados.
Estágio não-deambulante inicial: os objetivos abrangem a manutenção de uma nutrição ideal e das atividades da vida diária, assim como o manejo da escoliose.
Estágio não-deambulante tardio (normalmente com suporte ventilatório): os objetivos abrangem repouso e suporte dos músculos inspiratórios e expiratórios.
Os objetivos comuns aos três estágios são a prevenção de complicações cardíacas e o manejo respiratório. O suporte psicossocial para o paciente e sua família durante todo o curso da doença é essencial.
Prevenção de complicações cardíacas
Todos os pacientes com distrofia muscular de Duchenne (DMD) desenvolvem uma cardiomiopatia progressiva.[32]Tamura T, Shibuya N, Hashiba K, et al. Evaluation of myocardial damage in Duchenne's muscular dystrophy with thallium-201 myocardial SPECT. Jpn Heart J. 1993 Jan;34(1):51-61.
http://www.ncbi.nlm.nih.gov/pubmed/8515572?tool=bestpractice.com
Pode ser difícil avaliar os efeitos cardíacos nos pacientes com DMD porque a classificação de insuficiência cardíaca da New York Heart Association se baseia na redução da tolerância a exercícios; os sinais e sintomas de insuficiência cardíaca nos pacientes incapazes de deambular podem ser sutis e passar despercebidos.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
As evidências favorecem o tratamento precoce dos pacientes com DMD e outras distrofinopatias, mas ainda se debate se tal tratamento deve começar antes do início dos sintomas cardíacos (por exemplo, redução da fração de ejeção do ventrículo esquerdo [FEVE]) ou evidência de anormalidade em imagens.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[33]El-Aloul B, Altamirano-Diaz L, Zapata-Aldana E, et al. Pharmacological therapy for the prevention and management of cardiomyopathy in Duchenne muscular dystrophy: a systematic review. Neuromuscul Disord. 2017 Jan;27(1):4-14.
http://www.ncbi.nlm.nih.gov/pubmed/27815032?tool=bestpractice.com
[34]Bourke JP, Bueser T, Quinlivan R. Interventions for preventing and treating cardiac complications in Duchenne and Becker muscular dystrophy and X-linked dilated cardiomyopathy. Cochrane Database Syst Rev. 2018 Oct 16;(10):CD009068.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009068.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/30326162?tool=bestpractice.com
[35]McNally EM, Kaltman JR, Benson DW, et al. Contemporary cardiac issues in Duchenne muscular dystrophy. Working Group of the National Heart, Lung, and Blood Institute in collaboration with Parent Project Muscular Dystrophy. Circulation. 2015 May 5;131(18):1590-8.
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.114.015151
http://www.ncbi.nlm.nih.gov/pubmed/25940966?tool=bestpractice.com
Uma análise de dados de registros relatou que o tratamento profilático com inibidores da ECA foi associado a uma sobrevida global significativamente maior e a taxas mais baixas de hospitalização por insuficiência cardíaca.[36]Porcher R, Desguerre I, Amthor H, et al. Association between prophylactic angiotensin-converting enzyme inhibitors and overall survival in Duchenne muscular dystrophy - analysis of registry data. Eur Heart J. 2021 May 21;42(20):1976-84.
https://academic.oup.com/eurheartj/article/42/20/1976/6179515
http://www.ncbi.nlm.nih.gov/pubmed/33748842?tool=bestpractice.com
Recomenda-se iniciar um inibidor da ECA ou um antagonista do receptor da angiotensina-II nos pacientes com DMD aos 10 anos de idade.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
[35]McNally EM, Kaltman JR, Benson DW, et al. Contemporary cardiac issues in Duchenne muscular dystrophy. Working Group of the National Heart, Lung, and Blood Institute in collaboration with Parent Project Muscular Dystrophy. Circulation. 2015 May 5;131(18):1590-8.
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.114.015151
http://www.ncbi.nlm.nih.gov/pubmed/25940966?tool=bestpractice.com
[37]Feingold B, Mahle WT, Auerbach S, et al. Management of cardiac involvement associated with neuromuscular diseases: a scientific statement from the American Heart Association. Circulation. 2017 Sep 26;136(13):e200-31.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000000526
http://www.ncbi.nlm.nih.gov/pubmed/28838934?tool=bestpractice.com
A terapia farmacológica deve sempre ser iniciada (se já não tiver sido) quando um paciente apresentar sintomas de insuficiência cardíaca ou sinais de anormalidades em imagens. O tratamento consiste normalmente em um inibidor da ECA ou um antagonista do receptor de angiotensina II + betabloqueador.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
[35]McNally EM, Kaltman JR, Benson DW, et al. Contemporary cardiac issues in Duchenne muscular dystrophy. Working Group of the National Heart, Lung, and Blood Institute in collaboration with Parent Project Muscular Dystrophy. Circulation. 2015 May 5;131(18):1590-8.
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.114.015151
http://www.ncbi.nlm.nih.gov/pubmed/25940966?tool=bestpractice.com
[37]Feingold B, Mahle WT, Auerbach S, et al. Management of cardiac involvement associated with neuromuscular diseases: a scientific statement from the American Heart Association. Circulation. 2017 Sep 26;136(13):e200-31.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000000526
http://www.ncbi.nlm.nih.gov/pubmed/28838934?tool=bestpractice.com
Existem algumas evidências de que a eplerenona (um antagonista do receptor de mineralocorticoide) adjuvante pode trazer benefícios adicionais nos pacientes com cardiomiopatia precoce.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[34]Bourke JP, Bueser T, Quinlivan R. Interventions for preventing and treating cardiac complications in Duchenne and Becker muscular dystrophy and X-linked dilated cardiomyopathy. Cochrane Database Syst Rev. 2018 Oct 16;(10):CD009068.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009068.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/30326162?tool=bestpractice.com
[37]Feingold B, Mahle WT, Auerbach S, et al. Management of cardiac involvement associated with neuromuscular diseases: a scientific statement from the American Heart Association. Circulation. 2017 Sep 26;136(13):e200-31.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000000526
http://www.ncbi.nlm.nih.gov/pubmed/28838934?tool=bestpractice.com
[38]Raman SV, Hor KN, Mazur W, et al. Eplerenone for early cardiomyopathy in Duchenne muscular dystrophy: a randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2015 Feb;14(2):153-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4361281
http://www.ncbi.nlm.nih.gov/pubmed/25554404?tool=bestpractice.com
[39]Raman SV, Hor KN, Mazur W, et al. Eplerenone for early cardiomyopathy in Duchenne muscular dystrophy: results of a two-year open-label extension trial. Orphanet J Rare Dis. 2017 Feb 20;12(1):39.
https://ojrd.biomedcentral.com/articles/10.1186/s13023-017-0590-8
http://www.ncbi.nlm.nih.gov/pubmed/28219442?tool=bestpractice.com
Pacientes com DMD no estágio não-deambulante tardio correm o risco de anormalidades do ritmo cardíaco. Eles podem ser tratados com medicamentos antiarrítmicos padrão ou controlados com dispositivos. Não há recomendações específicas para os pacientes com DMD, mas diretrizes para adultos com insuficiência cardíaca estabelecida recomendam o uso de cardioversor-desfibrilador implantável para os pacientes com FEVE abaixo de 35%.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[37]Feingold B, Mahle WT, Auerbach S, et al. Management of cardiac involvement associated with neuromuscular diseases: a scientific statement from the American Heart Association. Circulation. 2017 Sep 26;136(13):e200-31.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000000526
http://www.ncbi.nlm.nih.gov/pubmed/28838934?tool=bestpractice.com
O suporte circulatório mecânico, como um dispositivo de assistência ventricular esquerda, pode ser considerado se o tratamento clínico máximo for inefetivo. Os riscos inerentes (por exemplo, tromboembolismo, sangramento, infecção, mau funcionamento do dispositivo, insuficiência cardíaca direita) e os benefícios potenciais devem ser cuidadosamente considerados e discutidos com o paciente.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[37]Feingold B, Mahle WT, Auerbach S, et al. Management of cardiac involvement associated with neuromuscular diseases: a scientific statement from the American Heart Association. Circulation. 2017 Sep 26;136(13):e200-31.
https://www.ahajournals.org/doi/10.1161/CIR.0000000000000526
http://www.ncbi.nlm.nih.gov/pubmed/28838934?tool=bestpractice.com
Manejo respiratório
É raro, mas não inédito, que os pacientes com capacidade de deambulação desenvolvam insuficiência respiratória. A capacidade vital forçada (CVF) deve ser medida pelo menos anualmente em todos os pacientes com DMD.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[40]Khan A, Frazer-Green L, Amin R, et al. Respiratory management of patients with neuromuscular weakness: an American College of Chest Physicians clinical practice guideline and expert panel report. Chest. 2023 Mar 13;S0012-3692(23)00353-7.
https://journal.chestnet.org/article/S0012-3692(23)00353-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36921894?tool=bestpractice.com
As contraturas dos tecidos moles da parede torácica e dos pulmões resultarão em menos expansão e, consequentemente, menores fluxos à tosse e um maior risco de pneumonia e insuficiência respiratória.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[40]Khan A, Frazer-Green L, Amin R, et al. Respiratory management of patients with neuromuscular weakness: an American College of Chest Physicians clinical practice guideline and expert panel report. Chest. 2023 Mar 13;S0012-3692(23)00353-7.
https://journal.chestnet.org/article/S0012-3692(23)00353-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36921894?tool=bestpractice.com
O recrutamento do volume pulmonar ("empilhamento de ar") é indicado quando a CVF for 60% ou menos do predito. Uma bolsa de ventilação manual autoinflável ou um dispositivo mecânico de insuflação-exsuflação é usado para fornecer insuflação pulmonar profunda além da capacidade inspiratória do paciente uma ou duas vezes ao dia.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[40]Khan A, Frazer-Green L, Amin R, et al. Respiratory management of patients with neuromuscular weakness: an American College of Chest Physicians clinical practice guideline and expert panel report. Chest. 2023 Mar 13;S0012-3692(23)00353-7.
https://journal.chestnet.org/article/S0012-3692(23)00353-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36921894?tool=bestpractice.com
A tosse manual e mecanicamente assistida é recomendada quando a CVF for inferior a 50% do predito, o pico de fluxo da tosse for inferior a 270 L/minuto ou a pressão expiratória máxima for inferior a 60 cm H₂O. Os prestadores de cuidados devem ser treinados nessas técnicas.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
[40]Khan A, Frazer-Green L, Amin R, et al. Respiratory management of patients with neuromuscular weakness: an American College of Chest Physicians clinical practice guideline and expert panel report. Chest. 2023 Mar 13;S0012-3692(23)00353-7.
https://journal.chestnet.org/article/S0012-3692(23)00353-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36921894?tool=bestpractice.com
Durante infecções intercorrentes do trato respiratório, a saturação inicial de oxiemoglobina do paciente (medida por um oxímetro de pulso) é mantida acima de 94% aumentando-se a frequência da tosse assistida e usando-se ventilação não invasiva conforme necessário.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
Suporte psicossocial
O atendimento psicossocial abrangente e vitalício é essencial para pacientes com DMD, outras distrofias musculares e AME. Ele deve abordar o desenvolvimento social, emocional e cognitivo, a qualidade de vida e a participação social. Também deve-se fornecer apoio às famílias (pais e irmãos) e outros cuidadores.[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
[41]Wang CH, Bonnemann CG, Rutkowski A, et al; International Standard of Care Committee for Congenital Muscular Dystrophy. Consensus statement on standard of care for congenital muscular dystrophies. J Child Neurol. 2010 Dec;25(12):1559-81.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5207780
http://www.ncbi.nlm.nih.gov/pubmed/21078917?tool=bestpractice.com
As pessoas com DMD e outras distrofias musculares têm taxas mais altas de deficiência intelectual, transtorno do espectro autista, TDAH, depressão e ansiedade do que a população em geral, e todos os pacientes devem ser avaliados para essas condições. Intervenções cognitivas e comportamentais e medicação devem ser oferecidas conforme apropriado.[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
Se houver preocupações quanto ao progresso do desenvolvimento de uma criança, é necessário encaminhar para avaliação neuropsicológica abrangente, para avaliação do desenvolvimento cognitivo, habilidades acadêmicas, função social, ajuste emocional e regulação comportamental. As intervenções devem ser oferecidas conforme necessário, com um plano de educação formal que seja reavaliado regularmente para refletir as mudanças nas necessidades e no progresso da criança.[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
Para a criança mais nova, o apoio ao paciente e à família se concentra em: encorajar atividades orientadas para um objetivo; desencorajar a superproteção da criança; abordar possíveis ressentimentos entre irmãos; facilitar a adesão ao introduzir e planejar futuras opções terapêuticas; e estabelecer expectativas de que os pacientes e suas famílias participarão ativamente das decisões sobre seus cuidados e atividades diárias. Pode ser necessário poio adicional durante mudanças significativas na vida, como começar a frequentar ou mudar de escola.[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
Os adolescentes com DMD carregam um fardo adicional por lidarem com uma incapacidade grave e progressiva, além das necessidades psicológicas de adolescentes em geral. Os pacientes podem se beneficiar de uma psicoterapia específica conduzida por psicólogos especializados nesse assunto.[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
[42]Barnett V, Bach JR. Psychological considerations in the treatment of individuals with generalized neuromuscular disorders. Semin Neurol. 1995 Mar;15(1):58-64.
http://www.ncbi.nlm.nih.gov/pubmed/7638459?tool=bestpractice.com
Os adultos com DMD (a maioria dos quais usará ventilação assistida) precisarão de apoio psicossocial contínuo para maximizar sua independência, potencial para emprego e integração social.[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
Estágio deambulante
As intervenções iniciais para a DMD incluem o início de corticoterapia para preservar a força muscular, intervenções para prevenir ou reduzir contraturas musculotendíneas dos membros, e exercícios.
Corticoterapia
Deve-se oferecer um corticosteroide para todos os pacientes com DMD. Os benefícios da corticoterapia de longo prazo incluem: retardar a perda da deambulação; preservação da função respiratória (retardando a necessidade de ventilação mecânica); evitar ou retardar a cirurgia para escoliose; retardar o aparecimento de cardiomiopatia; preservação da função do membro superior; e aumento da sobrevida.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[43]Gloss D, Moxley RT 3rd, Ashwal S, et al. Practice guideline update summary: corticosteroid treatment of Duchenne muscular dystrophy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016 Feb 2;86(5):465-72.
https://n.neurology.org/content/86/5/465
http://www.ncbi.nlm.nih.gov/pubmed/26833937?tool=bestpractice.com
[44]Matthews E, Brassington R, Kuntzer T, et al. Corticosteroids for the treatment of Duchenne muscular dystrophy. Cochrane Database Syst Rev. 2016 May 5;(5):CD003725.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003725.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27149418?tool=bestpractice.com
[45]McDonald CM, Henricson EK, Abresch RT, et al. Long-term effects of glucocorticoids on function, quality of life, and survival in patients with Duchenne muscular dystrophy: a prospective cohort study. Lancet. 2018 Feb 3;391(10119):451-61.
http://www.ncbi.nlm.nih.gov/pubmed/29174484?tool=bestpractice.com
Recomenda-se que a corticoterapia seja iniciada nas crianças pequenas, antes que ocorra um declínio físico significativo.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[46]Zhang T, Kong X. Recent advances of glucocorticoids in the treatment of Duchenne muscular dystrophy (review). Exp Ther Med. 2021 May;21(5):447.
https://www.spandidos-publications.com/10.3892/etm.2021.9875
http://www.ncbi.nlm.nih.gov/pubmed/33777191?tool=bestpractice.com
A prednisolona e o deflazacorte são geralmente usados.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[43]Gloss D, Moxley RT 3rd, Ashwal S, et al. Practice guideline update summary: corticosteroid treatment of Duchenne muscular dystrophy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016 Feb 2;86(5):465-72.
https://n.neurology.org/content/86/5/465
http://www.ncbi.nlm.nih.gov/pubmed/26833937?tool=bestpractice.com
[44]Matthews E, Brassington R, Kuntzer T, et al. Corticosteroids for the treatment of Duchenne muscular dystrophy. Cochrane Database Syst Rev. 2016 May 5;(5):CD003725.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003725.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27149418?tool=bestpractice.com
O deflazacorte é aprovado pela Food and Drug Administration (FDA) dos EUA para o tratamento da DMD em pacientes com idade igual ou superior a 2 anos. Uma revisão sugeriu que os pacientes que tomam deflazacort experimentam taxas semelhantes ou mais lentas de declínio funcional em comparação com os que tomam prednisolona.[47]Biggar WD, Skalsky A, McDonald CM. Comparing deflazacort and prednisone in Duchenne muscular dystrophy. J Neuromuscul Dis. 2022;9(4):463-76.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd210776
http://www.ncbi.nlm.nih.gov/pubmed/35723111?tool=bestpractice.com
Há incerteza quanto ao regime de dosagem ideal de corticosteroides para os pacientes com DMD. Algumas evidências sugerem que um regime de prednisolona apenas no fim de semana é tão efetiva quanto a prednisolona diária, com menos efeitos adversos.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[43]Gloss D, Moxley RT 3rd, Ashwal S, et al. Practice guideline update summary: corticosteroid treatment of Duchenne muscular dystrophy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016 Feb 2;86(5):465-72.
https://n.neurology.org/content/86/5/465
http://www.ncbi.nlm.nih.gov/pubmed/26833937?tool=bestpractice.com
[44]Matthews E, Brassington R, Kuntzer T, et al. Corticosteroids for the treatment of Duchenne muscular dystrophy. Cochrane Database Syst Rev. 2016 May 5;(5):CD003725.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003725.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27149418?tool=bestpractice.com
Outros regimes de dosagem para a prednisolona e o deflazacort (por exemplo, em dias alternados; intermitente) foram estudados.[46]Zhang T, Kong X. Recent advances of glucocorticoids in the treatment of Duchenne muscular dystrophy (review). Exp Ther Med. 2021 May;21(5):447.
https://www.spandidos-publications.com/10.3892/etm.2021.9875
http://www.ncbi.nlm.nih.gov/pubmed/33777191?tool=bestpractice.com
Um ensaio clínico randomizado e controlado relatou que a prednisolona diária ou o deflazacort diário resultaram em desfechos significativamente melhores que a prednisolona intermitente (10 dias de uso/10 dias de intervalo) após 3 anos de acompanhamento.[48]Guglieri M, Bushby K, McDermott MP, et al. Effect of different corticosteroid dosing regimens on clinical outcomes in boys with Duchenne muscular dystrophy: a randomized clinical trial. JAMA. 2022 Apr 19;327(15):1456-68.
https://jamanetwork.com/journals/jama/fullarticle/2790925
http://www.ncbi.nlm.nih.gov/pubmed/35381069?tool=bestpractice.com
Os efeitos adversos dos corticosteroides incluem obesidade troncular e ganho de peso, osteoporose e fraturas, deficit de crescimento com baixa estatura, retardo da puberdade e catarata.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[43]Gloss D, Moxley RT 3rd, Ashwal S, et al. Practice guideline update summary: corticosteroid treatment of Duchenne muscular dystrophy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016 Feb 2;86(5):465-72.
https://n.neurology.org/content/86/5/465
http://www.ncbi.nlm.nih.gov/pubmed/26833937?tool=bestpractice.com
[44]Matthews E, Brassington R, Kuntzer T, et al. Corticosteroids for the treatment of Duchenne muscular dystrophy. Cochrane Database Syst Rev. 2016 May 5;(5):CD003725.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003725.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27149418?tool=bestpractice.com
A prednisolona pode estar associada a maior ganho de peso que o deflazacorte, enquanto a taxa de fraturas, o deficit de crescimento e a catarata podem ser piores com o deflazacorte.[43]Gloss D, Moxley RT 3rd, Ashwal S, et al. Practice guideline update summary: corticosteroid treatment of Duchenne muscular dystrophy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016 Feb 2;86(5):465-72.
https://n.neurology.org/content/86/5/465
http://www.ncbi.nlm.nih.gov/pubmed/26833937?tool=bestpractice.com
[47]Biggar WD, Skalsky A, McDonald CM. Comparing deflazacort and prednisone in Duchenne muscular dystrophy. J Neuromuscul Dis. 2022;9(4):463-76.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd210776
http://www.ncbi.nlm.nih.gov/pubmed/35723111?tool=bestpractice.com
Pacientes e familiares devem ser informados sobre esses efeitos adversos e as intervenções para tratá-los.
Antes do início da corticoterapia, devem-se fornecer orientações preventivas para controle do peso. Devem-se adicionar suplementos, especialmente vitamina D e cálcio, logo após o início do tratamento.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
Os corticosteroides não demonstraram ser úteis para outras distrofias musculares, mas as evidências são limitadas devido à natureza rara desses distúrbios.[49]Quattrocelli M, Zelikovich AS, Salamone IM, et al. Mechanisms and clinical applications of glucocorticoid steroids in muscular dystrophy. J Neuromuscul Dis. 2021;8(1):39-52.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200556
http://www.ncbi.nlm.nih.gov/pubmed/33104035?tool=bestpractice.com
Prevenção ou redução de contraturas musculotendinosas dos membros
A deambulação é comprometida pela associação da fraqueza muscular às contraturas musculotendinosas. Para minimizar as contraturas articulares, deve-se iniciar um programa de alongamento domiciliar com foco nos tornozelos, joelhos e quadris, sob a orientação de um fisioterapeuta.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
Órteses tornozelo-pé podem ser usadas para alongamento noturno.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
A cirurgia é recomendada com menos frequência do que no passado para o tratamento de contraturas em pacientes com DMD. Se um paciente tiver contratura substancial do tornozelo com boa força no quadríceps e no extensor do quadril, a cirurgia no pé e no tendão de Aquiles é recomendada para melhorar a marcha em casos cuidadosamente selecionados. Intervenções cirúrgicas relacionadas aos quadris e joelhos não são recomendadas.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
As intervenções cirúrgicas podem ser até mais efetivas para prolongar a deambulação sem auxílio nos pacientes com distrofias musculares mais leves, como as distrofias musculares de Becker e de Emery-Dreifuss.
Exercício físico
Atividade aeróbica ou exercício submáximos regulares são benéficos. Os exercícios recomendados para as pessoas com DMD incluem natação e ciclismo (com assistência conforme necessário). Os exercícios de alta resistência ou treinamentos de força devem ser evitados, devido ao risco de dano muscular e anormalidades metabólicas. O exercício deve ser orientado e monitorado por um fisioterapeuta.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
Uma revisão Cochrane concluiu que as evidências sobre os benefícios do treinamento de força e das intervenções de exercícios aeróbicos para melhorar a função muscular e cardiorrespiratória na DMD permanecem incertas.[50]Voet NB, van der Kooi EL, van Engelen BG, et al. Strength training and aerobic exercise training for muscle disease. Cochrane Database Syst Rev. 2019 Dec 6;(12):CD003907.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003907.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/31808555?tool=bestpractice.com
Para pacientes com distrofia muscular fáscio-escápulo-umeral, o treinamento com exercícios aeróbicos pode aumentar a capacidade aeróbica.[50]Voet NB, van der Kooi EL, van Engelen BG, et al. Strength training and aerobic exercise training for muscle disease. Cochrane Database Syst Rev. 2019 Dec 6;(12):CD003907.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003907.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/31808555?tool=bestpractice.com
O exercício muscular foi associado a melhorias modestas na resistência durante a caminhada em pacientes com distrofias fáscio-escápulo-umeral e miotônica em uma metanálise, mas não melhorou a força muscular.[51]Gianola S, Castellini G, Pecoraro V, et al. Effect of muscular exercise on patients with muscular dystrophy: a systematic review and meta-analysis of the literature. Front Neurol. 2020;11:958.
https://www.frontiersin.org/articles/10.3389/fneur.2020.00958/full
http://www.ncbi.nlm.nih.gov/pubmed/33281695?tool=bestpractice.com
Estágio não-deambulante inicial
A corticoterapia, a fisioterapia e os exercícios (com assistência conforme necessária) devem continuar.
Manutenção das atividades da vida diária (útil para todas as distrofias musculares)
Tecnologia assistiva, dispositivos adaptativos e auxiliares de mobilidade devem ser fornecidos para ajudar os pacientes a otimizarem a função e manterem as atividades da vida diária, a participação social e a qualidade de vida.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
Os pacientes se beneficiam do uso de cadeiras de rodas motorizadas e/ou manuais.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
As cadeiras de rodas motorizadas stand-up (ortostáticas) ajudam a manter a integridade óssea e articular e otimizam a perspectiva psicológica. Uma tentativa com uma cadeira de rodas motorizada stand-up é adequada para os pacientes que se sentirem motivados a assumir uma posição ortostática, tiverem tolerância e conforto ao ficar nessa posição por no mínimo 10 minutos e tiverem contratura dos tornozelos inferior a 10 graus.[52]Schofield C, Evans K, Young H, et al. The development of a consensus statement for the prescription of powered wheelchair standing devices in Duchenne muscular dystrophy. Disabil Rehabil. 2022 May;44(10):1889-97.
http://www.ncbi.nlm.nih.gov/pubmed/32878485?tool=bestpractice.com
Órteses tornozelo-pé podem ser benéficas para o alongamento e o posicionamento durante o dia e para diminuição da taxa de desenvolvimento de contratura musculotendinosa.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[53]Rose KJ, Burns J, Wheeler DM, et al. Interventions for increasing ankle range of motion in patients with neuromuscular disease. Cochrane Database Syst Rev. 2010 Feb 17;(2):CD006973.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006973.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/20166090?tool=bestpractice.com
Existem braços robóticos que são programáveis, portáteis e adaptáveis a várias superfícies e aplicações. Eles podem auxiliar na maioria das atividades dos membros superiores. Computadores para automação e controle ambiental e órteses para repouso dos membros inferiores podem ser benéficos.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Homem de 47 anos de idade com distrofia muscular de Duchenne ilustrando uso de um computador para controle ambiental: A) um adaptador do tipo joystick que permita ao paciente uso de jogos de computadores; B) minijoystick; C) dispositivo que permita ao paciente uso de 5 interruptores separados para operar qualquer dispositivo que aceite 1 interruptor múltiplo; D) interruptor de plataforma ativado pela compressão da almofada elevada; E) microlâmpada ativada pela compressão da superfície com toque leve; F) dispositivo que permite que o paciente mova o cursor movendo a cabeçaDo acervo do Dr. John R. Bach, FAAPMR; usado com permissão [Citation ends].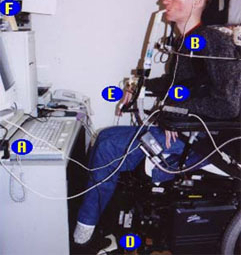
Tratamento da escoliose
Os pacientes tratados com corticosteroides geralmente apresentam curvatura da coluna vertebral mais leve do que os pacientes não tratados, reduzindo a necessidade de cirurgia para escoliose.[11]Duan D, Goemans N, Takeda S, et al. Duchenne muscular dystrophy. Nat Rev Dis Primers. 2021 Feb 18;7(1):13.
https://www.nature.com/articles/s41572-021-00248-3
http://www.ncbi.nlm.nih.gov/pubmed/33602943?tool=bestpractice.com
[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[54]Cheuk DK, Wong V, Wraige E, et al. Surgery for scoliosis in Duchenne muscular dystrophy. Cochrane Database Syst Rev. 2015 Oct 1;(10):CD005375.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005375.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/26423318?tool=bestpractice.com
No entanto, a curvatura da coluna vertebral ainda deve ser monitorada regularmente em todos os pacientes com DMD, pois a escoliose pode se desenvolver posteriormente.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
Se houver escoliose significativa, o paciente pode ser encaminhado para fusão vertebral posterior. A decisão de oferecer ou não a cirurgia dependerá de fatores como idade, maturidade esquelética e saúde geral do paciente, extensão da curvatura da coluna vertebral e a rapidez com que a escoliose estiver piorando. A progressão da escoliose nos pacientes em uso de corticosteroides é menos previsível, portanto, a observação de evidências de progressão é razoável antes da intervenção.[11]Duan D, Goemans N, Takeda S, et al. Duchenne muscular dystrophy. Nat Rev Dis Primers. 2021 Feb 18;7(1):13.
https://www.nature.com/articles/s41572-021-00248-3
http://www.ncbi.nlm.nih.gov/pubmed/33602943?tool=bestpractice.com
[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
As órteses vertebrais não são recomendadas.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
Estágio não-deambulante tardio (geralmente com suporte ventilatório)
Suporte ventilatório para todas as distrofias musculares
Os pacientes no estágio não-deambulante tardio precisam de ventilação assistida para prolongar a sobrevida. A ventilação não invasiva se aplica aos pacientes sintomáticos de hipoventilação noturna associada a fadiga, cefaleias matinais, sonolência diurna, despertares noturnos frequentes e dispneia. Alguns pacientes com DMD não apresentam sintomas de hipoventilação, portanto a ventilação não invasiva noturna também é recomendada quando um paciente apresenta CVF abaixo de 50% do predito ou pressão inspiratória máxima abaixo de 60 cm H₂O. Estudos do sono com resultados anormais (por exemplo, oximetria noturna, combinação de oximetria-capnografia e polissonografia com capnografia) também podem indicar uma necessidade de ventilação noturna. A ventilação não invasiva nasal ou oro-nasal é utilizada para suporte noturno.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[40]Khan A, Frazer-Green L, Amin R, et al. Respiratory management of patients with neuromuscular weakness: an American College of Chest Physicians clinical practice guideline and expert panel report. Chest. 2023 Mar 13;S0012-3692(23)00353-7.
https://journal.chestnet.org/article/S0012-3692(23)00353-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36921894?tool=bestpractice.com
À medida que os pacientes passam a precisar de mais suporte ventilatório, eles estendem a ventilação não invasiva para o dia. As diretrizes apoiam o uso de ventilação assistida não invasiva por até 24 horas por dia. As indicações para ventilação assistida durante o dia incluem: saturação de oxihemoglobina no sangue por oximetria de pulso (SpO₂) abaixo de 95%, pressão parcial de CO₂ acima de 45 mmHg ou sintomas de dispneia quando em vigília. Um bocal é mais comumente usado durante o dia, mas a ventilação nasal pode ser preferida por alguns pacientes e é necessária para os pacientes cujos lábios não conseguirem segurar um bocal.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[40]Khan A, Frazer-Green L, Amin R, et al. Respiratory management of patients with neuromuscular weakness: an American College of Chest Physicians clinical practice guideline and expert panel report. Chest. 2023 Mar 13;S0012-3692(23)00353-7.
https://journal.chestnet.org/article/S0012-3692(23)00353-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36921894?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Homem de 47 anos de idade com distrofia muscular de Duchenne usando bocal semirrígido achatado de 15 mm para suporte ventilatório diurnoDo acervo do Dr. John R. Bach, FAAPMR; usado com permissão [Citation ends].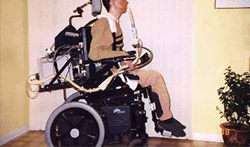
A combinação de ventilação assistida não invasiva com tosse manual e mecanicamente assistida, conforme necessário, é altamente efetiva no prolongamento da vida, e a traqueostomia geralmente não é necessária. As indicações para traqueostomia incluem: preferência do paciente, incapacidade de usar ventilação não invasiva (por exemplo, devido a comprometimento cognitivo), três tentativas de extubação malsucedidas durante uma doença crítica, apesar do uso ideal de ventilação não invasiva e tosse mecanicamente assistida, ou falha dos métodos não-invasivos de assistência à tosse para prevenir a aspiração.[29]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol. 2018 Apr;17(4):347-61.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5889091
http://www.ncbi.nlm.nih.gov/pubmed/29395990?tool=bestpractice.com
[40]Khan A, Frazer-Green L, Amin R, et al. Respiratory management of patients with neuromuscular weakness: an American College of Chest Physicians clinical practice guideline and expert panel report. Chest. 2023 Mar 13;S0012-3692(23)00353-7.
https://journal.chestnet.org/article/S0012-3692(23)00353-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36921894?tool=bestpractice.com
O marca-passo diafragmático não deve ser usado por pacientes com distrofias musculares, pois é inefetivo e pode ser nocivo.[55]Mahajan KR, Bach JR, Saporito L, et al. Diaphragm pacing and noninvasive respiratory management of amyotrophic lateral sclerosis/motor neuron disease. Muscle Nerve. 2012 Dec;46(6):851-5.
http://www.ncbi.nlm.nih.gov/pubmed/23042087?tool=bestpractice.com
[56]DiPALS Writing Committee; DiPALS Study Group Collaborators. Safety and efficacy of diaphragm pacing in patients with respiratory insufficiency due to amyotrophic lateral sclerosis (DiPALS): a multicentre, open-label, randomised controlled trial. Lancet Neurol. 2015 Sep;14(9):883-92.
https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(15)00152-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/26234554?tool=bestpractice.com
Manutenção de uma nutrição ideal
Uma gastrostomia de demora é necessária para os pacientes que não conseguem engolir com segurança ou que não conseguem manter nutrição ou hidratação adequadas, apesar de outras intervenções.[10]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol. 2018 Mar;17(3):251-67.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869704
http://www.ncbi.nlm.nih.gov/pubmed/29395989?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
Tratamentos da AME
Muitos dos princípios para o manejo da AME são semelhantes aos do manejo das distrofias musculares. Vários medicamentos estão disponíveis.
Tratamento farmacológico
O nusinersen é um oligonucleotídeo antissenso aprovado que pode ser usado para tratar pacientes com AME.[57]National Institute for Health and Care Excellence. Nusinersen for treating spinal muscular atrophy. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ta588
Este medicamento é aprovado pela European Medicines Agency (EMA) e pela FDA. Uma revisão Cochrane concluiu que o nusinersen intratecal melhora a função motora em pacientes com AME do tipo 2, com base em evidências de moderada certeza.[58]Wadman RI, van der Pol WL, Bosboom WM, et al. Drug treatment for spinal muscular atrophy types II and III. Cochrane Database Syst Rev. 2020 Jan 6;(1):CD006282.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006282.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/32006461?tool=bestpractice.com
Estudos subsequentes relataram uma função motora melhorada ou estabilizada em pacientes com AME do tipo 2 ou 3 após 12-24 meses de tratamento com nusinersen.[59]Pane M, Coratti G, Pera MC, et al; Italian ISMAC group. Nusinersen efficacy data for 24-month in type 2 and 3 spinal muscular atrophy. Ann Clin Transl Neurol. 2022 Mar;9(3):404-9.
https://onlinelibrary.wiley.com/doi/10.1002/acn3.51514
http://www.ncbi.nlm.nih.gov/pubmed/35166467?tool=bestpractice.com
[60]Coratti G, Pane M, Lucibello S, et al; iSMAC group. Age related treatment effect in type II spinal muscular atrophy pediatric patients treated with nusinersen. Neuromuscul Disord. 2021 Jul;31(7):596-602.
http://www.ncbi.nlm.nih.gov/pubmed/34099377?tool=bestpractice.com
[61]Pechmann A, Behrens M, Dörnbrack K, et al; SMArtCARE study group. Improved upper limb function in non-ambulant children with SMA type 2 and 3 during nusinersen treatment: a prospective 3-years SMArtCARE registry study. Orphanet J Rare Dis. 2022 Oct 23;17(1):384.
https://ojrd.biomedcentral.com/articles/10.1186/s13023-022-02547-8
http://www.ncbi.nlm.nih.gov/pubmed/36274155?tool=bestpractice.com
Outra revisão Cochrane determinou que é provável que o nusinersen prolongue as sobrevidas global e livre de ventilação em lactentes com AME do tipo 1; além disso, uma maior proporção de lactentes tratados com o nusinersen, comparados aos submetidos a um procedimento simulado, alcançam marcos do desenvolvimento motor e podem ser classificados como responsivos.[62]Wadman RI, van der Pol WL, Bosboom WM, et al. Drug treatment for spinal muscular atrophy type I. Cochrane Database Syst Rev. 2019 Dec 11;(12):CD006281.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006281.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/31825542?tool=bestpractice.com
Hidrocefalia comunicante (não relacionada a meningite ou sangramento) foi relatada em algumas pessoas durante o tratamento com nusinersen. A maioria dos casos se desenvolveu após 2 a 4 doses de ataque. A Medicines and Healthcare Products Regulatory Agency do Reino Unido (MHRA) recomenda investigação imediata de qualquer caso sugestivo de hidrocefalia comunicante em pacientes tratados com nusinersen, informando os pacientes sobre os sinais e sintomas da hidrocefalia comunicante antes de iniciarem o tratamento e aconselhando-os a procurar atendimento médico urgente caso qualquer possível sintoma ou sinal se desenvolva.[63]Medicines and Healthcare products Regulatory Agency. Nusinersen (Spinraza▼): reports of communicating hydrocephalus; discuss symptoms with patients and carers and investigate urgently. Sep 2018 [internet publication].
https://www.gov.uk/drug-safety-update/nusinersen-spinraza-reports-of-communicating-hydrocephalus-discuss-symptoms-with-patients-and-carers-and-investigate-urgently
O onasemnogene abeparvovec é a primeira terapia gênica aprovada pela FDA para o tratamento de crianças com menos de 2 anos de idade portadoras de AME do tipo 1.[64]National Institute for Health and Care Excellence. Onasemnogene abeparvovec for treating presymptomatic spinal muscular atrophy. Apr 2023 [internet publication].
https://www.nice.org.uk/guidance/hst24
Essa indicação foi aprovada pela FDA e pela EMA. Uma administração intravenosa única de onasemnogene abeparvovec resulta na expressão da proteína SMN nos neurônios motores da criança e, segundo relatos, melhora a função e o movimento muscular, além da sobrevida e dos marcos do desenvolvimento motor por até 5 anos.[65]Day JW, Finkel RS, Chiriboga CA, et al. Onasemnogene abeparvovec gene therapy for symptomatic infantile-onset spinal muscular atrophy in patients with two copies of SMN2 (STR1VE): an open-label, single-arm, multicentre, phase 3 trial. Lancet Neurol. 2021 Apr;20(4):284-93.
http://www.ncbi.nlm.nih.gov/pubmed/33743238?tool=bestpractice.com
[66]Mendell JR, Al-Zaidy SA, Lehman KJ, et al. Five-year extension results of the phase 1 START trial of onasemnogene abeparvovec in spinal muscular atrophy. JAMA Neurol. 2021 Jul 1;78(7):834-41.
https://jamanetwork.com/journals/jamaneurology/fullarticle/2780250
http://www.ncbi.nlm.nih.gov/pubmed/33999158?tool=bestpractice.com
[67]Mercuri E, Muntoni F, Baranello G, et al; STR1VE-EU study group. Onasemnogene abeparvovec gene therapy for symptomatic infantile-onset spinal muscular atrophy type 1 (STR1VE-EU): an open-label, single-arm, multicentre, phase 3 trial. Lancet Neurol. 2021 Oct;20(10):832-41.
http://www.ncbi.nlm.nih.gov/pubmed/34536405?tool=bestpractice.com
[68]Blair HA. Onasemnogene abeparvovec: a review in spinal muscular atrophy. CNS Drugs. 2022 Sep;36(9):995-1005.
https://link.springer.com/article/10.1007/s40263-022-00941-1
http://www.ncbi.nlm.nih.gov/pubmed/35960489?tool=bestpractice.com
[69]Weiß C, Ziegler A, Becker LL, et al. Gene replacement therapy with onasemnogene abeparvovec in children with spinal muscular atrophy aged 24 months or younger and bodyweight up to 15 kg: an observational cohort study. Lancet Child Adolesc Health. 2022 Jan;6(1):17-27.
http://www.ncbi.nlm.nih.gov/pubmed/34756190?tool=bestpractice.com
Existe um risco de hepatotoxicidade e microangiopatia trombótica. Casos fatais de insuficiência hepática aguda foram relatados, e a função hepática deve ser monitorada antes e após o tratamento.
O risdiplam é um modificador do splicing de RNA direcionado à sobrevivência do neurônio motor 2 (SMN2) para o tratamento da AME em adultos e crianças.[70]National Institute for Health and Care Excellence. Risdiplam for treating spinal muscular atrophy. Dec 2023 [internet publication].
https://www.nice.org.uk/guidance/ta755
Essa indicação foi aprovada pela FDA e pela EMA. Ele é o primeiro tratamento administrado por via oral que os pacientes podem tomar em casa. Em ensaios clínicos que incluíram pacientes a partir de 1 mês de idade, o risdiplam foi associado a melhorias clinicamente significativas na função motora e à conquista de marcos do desenvolvimento em pacientes com AME de tipos 1, 2 e 3, e aumentou a expressão de proteína SMN funcional em pacientes com AME do tipo 1.[71]Baranello G, Darras BT, Day JW, et al; FIREFISH Working Group. Risdiplam in type 1 spinal muscular atrophy. N Engl J Med. 2021 Mar 11;384(10):915-23.
https://www.nejm.org/doi/10.1056/NEJMoa2009965
http://www.ncbi.nlm.nih.gov/pubmed/33626251?tool=bestpractice.com
[72]Mercuri E, Deconinck N, Mazzone ES, et al; SUNFISH Study Group. Safety and efficacy of once-daily risdiplam in type 2 and non-ambulant type 3 spinal muscular atrophy (SUNFISH part 2): a phase 3, double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2022 Jan;21(1):42-52.
http://www.ncbi.nlm.nih.gov/pubmed/34942136?tool=bestpractice.com
Melhoras para pacientes com AME do tipo 1 foram registradas ao longo de 24 meses.[73]Masson R, Mazurkiewicz-Bełdzińska M, Rose K, et al; FIREFISH Study Group. Safety and efficacy of risdiplam in patients with type 1 spinal muscular atrophy (FIREFISH part 2): secondary analyses from an open-label trial. Lancet Neurol. 2022 Dec;21(12):1110-9.
http://www.ncbi.nlm.nih.gov/pubmed/36244364?tool=bestpractice.com
Manejo dos sintomas
As diferentes formas de AME têm diferentes graus de intensidade, e as diretrizes fornecem recomendações para não-autônomos, autônomos e caminhantes.[3]Mercuri E, Finkel RS, Muntoni F, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 1: recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018 Feb;28(2):103-15.
https://www.nmd-journal.com/article/S0960-8966(17)31284-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29290580?tool=bestpractice.com
[28]Finkel RS, Mercuri E, Meyer OH, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 2: pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018 Mar;28(3):197-207.
https://www.nmd-journal.com/article/S0960-8966(17)31290-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29305137?tool=bestpractice.com
Alongamento e posicionamento: as modalidades incluem o uso de órteses, imobilizações, métodos ativos-assistivos e passivos, estruturas supina/sentado/em pé com suporte, tala seriada e uso de suportes posturais.[3]Mercuri E, Finkel RS, Muntoni F, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 1: recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018 Feb;28(2):103-15.
https://www.nmd-journal.com/article/S0960-8966(17)31284-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29290580?tool=bestpractice.com
A desobstrução das vias aéreas é feita por fisioterapia torácica manual com insuflação-exsuflação mecânica. A ventilação não invasiva é recomendada para todas as crianças sintomáticas não deambulantes. Também é recomendada para não autônomos antes que os sinais de insuficiência respiratória sejam aparentes.[28]Finkel RS, Mercuri E, Meyer OH, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 2: pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018 Mar;28(3):197-207.
https://www.nmd-journal.com/article/S0960-8966(17)31290-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29305137?tool=bestpractice.com
[40]Khan A, Frazer-Green L, Amin R, et al. Respiratory management of patients with neuromuscular weakness: an American College of Chest Physicians clinical practice guideline and expert panel report. Chest. 2023 Mar 13;S0012-3692(23)00353-7.
https://journal.chestnet.org/article/S0012-3692(23)00353-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36921894?tool=bestpractice.com
Mobilidade e exercício: cadeiras de rodas manuais e motorizadas com suporte postural maximizam a mobilidade. O exercício é adaptado à capacidade do paciente, e pode incluir terapia aquática, exercícios aeróbicos e de condicionamento geral com e sem resistência e exercícios de equilíbrio.[3]Mercuri E, Finkel RS, Muntoni F, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 1: recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018 Feb;28(2):103-15.
https://www.nmd-journal.com/article/S0960-8966(17)31284-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29290580?tool=bestpractice.com
Uma revisão Cochrane concluiu que é incerto se o treinamento combinado de força e exercícios aeróbicos é benéfico ou prejudicial para pessoas com AME do tipo 3.[74]Bartels B, Montes J, van der Pol WL, et al. Physical exercise training for type 3 spinal muscular atrophy. Cochrane Database Syst Rev. 2019 Mar 1;(3):CD012120.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012120.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/30821348?tool=bestpractice.com
Manejo da deformidade e contraturas da coluna: a escoliose é comum nos pacientes com AME do tipo 1 ou 2. Órteses vertebrais podem ser usadas inicialmente, mas a cirurgia geralmente é necessária. As contraturas são tratadas com alongamento e órteses.[3]Mercuri E, Finkel RS, Muntoni F, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 1: recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018 Feb;28(2):103-15.
https://www.nmd-journal.com/article/S0960-8966(17)31284-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29290580?tool=bestpractice.com
As outras complicações da AME que podem exigir tratamento incluem sintomas cardíacos, disfagia, controle do peso e deficit de crescimento.[3]Mercuri E, Finkel RS, Muntoni F, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 1: recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018 Feb;28(2):103-15.
https://www.nmd-journal.com/article/S0960-8966(17)31284-1/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29290580?tool=bestpractice.com
[28]Finkel RS, Mercuri E, Meyer OH, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 2: pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018 Mar;28(3):197-207.
https://www.nmd-journal.com/article/S0960-8966(17)31290-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29305137?tool=bestpractice.com
Cuidados paliativos e no final da vida
Recomendam-se que haja consultas em cuidados neuropaliativos de maneira precoce. Os pacientes devem ser apoiados com o uso dos princípios dos cuidados paliativos e, em particular, o uso de uma abordagem holística para apoiar os pacientes e suas famílias durante a evolução da doença. Os principais componentes dos cuidados paliativos são discussões sobre os objetivos dos cuidados, planejamento de diretrizes antecipadas, manejo de sintomas e suporte no final da vida.[22]Fox H, Millington L, Mahabeer I, et al. Duchenne muscular dystrophy. BMJ. 2020 Jan 23;368:l7012.
http://www.ncbi.nlm.nih.gov/pubmed/31974125?tool=bestpractice.com
[28]Finkel RS, Mercuri E, Meyer OH, et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: part 2: pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018 Mar;28(3):197-207.
https://www.nmd-journal.com/article/S0960-8966(17)31290-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29305137?tool=bestpractice.com
[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
[31]Quinlivan R, Messer B, Murphy P, et al; ANSN. Adult North Star Network (ANSN): consensus guideline for the standard of care of adults with Duchenne muscular dystrophy. J Neuromuscul Dis. 2021;8(6):899-926.
https://content.iospress.com/articles/journal-of-neuromuscular-diseases/jnd200609
http://www.ncbi.nlm.nih.gov/pubmed/34511509?tool=bestpractice.com
[75]Taylor LP, Besbris JM, Graf WD, et al. Clinical guidance in neuropalliative care: an AAN position statement. Neurology. 2022 Mar 8;98(10):409-16.
https://n.neurology.org/content/98/10/409
http://www.ncbi.nlm.nih.gov/pubmed/35256519?tool=bestpractice.com
[76]Andrews JG, Wahl RA. Duchenne and Becker muscular dystrophy in adolescents: current perspectives. Adolesc Health Med Ther. 2018 Mar 15;9:53-63.
https://www.dovepress.com/duchenne-and-becker-muscular-dystrophy-in-adolescents-current-perspect-peer-reviewed-fulltext-article-AHMT
http://www.ncbi.nlm.nih.gov/pubmed/29588625?tool=bestpractice.com
As diretrizes antecipadas e os desejos de cuidados no final da vida devem ser discutidos com o paciente e a família/cuidadores o mais cedo possível, muito antes de os cuidados de hospice serem necessários, e devem ser uma conversa contínua.[30]Birnkrant DJ, Bushby K, Bann CM, et al; DMD Care Considerations Working Group. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018 May;17(5):445-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902408
http://www.ncbi.nlm.nih.gov/pubmed/29398641?tool=bestpractice.com
[75]Taylor LP, Besbris JM, Graf WD, et al. Clinical guidance in neuropalliative care: an AAN position statement. Neurology. 2022 Mar 8;98(10):409-16.
https://n.neurology.org/content/98/10/409
http://www.ncbi.nlm.nih.gov/pubmed/35256519?tool=bestpractice.com

