Etiologia
A doença granulomatosa crônica é causada por mutações nos genes que codificam as subunidades do complexo nicotinamida-adenina dinucleotídeo fosfato-oxidase (NADPH oxidase). A doença granulomatosa crônica ligada ao cromossomo X é causada pelos defeitos genéticos no gene que codifica a subunidade gp91phox da NADPH oxidase, localizada no cromossomo Xp21.1; ela representa cerca de 65% das doenças granulomatosas crônicas.[1][2][20] Em casos raros, mulheres com padrões distorcidos de inativação do cromossomo X podem se apresentar com doença granulomatosa crônica ligada ao cromossomo X.
A forma autossômica recessiva decorre das mutações nos genes que codificam quatro das subunidades da NADPH oxidase: p22phox, p47phox, p67phox ou p40phox, localizadas nos cromossomos 16, 7, 1 e 22, respectivamente.[1][2][21] As mutações do gene da subunidade p47phox constituem a causa autossômica recessiva mais comum (25% das doenças granulomatosas crônicas), seguidas por defeitos nas subunidades p67phox e p22phox (cerca de 5% das doenças granulomatosas crônicas cada) e na subunidade p40phox (raro).[2][20] As formas autossômicas recessivas afetam ambos os sexos.[20] Mutações no EROS (CYBC1/C17ORF62), que regula a abundância do heterodímero gp91phox-p22phox, também podem causar doença granulomatosa crônica.[22]
Fisiopatologia
O complexo nicotinamida adenina dinucleotídeo fosfato-oxidase (neutrófilos e fagócitos mononucleares como macrófagos) é utilizado pelos fagócitos para gerar o superóxido, importante para a destruição microbiana eficaz pelos fagócitos.[23] Duas subunidades, gp91phox e p22phox, coexistem no plasma do fagócito e nas membranas dos grânulos fagocíticos e formam o flavocitocromo b558. Três outras subunidades do complexo nicotinamida adenina dinucleotídeo fosfato oxidase (NADPH oxidase) coexistem no citosol: p40phox, p47phox e p67phox. Esse complexo citosólico localiza a estrutura b558 do citocromo após a ativação do fagócito, juntamente com Rac2. Todo esse complexo gera o superóxido, usando o NADPH como o doador de elétron. Os elétrons são transportados através da membrana do fagossomo e para o oxigênio no fagossomo.
Em decorrência do defeito na atividade do NADPH, os fagócitos não conseguem gerar o superóxido. O superóxido, produzido pelo complexo NADPH oxidase, é postulado para auxiliar inicialmente na alcalinização do potencial hidrogeniônico (pH) do fagossomo. Acoplado com fluxos de íons compensatórios em resposta a uma carga eletronegativa gerada através da membrana do vacúolo, o pH alcalinizado otimiza as condições das proteases microbicidas (por exemplo, elastase, catepsina G) liberadas pelos grânulos primários.[24][25] Esta teoria ajuda a explicar a suscetibilidade à infecção por organismos negativos para catalase, como Staphylococcus aureus e Aspergillus nidulans (artificialmente modificados) em modelos de camundongo.[26][27] A incapacidade de realizar explosão oxidativa também torna os neutrófilos incapazes de formar armadilhas extracelulares neutrofílicas, o que prejudica ainda mais sua atividade antibiótica.[28] Inflamação repetida pode causar a formação extensa de granuloma na pele, pulmões, linfonodos, fígado ou ossos, o que pode obstruir os tratos gastrointestinal e geniturinário. Pacientes com atividade residual da NADPH oxidase apresentam melhor evolução clínica, independentemente do subtipo.[29][Figure caption and citation for the preceding image starts]: Complexo nicotinamida adenina dinucleotídeo fosfato-oxidase (NADPH oxidase)Criado pela contribuidora anterior, Rebecca A. Marsh, MD; usado com permissão do Cincinnati Children’s Hospital Medical Center Diagnostic Immunology Laboratory [Citation ends].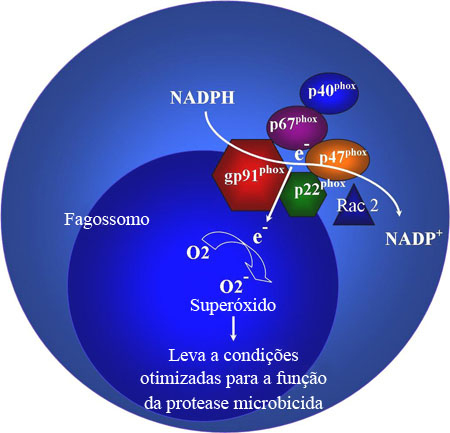
Classificação
O uso deste conteúdo está sujeito ao nosso aviso legal