A prevenção da sensibilização RhD em mães Rh-negativas que carregam um feto Rh-positivo é o principal objetivo do tratamento. Isso envolve imunoprofilaxia por meio da administração de imunoglobulina anti-D (também conhecida como imunoglobulina Rho(D) em alguns países) às mulheres em risco.
Uma vez que a sensibilização tiver ocorrido, a janela para a prevenção primária é fechada efetivamente e a imunoprofilaxia de Rh não é mais apropriada. As ações passam a envolver as vigilâncias materna e fetal quanto a sinais de anemia fetal ou hidropisia.
Prevenção da sensibilização ao RhD
A imunoprofilaxia com imunoglobulina anti-D é altamente efetiva na prevenção da sensibilização de mães Rh-negativas grávidas de fetos Rh-positivos.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[26]Urbaniak SJ, Greiss MA. RhD haemolytic disease of the fetus and the newborn. Blood Rev. 2000 Mar;14(1):44-61.
http://www.ncbi.nlm.nih.gov/pubmed/10805260?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Isso foi fundamental na redução dramática das mortes por incompatibilidade de Rh. A imunoglobulina anti-D (imunoglobulina Rho[D]) é um hemoderivado que contém um alto título de anticorpos para os antígenos Rh eritrocitários. Seu mecanismo de ação preciso é desconhecido, mas pode funcionar neutralizando os eritrócitos fetais Rh positivos no sangue materno, reduzindo assim o risco de sensibilização. A administração é eficaz tanto por via intramuscular quanto por via intravenosa.[53]Okwundu CI, Afolabi BB. Intramuscular versus intravenous anti-D for preventing Rhesus alloimmunization during pregnancy. Cochrane Database Syst Rev. 2013 Jan 31;(1):CD007885.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD007885.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/23440818?tool=bestpractice.com
Os anticorpos anti-Rh persistem por mais de 3 meses após uma dose.
Um pré-requisito para a imunoprofilaxia é o conhecimento do status materno para rhesus.[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Todas as gestantes devem ser testadas no momento da primeira visita pré-natal para o tipo RhD, e examinadas quanto à presença de anticorpos anti-D, para identificar as pacientes RhD-negativas não sensibilizadas que sejam candidatas potenciais à imunoprofilaxia.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
A imunoglobulina anti-D não é administrada a mulheres RhD-negativas que já tiverem sido sensibilizadas ao antígeno RhD.
As candidatas elegíveis devem receber administrações pré e pós-natal de imunoglobulina anti-D, conforme descrito abaixo. Além disso, o risco de sensibilização pode ser reduzido pela administração de imunoglobulina anti-D a mulheres em situações nas quais a hemorragia feto-materna (HFM) for provável, como aborto espontâneo, amostragem de vilosidades coriônicas e amniocentese.[7]National Institute for Health and Care Excellence. Routine antenatal anti-D prophylaxis for women who are rhesus D negative. Aug 2008 [internet publication].
https://www.nice.org.uk/guidance/TA156
Várias diretrizes clínicas descrevendo estratégias de prevenção de sensibilização ao RhD foram publicadas, incluindo as do Colégio Americano de Obstetras e Ginecologistas (American College of Obstetricians and Gynecologists) e da Federação Internacional de Ginecologia e Obstetrícia/Confederação Internacional de Doulas (International Federation of Gynecology and Obstetrics/International Confederation of Midwives).[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Administração pós-natal rotineira de imunoglobulina anti-D
A sensibilização ao RhD ocorre em aproximadamente 16% das gestações entre mulheres RhD-negativas.[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
A administração pós-natal de imunoglobulina anti-D reduz esse risco para aproximadamente 1.5% e é a intervenção mais efetiva para prevenir a incompatibilidade de Rh em gestações subsequentes.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Após o nascimento, os neonatos de mulheres RhD-negativas devem ter seu fator Rh determinado a partir do sangue do cordão umbilical.[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Se seus bebês forem confirmados como RhD positivos, todas as mulheres RhD negativas que não tiverem sido sensibilizadas devem receber imunoglobulina anti-D (por via intravenosa ou intramuscular) dentro de 72 horas após o parto.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
As diretrizes variam quanto à dose de imunoglobulina anti-D que deve ser administrada, e podem depender do tamanho da HFM, da marca da imunoglobulina anti-D usada e da acessibilidade.[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Uma dose profilática de 1500 UI (equivalente a 300 microgramas) de imunoglobulina anti-D é comumente administrada em países de alta renda e pode prevenir a sensibilização por RhD após uma exposição a até 30 mL de sangue total fetal RhD-positivo ou 15 mL de eritrócitos fetais.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
[54]Pollack W, Ascari WQ, Kochesky RJ, et al. Studies on Rh prophylaxis. 1. Relationship between doses of anti-Rh and size of antigenic stimulus. Transfusion. 1971 Nov-Dec;11(6):333-9.
http://www.ncbi.nlm.nih.gov/pubmed/5002765?tool=bestpractice.com
Em raras ocasiões, a HFM associada ao parto pode ser superior a 30 mL. Circunstâncias como partos traumáticos, partos cesáreos, remoção manual da placenta, parto de gêmeos e hidropisia fetal inexplicável têm maior probabilidade de estar associadas a uma HFM de grande porte. Consequentemente, várias diretrizes, incluindo as do American College of Obstetricians and Gynecologists e da British Society for Haematology, recomendam que as mulheres RhD-negativas que dão à luz bebês RhD-positivos sejam submetidas a exames adicionais para avaliar o volume da HFM e orientar a quantidade de imunoglobulina anti-D necessária para prevenir a sensibilização.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
[55]Fung MK, Grossman BJ, Hillyer CD, et al, eds. Technical manual. 18th ed. Bethesda (MD): American Association of Blood Banks; 2014. No entanto, em nenhum momento o tratamento com imunoglobulina anti-D deve ser protelado enquanto se aguardam os resultados dos exames quantitativos de HFM.[56]National Blood Authority. Prophylactic use of Rh D immunoglobulin in pregnancy care. 2021 [internet publication].
https://www.blood.gov.au/anti-d-0
Se a imunoglobulina anti-D não for administrada em até 72 horas após o parto, ela deve ser administrada assim que a necessidade for reconhecida, até 28 dias após o parto.[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
Administração pré-natal de rotina de imunoglobulina anti-D
Com base na eficácia da administração pós-parto da imunoglobulina anti-D, o risco de sensibilização por RhD em mulheres Rh-negativas que carregam um bebê Rh-positivo demonstrou ser ainda mais reduzido (para aproximadamente 0.5%) com a introdução da administração pré-natal de rotina.[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
[57]McBain RD, Crowther CA, Middleton P. Anti-D administration in pregnancy for preventing Rhesus alloimmunisation. Cochrane Database Syst Rev. 2015 Sep 3;(9):CD000020.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000020.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/26334436?tool=bestpractice.com
O rastreamento de anticorpos pré-natais de rotina deve ser obtido a 28 semanas de gestação antes da administração de imunoglobulina anti-D (para identificar mulheres que tiverem se tornado sensibilizadas antes de 28 semanas de gestação).[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
[58]Royal College of Obstetricians and Gynaecologists. The management of women with red cell antibodies during pregnancy: green-top guideline no 65. May 2014 [internet publication].
https://www.rcog.org.uk/media/oykp1rtg/rbc_gtg65.pdf
Se forem identificados anticorpos anti-D, deve-se determinar se essa presença é mediada imunologicamente ou passiva (por exemplo, como resultado de tratamento anterior com imunoglobulina anti-D). Se os anticorpos anti-RhD forem passivos, a mulher deve continuar recebendo profilaxia com imunoglobulina anti-D; no entanto, se estiverem presentes devido a uma sensibilização a profilaxia não é benéfica, e o tratamento deve ser feito de acordo com os protocolos para gestações sensibilizadas por RhD.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
A imunoglobulina anti-D pré-natal profilática deve ser oferecida às mulheres RhD-negativas não sensibilizadas, seja o tipo de sangue fetal desconhecido ou conhecido como Rh-positivo.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
O American College of Obstetricians and Gynecologists recomenda que uma única dose seja oferecida às 28 semanas de gestação, enquanto outras diretrizes recomendam uma única dose em torno de 28 semanas ou duas doses em torno de a 28 e a 34 semanas de gestação.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
A determinação não invasiva da situação do Rh fetal agora é possível por meio da análise de DNA livre de células no plasma materno. Alguns países recomendam o emprego dessa técnica no primeiro trimestre, para permitir a imunoprofilaxia anti-RhD pré-natal direcionada (isto é, somente quando o feto é RhD-positivo); no entanto, o American College of Obstetricians and Gynecologists não recomenda o uso rotineiro dessa abordagem com base na custo-efetividade.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Quando a paternidade é certa, o exame para rhesus do pai do bebê pode ser oferecido como um meio de determinar o status de RhD fetal.[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
A profilaxia pré-natal de rotina com imunoglobulina anti-D deve ser administrada independentemente de, e em adição a, qualquer imunoglobulina anti-D que possa ter sido administrada para um evento potencialmente sensibilizante (ver abaixo).[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
Antigamente, recomendava-se que uma segunda dose de imunoglobulina anti-D fosse administrada a mulheres que não tivessem dado à luz com 40 semanas; no entanto, as diretrizes atuais sugerem que isso geralmente não é necessário, desde que a injeção pré-natal não tenha sido aplicada antes de 28 semanas de gestação.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
Administração de imunoglobulina anti-D após eventos potencialmente sensibilizantes
Em mulheres RhD-negativas não previamente sensibilizadas, uma variedade de eventos associados a um potencial trauma placentário ou interrupção da interface feto-materna pode levar à sensibilização por HFM durante a gravidez. A imunoglobulina anti-D pode ajudar a minimizar o risco de tal sensibilização e, se indicada, deve ser administrada o mais rapidamente possível após o evento, idealmente dentro de 72 horas.[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
Se a imunoglobulina anti-D não for administrada dentro de 72 horas, ela deve ser administrada assim que a necessidade for reconhecida, até 28 dias após o evento potencialmente sensibilizante.[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
Para eventos sensibilizantes que ocorrerem após 20 semanas de gestação, a magnitude da HFM deve ser avaliada, e doses adicionais de imunoglobulina anti-D administradas se necessário.[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
[56]National Blood Authority. Prophylactic use of Rh D immunoglobulin in pregnancy care. 2021 [internet publication].
https://www.blood.gov.au/anti-d-0
Aborto espontâneo/aborto e óbito fetal intrauterino
As diretrizes para a administração de imunoglobulina anti-D após um aborto espontâneo ou provocado variam, e os protocolos locais devem ser seguidos.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
[56]National Blood Authority. Prophylactic use of Rh D immunoglobulin in pregnancy care. 2021 [internet publication].
https://www.blood.gov.au/anti-d-0
[59]National Institute for Health and Care Excellence. Ectopic pregnancy and miscarriage: diagnosis and initial management. Nov 2021 [internet publication].
https://www.nice.org.uk/guidance/ng126
O American College of Obstetricians and Gynecologists afirma que, no caso de aborto espontâneo no primeiro trimestre em mulheres RhD-negativas, embora o risco de sensibilização seja baixo, as consequências podem ser significativas e a administração de imunoglobulina anti-D deve ser considerada, especialmente para aquelas que estiverem no final do primeiro trimestre.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
Além disso, ele recomenda que a imunoglobulina anti-D seja administrada a mulheres RhD-negativas não sensibilizadas que tenham sido submetidas a intervenção devido a aborto espontâneo; que tiverem realizado uma interrupção de gravidez (seja clínica ou cirúrgica); ou que tiverem tido morte fetal no segundo ou terceiro trimestres.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
As diretrizes da International Federation of Gynecology and Obstetrics/International Confederation of Midwives observam que, como um óbito fetal intrauterino pode ter sido causado por uma HFM de grande porte, pode ser útil realizar um teste de Kleihauer–Betke para determinar o tamanho da hemorragia, e assim a dose de imunoglobulina anti-D necessária.[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Gravidez ectópica
Várias diretrizes recomendam a administração de imunoglobulina anti-D para todos os casos de gravidez ectópica em mulheres RhD-negativas não sensibilizadas.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Entretanto, no Reino Unido, as diretrizes do National Institute for Health and Care Excellence (NICE) recomendam que a imunoglobulina anti-D seja administrada apenas a mulheres Rh-negativas que recebam tratamento cirúrgico devido a uma gravidez ectópica (e não aquelas que recebam apenas tratamento clínico).[59]National Institute for Health and Care Excellence. Ectopic pregnancy and miscarriage: diagnosis and initial management. Nov 2021 [internet publication].
https://www.nice.org.uk/guidance/ng126
Gravidez molar
Em uma gravidez molar completa, a sensibilização por RhD não deve ocorrer, devido à ausência de desenvolvimento de órgãos fetais. No entanto, a situação é diferente em uma gestação molar parcial. Como a diferenciação entre as formas de gestação molar pode ser difícil, geralmente é aconselhável administrar imunoglobulina anti-D a todas as mulheres RhD-negativas não sensibilizadas com gravidez molar.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Procedimentos invasivos (por exemplo, coleta de amostras de vilosidades coriônicas, amniocentese)
A maioria dos países recomenda a administração de imunoglobulina anti-D após procedimentos de diagnóstico invasivos, como coleta de amostras de vilosidades coriônicas ou amniocentese, em mulheres RhD-negativas não sensibilizadas quando os fetos puderem ser RhD-positivos.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
Sangramento e trauma abdominal na gestação
A imunoglobulina anti-D é recomendada para as mulheres RhD-negativas que apresentarem hemorragia pré-natal após 20 semanas de gestação; algumas diretrizes também sugerem que a imunoglobulina anti-D deve ser considerada em certos casos de sangramento no início da gestação.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
A imunoglobulina anti-D deve ser administrada às mulheres RhD-negativas que tiverem sofrido trauma abdominal.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
[52]Visser GHA, Thommesen T, Di Renzo GC, et al. FIGO/ICM guidelines for preventing Rhesus disease: a call to action. Int J Gynaecol Obstet. 2021 Feb;152(2):144-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7898700
http://www.ncbi.nlm.nih.gov/pubmed/33128246?tool=bestpractice.com
O teste quantitativo de HFM pode ser considerado após eventos potencialmente associados a trauma placentário e à ruptura da interface materno-fetal (por exemplo, descolamento da placenta, traumatismo contuso do abdome, cordocentese, placenta prévia com sangramento).[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
Há um risco substancial de HFM acima de 30 mL com tais eventos.[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
Versão cefálica externa na apresentação de nádegas
Algumas diretrizes recomendam a administração de imunoglobulina anti-D para as pacientes RhD-negativas não sensibilizadas após uma versão cefálica externa.[23]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 181: prevention of Rh D alloimmunization. Obstet Gynecol. 2017 Aug;130(2):e57-70.
http://www.ncbi.nlm.nih.gov/pubmed/28742673?tool=bestpractice.com
[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
[42]Qureshi H, Massey E, Kirwan D, et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med. 2014 Feb;24(1):8-20.
https://onlinelibrary.wiley.com/doi/full/10.1111/tme.12091
http://www.ncbi.nlm.nih.gov/pubmed/25121158?tool=bestpractice.com
Exames quantitativos para HFM também podem ser considerados.[28]Fung KFK, Eason E. No. 133: prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2018 Jan;40(1):e1-10.
http://www.ncbi.nlm.nih.gov/pubmed/29274715?tool=bestpractice.com
O consentimento verbal ou por escrito deve ser obtido antes da administração da imunoglobulina anti-D.
Manejo após sensibilização por RhD
Se o rastreamento para anticorpos identificar anticorpos anti-D em uma gestante RhD-negativa e as avaliações concluírem que sua presença é ativa, não passiva, a paciente deve ser considerada sensibilizada e deve-se procurar orientação obstétrica especializada.[56]National Blood Authority. Prophylactic use of Rh D immunoglobulin in pregnancy care. 2021 [internet publication].
https://www.blood.gov.au/anti-d-0
A imunoprofilaxia para Rh não é mais administrada.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
Felizmente, a sensibilização inicial em uma primeira gestação afetada frequentemente é leve.
O manejo inicial de uma gestação sensibilizada por RhD envolve a determinação do status de Rh paterno. Se a paternidade for certa e o pai for RhD-negativo, nenhuma avaliação/intervenção adicional é necessária. Todas as crianças de pais homozigotos positivos para RhD e 50% de pais heterozigotos positivos para RhD serão RhD-positivas.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
No caso de um genótipo paterno heterozigoto positivo ou desconhecido para RhD, o tipo de antígeno fetal deve ser avaliado (por amniocentese ou análise não invasiva do sangue materno).[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
No caso de um feto RhD-positivo, o manejo envolve vigilância fetal e materna quanto a sinais de anemia e hidropisia fetal.
A quantificação do título de anticorpos materno é realizada em série para documentar o agravamento da doença e identificar a necessidade de exames fetais e/ou tratamentos adicionais. O American College of Obstetricians and Gynecologists afirma que considera-se um título crítico (título associado a um risco significativo de doença hemolítica grave do feto e do neonato e hidropisia) um título entre 1:8 e 1:32 na maioria dos centros.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
Se o título de anticorpos inicial for 1:8 ou menos, o paciente pode ser monitorado com avaliação do título a cada 4 semanas.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
No entanto, os títulos seriados não são adequados para monitorar o status fetal quando a mãe tiver tido um feto ou neonato previamente afetado.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
No Reino Unido, o Royal College of Obstetricians and Gynecologists recomenda que os anticorpos anti-D sejam medidos a cada 4 semanas até 28 semanas de gestação, e depois a cada 2 semanas até o parto, e o encaminhamento a um especialista em medicina fetal deve ocorrer se houver aumento dos níveis de anticorpos, se o nível atingir o limite específico de >4 UI/mL, ou se as características da ultrassonografia forem sugestivas de anemia fetal.[58]Royal College of Obstetricians and Gynaecologists. The management of women with red cell antibodies during pregnancy: green-top guideline no 65. May 2014 [internet publication].
https://www.rcog.org.uk/media/oykp1rtg/rbc_gtg65.pdf
Em um centro com equipe treinada e quando o feto estiver em uma idade gestacional apropriada, a medição por Doppler da velocidade sistólica de pico na artéria cerebral média fetal é um meio não invasivo apropriado para monitorar as gestações complicadas por sensibilização por RhD.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
A avaliação ultrassonográfica fetal também é empregada.
A maioria dos casos de sensibilização por rhesus causando doença hemolítica grave no feto é o resultado de incompatibilidade com relação ao antígeno D.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
No entanto, mais de 30 variantes antigênicas foram identificadas, e o cuidado de pacientes com sensibilização por antígenos diferentes do RhD que são conhecidos por causar doença hemolítica deve ser o mesmo que para pacientes com sensibilização por D.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
Uma possível exceção é a sensibilização por antígenos de Kell.[41]American Congress of Obstetrics and Gynecology. ACOG practice bulletin no. 192: management of alloimmunization during pregnancy. Obstet Gynecol. 2018 Mar;131(3):e82-90.
http://www.ncbi.nlm.nih.gov/pubmed/29470342?tool=bestpractice.com
Terapia fetal
O objetivo da terapia fetal é corrigir a anemia grave, melhorar a hipóxia dos tecidos, prevenir (ou reverter) a hidropisia fetal e evitar o óbito do feto.
Se o sangue do feto for Rh-negativo ou o fluxo sanguíneo da artéria cerebral média ou os níveis de bilirrubina amniótica permanecerem normais em um feto Rh-positivo, a gestação pode continuar até o termo sem tratamento. Se o sangue do feto for Rh-positivo ou tiver status de Rh desconhecido e se o fluxo da artéria cerebral média ou os níveis de bilirrubina amniótica estiverem elevados, sugerindo anemia fetal, transfusões sanguíneas intrauterinas podem ser administradas ao feto por um especialista em uma unidade equipada para assistência a gestações de alto risco.[Figure caption and citation for the preceding image starts]: Transfusão intraperitoneal; agulha com ponta ecogênica visualizada na bolsa da asciteThe Ottawa Hospital; usado com o consentimento do paciente [Citation ends].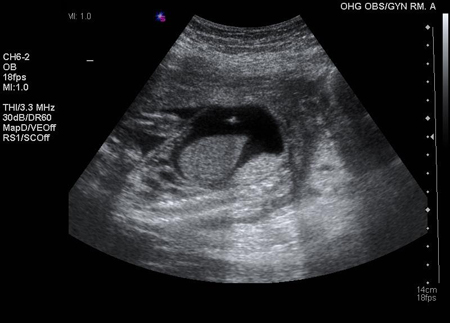
Terapia neonatal
Neonatos com eritroblastose devem ser avaliados imediatamente por um pediatra para determinar a necessidade de exsanguineotransfusão, fototerapia ou imunoglobulina intravenosa (IGIV). A IGIV é usada em algumas práticas clínicas, já que se demonstrou que reduz a necessidade de exsanguineotransfusão em neonatos com doença hemolítica comprovada devido à incompatibilidade de Rh e/ou ABO e para diminuir a duração da hospitalização e da fototerapia.[60]Li MJ, Chen CH, Wu Q, et al. Intravenous immunoglobulin G for hemolytic disease of the newborn: a systematic review [in Chinese]. Chin J Evid Based Med. 2010;10:1199-204.
http://en.cnki.com.cn/Article_en/CJFDTotal-ZZXZ201010016.htm
[61]Huizing K, Røislien J, Hansen T. Intravenous immunoglobulin reduces the need for exchange transfusion in Rhesus and ABO incompatibility. Acta Paediatr. 2008 Oct;97(10):1362-5.
http://www.ncbi.nlm.nih.gov/pubmed/18616629?tool=bestpractice.com
No entanto, há uma falta geral de evidências para apoiar seu uso para o tratamento da doença hemolítica aloimune.[62]Smits-Wintjens VE, Walther FJ, Rath ME, et al. Intravenous immunoglobulin in neonates with rhesus hemolytic disease: a randomized controlled trial. Pediatrics. 2011 Apr;127(4):680-6.
http://www.ncbi.nlm.nih.gov/pubmed/21422084?tool=bestpractice.com
[63]Zwiers C, Scheffer-Rath ME, Lopriore E, et al. Immunoglobulin for alloimmune hemolytic disease in neonates. Cochrane Database Syst Rev. 2018 Mar 18;(3):CD003313.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003313.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/29551014?tool=bestpractice.com
[  ]
What are the benefits and harms of immunoglobulin for neonates with alloimmune hemolytic disease/jaundice?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2095/fullMostre-me a resposta[Evidência C]4509cc75-dd20-41da-9a0e-ba338e3b2c4eccaCQuais são os benefícios e malefícios da imunoglobulina para neonatos com doença hemolítica aloimune/icterícia?
]
What are the benefits and harms of immunoglobulin for neonates with alloimmune hemolytic disease/jaundice?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2095/fullMostre-me a resposta[Evidência C]4509cc75-dd20-41da-9a0e-ba338e3b2c4eccaCQuais são os benefícios e malefícios da imunoglobulina para neonatos com doença hemolítica aloimune/icterícia?

 ]
[Evidência C]
]
[Evidência C]