Etiologia
Hiperplasia endometrial
A hiperplasia endometrial é caracterizada pela proliferação de glândulas endometriais, resultando em uma proporção glândula/estroma maior que a observada no endométrio normal. Ela tem sido associada a progressão para adenocarcinoma em alguns estudos.[31][32][33]
A hiperplasia endometrial normalmente resulta da estimulação estrogênica crônica sem oposição pelos efeitos de contrabalanceamento da progesterona.[31]
A hiperplasia complexa com atipia citológica é denominada neoplasia intraepitelial endometrial (NEI).[32][Figure caption and citation for the preceding image starts]: Neoplasia epitelial in situ crescendo em endométrio proliferativo (fotomicrografia, coloração de hematoxilina e eosina)Do acervo de George Mutter MD, Division of Women's and Perinatal Pathology, Brigham and Women's Hospital, Harvard Medical School [Citation ends].
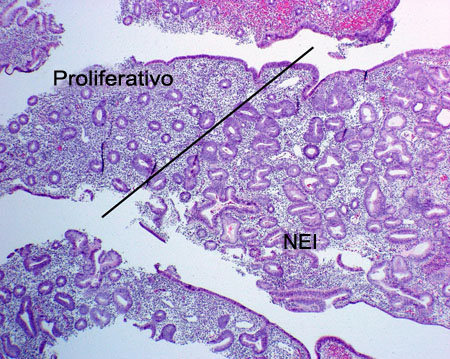
Com o uso crescente de moduladores do receptor de progesterona (MRPs) como a mifepristona (RU486) para manejo da endometriose e do leiomioma uterino, o termo "alterações endometriais associadas ao MRP" foi proposto; essas alterações histológicas no endométrio não devem ser confundidas com NEI.[33]
Estimulação estrogênica endógena do endométrio sem oposição
Observada em anovulação crônica, que é uma característica da síndrome do ovário policístico.
Em mulheres menopausadas, os estrogênios são produzidos principalmente através da aromatização periférica dos andrógenos, particularmente a androstenediona, nos adipócitos. A obesidade aumenta a taxa de produção de estrogênios por este mecanismo.
Tumores estromais do cordão sexual do ovário, como os tumores de células granulosas, também são uma fonte de estradiol endógeno.
Estimulação estrogênica exógena do endométrio sem oposição
A terapia de estrogênio exógeno (por exemplo, terapia de reposição hormonal) em mulheres na pré-menopausa e menopausadas está associada à hiperplasia endometrial e ao câncer de endométrio.[31][34][35]
Síndromes de câncer familiar
A síndrome de Lynch (também conhecida como câncer colorretal hereditário sem polipose) está associada a mutações em genes de reparo de erro de pareamento (MMR) de DNA (incluindo MSH2, MLH1, MSH6 e PMS2) e deleções no gene da molécula de adesão celular epitelial (EPCAM).[36][37]
História familiar de câncer colorretal, endometrial e/ou de ovário é frequentemente observada.[38][39]
Síndrome de Cowden, relacionada à mutação no gene supressor de tumor PTEN. As portadoras apresentam um aumento do risco de câncer endometrial, de mama, de tireoide, colorretal e renal.[40]
Fisiopatologia
Há diversos fatores fisiopatológicos que podem estar associados ao câncer de endométrio.
Estrogênio: a capacidade do estrogênio de funcionar como um mitógeno é clara, embora sua capacidade de agir como um mutágeno na estimulação da divisão celular e no crescimento dos órgãos seja controversa. Os primeiros efeitos parecem ocorrer pela estimulação da transcrição dos genes para ciclina D, proto-oncogenes, fatores de crescimento e receptores do fator de crescimento. O estrogênio pode afetar a expressão dos genes, alterando, assim, a regulação dos sinais celulares no desenvolvimento da hiperplasia endometrial. A mutação do gene PTEN (homólogo da fosfatase e da tensina) com perda da expressão da proteína PTEN é um evento precoce nessa progressão, enquanto as mutações de RAS e dos genes de reparo de erro de pareamento ocorrem posteriormente.[40][41][42][43]
Mutação do gene supressor de tumor PTEN: a coloração imuno-histoquímica utilizando anticorpos anti-PTEN em tecido parafinado mostra que mais da metade dos adenocarcinomas endometriais endometrioides, e das lesões precursoras de neoplasia endometrial intraepitelial (NEI), terão perdido a proteína PTEN.[44][45][Figure caption and citation for the preceding image starts]: Adenocarcinoma de baixo grau crescendo em endométrio proliferativo, coloração usando imuno-histoquímica (coloração marrom) para proteína homóloga da fosfatase e da tensina; observe as glândulas neoplásicas com coloração negativa (não marrom) (o epitélio normal geralmente com a coloração marrom)Do acervo de George Mutter MD, Division of Women's and Perinatal Pathology, Brigham and Women's Hospital, Harvard Medical School [Citation ends].
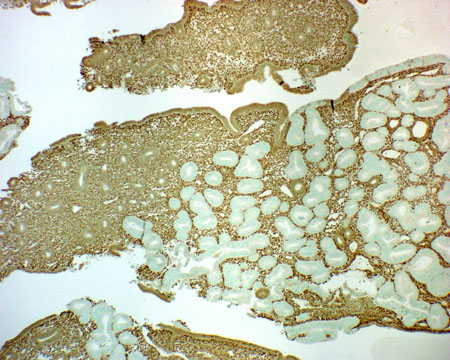
Mutação no gene K-ras: adenocarcinomas endometrioides, que são estrogênio-dependentes (e são responsáveis por 80% de todos os cânceres de endométrio), contêm mutações em K-ras em 24% dos casos.[46]
Instabilidade de microssatélite e genes de reparo de erro de pareamento (MMR): adenocarcinomas endometrioides estrogênio-dependentes mostram instabilidade de microssatélite em 20% a 30% dos casos.[47][48] Mutações de linha germinativa nos genes de MMR, MLH1, MSH2, MSH6 e PMS2, podem levar ao desenvolvimento da síndrome de Lynch (câncer colorretal hereditário sem polipose [HNPCC]). Deleções no gene da molécula de adesão celular epitelial (EPCAM) podem causar a síndrome de Lynch ao silenciar a expressão de MSH2. Essas mutações conferem uma forte suscetibilidade ao câncer, incluindo câncer colorretal, de endométrico e de ovário.[40][41][49]
Mutação do gene p53: a mutação do gene supressor do tumor p53 não é encontrada na hiperplasia endometrial, mas pode ser detectada em 20% dos casos de carcinoma endometrioide e em mais de 90% dos tumores serosos do endométrio (estrogênio-independentes, que surgem do endométrio atrófico, e não do hiperplásico).[13]
Gene HER-2/neu: a superexpressão ou amplificação de HER2 (codificada pelo gene ERBB2) no carcinoma seroso uterino está associada a um prognóstico desfavorável. O carcinoma seroso uterino, um subtipo biologicamente distinto de câncer de endométrio, é caracterizado por seis alterações genéticas moleculares importantes, incluindo: mutação em TP53, mutação/amplificação ativadora em PIK3CA, amplificação de ERBB2, amplificação de CCNE1, mutação/deleção inativadora em FBXW7 e mutação inativadora em PPP2R1A.[50]
Estudos de associação genômica ampla identificaram genes candidatos adicionais, que codificam reguladores negativos de proteínas de transdução de sinal oncogênico, nos cromossomos 12 e 17.[51]
Classificação
Classificação dos tumores do corpo uterino segundo a Organização Mundial da Saúde (OMS)[1]
Tumores epiteliais endometriais e precursores
Lesões precursoras
Hiperplasia endometrial sem atipia
Hiperplasia endometrial atípica/neoplasia intraepitelial endometrioide
Carcinomas do endométrio
Carcinoma endometrioide do corpo uterino: o subtipo mais comum de câncer do endométrio, presente em até 90% dos casos, com a histologia mostrando glândulas malignas reconhecíveis e células glandulares nas formas mais bem diferenciadas (baixo grau)[2][Figure caption and citation for the preceding image starts]: Subtipo histológico: adenocarcinoma endometrial endometrioide, o subtipo mais comum; diagnosticado em dilatação e curetagem em uma paciente que apresenta sangramento pós-menopausa (fotomicrografia, coloração de hematoxilina e eosina)Cortesia do Professor Robert H. Young, Departamento de Patologia, Massachusetts General Hospital [Citation ends].

Carcinoma seroso do corpo uterino[Figure caption and citation for the preceding image starts]: Subtipo histológico: carcinoma seroso papilar uterino com papilas pequenas típicas e espaços tipo fenda. (fotomicrografia, coloração de hematoxilina e eosina)Cortesia do Professor Robert H. Young, Departamento de Patologia, Massachusetts General Hospital [Citation ends].
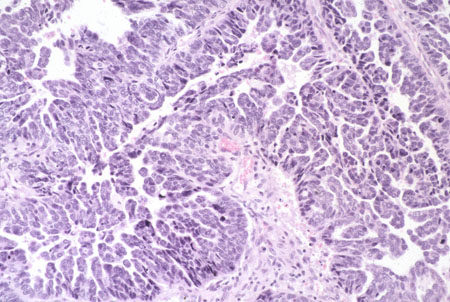
Carcinoma de células claras do corpo uterino (1% a 6% dos casos)[3][4][5][Figure caption and citation for the preceding image starts]: Subtipo histológico: adenocarcinoma de células claras (fotomicrografia, coloração de hematoxilina e eosina)Cortesia do Professor Robert H. Young, Departamento de Patologia, Massachusetts General Hospital [Citation ends].
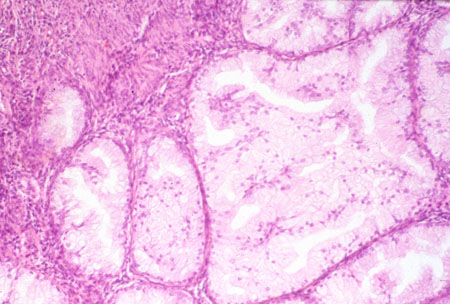
Carcinomas indiferenciados e desdiferenciados do corpo uterino
Carcinoma misto do corpo uterino
Outros carcinomas endometriais
Carcinossarcoma do corpo uterino
Lesões semelhantes a tumor
Pólipo endometrial
Metaplasia endometrial
Reação de Arias-Stella do corpo uterino
Tumores mesenquimais do útero
Tumores do músculo liso
Leiomioma uterino
Leiomiomatose intravenosa
Tumor de músculo liso de potencial maligno incerto do corpo uterino
Leiomioma metastático
Leiomiossarcoma uterino
Tumores estromais endometriais e relacionados
Sarcoma estromal endometrial, baixo grau
Sarcoma estromal endometrial, alto grau
Nódulo estromal endometrial
Sarcoma endometrial indiferenciado
Tumores mesenquimais diversos
Tumor uterino semelhante a tumor de ovário do tipo cordão sexual
Tumor de células epitelioides perivasculares (PEComa)
Tumor miofibroblástico inflamatório
Outros tumores mesenquimais do útero
Tumores epiteliais e mesenquimais mistos
Adenomioma do corpo uterino
Adenomioma polipoide atípico
Adenossarcoma do corpo uterino
Tumores diversos
Tumores do tipo células germinativas
Tumor neuroectodérmico primitivo central/tumor embrionário do sistema nervoso central
Estadiamento histológico segundo a International Federation of Gynecology and Obstetrics (FIGO)[6][7]
Os cânceres de endométrio são classificados primariamente como endometrioides versus não endometrioides. Os cânceres endometrioides constituem a maioria, estão mais comumente presentes no estádio inicial de grau 1-2, são frequentemente dependentes de hormônios e têm uma evolução clínica mais favorável. Os cânceres endometrioides de grau 3 são mais mistos e geralmente têm um prognóstico menos favorável.
Os cânceres não endometrioides são cânceres serosos mais agressivos, cânceres de células claras e carcinossarcomas que geralmente apresentam maior risco de disseminação precoce à distância.[7]
Graus histopatológicos:
Gx: o grau não pode ser avaliado
G1: bem-diferenciado
G2: Moderadamente diferenciado
G3: pouco diferenciado ou indiferenciado.
O grau de diferenciação é outra base para a classificação:
Grau 1 (G1): padrão de crescimento sólido não escamoso ou não morular de ≤5%[Figure caption and citation for the preceding image starts]: Adenocarcinoma endometrioide de grau 1 ou de baixo grau (direita) com um histórico de endométrio proliferativo (esquerda); (fotomicrografia, coloração de hematoxilina e eosina)Cortesia do Professor Robert H. Young, Departamento de Patologia, Massachusetts General Hospital [Citation ends].
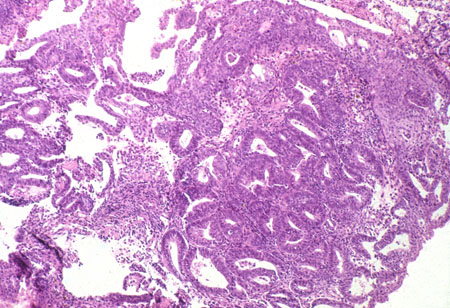
Grau 2 (G2): padrão de crescimento sólido não escamoso ou não morular de 6% a 50%
Grau 3 (G3): padrão de crescimento sólido não escamoso ou não morular >50%.[Figure caption and citation for the preceding image starts]: Adenocarcinoma endometrioide de grau 3 ou de alto grau com um histórico de endométrio atrófico (fotomicrografia, coloração de hematoxilina e eosina)Cortesia do Professor Robert H. Young, Departamento de Patologia, Massachusetts General Hospital [Citation ends].

Geralmente, G1 e G2 são baixos e G3 é alto.
Fenótipo da paciente, I ou II
Carcinoma do endométrio tipo I:
Mais comumente observado no quadro clínico clássico de uma paciente obesa com hiperlipidemia, hipoestrogenismo, resistência insulínica e infertilidade
Também comum em mulheres com sangramento uterino e início tardio da menopausa associado à hiperplasia endometrial induzida por estrogênio
Esses cânceres endometrioides de menor grau e positivos para o receptor de hormônio geralmente ocorrem em mulheres mais jovens.[8]
Carcinomas do endométrio tipo II:
Costumam aparecer mais frequentemente no endométrio atrófico em mulheres com idade mais avançada
Associados às mutações do gene TP53
Estado do receptor de hormônio do tumor[9]
O estado do receptor estrogênico (RE) e do receptor de progesterona (RP) é avaliado somente para o possível uso paliativo da terapia hormonal em tumores avançados ou recidivados, mas tem valor prognóstico:
Presença de RE (RE positivo)
Presença de RP (RP positivo)
Resposta clínica a um ensaio de progestina (normalmente medroxiprogesterona).
Estado do biomarcador do tumor
Usado cada vez mais para subclassificar o carcinoma do endométrio e para fins de tratamento e prognóstico.
A perda do gene supressor de tumor homólogo da fosfatase e da tensina (PTEN) foi relatada em 30% a 50% dos cânceres tipo 1, mas raramente é observada em cânceres serosos.[11][12][13]
O proto-oncogene HER2/neu, um receptor do fator de crescimento transmembranar, é comumente amplificado ou superexpresso em cânceres serosos e está associado a uma sobrevida desfavorável.[14][15][16][17][18]
Os tumores serosos também apresentam altas taxas de mutação no gene p53, observadas com menos frequência em tumores tipo 1 e de menor grau.
Os biomarcadores comumente utilizados podem ser detectados pela maioria dos laboratórios de patologia cirúrgica usando imuno-histoquímica em seções teciduais:
PTEN[Figure caption and citation for the preceding image starts]: Adenocarcinoma de baixo grau crescendo em endométrio proliferativo, coloração usando imuno-histoquímica (coloração marrom) para proteína homóloga da fosfatase e da tensina; observe as glândulas neoplásicas com coloração negativa (não marrom) (o epitélio normal geralmente com a coloração marrom)Do acervo de George Mutter MD, Division of Women's and Perinatal Pathology, Brigham and Women's Hospital, Harvard Medical School [Citation ends].

Genes de reparo de pareamento incorreto MLH1, MSH2, MSH6 e PMS2
p53
HER-2
Fosfo-AKT (controverso).
Classificação da Cancer Genome Atlas (TCGA)[19]
A rede de pesquisa da TCGA caracterizou 373 carcinomas endometriais utilizando tecnologias baseadas em sequenciamento e arranjo e propôs os seguintes quatro subgrupos moleculares de carcinoma de endométrio:
Ultramutado por polimerase (POLE) (carcinomas endometrioides com mutações POLE
Hipermutado por instabilidade de microssatélite (carcinoma endometrioides com instabilidade de microssatélite)
Baixo número de cópias (carcinomas endometrioides com baixo grau de alterações no número de cópias)
Alto número de cópias (predominantemente seroso, mas também carcinomas endometrioides similares ao tipo seroso, com alto grau de alterações no número de cópias e mutações TP53 frequentes).
O perfil molecular tem cada vez mais preferência em relação à classificação morfológica para informar o prognóstico e as decisões relacionadas ao tratamento.[7] A classificação molecular está sendo integrada em diretrizes nacionais e internacionais.[7]
Classificador de Risco Molecular Proativo para Câncer de Endométrio (ProMisE)[20]
O novo classificador molecular ProMisE atribui pacientes com câncer de endométrio a um dos quatro grupos com base em uma combinação de mutações e análises de expressão de proteínas. A primeira avaliação é a imuno-histoquímica para determinar a presença ou ausência de proteínas de reparo de erro de pareamento (para identificar a deficiência de proteínas de reparo de erro de pareamento [MMR-D]), permitindo um encaminhamento rápido para programas de câncer hereditário.
Os tumores são então avaliados para mutações em POLE e, finalmente, para a proteína 53, resultando em quatro subgrupos:
MMR-D - deficiente em proteínas de reparo de erro de pareamento (MMR)
POLE EDM - Mutações no domínio da exonuclease (EDM) da polimerase-e (POLE)
P53 wt - Proteína 53 (p53) do tipo selvagem (wt)
P53 abn - Mutações nulas/de sentido incorreto da proteína 53.
O uso deste conteúdo está sujeito ao nosso aviso legal