O tratamento da obstrução central das vias aéreas (OCVA) é desafiador e exige a abordagem de uma equipe multidisciplinar com o envolvimento de um pneumologista, um rádio-oncologista e oncologista clínico, um anestesista, um otorrinolaringologista, um cirurgião torácico e um broncoscopista intervencionista.[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
O tratamento de OCVA depende amplamente da apresentação inicial. Mais da metade das intervenções para tratamento de obstrução das vias aéreas é realizada em uma situação de urgência ou de emergência.[30]Ernst A, Simoff M, Ost D, et al. Prospective risk-adjusted morbidity and mortality outcome analysis after therapeutic bronchoscopic procedures: results of a multi-institutional outcomes database. Chest. 2008;134:514-519.
http://www.ncbi.nlm.nih.gov/pubmed/18641088?tool=bestpractice.com
Uma obstrução das vias aéreas significativa que se apresenta com sufocação iminente exige uma ação imediata para restabelecer e assegurar de maneira rápida e efetiva vias aéreas permeáveis e aliviar a obstrução.[18]Bolliger CT, Sutedja TG, Strausz J, et al. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J. 2006;27:1258-1271.
http://erj.ersjournals.com/content/27/6/1258.full
http://www.ncbi.nlm.nih.gov/pubmed/16772389?tool=bestpractice.com
Devido à severidade da apresentação em tais pacientes, investigações que normalmente seriam preliminares (por exemplo, tomografia computadorizada de alta resolução, testes de função pulmonar) e uma broncoscopia flexível diagnóstica podem não ser realizadas inicialmente.
A maioria dos pacientes cuja apresentação de OCVA é benigna ou não aguda são tratados como casos ambulatoriais. Esses pacientes são observados por várias horas na sala de recuperação e, se estiverem clinicamente estáveis depois do procedimento, recebem alta no mesmo dia.[9]Mehta AC, Harris RJ, De Boer GE. Endoscopic management of benign airway stenosis. Clin Chest Med. 1995;16:401-413.
http://www.ncbi.nlm.nih.gov/pubmed/8521696?tool=bestpractice.com
Os especialistas geralmente descrevem uma abordagem de duas etapas ao tratamento de OCVA, com estabilização inicial seguida pelo uso de diversas intervenções nas vias aéreas que podem ser divididas em terapias endoscópicas ou cirúrgicas.
Estabilização inicial
A etapa inicial, prioridade obrigatória no tratamento de OCVA, é manter oxigenação e ventilação adequadas.
Pacientes com uma apresentação subaguda de OCVA podem ser tratados com oxigênio suplementar por meio de cânulas nasais ou máscaras respiratórias. Nesses pacientes estáveis, informações diagnósticas adicionais podem ser obtidas por meio de uma broncoscopia flexível diagnóstica.
Em pacientes que apresentem grave obstrução brônquica ou traqueal que estejam instáveis e com insuficiência respiratória iminente, a estabilização inicial se concentra no estabelecimento de vias aéreas seguras. Esses pacientes devem ser avaliados e tratados em ambiente de unidade de terapia intensiva (UTI). O estabelecimento de vias aéreas seguras pode exigir intubação endotraqueal ou broncoscopia rígida. Em pacientes com grave obstrução das vias aéreas superiores proximais, o procedimento de escolha é uma cricotireoidotomia ou traqueotomia urgente.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[69]Simoff MJ, Sterman DH, Ernst A (eds). Thoracic endoscopy. Advances in interventional pulmonology. Malden, MA: Blackwell; 2006.
A intubação endotraqueal deve ser executada com anestesia das membranas mucosas em um paciente acordado ou levemente sedado que esteja respirando ativamente. É aconselhável evitar o uso de relaxantes musculares, pois a intubação pode ser difícil ou impossível.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[69]Simoff MJ, Sterman DH, Ernst A (eds). Thoracic endoscopy. Advances in interventional pulmonology. Malden, MA: Blackwell; 2006. Embora pacientes com OCVA estejam muito ansiosos, sedativos devem ser usados com cautela, pois a hipoventilação pode comprometer ainda mais as vias aéreas.[62]Brodsky JB. Bronchoscopic procedures for central airway obstruction. J Cardiothorac Vasc Anesth. 2003;17:638-646.
http://www.ncbi.nlm.nih.gov/pubmed/14579222?tool=bestpractice.com
[83]Finlayson GN, Brodsky JB. Anesthetic considerations for airway stenting in adult patients. Anesthesiol Clin. 2008;26:281-291.
http://www.ncbi.nlm.nih.gov/pubmed/18456213?tool=bestpractice.com
O tubo endotraqueal deve ser cuidadosamente introduzido ao longo da traqueia, pois trauma aos tecidos friáveis pode exacerbar uma obstrução intraluminal e causar sangramento.[62]Brodsky JB. Bronchoscopic procedures for central airway obstruction. J Cardiothorac Vasc Anesth. 2003;17:638-646.
http://www.ncbi.nlm.nih.gov/pubmed/14579222?tool=bestpractice.com
Deve ser considerada a intubação assistida por fibra óptica com colocação de tubo endotraqueal sob visualização direta, para obstruções da traqueia proximal.[62]Brodsky JB. Bronchoscopic procedures for central airway obstruction. J Cardiothorac Vasc Anesth. 2003;17:638-646.
http://www.ncbi.nlm.nih.gov/pubmed/14579222?tool=bestpractice.com
Máscara laríngea de via aérea ou laringoscopia de suspensão são alternativas para evitar essas complicações.[83]Finlayson GN, Brodsky JB. Anesthetic considerations for airway stenting in adult patients. Anesthesiol Clin. 2008;26:281-291.
http://www.ncbi.nlm.nih.gov/pubmed/18456213?tool=bestpractice.com
Caso haja qualquer dúvida acerca da estabilidade das vias aéreas na obstrução grave, a broncoscopia rígida é o procedimento de escolha, pois proporciona vias aéreas seguras, possibilitando oxigenação e ventilação.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[72]Jeon K, Kim H, Yu CM, et al. Rigid bronchoscopic intervention in patients with respiratory failure caused by malignant central airway obstruction. J Thorac Oncol. 2006 May;1(4):319-23.
http://www.ncbi.nlm.nih.gov/pubmed/17409877?tool=bestpractice.com
Ela também funciona como uma ferramenta terapêutica para a rápida dilatação de uma estenose.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
[69]Simoff MJ, Sterman DH, Ernst A (eds). Thoracic endoscopy. Advances in interventional pulmonology. Malden, MA: Blackwell; 2006.
Heliox, uma mistura de 60% a 80% de hélio e 20% a 40% de oxigênio, pode ser usado em pacientes agudos como terapia-ponte, com a finalidade de evitar intubação ou para realizar uma intubação mais segura ou estável. Ele reduz o trabalho respiratório pela diminuição do fluxo turbulento de gases nas grandes vias aéreas e permite o estabelecimento mais rápido de um fluxo laminar depois de alterações no diâmetro das vias aéreas.[15]Aboussouan LS, Stoller JK. Diagnosis and management of upper airway obstruction. Clin Chest Med. 1994;15:35-53.
http://www.ncbi.nlm.nih.gov/pubmed/8200192?tool=bestpractice.com
[83]Finlayson GN, Brodsky JB. Anesthetic considerations for airway stenting in adult patients. Anesthesiol Clin. 2008;26:281-291.
http://www.ncbi.nlm.nih.gov/pubmed/18456213?tool=bestpractice.com
Esse efeito reduz a pressão de impulso necessária para a obtenção de um dado fluxo ou um melhor fluxo com a mesma pressão de impulso. O trabalho respiratório reduzido resultante permite uma intubação mais estável com tubo endotraqueal ou broncoscopia rígida. A principal limitação do uso de Heliox é a incapacidade de fornecimento de gás com uma fração de oxigênio inspirado (FiO2) >40%. Apesar das evidências fisiológicas e relatos clínicos, faltam ensaios clínicos randomizados prospectivos que demonstrem a melhora dos desfechos com o uso de Heliox.
Se uma equipe dedicada especializada em vias aéreas não estiver disponível, deve ser considerada a transferência do paciente para um centro especializado depois da estabilização inicial. Se o paciente se apresentar com insuficiência respiratória iminente decorrente de compressão extrínseca das vias aéreas, a intubação imediata com um broncoscópio flexível passado distal à estenose e a limpeza das vias aéreas distais para remoção de pus e muco antes do encaminhamento podem salvar a vida do paciente. A insuflação do manguito traqueal ajuda a compressão da seção tumoral e o paciente pode ser transportado com segurança para um centro de referência para tratamento adicional.[18]Bolliger CT, Sutedja TG, Strausz J, et al. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J. 2006;27:1258-1271.
http://erj.ersjournals.com/content/27/6/1258.full
http://www.ncbi.nlm.nih.gov/pubmed/16772389?tool=bestpractice.com
Em alguns casos, o suporte de oxigenação por membrana extracorpórea (ECMO) pode ser considerado se o grau de estenose e o risco de descompensação respiratória forem considerados proibitivos para uma abordagem broncoscópica convencional.[84]Lin J, Frye L. The intersection of bronchoscopy and extracorporeal membrane oxygenation. J Thorac Dis. 2021 Aug;13(8):5176-82.
https://jtd.amegroups.org/article/view/39924/html
http://www.ncbi.nlm.nih.gov/pubmed/34527357?tool=bestpractice.com
[85]Wu H, Zhuo K, Cheng D. Extracorporeal membrane oxygenation in critical airway interventional therapy: A review. Front Oncol. 2023;13:1098594.
https://www.frontiersin.org/journals/oncology/articles/10.3389/fonc.2023.1098594/full
http://www.ncbi.nlm.nih.gov/pubmed/37051538?tool=bestpractice.com
O potencial desfecho terapêutico adverso deve superar o risco da ECMO em si.[23]Shaller BD, Filsoof D, Pineda JM, et al. Malignant central airway obstruction: what's new? Semin Respir Crit Care Med. 2022 Aug;43(4):512-29.
http://www.ncbi.nlm.nih.gov/pubmed/35654419?tool=bestpractice.com
[86]Ratwani AP, Davis A, Maldonado F. Current practices in the management of central airway obstruction. Curr Opin Pulm Med. 2022 Jan 1;28(1):45-51.
http://www.ncbi.nlm.nih.gov/pubmed/34720097?tool=bestpractice.com
Uma vez obtida a estabilização inicial nos pacientes não tratados com broncoscopia rígida ou nos que não necessitam de uma intervenção urgente, pode ser realizada uma broncoscopia flexível detalhada e cuidadosa, além de outros estudos adicionais necessários para o diagnóstico e planejamento do tratamento.
Obstrução maligna das vias aéreas
Tumores ressecáveis
A ressecção cirúrgica radical com dissecção nodal sistêmica constitui a abordagem terapêutica padrão em tumores ressecáveis.[18]Bolliger CT, Sutedja TG, Strausz J, et al. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J. 2006;27:1258-1271.
http://erj.ersjournals.com/content/27/6/1258.full
http://www.ncbi.nlm.nih.gov/pubmed/16772389?tool=bestpractice.com
Tumores não ressecáveis
A OCVA maligna normalmente se apresenta como doença avançada sem possibilidade de ressecção cirúrgica curativa.
Em pacientes com tumores inoperáveis das vias aéreas centrais, a restauração da patência das vias aéreas tem efeitos paliativos e pode prolongar a vida, principalmente em casos de OCVA que se apresenta com insuficiência respiratória iminente.[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
A broncoscopia intervencionista pode ser indicada antes da quimioterapia ou radioterapia (ou quando esse tratamento falhar) no tratamento de tumores não ressecáveis, tendo sido mostrado que esse procedimento melhora a dispneia e os índices de extubação aumentando, portanto, a qualidade de vida.[31]Cosano Povedano A, Muñoz Cabrera L, Cosano Povedano FJ, et al. Endoscopic treatment of central airway stenosis: five years' experience. Arch Bronconeumol. 2005;41:322-327.
http://www.ncbi.nlm.nih.gov/pubmed/15989889?tool=bestpractice.com
[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
A terapia broncoscópica é uma alternativa à cirurgia em casos em que um tumor ressecável é considerado inoperável em virtude do alto risco funcional ou anestésico ao paciente.[31]Cosano Povedano A, Muñoz Cabrera L, Cosano Povedano FJ, et al. Endoscopic treatment of central airway stenosis: five years' experience. Arch Bronconeumol. 2005;41:322-327.
http://www.ncbi.nlm.nih.gov/pubmed/15989889?tool=bestpractice.com
Embora existam pouquíssimos casos em que cânceres pulmonares não ressecáveis se tornaram operáveis após tratamentos broncoscópicos intervencionistas, a broncoscopia terapêutica pode ser usada como uma ferramenta complementar no tratamento broncoscópico e cirúrgico combinado de OCVA maligna antes da cirurgia pulmonar curativa.[31]Cosano Povedano A, Muñoz Cabrera L, Cosano Povedano FJ, et al. Endoscopic treatment of central airway stenosis: five years' experience. Arch Bronconeumol. 2005;41:322-327.
http://www.ncbi.nlm.nih.gov/pubmed/15989889?tool=bestpractice.com
[32]Chhajed PN, Eberhardt R, Dienemann H, et al. Therapeutic bronchoscopy interventions before surgical resection of lung cancer. Ann Thorac Surg. 2006;81:1839-1843.
http://www.ncbi.nlm.nih.gov/pubmed/16631682?tool=bestpractice.com
[87]Cavaliere S, Foccoli P, Toninelli C, et al. Laser in lung cancer. An 11-year experience with 2253 applications in 1585 patients. J Bronchology. 1996;3:112-115.
Pacientes com câncer de pulmão inoperável e obstrução sintomática das vias aéreas devem receber broncoscopia terapêutica com ablação mecânica ou térmica, braquiterapia ou colocação de endoprótese, com a finalidade de melhorar a dispneia, tosse, hemoptise e qualidade de vida.[88]Simoff MJ, Lally B, Slade MG, et al. Symptom management in patients with lung cancer: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143(suppl 5):e455S-e497S.
https://journal.chestnet.org/article/S0012-3692(13)60305-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/23649452?tool=bestpractice.com
Um grande estudo retrospectivo de mais de 800 pacientes mostrou que procedimentos broncoscópicos intervencionistas para grave obstrução neoplásica das vias aéreas apresentaram taxas de sucesso de 85%.[89]Hespanhol V, Magalhães A, Marques A, et al. Neoplastic severe central airways obstruction, interventional bronchoscopy: a decision-making analysis. J Thorac Cardiovasc Surg. 2013;145:926-932.
http://www.ncbi.nlm.nih.gov/pubmed/23020944?tool=bestpractice.com
Obstrução não maligna das vias aéreas
O tratamento da obstrução não maligna das vias aéreas exige a colaboração íntima com um cirurgião torácico experiente na reconstrução de anormalidades complexas das vias aéreas.
O tratamento do colapso expiratório central das vias aéreas depende da gravidade do comprometimento funcional, de sua etiologia, do grau de estenose das vias aéreas e da extensão do colapso. Traqueobroncomalácia ou grave colapso dinâmico sintomático posterior das vias aéreas pode ser tratado por terapia conservadora, como broncodilatadores em doses padrão ou ventilação por pressão positiva contínua.[13]Murgu SD, Colt HG. Complications of silicone stent insertion in patients with expiratory central airway collapse. Ann Thorac Surg. 2007;84:1870-1877.
http://www.ncbi.nlm.nih.gov/pubmed/18036901?tool=bestpractice.com
Em pacientes de baixo risco com estenose traqueal focal, ressecção cirúrgica com reanastomose primária é a terapia de primeira linha.[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
Em pacientes com colapso expiratório central das vias aéreas decorrente de traqueobroncomalácia ou de colapso dinâmico excessivo das vias aéreas, pode ser indicada a colocação temporária de endoprótese nas vias aéreas caso o paciente seja candidato à traqueoplastia, pois existe a possibilidade de melhora dos sintomas depois da colocação de endoprótese. Um corpo estranho obstruindo as vias aéreas centrais pode ser removido por meio de diversos instrumentos, incluindo fórceps, ganchos ou cestas, balão de Fogarty ou sonda de crioterapia.[74]Ko-Pen W, Mehta AC, Turner JF. Flexible bronchoscopy. 2nd ed. Malden, MA: Blackwell; 2004.
Broncoscopia flexível e rígida
A terapia broncoscópica, que pode ser realizada por meio de broncoscopia flexível ou rígida, acarreta melhora dos sintomas, da qualidade de vida e da sobrevida. Entretanto, para qualquer alívio terapêutico pretendido da obstrução em pacientes sintomáticos, a broncoscopia rígida é a opção preferencial.[61]Rosell A, Stratakos G. Therapeutic bronchoscopy for central airway diseases. Eur Respir Rev. 2020 Nov 18;29(158):190178.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9488119
http://www.ncbi.nlm.nih.gov/pubmed/33208484?tool=bestpractice.com
A escolha da abordagem adequada entre as possíveis intervenções endoscópicas (térmica, não térmica e radiação) depende de diversos fatores, incluindo a severidade da apresentação, a causa subjacente e o tipo de lesão, a estabilidade do paciente, o estado geral, cardíaco e pulmonar do paciente, a qualidade de vida, o prognóstico geral, a experiência do médico e a tecnologia disponível.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
Geralmente é usado um tratamento multimodal, com a combinação de vários processos endoscópicos, pois algumas técnicas, como laserterapia ou eletrocirurgia com colocação de endoprótese nas vias aéreas, são complementares umas às outras.[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
Em geral, o manejo endoscópico envolve menos risco, desconforto e morbidade que o tratamento cirúrgico.[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonarDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].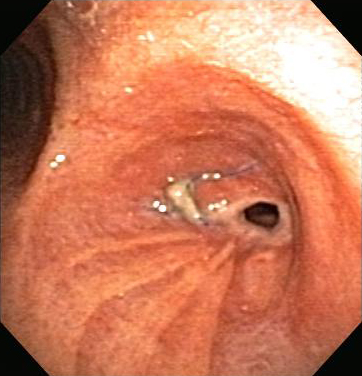 [Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: anastomose nos brônquios principais direitos pós-terapia endoscópica multimodalDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: anastomose nos brônquios principais direitos pós-terapia endoscópica multimodalDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].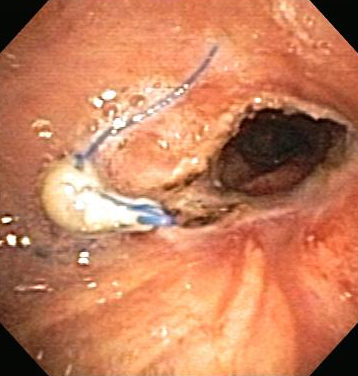
Broncoscopia rígida
É uma maneira segura e efetiva de assegurar as vias aéreas que proporcionam a capacidade de ventilar e oxigenar o paciente durante a realização de intervenções diagnósticas e terapêuticas nas vias aéreas.[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[69]Simoff MJ, Sterman DH, Ernst A (eds). Thoracic endoscopy. Advances in interventional pulmonology. Malden, MA: Blackwell; 2006.[72]Jeon K, Kim H, Yu CM, et al. Rigid bronchoscopic intervention in patients with respiratory failure caused by malignant central airway obstruction. J Thorac Oncol. 2006 May;1(4):319-23.
http://www.ncbi.nlm.nih.gov/pubmed/17409877?tool=bestpractice.com
[73]Ayers ML, Beamis JF Jr. Rigid bronchoscopy in the twenty-first century. Clin Chest Med. 2001;22:355-364.
http://www.ncbi.nlm.nih.gov/pubmed/11444118?tool=bestpractice.com
[74]Ko-Pen W, Mehta AC, Turner JF. Flexible bronchoscopy. 2nd ed. Malden, MA: Blackwell; 2004.[90]Ernst A, Silvestri GA, Johnstone D. Interventional pulmonary procedures: guidelines from the American College of Chest Physicians. Chest. 2003;123:1693-1717.
http://www.ncbi.nlm.nih.gov/pubmed/12740291?tool=bestpractice.com
Modalidade broncoscópica de escolha em pacientes com insuficiência respiratória iminente e a abordagem preferencial para qualquer alívio terapêutico pretendido de obstrução em pacientes sintomáticos.[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
[61]Rosell A, Stratakos G. Therapeutic bronchoscopy for central airway diseases. Eur Respir Rev. 2020 Nov 18;29(158):190178.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9488119
http://www.ncbi.nlm.nih.gov/pubmed/33208484?tool=bestpractice.com
Permite a utilização de cateteres de sucção de grosso calibre para aspiração de sangue e detritos, ao passo que o tubo pode ser usado para dilatar estenoses e como instrumento de desbridamento para obstruções tumorais.
São necessárias anestesia geral e uma sala de cirurgia.[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
A ventilação pode ser obtida por meio de ventilação espontânea, ventilação espontânea assistida, ventilação controlada por jato (venturi), ventilação de alta frequência ou ventilação por pressão positiva em circuito fechado através do broncoscópio rígido.[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[62]Brodsky JB. Bronchoscopic procedures for central airway obstruction. J Cardiothorac Vasc Anesth. 2003;17:638-646.
http://www.ncbi.nlm.nih.gov/pubmed/14579222?tool=bestpractice.com
[73]Ayers ML, Beamis JF Jr. Rigid bronchoscopy in the twenty-first century. Clin Chest Med. 2001;22:355-364.
http://www.ncbi.nlm.nih.gov/pubmed/11444118?tool=bestpractice.com
[83]Finlayson GN, Brodsky JB. Anesthetic considerations for airway stenting in adult patients. Anesthesiol Clin. 2008;26:281-291.
http://www.ncbi.nlm.nih.gov/pubmed/18456213?tool=bestpractice.com
A ventilação por jato é usada por um sistema aberto onde um adaptador para ventilação a jato é conectado em direção proximal ao broncoscópico rígido. Geralmente, injeta-se oxigênio a 100% a 50 psi com uma frequência de 8 a 15 respirações por minuto. Como é um sistema aberto, o ar ambiente também é introduzido e uma FiO2 variável é transmitida às vias aéreas distais. Complicações potenciais incluem pneumotórax iatrogênico.[91]Yarmus L, Feller-Kopman D. New bronchoscopic instrumentation: a review and update in rigid bronchoscopy. In: Beamis JF, Mathur P, Mehta AC, eds. Interventional pulmonary medicine. 2nd ed. New York, NY: Informa Healthcare; 2009.
As contraindicações são aquelas relacionadas à anestesia e à anatomia do pescoço e da mandíbula (por exemplo, coluna cervical instável, trauma oral ou maxilofacial, anquilose cervical ou cifoescoliose grave).[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[73]Ayers ML, Beamis JF Jr. Rigid bronchoscopy in the twenty-first century. Clin Chest Med. 2001;22:355-364.
http://www.ncbi.nlm.nih.gov/pubmed/11444118?tool=bestpractice.com
Complicações são incomuns. Existem poucos dados sobre a incidência de complicações, mas complicações graves são raras em mãos experientes. A complicação mais comum é faringite após o procedimento. Outras complicações incluem lesão nos dentes ou gengivas, lacerações traqueais ou brônquicas e sangramento intenso. Isquemia cardíaca induzida por hipoxemia e arritmias são as complicações mais perigosas. A mortalidade geral relacionada a broncoscopia rígida é tão baixa quanto 0.4%.[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[73]Ayers ML, Beamis JF Jr. Rigid bronchoscopy in the twenty-first century. Clin Chest Med. 2001;22:355-364.
http://www.ncbi.nlm.nih.gov/pubmed/11444118?tool=bestpractice.com
[90]Ernst A, Silvestri GA, Johnstone D. Interventional pulmonary procedures: guidelines from the American College of Chest Physicians. Chest. 2003;123:1693-1717.
http://www.ncbi.nlm.nih.gov/pubmed/12740291?tool=bestpractice.com
[92]Alraiyes AH, Machuzak MS. Rigid bronchoscopy. Semin Respir Crit Care Med. 2014;35:671-680.
http://www.ncbi.nlm.nih.gov/pubmed/25463158?tool=bestpractice.com
Um estudo retrospectivo mostrou que broncoscopia rígida e esvaziamento mecânico como terapia única é um procedimento seguro e bem-sucedido em até 83% dos casos de tumores das vias aéreas centrais.[93]Vishwanath G, Madan K, Bal A, et al. Rigid bronchoscopy and mechanical debulking in the management of central airway tumors: an Indian experience. J Bronchology Interv Pulmonol. 2013;20:127-133.
http://www.ncbi.nlm.nih.gov/pubmed/23609246?tool=bestpractice.com
Aperfeiçoamentos têm sido feitos ao projeto do broncoscópio rígido para a criação de um instrumento mais versátil.[94]Yarmus L, Feller-Kopman D. Bronchoscopes of the twenty-first century. Clin Chest Med. 2001;31;19-27.
http://www.ncbi.nlm.nih.gov/pubmed/20172429?tool=bestpractice.com
Os broncoscópicos rígidos comumente usados são o Bryan-Dumon série II e o Karl Storz. O broncoscópio rígido Hemer possui um tubo a ele conectado que permite a medição das pressões inspiratória e expiratória, além das concentrações de oxigênio e dióxido de carbono.[95]Dutau H, Vandemoortele T, Breen DP. Rigid bronchoscopy. Clin Chest Med. 2013;34:427-435.
http://www.ncbi.nlm.nih.gov/pubmed/23993814?tool=bestpractice.com
Broncoscopia rígida requer treinamento especial. Nos Estados Unidos ela é subutilizada, pois o treinamento de broncoscopia rígida é oferecido em apenas 4.4% dos programas de medicina pulmonar e 31.3% dos programas pulmonares que têm um serviço de pneumologia intervencionista.[92]Alraiyes AH, Machuzak MS. Rigid bronchoscopy. Semin Respir Crit Care Med. 2014;35:671-680.
http://www.ncbi.nlm.nih.gov/pubmed/25463158?tool=bestpractice.com
Broncoscopia flexível
Uma vez que a estabilização inicial seja obtida, pode ser realizada uma broncoscopia flexível detalhada e cuidadosa, além de outros estudos adicionais necessários para o diagnóstico e planejamento do tratamento. Isso não é necessário em pacientes que são inicialmente tratados com broncoscopia rígida ou em pacientes que exigem intervenção urgente.
Ele pode ser realizado sob anestesia local com sedação intravenosa ou sob anestesia geral.
Em procedimentos de broncoscopia flexível sem tubo endotraqueal, a ventilação é espontânea, ao passo que nos procedimentos realizados através de tubo endotraqueal ou de máscara laríngea de via aérea, é necessária ventilação por pressão positiva intermitente.[62]Brodsky JB. Bronchoscopic procedures for central airway obstruction. J Cardiothorac Vasc Anesth. 2003;17:638-646.
http://www.ncbi.nlm.nih.gov/pubmed/14579222?tool=bestpractice.com
Intervenções nas vias aéreas por endoscopia térmica
Todas as intervenções nas vias aéreas por endoscopia térmica podem ser realizadas com broncoscópio rígido ou flexível.
Laserterapia[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[3]Beamis JF Jr. Interventional pulmonology techniques for treating malignant large airway obstruction: an update. Curr Opin Pulm Med. 2005;11:292-295.
http://www.ncbi.nlm.nih.gov/pubmed/15928494?tool=bestpractice.com
[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[17]Folch E, Mehta AC. Airway interventions in the tracheobronchial tree. Semin Respir Crit Care Med. 2008 Aug;29(4):441-52.
http://www.ncbi.nlm.nih.gov/pubmed/18651361?tool=bestpractice.com
[18]Bolliger CT, Sutedja TG, Strausz J, et al. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J. 2006;27:1258-1271.
http://erj.ersjournals.com/content/27/6/1258.full
http://www.ncbi.nlm.nih.gov/pubmed/16772389?tool=bestpractice.com
[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
[69]Simoff MJ, Sterman DH, Ernst A (eds). Thoracic endoscopy. Advances in interventional pulmonology. Malden, MA: Blackwell; 2006.[74]Ko-Pen W, Mehta AC, Turner JF. Flexible bronchoscopy. 2nd ed. Malden, MA: Blackwell; 2004.[90]Ernst A, Silvestri GA, Johnstone D. Interventional pulmonary procedures: guidelines from the American College of Chest Physicians. Chest. 2003;123:1693-1717.
http://www.ncbi.nlm.nih.gov/pubmed/12740291?tool=bestpractice.com
[96]Bolliger CT. Laser bronchoscopy, electrocautery, APC and microdebrider. In: Beamis JF, Mathur P, Mehta AC, eds. Interventional pulmonary medicine. 2nd ed. New York, NY: Informa Healthcare; 2009.[97]Chua AP, Santacruz JF, Gildea TR. Pulmonary complications of cancer therapy and central airway obstruction. In: Davis M, Feyer P, Ortner P, et al, eds. Supportive oncology. 1st ed. Philadelphia, PA: Elsevier Saunders; 2011:309-327.
A fotorressecção por laser se refere à aplicação de energia do laser para produzir alterações térmicas, fotodinâmicas e eletromagnéticas em tecidos vivos. Existem diversos tipos de laser, incluindo o laser de alumínio ítrio garnet dopado com neodímio, o de CO₂ (dióxido de carbono) e o laser de alumínio ítrio perovsquita dopado com neodímio. O laser de alumínio ítrio garnet dopado com neodímio é o tipo de laser mais amplamente usado para doença endobrônquica.
O laser de alumínio ítrio garnet dopado com neodímio é uma técnica com ou sem contato em que a energia do laser é aplicada ao tecido das vias aéreas para o alívio de OCVA maligna e não maligna.[Figure caption and citation for the preceding image starts]: obstrução das vias aéreas centrais: obstrução maligna do brônquio principal direitoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: fotorressecção a laserDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: fotorressecção a laserDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
Ele pode ser usado em situações de emergência e é uma excelente ferramenta para rápido esvaziamento brônquico, com uma taxa relatada de restauração do lúmen de 83% a 93% e de alívio dos sintomas de 63% a 94%.[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
Um "Regra de Quatro" para a fotorressecção pode ser usada para aumentar as chances de sucesso e minimizar o risco:[17]Folch E, Mehta AC. Airway interventions in the tracheobronchial tree. Semin Respir Crit Care Med. 2008 Aug;29(4):441-52.
http://www.ncbi.nlm.nih.gov/pubmed/18651361?tool=bestpractice.com
Duração do colapso: <4 semanas
Comprimento da lesão: <4 cm
Distância entre o tubo endotraqueal e a lesão: >4 cm
Distância entre a ponta de fibra e a lesão (sem contato): 4 mm
Distância entre o broncoscópio e a ponta de fibra: 4 mm
FiO2: <40%
Potência (watts) - sem contato: 40 W
Potência (watts) - com contato: 4 W
Duração do pulso: 0.4 segundos
Número de pulsos entre limpezas: 40
Tempo na sala de cirurgia: <4 horas
Equipe de laser: 4
Com a ressecção a laser, a vaporização do tecido é imediata, e a profundidade da destruição do tecido é geralmente de 3 a 4 mm. Um excelente conhecimento da anatomia é essencial para evitar complicações como perfuração de grandes vasos.
Como a profundidade da destruição do tecido não pode ser precisamente avaliada pela aparência de sua superfície, deve-se ter extrema cautela para direcionar o feixe de laser paralelamente à parede brônquica para evitar danos. Para a obtenção de um campo imóvel para o alinhamento preciso do feixe de laser, prefere-se anestesia geral com relaxantes neuromusculares para evitar movimentos (por exemplo, tosse).[62]Brodsky JB. Bronchoscopic procedures for central airway obstruction. J Cardiothorac Vasc Anesth. 2003;17:638-646.
http://www.ncbi.nlm.nih.gov/pubmed/14579222?tool=bestpractice.com
[73]Ayers ML, Beamis JF Jr. Rigid bronchoscopy in the twenty-first century. Clin Chest Med. 2001;22:355-364.
http://www.ncbi.nlm.nih.gov/pubmed/11444118?tool=bestpractice.com
A única contraindicação absoluta é doença extrabrônquica isolada.
Em geral, a ressecção por laser apresenta uma taxa de complicações <3%.
As complicações incluem perfuração (das vias aéreas, do esôfago ou da artéria pulmonar), arritmias cardíacas, pneumotórax (hipertensivo ou não), hemorragia, hipoxemia, infarto do miocárdio, acidente vascular cerebral (AVC), embolia gasosa (subsequente ao gás que sai da ponta da sonda sob pressão e atravessa as membranas mucosas para o interior dos vasos sanguíneos através de fístulas broncovasculares formadas pela coagulação do tecido) e queimadura endobrônquica.[63]Reddy C, Majid A, Michaud G, et al. Gas embolism following bronchoscopic argon plasma coagulation: a case series. Chest. 2008;134:1066-1069.
http://www.ncbi.nlm.nih.gov/pubmed/18988782?tool=bestpractice.com
Portanto, recomenda-se que a FiO2 não exceda 40% durante o procedimento.
Embora não existam ensaios clínicos randomizados para comparar a laserterapia por laser de alumínio ítrio garnet dopado com neodímio com outras formas de tratamento para OCVA, vários estudos retrospectivos mostraram desfechos bem-sucedidos.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[98]Dumon JF, Reboud E, Garbe L, et al. Treatment of tracheobronchial lesions by laser photoresection. Chest. 1982;81:278-284.
http://www.ncbi.nlm.nih.gov/pubmed/7056101?tool=bestpractice.com
[99]Cavaliere S, Venuta F, Foccoli P, et al. Endoscopic treatment of malignant airway obstructions in 2,008 patients. Chest. 1996;110:1536-1542.
http://journal.publications.chestnet.org/pdfaccess.ashx?url=/data/journals/chest/21740/1536.pdf
http://www.ncbi.nlm.nih.gov/pubmed/8989073?tool=bestpractice.com
[100]Desai SJ, Mehta AC, VanderBrug Medendorp S, et al. Survival experience following nd:YAG laser photoresection for primary bronchogenic carcinoma. Chest. 1988;94:939-944.
http://www.ncbi.nlm.nih.gov/pubmed/2460297?tool=bestpractice.com
Eletrocirurgia (eletrocauterização)[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[3]Beamis JF Jr. Interventional pulmonology techniques for treating malignant large airway obstruction: an update. Curr Opin Pulm Med. 2005;11:292-295.
http://www.ncbi.nlm.nih.gov/pubmed/15928494?tool=bestpractice.com
[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[17]Folch E, Mehta AC. Airway interventions in the tracheobronchial tree. Semin Respir Crit Care Med. 2008 Aug;29(4):441-52.
http://www.ncbi.nlm.nih.gov/pubmed/18651361?tool=bestpractice.com
[18]Bolliger CT, Sutedja TG, Strausz J, et al. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J. 2006;27:1258-1271.
http://erj.ersjournals.com/content/27/6/1258.full
http://www.ncbi.nlm.nih.gov/pubmed/16772389?tool=bestpractice.com
[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
[90]Ernst A, Silvestri GA, Johnstone D. Interventional pulmonary procedures: guidelines from the American College of Chest Physicians. Chest. 2003;123:1693-1717.
http://www.ncbi.nlm.nih.gov/pubmed/12740291?tool=bestpractice.com
[94]Yarmus L, Feller-Kopman D. Bronchoscopes of the twenty-first century. Clin Chest Med. 2001;31;19-27.
http://www.ncbi.nlm.nih.gov/pubmed/20172429?tool=bestpractice.com
[96]Bolliger CT. Laser bronchoscopy, electrocautery, APC and microdebrider. In: Beamis JF, Mathur P, Mehta AC, eds. Interventional pulmonary medicine. 2nd ed. New York, NY: Informa Healthcare; 2009.[101]Sheski FD, Mathur PN. Cryotherapy, electrocautery, and brachytherapy. Clin Chest Med. 1999;20:123-138.
http://www.ncbi.nlm.nih.gov/pubmed/10205722?tool=bestpractice.com
[102]Sheski FD, Mathur PN. Endobronchial electrosurgery: argon plasma coagulation and electrocautery. Semin Respir Crit Care Med. 2004;25:367-374.
http://www.ncbi.nlm.nih.gov/pubmed/16088479?tool=bestpractice.com
[103]Coulter TD, Mehta AC. The heat is on: impact of endobronchial electrosurgery on the need for nd-YAG laser photoresection. Chest. 2000;118:516-521.
http://www.ncbi.nlm.nih.gov/pubmed/10936149?tool=bestpractice.com
Técnica com ou sem contato em que uma corrente elétrica alternada de alta frequência é aplicada ao tecido das vias aéreas para o alívio de OCVA maligna e não maligna.[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonarDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: incisão radial por eletrocauterizaçãoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: incisão radial por eletrocauterizaçãoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
O efeito sobre o tecido das vias aéreas depende da potência usada, do tempo de aplicação, da área da superfície de contato e do tipo de tecido. O calor gerado pela corrente elétrica é diretamente proporcional à resistência do tecido e inversamente proporcional à vascularidade do tecido e ao conteúdo de umidade.
O procedimento pode ser usado em situações de emergência e é uma excelente ferramenta para rápido esvaziamento brônquico, com uma taxa relatada de restauração do lúmen de aproximadamente 90% e de alívio dos sintomas de 70% a 97%.
Existem várias ferramentas para aplicação da eletrocauterização nas vias aéreas, por exemplo, sondas e fórceps de eletrocauterização rígidos. Para o broncoscópio flexível, laços para eletrocauterização, faca, sondas rombas e fórceps para eletrocauterização estão disponíveis.
Geralmente, usa-se uma configuração de potência de 10-40 W com as sondas rombas e 10-40 W com o laço ou eletrocauterização.[104]Mahmood K, Wahidi MM. Ablative therapies for central airway obstruction. Semin Respir Crit Care Med. 2014;35:681-692.
http://www.ncbi.nlm.nih.gov/pubmed/25463159?tool=bestpractice.com
Contraindicada na compressão extrínseca das vias aéreas. Em pacientes com marca-passos ou cardioversores/desfibriladores implantáveis automáticos, em virtude da possibilidade de disritmias ou de mau funcionamento do dispositivo, recomenda-se cautela e o dispositivo deve ser desligado sempre que for possível e clinicamente indicado.
O risco de hemorragia é de 2% a 5%. Outras complicações incluem queimadura endobrônquica, choque elétrico no operador se não houver aterramento adequado e perfuração das vias aéreas. Pode ocorrer perda de efetividade com sangramento decorrente de difusão da corrente através de uma área de superfície maior.
Como na coagulação por laser e com plasma de argônio, a FiO2 deve ser inferior a 40% para evitar queimaduras nas vias aéreas.
Coagulação com plasma de argônio (CPA)[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[3]Beamis JF Jr. Interventional pulmonology techniques for treating malignant large airway obstruction: an update. Curr Opin Pulm Med. 2005;11:292-295.
http://www.ncbi.nlm.nih.gov/pubmed/15928494?tool=bestpractice.com
[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[17]Folch E, Mehta AC. Airway interventions in the tracheobronchial tree. Semin Respir Crit Care Med. 2008 Aug;29(4):441-52.
http://www.ncbi.nlm.nih.gov/pubmed/18651361?tool=bestpractice.com
[18]Bolliger CT, Sutedja TG, Strausz J, et al. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J. 2006;27:1258-1271.
http://erj.ersjournals.com/content/27/6/1258.full
http://www.ncbi.nlm.nih.gov/pubmed/16772389?tool=bestpractice.com
[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
[69]Simoff MJ, Sterman DH, Ernst A (eds). Thoracic endoscopy. Advances in interventional pulmonology. Malden, MA: Blackwell; 2006.[74]Ko-Pen W, Mehta AC, Turner JF. Flexible bronchoscopy. 2nd ed. Malden, MA: Blackwell; 2004.[90]Ernst A, Silvestri GA, Johnstone D. Interventional pulmonary procedures: guidelines from the American College of Chest Physicians. Chest. 2003;123:1693-1717.
http://www.ncbi.nlm.nih.gov/pubmed/12740291?tool=bestpractice.com
[94]Yarmus L, Feller-Kopman D. Bronchoscopes of the twenty-first century. Clin Chest Med. 2001;31;19-27.
http://www.ncbi.nlm.nih.gov/pubmed/20172429?tool=bestpractice.com
[96]Bolliger CT. Laser bronchoscopy, electrocautery, APC and microdebrider. In: Beamis JF, Mathur P, Mehta AC, eds. Interventional pulmonary medicine. 2nd ed. New York, NY: Informa Healthcare; 2009.
Modo de eletrocoagulação tecidual sem contato no qual gás argônio ionizado é usado para conduzir corrente elétrica para o tecido das vias aéreas na paliação de OCVA maligna como parte de tratamento multimodal e para o alívio de doença endobrônquica não maligna, como tecido de granulação e papilomatose das vias aéreas.[Figure caption and citation for the preceding image starts]: obstrução das vias aéreas centrais: obstrução maligna do brônquio principal direitoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: coagulação com plasma de argônioDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: coagulação com plasma de argônioDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].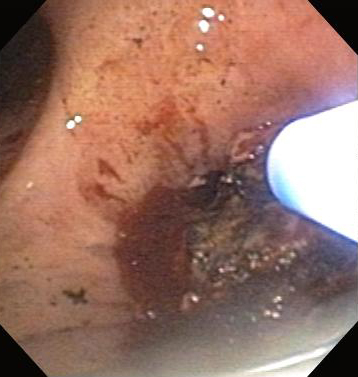
Método cada vez mais usado como alternativa à laserterapia e eletrocirurgia por ser uma excelente ferramenta para fotocoagulação (hemostasia), com taxa de restauração luminal de 91%.[105]Morice RC, Ece T, Ece F, et al. Endobronchial argon plasma coagulation for treatment of hemoptysis and neoplastic airway obstruction. Chest. 2001;119:781-787.
http://www.ncbi.nlm.nih.gov/pubmed/11243957?tool=bestpractice.com
Sondas de fibra retas, radiais e laterais estão disponíveis para diferentes indicações.
Geralmente, usa-se uma configuração de potência de 30 W no modo forçado e 10 W no modo pulsado. O fluxo de gás recomendado é de 0.3 litro por minuto a 0.8 litro por minuto.[104]Mahmood K, Wahidi MM. Ablative therapies for central airway obstruction. Semin Respir Crit Care Med. 2014;35:681-692.
http://www.ncbi.nlm.nih.gov/pubmed/25463159?tool=bestpractice.com
Embora ela tenha a vantagem de poder acessar lesões laterais, ao redor e em ângulos agudos com a sonda, a CPA não causa vaporização do tumor, portanto outras modalidades são necessárias para o esvaziamento de grandes massas tumorais. Depois da aplicação da CPA a um tumor endobrônquico, o operador pode remover as áreas de necrose e os debris resultantes com sucção, fórceps ou crioadesão por meio de uma criossonda.
Contraindicada na compressão extrínseca das vias aéreas. Em pacientes com marca-passos ou cardioversores/desfibriladores implantáveis automáticos, em virtude da possibilidade de disritmias ou de mau funcionamento do dispositivo, recomenda-se cautela e o dispositivo deve ser desligado sempre que for possível e clinicamente indicado.
Taxa de complicações <1%. As complicações incluem hemorragia, perfuração e estenose das vias aéreas, queimadura endobrônquica e embolia gasosa com gás argônio. A FiO2 deve ser inferior a 40% durante o uso da CPA para evitar queimaduras das vias aéreas.
Crioterapia[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[17]Folch E, Mehta AC. Airway interventions in the tracheobronchial tree. Semin Respir Crit Care Med. 2008 Aug;29(4):441-52.
http://www.ncbi.nlm.nih.gov/pubmed/18651361?tool=bestpractice.com
[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
[90]Ernst A, Silvestri GA, Johnstone D. Interventional pulmonary procedures: guidelines from the American College of Chest Physicians. Chest. 2003;123:1693-1717.
http://www.ncbi.nlm.nih.gov/pubmed/12740291?tool=bestpractice.com
[101]Sheski FD, Mathur PN. Cryotherapy, electrocautery, and brachytherapy. Clin Chest Med. 1999;20:123-138.
http://www.ncbi.nlm.nih.gov/pubmed/10205722?tool=bestpractice.com
[106]Mathur PN, Wolf KM, Busk MF, et al. Fiberoptic bronchoscopic cryotherapy in the management of tracheobronchial obstruction. Chest. 1996;110:718-723.
http://journal.publications.chestnet.org/pdfaccess.ashx?url=/data/journals/chest/21736/718.pdf
http://www.ncbi.nlm.nih.gov/pubmed/8797417?tool=bestpractice.com
Técnica de contato na qual uma substância criogênica (mais comumente óxido nítrico) é aplicada ao tecido das vias aéreas no tratamento de OCVA maligna e não maligna sem insuficiência respiratória iminente.
Método particularmente bem-sucedido na remoção de corpos estranhos e coágulos sanguíneos (por crioadesão), rolhas de muco, tecido de granulação e lesões polipoides, com uma taxa de restauração luminar de, aproximadamente, 80% e de alívio de sintomas de 70% a 93%.
A maioria dos efeitos da criocirurgia não ocorre até depois de algumas horas depois do tratamento e, historicamente, o uso da crioterapia nas vias aéreas tem sido limitado à obstrução não aguda ou grave das vias aéreas. Na literatura, a maior parte do uso da crioterapia tem sido direcionada a estenoses de baixo grau ou como terapia adjuvante. A destruição tecidual máxima ocorre em 1 a 2 semanas e são recomendados tratamentos repetidos para a obtenção do efeito desejado.[107]Seaman JC, Musani AI. Endobronchial ablative therapies. Clin Chest Med. 2013;34:417-425.
http://www.ncbi.nlm.nih.gov/pubmed/23993813?tool=bestpractice.com
Relatos de casos e estudos retrospectivos mostram que o uso de crioterapia para recanalização tem um efeito terapêutico imediato.[108]Boujaoude Z, Young D, Lotano R, et al. Cryosurgery for the immediate treatment of acute central airway obstruction. J Bronchology Interv Pulmonol. 2013;20:45-47.
http://www.ncbi.nlm.nih.gov/pubmed/23328143?tool=bestpractice.com
Um grande estudo retrospectivo de 225 casos apresentou uma taxa de sucesso de 91% com a criossonda flexível para recanalização de estenose maligna com um perfil seguro.[109]Schumann C, Hetzel M, Babiak AJ, et al. Endobronchial tumor debulking with a flexible cryoprobe for immediate treatment of malignant stenosis. J Thorac Cardiovasc Surg. 2010;139:997-1000.
http://www.jtcvsonline.org/article/S0022-5223%2809%2900877-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/19716140?tool=bestpractice.com
O efeito sobre o tecido das vias aéreas depende do número de ciclos de congelamento-descongelamento, da temperatura alcançada (geralmente abaixo de -40 °C) e do conteúdo de água do tecido, com o efeito máximo atingido com congelamento rápido e descongelamento lento. Os tecidos criossensíveis incluem a pele, os nervos, o endotélio, o tecido de granulação e as membranas mucosas. Tecido conjuntivo e fibroso, a bainha nervosa, cartilagem e gordura são criorresistentes.
Procedimento seguro com poucas complicações relativamente sem importância, sendo as mais comuns febre pós-procedimento e descamação das vias aéreas, necessitando da repetição de broncoscopias para acompanhamento. A crioterapia induz danos limitados à parede brônquica, sem estenose residual, trazendo um risco marcantemente reduzido de perfuração das vias aéreas.
Intervenções endoscópicas não térmicas nas vias aéreas
Terapia fotodinâmica (TFD)[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[17]Folch E, Mehta AC. Airway interventions in the tracheobronchial tree. Semin Respir Crit Care Med. 2008 Aug;29(4):441-52.
http://www.ncbi.nlm.nih.gov/pubmed/18651361?tool=bestpractice.com
[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
[90]Ernst A, Silvestri GA, Johnstone D. Interventional pulmonary procedures: guidelines from the American College of Chest Physicians. Chest. 2003;123:1693-1717.
http://www.ncbi.nlm.nih.gov/pubmed/12740291?tool=bestpractice.com
Uma luz de comprimento de onda específico (de laser de potássio titanil fosfato [KTP]) é aplicada por meio de um broncoscópio flexível 24 a 72 horas depois da injeção local ou sistêmica de um medicamento fotossensibilizante, como éster de di-hematoporfirina (DHE). Isso causa uma reação fototóxica e destruição tumoral, pois o medicamento fotossensibilizante é captado preferencialmente pelas células malignas.
Imediatamente e 48 horas depois do procedimento, realiza-se a higiene broncoscópica (limpeza e esvaziamento da área para remover detritos tumorais, secreções retidas e mucosa descamada) para estabelecer a patência das vias aéreas e avaliar a necessidade de tratamento adicional.
Indicada no tratamento paliativo de OCVA sem dispneia aguda, e particularmente útil em obstruções distais decorrentes de massas endobrônquicas polipoides malignas com compressão extrínseca mínima das vias aéreas. Também pode ser aplicada a pacientes que já foram submetidos à cirurgia, radiação ou quimioterapia.
Em virtude da resposta tardia ao tratamento, a TFD não deve ser usada no manejo de emergência de OCVA aguda grave.
A complicação mais comum é a fotossensibilidade da pele, que dura de 4 a 6 semanas; os pacientes devem ser aconselhados a evitar a exposição ao sol durante esse período. Outras complicações incluem edema local das vias aéreas, estenoses, hemorragia e formação de fístulas, embora a TFD apresente um risco mais baixo de perfuração das vias aéreas.
Os efeitos são relativamente duradouros, e foi mostrado que a TFD exerce efeitos paliativos sobre a obstrução das vias aéreas em 80% dos pacientes.
Dilatação das vias aéreas
A dilatação das estenoses das vias aéreas pode ser obtida com a introdução do tubo de um broncoscópio rígido ou por meio da dilatação de um balão.
A dilatação das vias aéreas por broncoscopia rígida pode ser usada em situações de emergência, pois pode ser obtida uma recanalização rápida.[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
[73]Ayers ML, Beamis JF Jr. Rigid bronchoscopy in the twenty-first century. Clin Chest Med. 2001;22:355-364.
http://www.ncbi.nlm.nih.gov/pubmed/11444118?tool=bestpractice.com
A extremidade distal do broncoscópio rígido age como um saca-rolhas, dilatando uma estenose, ou como um descaroçador de maçãs, penetrando através de grandes tumores obstrutivos. O cilindro do broncoscópio pode ser usado para o tamponamento de lesões com sangramento. Grandes fórceps podem ser introduzidos através do broncoscópio para ajudar no desbridamento mecânico de tumores volumosos, para remover corpos estranhos ou evacuar coágulos. Um broncoscópio flexível pode ser usado durante a broncoscopia rígida para facilitar o desbridamento tecidual em vias aéreas angulosas ou distais. Essas técnicas, embora ainda sejam comumente usadas, devem ser reservadas para os casos mais graves.[30]Ernst A, Simoff M, Ost D, et al. Prospective risk-adjusted morbidity and mortality outcome analysis after therapeutic bronchoscopic procedures: results of a multi-institutional outcomes database. Chest. 2008;134:514-519.
http://www.ncbi.nlm.nih.gov/pubmed/18641088?tool=bestpractice.com
A broncoplastia com balão pode ser realizada durante broncoscopia rígida ou flexível, com ou sem fluoroscopia, e envolve o uso de balões com diâmetro cada vez maior preenchidos com soro fisiológico e mantidos em posição por 15-60 segundos para cuidadosamente dilatar as vias aéreas.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[17]Folch E, Mehta AC. Airway interventions in the tracheobronchial tree. Semin Respir Crit Care Med. 2008 Aug;29(4):441-52.
http://www.ncbi.nlm.nih.gov/pubmed/18651361?tool=bestpractice.com
[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
[110]Hautmann H, Gamarra F, Pfeifer KJ, et al. Fiberoptic bronchoscopic balloon dilatation in malignant tracheobronchial disease: indications and results. Chest. 2001;120:43-49.
http://www.ncbi.nlm.nih.gov/pubmed/11451814?tool=bestpractice.com
[111]McArdle JR, Gildea TR, Mehta AC. Balloon bronchoplasty: its indications, benefits, and complications. J Bronchology. 2005;12:123-127.
http://journals.lww.com/bronchology/Fulltext/2005/04000/Balloon_Bronchoplasty__Its_Indications,_Benefits,.18.aspx
O procedimento induz menos trauma à mucosa e formação subsequente de tecido de granulação que a dilatação rígida. A traqueoplastia e a broncoplastia com balão podem ser usadas na OCVA maligna e não maligna, em estenoses subsequentes a ressecções cirúrgicas e transplantes de pulmão e em estenose traqueal pós-intubação. A broncoplastia com balão acarreta uma melhora imediata na OCVA maligna extrínseca e intrínseca em até 79% dos pacientes e é útil na dilatação das vias aéreas antes da colocação de endoprótese. Como seus efeitos não são duradouros, a dilatação com broncoplastia com balão geralmente é seguida por outras terapias, como ressecção a laser, radioterapia ou colocação de endoprótese. As complicações incluem a recorrência de estenose, dor, mediastinite e sangramento, além de laceração ou ruptura das vias aéreas com pneumotórax ou pneumomediastino subsequente.[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonarDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: broncoplastia com balãoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: broncoplastia com balãoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].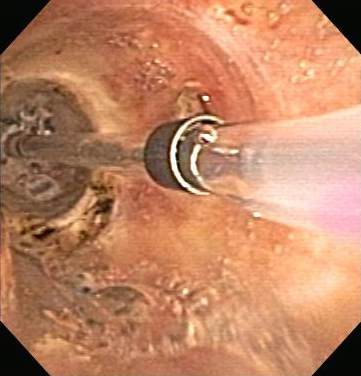
Endopróteses das vias aéreas[3]Beamis JF Jr. Interventional pulmonology techniques for treating malignant large airway obstruction: an update. Curr Opin Pulm Med. 2005;11:292-295.
http://www.ncbi.nlm.nih.gov/pubmed/15928494?tool=bestpractice.com
[112]Santacruz JF, Folch E, Mehta AC. Silicone and metallic stents in interventional pulmonology. Minerva Pneumol. 2009;48:243-259.[113]Casal RF. Update in airway stents. Curr Opin Pulm Med. 2010;16:321-328.
http://www.ncbi.nlm.nih.gov/pubmed/20539232?tool=bestpractice.com
Próteses endobrônquicas de diversos materiais podem ser usadas para dar suporte e manter a patência das vias aéreas. Dois tipos de endopróteses (de silicone e metálicas ou híbridas) são, no momento, amplamente usadas nas vias aéreas, sendo a mais comumente usada a endoprótese de silicone, que é introduzida com broncoscopia rígida.
Endopróteses de silicone (por exemplo, endoprótese de Dumon, tubo em T de Montgomery, endoprótese de Hood, endoprótese de Reynders-Noppen Tygon) apresentam complicações em virtude de uma alta taxa de migração e obstrução pela formação de tecido de granulação em suas extremidades ou por secreções de muco decorrentes do comprometimento do clearance mucociliar.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[69]Simoff MJ, Sterman DH, Ernst A (eds). Thoracic endoscopy. Advances in interventional pulmonology. Malden, MA: Blackwell; 2006.[74]Ko-Pen W, Mehta AC, Turner JF. Flexible bronchoscopy. 2nd ed. Malden, MA: Blackwell; 2004.[114]Wood DE, Liu YH, Vallieres E, et al. Airway stenting for malignant and benign tracheobronchial stenosis. Ann Thorac Surg. 2003;76:167-172.
http://www.ncbi.nlm.nih.gov/pubmed/12842534?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Radiografia torácica mostrando oclusão de endoprótese endobrônquica nos brônquios principais direitos com mucoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
Endopróteses de silicone podem ser usadas em doenças benignas e malignas e são o tipo de endoprótese preferido para doenças benignas das vias aéreas.[1]Murgu SD, Egressy K, Laxmanan B, et al. Central Airway Obstruction: Benign Strictures, Tracheobronchomalacia, and Malignancy-related Obstruction. Chest. 2016 Aug;150(2):426-41.
https://journal.chestnet.org/article/S0012-3692(16)00615-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/26874192?tool=bestpractice.com
A endoprótese de silicone em Y de Dumon é particularmente útil em doenças malignas envolvendo a carina e os brônquios principais. Uma análise retrospectiva mostrou a segurança e a eficácia de um novo tipo de endoprótese metálica autoexpansível em Y.[115]Gompelmann D, Eberhardt R, Schuhmann M, et al. Self-expanding Y stents in the treatment of central airway stenosis: a retrospective analysis. Ther Adv Respir Dis. 2013;7:255-263.
http://www.ncbi.nlm.nih.gov/pubmed/23823488?tool=bestpractice.com
Endopróteses híbridas, teoricamente, combinam as qualidades das endopróteses de silicone e metálicas (por exemplo, as endopróteses cobertas Wallstent, Ultraflex, Polyflex e Alveolus). Elas estão disponíveis em versões descobertas (endopróteses metálicas) e cobertas (endopróteses metálicas hibridas). As endopróteses híbridas cobertas têm a vantagem de proporcionar uma barreira mecânica ao crescimento interno de tumores.
Indicadas no manejo de compressão maligna extrínseca e na manutenção da patência das vias aéreas depois da remoção endoscópica de tumor maligno intrínseco ou misto. Embora usada na estenose recalcitrante pós-transplante de pulmão, a colocação de endoprótese só é usada em outras formas de OCVA não maligna em caso de falha de outros tratamentos, pois o nível de complicação da colocação de endopróteses nessas doenças é de 75%.[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
[116]Lunn W, Feller-Kopman D, Wahidi M, et al. Endoscopic removal of metallic airway stents. Chest. 2005;127:2106-2112.
http://www.ncbi.nlm.nih.gov/pubmed/15947327?tool=bestpractice.com
[117]Gildea TR, Murthy SC, Sahoo D, et al. Performance of a self-expanding silicone stent in palliation of benign airway conditions. Chest. 2006;130:1419-1423.
http://www.ncbi.nlm.nih.gov/pubmed/17099019?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: obstrução das vias aéreas centrais: obstrução maligna do brônquio principal direitoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: colocação de stentDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: colocação de stentDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].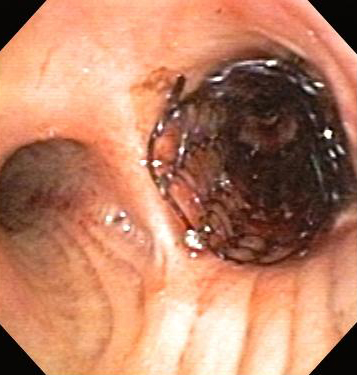
Embora as endopróteses metálicas autoexpansíveis sejam de fácil implementação sem a necessidade de broncoscopia rígida, suas complicações podem ser graves e, portanto, elas devem ser usadas em doenças benignas com cautela. Em 2005, a Food and Drug Administration (FDA) dos EUA também emitiu um alerta de que o uso de stents metálicos deve ser evitado em doenças benignas.
Fornecem paliação imediata e durável, com alívio sintomático obtido em até 84% dos pacientes.[118]Saji H, Furukawa K, Tsutsui H, et al. Outcomes of airway stenting for advanced lung cancer with central airway obstruction. Interact Cardiovasc Thorac Surg. 2010;11:425-428.
http://icvts.oxfordjournals.org/content/11/4/425.full
http://www.ncbi.nlm.nih.gov/pubmed/20656802?tool=bestpractice.com
Foi mostrado que as endopróteses traqueobrônquicas melhoram a qualidade de vida e a sobrevida em pacientes com obstrução maligna avançada.[114]Wood DE, Liu YH, Vallieres E, et al. Airway stenting for malignant and benign tracheobronchial stenosis. Ann Thorac Surg. 2003;76:167-172.
http://www.ncbi.nlm.nih.gov/pubmed/12842534?tool=bestpractice.com
[119]Kim JH, Shin JH, Song HY, et al. Use of a retrievable metallic stent internally coated with silicone to treat airway obstruction. J Vasc Interv Radiol. 2008;19:1208-1214.
http://www.ncbi.nlm.nih.gov/pubmed/18656015?tool=bestpractice.com
[120]Chhajed PN, Baty F, Pless M, et al. Outcome of treated advanced non-small cell lung cancer with and without central airway obstruction. Chest. 2006;130:1803-1807.
http://www.ncbi.nlm.nih.gov/pubmed/17167000?tool=bestpractice.com
[121]Furukawa K, Ishida J, Yamaguchi G, et al. The role of airway stent placement in the management of tracheobronchial stenosis caused by inoperable advanced lung cancer. Surg Today. 2010;40:315-320.
http://www.ncbi.nlm.nih.gov/pubmed/20339985?tool=bestpractice.com
Associadas a uma alta taxa de complicação, particularmente com o uso em longo prazo de endopróteses metálicas ou híbridas.[19]Makris D, Marquette CH. Tracheobronchial stenting and central airway replacement. Curr Opin Pulm Med. 2007;13:278-283.
http://www.ncbi.nlm.nih.gov/pubmed/17534173?tool=bestpractice.com
Em associação com as complicações mencionadas anteriormente, as endopróteses também podem estar associadas a halitose, fratura da endoprótese, fadiga metálica, perfurações vasculares e das vias aéreas, lacerações da mucosa e obstrução de orifícios lobares.[18]Bolliger CT, Sutedja TG, Strausz J, et al. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J. 2006;27:1258-1271.
http://erj.ersjournals.com/content/27/6/1258.full
http://www.ncbi.nlm.nih.gov/pubmed/16772389?tool=bestpractice.com
[69]Simoff MJ, Sterman DH, Ernst A (eds). Thoracic endoscopy. Advances in interventional pulmonology. Malden, MA: Blackwell; 2006.[74]Ko-Pen W, Mehta AC, Turner JF. Flexible bronchoscopy. 2nd ed. Malden, MA: Blackwell; 2004.[122]Mehta AC, Dasgupta A. Airway stents. Clin Chest Med. 1999;20:139-151.
http://www.ncbi.nlm.nih.gov/pubmed/10205723?tool=bestpractice.com
Um cartão de "alerta de endoprótese" deve ser dado a todos os pacientes com endoprótese nas vias aéreas. Ele deve especificar o tipo e o tamanho da endoprótese, o local e o tamanho adequado do tubo endotraqueal a ser usado caso seja necessária uma intubação de emergência no caso de endoprótese traqueal.[123]Lee P, Kupeli E, Mehta AC. Airway stents. Clin Chest Med. 2010;31;141-150.
http://www.ncbi.nlm.nih.gov/pubmed/20172440?tool=bestpractice.com
Microdebridador[96]Bolliger CT. Laser bronchoscopy, electrocautery, APC and microdebrider. In: Beamis JF, Mathur P, Mehta AC, eds. Interventional pulmonary medicine. 2nd ed. New York, NY: Informa Healthcare; 2009.[124]Kennedy MP, Morice RC, Jimenez CA, et al. Treatment of bronchial airway obstruction using a rotating tip microdebrider: a case report. J Cardiothorac Surg. 2007;2:16.
http://www.cardiothoracicsurgery.org/content/2/1/16
http://www.ncbi.nlm.nih.gov/pubmed/17386099?tool=bestpractice.com
[125]Lunn W, Bagherzadegan N, Munjampalli SKJ, et al. Initial experience with a rotating airway microdebrider. J Bronchology. 2008;15:91-94.
http://journals.lww.com/bronchology/Fulltext/2008/04000/Initial_Experience_With_a_Rotating_Airway.7.aspx
Uma lâmina rotativa elétrica acarreta o desbridamento da obstrução. A sucção simultânea permite a remoção rápida de sangue e detritos com trauma mínimo às vias aéreas, embora o tecido removido possa não ser adequado à inspeção patológica.
A lâmina do microdebridador pode ser lisa ou serrilhada e vem em 2 comprimentos: 37 cm para acessar lesões da traqueia e dos brônquios principais mais proximais e 45 cm para lesões mais distais. A velocidade usual da lâmina é de 1000 a 2000 rpm.
Pode ser usada para a terapia de estenose subglótica e também de tecido de granulação e de doenças malignas na traqueia, brônquios principais e brônquios distais.[Figure caption and citation for the preceding image starts]: obstrução das vias aéreas centrais: obstrução maligna do brônquio principal direitoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: esvaziamento pós-mecânicoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: esvaziamento pós-mecânicoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].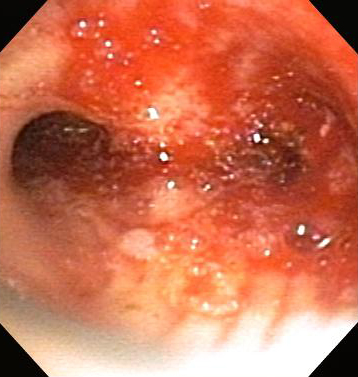
Pode ser uma boa opção para pacientes com reserva pulmonar deficiente, pois não é necessário diminuir a FiO2 durante esvaziamento de tumor.
A adição de eletrocauterização pode ser necessária para atingir hemostasia em até 35% dos pacientes.
Um estudo retrospectivo constatou que o microdebridador é seguro e efetivo no manejo de obstruções benignas e malignas das vias aéreas centrais.[126]Casal RF, Iribarren J, Eapen G, et al. Safety and effectiveness of microdebrider bronchoscopy for the management of central airway obstruction. Respirology. 2013;18:1011-1015.
http://www.ncbi.nlm.nih.gov/pubmed/23520982?tool=bestpractice.com
Intervenções endoscópicas nas vias aéreas por radiação (braquiterapia)
O fornecimento endobrônquico de radiação é obtido através da colocação de uma substância radioativa (mais comumente, irídio-192) diretamente no tumor das vias aéreas ou intimamente próximo a ele, por meio de um broncoscópio flexível. Isso acarreta destruição tecidual através de mutações no ácido desoxirribonucleico (DNA) que causam apoptose celular.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[16]Bolliger CT, Mathur PN, Beamis JF, et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society. Eur Respir J. 2002;19:356-373.
http://erj.ersjournals.com/content/19/2/356.full
http://www.ncbi.nlm.nih.gov/pubmed/11866017?tool=bestpractice.com
[17]Folch E, Mehta AC. Airway interventions in the tracheobronchial tree. Semin Respir Crit Care Med. 2008 Aug;29(4):441-52.
http://www.ncbi.nlm.nih.gov/pubmed/18651361?tool=bestpractice.com
[22]Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001;344:740-749.
http://www.ncbi.nlm.nih.gov/pubmed/11236779?tool=bestpractice.com
[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
[90]Ernst A, Silvestri GA, Johnstone D. Interventional pulmonary procedures: guidelines from the American College of Chest Physicians. Chest. 2003;123:1693-1717.
http://www.ncbi.nlm.nih.gov/pubmed/12740291?tool=bestpractice.com
[101]Sheski FD, Mathur PN. Cryotherapy, electrocautery, and brachytherapy. Clin Chest Med. 1999;20:123-138.
http://www.ncbi.nlm.nih.gov/pubmed/10205722?tool=bestpractice.com
A braquiterapia é indicada para paliação de sintomas (em particular, dispneia, tosse e hemoptise) relacionados à obstrução das vias aéreas. A braquiterapia endobrônquica de alta dose também é bem-sucedida no tratamento da formação excessiva de tecido de granulação depois de transplante pulmonar no local da anastomose ou como complicação da colocação de endoprótese nas vias aéreas.[14]Santacruz JF, Mehta AC. Airway complications and management after lung transplantation: ischemia, dehiscence, and stenosis. Proc Am Thorac Soc. 2009;6:79-93.
http://www.ncbi.nlm.nih.gov/pubmed/19131533?tool=bestpractice.com
[127]Kennedy AS, Sonett JR, Orens JB, et al. High dose rate brachytherapy to prevent recurrent benign hyperplasia in lung transplant bronchi: theoretical and clinical considerations. J Heart Lung Transplant. 2000;19:155-159.
http://www.ncbi.nlm.nih.gov/pubmed/10703691?tool=bestpractice.com
[128]Tendulkar RD, Fleming PA, Reddy CA, et al. High-dose-rate endobronchial brachytherapy for recurrent airway obstruction from hyperplastic granulation tissue. Int J Radiat Oncol Biol Phys. 2008;70:701-706.
http://www.ncbi.nlm.nih.gov/pubmed/17904764?tool=bestpractice.com
Como a braquiterapia demora até 3 semanas para ser efetiva, ela não deve ser usada no manejo de emergência de OCVA grave aguda. Os efeitos da braquiterapia são duradouros, com uma taxa relatada de restauração luminal de 78% a 85% e de alívio de sintomas de 69% a 93%.[7]Manali ED, Saad CP, Krizmanich G, et al. Endobronchial findings of fibrosing mediastinitis. Respir Care. 2003;48:1038-1042.
http://www.rcjournal.com/contents/11.03/11.03.1038.pdf
http://www.ncbi.nlm.nih.gov/pubmed/14635620?tool=bestpractice.com
Uma vantagem da braquiterapia é que ela pode ser usada em tumores em áreas inacessíveis a outras modalidades de tratamento (por exemplo, brônquios do lobo superior e brônquios segmentares). A administração da braquiterapia ocorre por meio de métodos endobrônquicos de baixa taxa de dose ou de alta taxa de dose. A braquiterapia de alta taxa de dose pode fornecer doses mais elevadas de radiação com menos tempo em cada fração, o que permite que ela seja usada ambulatorialmente.
A braquiterapia pode ser usada em combinação com outras técnicas, como laserterapia ou radiação por feixe externo, com a qual ela apresenta efeitos sinérgicos.
As complicações dessa técnica incluem hemorragia (em particular nos lobos superiores direito e esquerdo e, muitas vezes, apresentando hemoptise maciça), formação de fístulas no mediastino, arritmias, hipotensão, broncoespasmo, estenose ou necrose brônquica e bronquite por radiação. Tem sido descrita hemorragia fatal em até 32% dos casos; entretanto, é difícil diferenciar sangramento causado por radiação daquele causado pelo próprio tumor.
Radiação por feixe externo (RFE)
Embora seja uma terapia estabelecida para câncer de pulmão e seja considerada o tratamento de primeira escolha para pacientes com câncer pulmonar de células não pequenas inoperável, a efetividade da RFE para OCVA maligna é no máximo variável e seus efeitos são tardios e pouco confiáveis.
Com os recentes avanços da broncoscopia intervencionista, o tratamento de pacientes com OCVA maligna está mudando de RFE para broncoscopia, e em centros com capacidade para pneumologia intervencionista, a broncoscopia deve agora ser considerada como tratamento de primeira linha.[2]Ernst A, Feller-Kopman D, Becker HD, et al. Central airway obstruction. Am J Respir Crit Care Med. 2004;169:1278-97.
http://www.ncbi.nlm.nih.gov/pubmed/15187010?tool=bestpractice.com
[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
[65]Wahidi MM, Herth FJ, Ernst A. State of the art: interventional pulmonology. Chest. 2007;131:261-274.
http://www.ncbi.nlm.nih.gov/pubmed/17218585?tool=bestpractice.com
Ocasionalmente, a RFE pode ser realizada em um paciente estável com capacidade funcional melhorada subsequentemente à intervenção por broncoscopia para consolidar os efeitos desse tratamento.
O principal fator limitante da RFE é a exposição indesejável do tecido normal à radiação, incluindo o parênquima pulmonar, o coração, a coluna e o esôfago. Aproximadamente 50% dos pacientes tratados com RFE para controle local apresentam evolução de doença no campo irradiado.
A taxa de sucesso da terapia por RFE para hemoptise é de 84%, embora ela seja efetiva somente para tratamento de obstrução e atelectasia das vias aéreas em aproximadamente 20% dos pacientes.
Tratamento cirúrgico
A cirurgia pode ser indicada na OCVA maligna e não maligna, dependendo da extensão da doença maligna na apresentação, da natureza da doença benigna e da existência de comorbidade clinica.[60]Mahmood K, Frazer-Green L, Gonzalez AV, et al. Management of central airway obstruction: an American College of Chest Physicians clinical practice guideline. Chest. 18 Jul 2024 [Epub ahead of print].
https://journal.chestnet.org/article/S0012-3692(24)04614-2/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/39029785?tool=bestpractice.com
[72]Jeon K, Kim H, Yu CM, et al. Rigid bronchoscopic intervention in patients with respiratory failure caused by malignant central airway obstruction. J Thorac Oncol. 2006 May;1(4):319-23.
http://www.ncbi.nlm.nih.gov/pubmed/17409877?tool=bestpractice.com
[129]Husain SA, Finch D, Ahmed M, et al. Long-term follow-up of ultraflex metallic stents in benign and malignant central airway obstruction. Ann Thorac Surg. 2007;83:1251-1256.
http://www.ncbi.nlm.nih.gov/pubmed/17383321?tool=bestpractice.com
O manejo cirúrgico da OCVA benigna é um campo altamente especializado e deve ser realizado por um cirurgião torácico com experiência significativa em procedimentos complexos das vias aéreas.[130]Grillo HC, Mathisen DJ, Wain JC. Management of tumors of the trachea. Oncology (Williston Park). 1992;6:61-67.
http://www.ncbi.nlm.nih.gov/pubmed/1313276?tool=bestpractice.com
O objetivo da cirurgia é aumentar o tamanho disponível das vias aéreas ou ressecar o segmento estenótico. Assim sendo, os procedimentos mais comuns são a anastomose término-terminal ou a ressecção em manga da traqueia.
Obstrução maligna das vias aéreas
Cirurgia é o tratamento de primeira escolha para câncer pulmonar de células não pequenas (CPCNP) em estádio inicial, com sobrevida em 5 anos >70% observada na doença em estádio IA.[32]Chhajed PN, Eberhardt R, Dienemann H, et al. Therapeutic bronchoscopy interventions before surgical resection of lung cancer. Ann Thorac Surg. 2006;81:1839-1843.
http://www.ncbi.nlm.nih.gov/pubmed/16631682?tool=bestpractice.com
[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
[131]Hanley ME, Welsh CH. Current diagnosis & treatment in pulmonary medicine. New York, NY: McGraw-Hill; 2003. Uma vez que 80% dos pacientes se apresentam com estádio III ou IV, a sobrevida global em 5 anos é de apenas 4%.[64]Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002;23:241-256.
http://www.ncbi.nlm.nih.gov/pubmed/11901914?tool=bestpractice.com
[131]Hanley ME, Welsh CH. Current diagnosis & treatment in pulmonary medicine. New York, NY: McGraw-Hill; 2003.[132]Schuurmans MM, Michaud GC, Diacon AH, et al. Use of an ultrathin bronchoscope in the assessment of central airway obstruction. Chest. 2003;124:735-739.
http://www.ncbi.nlm.nih.gov/pubmed/12907567?tool=bestpractice.com
Portanto, para a maioria dos pacientes com câncer pulmonar avançado, o tratamento é focado na paliação dos sintomas e na melhora da qualidade de vida.
Obstrução não maligna das vias aéreas
Embora a ressecção cirúrgica com anastomose seja o tratamento de primeira escolha nas estenoses traqueais benignas, a ressecção traqueal só é possível em aproximadamente 50% dos pacientes adequados à cirurgia, e até hoje não foi desenvolvida uma prótese satisfatória que permita uma ressecção mais extensa da traqueia.[129]Husain SA, Finch D, Ahmed M, et al. Long-term follow-up of ultraflex metallic stents in benign and malignant central airway obstruction. Ann Thorac Surg. 2007;83:1251-1256.
http://www.ncbi.nlm.nih.gov/pubmed/17383321?tool=bestpractice.com
 [Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: anastomose nos brônquios principais direitos pós-terapia endoscópica multimodalDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: anastomose nos brônquios principais direitos pós-terapia endoscópica multimodalDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: fotorressecção a laserDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: fotorressecção a laserDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: incisão radial por eletrocauterizaçãoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: incisão radial por eletrocauterizaçãoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: coagulação com plasma de argônioDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: coagulação com plasma de argônioDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: broncoplastia com balãoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Estenose brônquica anastomótica pós-transplante pulmonar: broncoplastia com balãoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].

 [Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: colocação de stentDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: colocação de stentDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: esvaziamento pós-mecânicoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Terapia broncoscópica para obstrução das vias aéreas centrais dos brônquios principais direitos: esvaziamento pós-mecânicoDos acervos de Jose Fernando Santacruz MD, FCCP, DAABIP e Erik Folch MD, MSc; usado com permissão [Citation ends].