Abordaje
Cuando hay sospecha de gangrena, la decisión más importante es diferenciar la gangrena isquémica de la gangrena infecciosa y reconocer las infecciones necrosantes profundas que requieren una intervención quirúrgica urgente.
Generalmente, se requiere:
Identificación de factores de riesgo
Una anamnesis detallada y una exploración física integral
Análisis clínicos adecuados
Estudios por imágenes y otros estudios, en casos determinados
El avance rápido, la propagación o el deterioro clínico indican la necesidad de exploración quirúrgica. En casos ambiguos, se requiere una biopsia o exploración quirúrgica para determinar si la fascia está afectada ya que la observación de los tejidos blandos más profundos es el único método definitivo para realizar el diagnóstico.[38]
Identificación de los factores de riesgo
Los factores de riesgo para la gangrena isquémica incluyen diabetes mellitus, aterosclerosis, tabaquismo, aplicación prolongada de torniquetes, estados de hipercoagulabilidad, abuso de drogas, neoplasias malignas y nefropatía.
Los factores de riesgo de la gangrena infecciosa incluyen traumatismos o cirugías abdominales recientes, heridas contaminadas, diabetes mellitus, alcoholismo, nefropatía, abuso de drogas, lesión por varicela, mordedura de piel/insectos, neoplasia maligna, inmunosupresión y desnutrición.
Evaluación clínica
Entre los hallazgos que sugieren gangrena isquémica arterial, se incluyen: extremidades frías, antecedentes de trombosis previa, evolución crónica, cambios tróficos de la piel, dolor (descrito clásicamente como un dolor tipo ardor en el metatarso del pie y en los dedos del pie que empeora por la noche), púrpura, edema, úlceras y livedo reticularis.[19]
La evaluación de la presión sanguínea es útil para evaluar la gangrena isquémica. Una presión sistólica en el tobillo de 50 mm Hg o inferior, o una presión sistólica en los dedos del pie de 30 mm Hg o inferior, respalda el diagnóstico de gangrena isquémica; sin embargo, estos parámetros pueden ser menos confiables en pacientes con diabetes, ya que la calcificación de la pared arterial puede afectar la compresión de los vasos por un esfigmomanómetro y produce mediciones de presión sistólica superiores a los niveles reales.[9] Otra medida útil es el índice tobillo/brazo (ITB), que consiste en el ratio entre la presión sistólica en la arteria dorsal del pie o en la arteria tibial posterior dividido por la presión sistólica en la arteria braquial. Los pacientes con una isquemia crítica en los miembros generalmente presentan un ITB de 0.4 o inferior.[9]
Clínicamente, entre las características que pueden ayudar a categorizar la viabilidad de un miembro isquémico agudo, se encuentran:
Viable: sin riesgo inmediato; sin pérdida sensorial o debilidad muscular; señales Doppler arteriales y venosas audibles.
Ligeramente amenazado: recuperable si se trata de inmediato; sin pérdida sensorial (de los dedos del pie) o pérdida mínima; sin debilidad muscular; con frecuencia señales Doppler arteriales inaudibles; señales Doppler venosas audibles
Inmediatamente amenazado: recuperable con revascularización inmediata; pérdida sensorial extendida más allá de los dedos del pie junto con dolor en reposo; debilidad muscular leve a moderada; por lo general señales Doppler arteriales inaudibles, señales Doppler venosas audibles.
Irreversible/no viable: pérdida tisular importante o daño permanente de nervios; anestesia profunda; parálisis profunda (rigidez); señales Doppler arteriales y venosas inaudibles.
La flegmasía cerúlea dolorosa, generalmente asociada con neoplasia maligna, causa una obstrucción total o casi total del drenaje venoso de un miembro. Se produce dolor, un edema marcado del miembro y cianosis de la piel durante un período de tiempo variable. En aproximadamente la mitad de los casos, la cianosis puede estar precedida de una apariencia blanquecina de la piel causada por un edema subcutáneo sin congestión venosa.
Entre los hallazgos que sugieren gangrena infecciosa, se incluyen: febrícula y escalofríos moderados, lesiones callosas de color púrpura o rojo, dolor severo a la palpación en áreas contiguas pero aparentemente no afectadas, márgenes poco definidos, pérdida de sensación distal al área afectada y avance rápido de la infección.[6]
La celulitis necrosante (CN) se presenta con heridas con un drenaje acuoso oscuro y formación de gas en la piel con desprendimiento de fascia y músculos profundos. El comienzo es gradual, sin dolor, inflamación ni toxicidad sistémica.[39][40]
La fascitis necrosante (FN) es una infección profunda del tejido subcutáneo que ocasiona una destrucción progresiva de la fascia y la grasa. Generalmente es eritematosa, sin márgenes definidos, inflamada, caliente, brillante y extremadamente sensible a la palpación, progresa rápidamente, en el transcurso de días, con cambios en el color de la piel y formación de ampollas. La gangrena cutánea franca se puede observar a los 3 a 5 días con un pródromo de anestesia antes de la aparición de la necrosis cutánea. Esto ayuda a diferenciarla de la CN mencionada más arriba.[39][40]
La miositis necrosante (miositis gangrenosa espontanea) es una infección agresiva que se presenta con fiebre, mucho dolor e inflamación muscular. La piel suprayacente puede desarrollar eritema, calor, petequias, ampollas y vesículas que avanzan en varias horas hacia los grupos musculares y tejidos blandos adyacentes. Puede producirse un shock séptico con las características de un síndrome de shock tóxico estreptocócico. El tiempo de la progresión ayuda a diferenciarla de la FN.[39][40][Figure caption and citation for the preceding image starts]: Formación de ampolla hemorrágica secundaria a gangrena isquémicaColección de José Contreras-Ruiz (Clínica del Cuidado Integral de Heridas y Estomas) [Citation ends].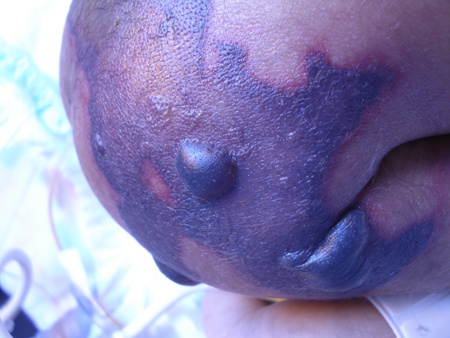 [Figure caption and citation for the preceding image starts]: Recién nacido con púrpura fulminante debido a Streptococcus B haemolyticusColección de José Contreras-Ruiz (Clínica del Cuidado Integral de Heridas y Estomas) [Citation ends].
[Figure caption and citation for the preceding image starts]: Recién nacido con púrpura fulminante debido a Streptococcus B haemolyticusColección de José Contreras-Ruiz (Clínica del Cuidado Integral de Heridas y Estomas) [Citation ends].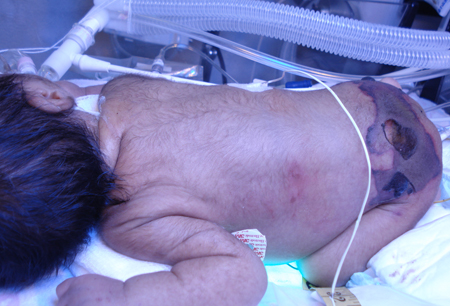
Análisis clínicos
En el caso de la gangrena isquémica e infecciosa, la evaluación inicial de laboratorio incluye un hemograma completo con frotis de sangre periférica, pruebas de función hepática, pruebas de función renal, proteína C-reactiva (CRP), lactato deshidrogenasa sérica (LDH) y estudios de coagulación de referencia.
Entre los hallazgos que respaldarían el diagnóstico de gangrena y pueden justificar pruebas diagnósticas adicionales, se incluyen:
Proteína C-reactiva >3.26 mmol/L (>150 mg/L)
Recuento de leucocitos >15 x 10⁹/L (>15,000 células/microlitro); tenga en cuenta que a pesar de una infección grave, los leucocitos pueden no aumentar
Hemoglobina <135 g/L (<13.5 g/dL); la anemia hemolítica es un hallazgo frecuente en la gangrena gaseosa.
Sodio <135 mmol/L (<135 mEq/L).
Niveles elevados de LDH.
Resultados de laboratorio que sugieren insuficiencia renal aguda, insuficiencia hepática o acidosis metabólica.
Se recomienda realizar hemocultivos si se sospecha gangrena infecciosa.
El sistema de puntuación LRINEC es una herramienta útil para utilizar la prueba de laboratorio inicial para pronosticar el riesgo de fascitis necrotizante (FN).[3][41] Tiene un valor predictivo positivo del 92% y un valor predictivo negativo del 96%. Se dan puntuaciones para los niveles de PCR, recuento de leucocitos, hemoglobina, sodio, creatinina y glucosa. Cualquier puntuación de 6 o más es sospechosa para la FN y una puntuación de 8 o más constituye un valor altamente predictivo de fascitis necrosante (FN).
Si las pruebas de rutina son poco reveladoras, las pruebas adicionales pueden ayudar a diagnosticar enfermedades que pueden contribuir al desarrollo de la isquemia y gangrena: en pacientes con sospecha de gangrena isquémica, que hace que los dedos del pie adquieran un color púrpura o azul, se pueden indicar anticuerpos antinucleares (síndrome de Sjögren, lupus eritematoso sistémico [LES], lupus discoide), anticuerpos antifosfolípidos (síndrome antifosfolípido), crioaglutininas (enfermedad por crioaglutininas primaria o secundaria), criofibrinógenos (criofibrinogenemia esencial o en asociación con infecciones, trastornos reumatológicos o cáncer), y crioglobulina (asociada a enfermedad linfoproliferativa, inflamatoria o infecciosa).[19]
La tinción de Gram del tejido infectado puede revelar la presencia de bacilos grampositivos. Cadenas pequeñas de cocos grampositivos sugieren una infección estreptocócica; agrupaciones de cocos grandes sugieren Staphylococcus aureus.[1] Los hemocultivos y los cultivos tisulares pueden ofrecer un diagnóstico bacteriológico definitivo e indicar si la infección es polimicrobiana o monomicrobiana.
Estudios por imágenes
Si se sospecha gangrena gaseosa en un paciente, las radiografías simples pueden mostrar gas en los tejidos blandos y/o indicar una osteomielitis subyacente. La resonancia magnética (IRM) o la tomografía computarizada (TC) pueden revelar la formación de abscesos o evidencia de realce, edema o engrosamiento de la fascia. Sin embargo, la falta de gas demostrable en los tejidos blandos no descarta el diagnóstico de una infección necrosante. La exploración por TC puede revelar acumulaciones de gas de menor tamaño en los tejidos que la radiografía simple y, por lo tanto, se puede preferir en este sentido. Las exploraciones por TC también pueden mostrar con mayor facilidad acumulaciones de líquido. La IRM, aunque permite visualizar con mayor detalle los tejidos blandos que la TC, generalmente, está menos disponible y también puede presentar problemas logísticos en pacientes que a menudo presentan una enfermedad bastante grave.
En un paciente con sospecha de gangrena isquémica, se pueden indicar diferentes técnicas de estudios por imágenes, según la situación clínica exacta:
El ultrasonido dúplex puede ser útil para demostrar la localización y la gravedad del estrechamiento u obstrucción arterial y también puede detectar tromboembolia venosa.[19] Es la modalidad más utilizada para evaluar la localización y el grado de estenosis en la enfermedad vascular periférica, así como la permeabilidad de los injertos de derivación (bypass). La sensibilidad y especificidad en estenosis del 50% o superior desde la arteria ilíaca hasta la arteria poplitea son del 90% y 95%, respectivamente.
La angiografía convencional se usa con frecuencia para identificar la localización y la extensión de la obstrucción arterial o venosa. La precisión e interpretación se mejoran mediante el empleo de técnicas, como la angioplastia por sustracción digital, que eliminan los artefactos óseos y de tejido denso. Sin embargo, es un procedimiento invasivo que requiere contraste.
Si está disponible, se pueden utilizar la angiografía por TC o la angiografía por resonancia magnética (ARM) para detectar la presencia de ateroembolia. La angiografía por TC se usa cada vez más, pero todavía requiere contraste por vía intravenosa, aunque se expone al paciente a menos radiación que con la angiografía tradicional. También se pueden reconstruir las imágenes en 3D. Las nuevas imágenes por TC de 64 cortes pueden tener una sensibilidad del 89% al 100% y una especificidad del 92% al 100% para estenosis >50%. Sin embargo, la resolución espacial es menor que en la angiografía por sustracción digital y la opacificación venosa puede oscurecer el llenado arterial. Aunque estén menos disponibles, la sensibilidad y especificidad de la ARM para detectar una estenosis superior al 50% pueden ser hasta del 90% o 100%, obteniendo la precisión más alta cuando se usa gadolinio. Sin embargo, tiene numerosas limitaciones. La ARM tiende a sobrestimar la estenosis y las oclusiones; las grapas metálicas pueden imitar oclusiones, lo que limita su uso en pacientes posquirúrgicos. Además, los pacientes con marcapasos, desfibriladores y algunas grapas para aneurisma cerebral no se pueden explorar de manera segura y el gadolinio ha causado fibrosis sistémica nefrogénica en pacientes con insuficiencia renal crónica.
Las exploraciones por TC de tórax y abdomen se indican en el caso de pacientes en los que se sospecha que puede haber una neoplasia maligna oculta que produce un síndrome de tromboembolia paraneoplásico como causa de la isquemia.
La ecocardiografía se indica en los casos en que las características de la anamnesis y de la exploración física (p. ej., antecedentes de enfermedad valvular, presencia de soplos cardíacos) sugieren la posible sospecha de endocarditis infecciosa, mixoma y endocarditis trombótica no bacteriana.
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad